一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法与流程
本发明涉及荧光生物传感器技术领域,具体涉及一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法。
背景技术:
量子点作为一种纳米发光材料,可应用于生物的荧光标记。量子点荧光稳定性强,具有狭窄对称的荧光光谱,量子产量高,尺寸可调,抗光漂白性好,水溶性量子点的生物兼容性好,经过化学修饰后,可特异性连接生物分子,进行生物活体标记和检测。在量子点表面涂一层无毒的无机分子、有机分子或聚合物,可以尽量减少或避免量子点毒性的干扰。通过静电吸引将cdse/zns量子点与蛋白质分子连接一起后,量子点就广泛的应用到多肽、蛋白等生物检测中。而通过不同物质之间的静电吸引构建传感器,静电自组装构建传感器结构不稳定,易随着环境的改变而改变。水溶性cdse/zns量子点表面常常有羧基的存在,而大多数生物分子具有与羧基共价连接的氨基,这种共价键构成的传感器结构稳定,不易被破坏。
多孔硅具有比表面积巨大、生物兼容性好,经溶液处理后多孔硅荧光背景低、红外透光,可用包括微电子技术在内的多种方法制备成光器件,已经广泛的应用于生物检测。多孔硅光学传感器的检测机理主要有两类:第一类是对生物反应引起的折射率变化进行检测的,第二类是对生物反应引起的荧光变化进行检测,其中基于荧光变化的生物检测具有灵敏度高、选择性好、所需生物量少、响应时间快和重复性好等特点。利用多孔硅光子晶体可进一步提升量子点的发光效率,所以将水溶性量子点独特的光学性质与多孔硅优良的特性结合起来,可制作出高灵敏度的光学生物传感器和芯片。
本发明所提及的重组菌p38购买自新疆医科大学,已被现有文献公开,现有文献为《细粒棘球绦虫p38蛋白原核表达及其多克隆抗体制备》(吕国栋,王红丽,刘辉,张富春,林仁勇,《中国人兽共患病学报》,2014,30(1):27-31)。
技术实现要素:
本发明的目的就是针对上述现有技术中的缺陷,提供了一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法,实现了多层多孔硅巨大的比表面积及bragg结构对量子点荧光的双重增强效果,从而提高了多孔硅生物传感器的灵敏度。
为了实现上述目的,本发明提供的技术方案为:一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法,包括以下步骤:
1)在常温环境下,用电化学腐蚀法制备多层多孔硅样品,采用的基底单晶si材料为p型;
2)制备待测抗原;
3)通过偶联剂edc和sulfo-nhs将水溶性cdse/zns量子点羧基活化,与表面有氨基功能团的生物分子偶联;
4)将步骤2)得到的待测抗原渗透到步骤1)得到的多层多孔硅样品;
5)将步骤3)得到的量子点偶联的抗体渗透到步骤4)得到的待测抗原修饰的多层多孔硅样品,得到所述基于多孔硅/量子点的荧光生物传感器基底材料;
6)对样品进行表面形貌表征、反射谱测量及荧光检测。
进一步的,上述的一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法,所述步骤1)中,p型单晶硅晶向为<100>,电阻率为0.03-0.06ω·cm,厚度为400μm。
进一步的,上述的一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法,所述步骤1)中,电化学腐蚀用的电解液为按照体积比1:1混合的浓度40%的氢氟酸和浓度≥99%的酒精。
进一步的,上述的一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法,所述步骤2)中,待测抗原的具体制备方法为:将重组菌p38在无菌条件下接种于含100mg/ml卡纳霉素的10ml的lb培养基中进行培养,经过异丙基硫代-β-d-半乳糖苷诱导、超声破碎、纯化得到最终包虫病抗原,通过sds-page电泳检测抗原蛋白表达。
所述布拉格反射镜由低孔隙率层和高孔隙率层交替堆叠构成,分别对应于高折射率和低折射率的区域。
通过偶联剂edc和sulfo-nhs的活化作用,激活水溶性量子点表面的羧基,成功的与具有氨基功能团的抗体偶联,通过离心去除没有偶合的量子点、抗体。
先将待检验的抗原渗透偶联到戊二醛修饰过的多孔硅上,多孔硅巨大的比表面积可以偶联大量的抗原分子。
将量子点标记过的抗体分子,滴加到抗原修饰过的多孔硅上,通过抗原抗体特异性反应,将量子点间接偶联到多孔硅上。
制备出的多孔硅具有特殊高反射带的布拉格反射镜,能将量子点的荧光进一步增强,及多孔硅巨大的比表面积可以承载更多的量子点,使量子点的数量增加,以此双重提高量子点的荧光强度,从而提高多孔硅生物传感器的灵敏度。
根据荧光光谱仪(hitachif-4600)检测多孔硅上偶联量子点的荧光强度,从而检测待测抗原的浓度。本方法主要是将量子点标记的抗体,滴加到不同浓度待测抗原修饰的多孔硅上,通过抗原抗体特异性反应,将量子点间接偶联到多孔硅上,修饰多孔硅的待测抗原浓度越大,参与特异性反应的抗体就越多,而抗体与量子点偶联,说明连接的量子点也越多,从而量子点的荧光强度越强。
本发明的有益效果为:
本发明提供的一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法,首先制备出了高反射带位置小于量子点荧光发射峰的一维多孔硅光子晶体,依次通过氧化、硅烷化、戊二醛、待测抗原修饰多孔硅,成功的将cdse/zns量子点标记的抗体特异性结合到多孔硅中,特异性反应后的多孔硅高反射带覆盖量子点荧光发射峰。经过多次清洗,将没有发生特异性反应的量子点标记的抗体彻底清除,排除没参与反应的量子点荧光的干扰。通过检测不同浓度待测抗原修饰的多孔硅,特异性连接量子点标记的抗体后的荧光强度,得出结论,当待检测的抗原浓度越来越低时,连接量子点-抗体的数量相应减少,量子点免疫反应结合物的荧光强度越来越弱,经过多孔硅布拉格反射镜的高反射带,将量子点免疫反应结合物向下发射的荧光反射成向上发射的荧光,增强量子点免疫反应结合物的荧光,提高了多孔硅生物传感器的灵敏度。以量子点为荧光标记物,多孔硅为荧光放大器的生物传感器检测低浓度的待测抗原,其检测灵敏度显著提高。此外,该系统可以修改为其他生物的特异性检测,从而扩大其适用范围。
附图说明
图1显示为本发明多层多孔硅的扫描电镜表面形貌图。
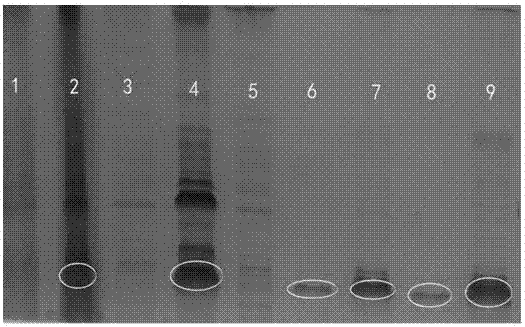
图2显示为本发明制备的待测抗原sds-page电泳蛋白表达图。
图3显示为本发明cdse/zns量子点与cdse/zns量子点标记抗体荧光图。
图4显示为本发明制备的多孔硅样品经过待测抗原修饰后的反射光谱图。
图5显示为本发明不同浓度待测抗原修饰多孔硅后,与量子点标记抗体发生特异性反应后的荧光图。
图6显示为本发明通过检测不同浓度待测抗原(以包虫病为例)的线性拟合图。
具体实施方式
实施例1:
本发明提供的一种基于多孔硅/量子点的荧光生物传感器基底材料的制备方法,所述具体制备及检测方法包括以下步骤:
1)图1为本发明制备的多孔硅样品扫描电子显微镜表面形貌及截面形貌图。通过电化学腐蚀法制备多孔硅样品,采用的基底单晶si材料为p型,晶向为<100>,电阻率为0.03~0.06ω·cm,厚度为400μm。所用电解液为体积比为1:1的氢氟酸(浓度为40%)和酒精(浓度≥99%)的混合液。
制备的多层多孔硅样品的腐蚀条件为ih=110ma·cm-2、il=40ma·cm-2,对应的时间分别0.9s和1.1s;
多层布拉格反射镜由低孔隙率层和高孔隙率层交替堆叠构成,分别对应于高折射率和低折射率的区域。布拉格反射镜与缺陷层的光学厚度满足以下关系:
其中m是整数,nl(nh)和dl(dh)分别对应低(高)折射率层的折射率和厚度。λbragg是中心禁带位置处对应的波长。
2)从sds-page电泳检测蛋白(包虫病抗原为例)表达(图2),可判断黄线所圈出来的位置即是经过培养菌种、诱导、超声破碎及纯化后待测的抗原蛋白。
3)如图3cdse/zns量子点与cdse/zns量子点标记抗体荧光图。可知水溶性量子点的荧光发射峰位于528nm,而量子点标记抗体后,量子点的荧光发射峰红移到532nm左右,由于量子点表面的羧基与抗体的氨基发生共价连接,抗体是大分子蛋白质,一个抗体分子上可以连接多个量子点,使量子点间的距离缩短,粒子间的极偶相互作用增加,使stokes位移增加,导致量子点的荧光光谱发生红移,说明量子点成功标记了抗体分子。荧光强度的减弱可能是量子点稀释后浓度变小,也可能是蛋白的猝灭作用。偶联抗体分子后的量子点荧光发射光谱窄且对称,说明偶联生物分子后量子点的分散性良好。
4)如图4,是为了检测待测抗原分子是否连接到多孔硅内,通过对比戊二醛功能化后多孔硅的反射光谱,与连接待测抗原分子后多孔硅的反射光谱,可以看到多孔硅反射光谱发生了明显的红移,说明多孔硅孔壁厚度增加导致孔内有效折射率发生变化,由此证明待测抗原成功连接到多孔硅内。
5)将qds-抗体滴加到不同浓度待测抗原修饰过的多层多孔硅中,如图5所示,可以看到量子点免疫反应结合物的荧光呈现梯度变化,随着多孔硅内待测抗原浓度的不断增加,连接到多孔硅上的抗体数量增加,而抗体与量子点偶联,说明连接到多孔硅上的量子点数量也在不断增加,荧光强度也不断增加。选择多孔硅作为基底一是因为多孔硅的布拉格反射镜的高反射带可以将量子点免疫结合物的荧光进一步增强,提高检测灵敏度,二是经过多次清洗,可以将没有反应的量子点-抗体彻底清洗掉,排除没有连接到多孔硅内的量子点荧光的干扰。
6)如图6,可以看到(包虫病)抗原浓度从15pg/ml到0.5pg/ml对应的量子点免疫反应结合物的荧光强度,待测抗原浓度与量子点免疫反应结合物荧光强度成线性关系,线性方程为y=312.9+26.86348x,其中y代表量子点免疫反应结合物的荧光强度,x代表待测抗原浓度。利用计算机软件orgin进行拟合,拟合系数为0.99789,拟合度非常高。从图中数据可以看出基于多孔硅和量子点结合的荧光生物传感器的检出限为500fg/ml。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺