一种基于链置换放大和表面临近杂交反应的AFB1电化学检测方法及应用与流程
本发明属于农产品质量安全检测技术领域,涉及农产品中黄曲霉毒素B1(AFB1)的检测,具体涉及一种基于链置换放大和表面临近杂交反应的AFB1电化学检测方法及应用。
背景技术:
黄曲霉毒素( aflatoxin,AF) 作为许多霉菌的二级代谢物,在田间和存储过程中能够污染大多数农产品,比如谷物、花生、玉米、油籽等多种粮食和饲料,已经成为影响食品安全、危害人类和动物健康的巨型杀手。目前已经发现的黄曲霉毒素具有诱导突变、抑制免疫和致癌作用,被世界卫生组织的癌症研究机构划定为Ⅰ类致癌物质,目前已经发现的有AFB1、AFB2、AFG1、AFG2、AFM1和AFM2等18种,其中以AFB1最为多见,危害性也最强。据报道,AFB1的毒性分别是呕吐毒素的30倍,玉米赤霉烯酮的20倍,氰化钾的10倍,砒霜的68倍。因此,很多国家制订了严格的AF限量标准,其中尤以欧盟的最为苛刻,规定花生中AFB1含量不得超过2 ppb,婴儿食品中AFB1含量不得高于0.1 ppb(European Commission regulation 1881/2006)。目前黄曲霉毒素B1(AFB1)的检测方法主要有高效液相色谱法(HPLC)、薄层层析法(TLC)、酶联免疫法(ELISA) 等。因大多数情况下,农产品中AFB1的含量极其微量,所以开发操作简单、灵敏度高、准确性好、检测通量高的检测方法对于减少AF对人类生命安全的危害、保证国际进出口贸易的畅通具有极其重要的作用。
核酸适配体作为单链寡核苷酸(20~60碱基),被称为“化学抗体”,具有诸多优点:特异性高,兼容性好,稳定性好且易合成,易标记。电化学生物传感检测方法具有快速、灵敏、仪器设备简单等特殊优势。
技术实现要素:
本发明为解决目前AFB1检测方法的灵敏度低,操作难度大,检测成本高的技术难题,公开了一种基于链置换放大和表面临近杂交反应的AFB1电化学检测方法及应用。
为解决上述技术难题,本发明采用以下技术方案:
一种基于链置换放大和表面临近杂交反应的AFB1电化学检测方法,所述检测方法将AFB1核酸酸适配体作为分子识别元件,丝网印刷电极作为换能器,采用恒温链置换扩增方法进行信号放大后,再通过表面临近杂交反应进行信号输出。
所述AFB1核酸酸适配体的序列如SEQ ID NO:1所示。
基于链置换放大和表面临近杂交反应的AFB1电化学检测方法,包括以下步骤:
(1)磁珠的表面修饰:将生物素标记的AFB1核酸适配体和Block探针储备液,分别经95℃ 5min,0℃ 10min的预处理,然后用AFB1 1×BB缓冲液稀释至200nM,并于室温杂交30min,制得杂交混合液;同时,取50 µL磁珠用500 µL AFB1 1×BB缓冲液洗涤两次;取200µL杂交混合液于离心管中加入洗涤过的磁珠,于室温下孵育15min,最后再用500 µL AFB1 1×BB缓冲液,洗涤孵育过的磁珠两次,完成磁珠的表面修饰;
(2)丝网印刷电极的预处理及传感界面的制备:在经无水乙醇和去离子水洗涤干净的丝网印刷电极的电极表面上,滴加40 µL 0.1 M H2SO4溶液,在2V直流电压下活化60s,在活化后的丝网印刷电极上,滴加4 µL含有1μM巯基修饰探针的缓冲溶液,在30℃条件下组装3h,用AFB1 1×BB缓冲液清洗组装后的丝网印刷电极,最后滴加4 µL 1 mM6-巯基己醇溶液于室温中封闭30min,用AFB11×BB缓冲液清洗3次后,将丝网印刷电极吹干于4℃备用;
(3)AFB1结合介导的链置换和表面临近杂交反应:在AFB1靶标溶液中加入50µL步骤(1)中修饰好的磁珠,于室温下轻轻震荡孵育30 min,随后磁分离,取10 µL上清,加入10 µL 10×NEB buffer 3.1、2 µL 0.5 μM 链置换探针、2 µL 10 mM dNTPs、4 µL 2 U/µL聚合酶和2 µL 10 U/ µL切刻内切酶,用去离子水补充反应体系到100 µL,于55℃下反应1h;接着添加10 µL二茂铁标记探针,混合均匀后,取40 µL滴加到(2)中,修饰好的丝网印刷电极表面室温反应30 min,最后用1×AFB1缓冲液洗涤干净并用氮气吹干;
(4)电化学检测:向经步骤(3)处理过的丝网印刷电极表面滴加40 µL 含有10 mM MgCl2的0.1 M KClO4溶液,然后进行差示脉冲电化学检测。
所述步骤(1)中Block 探针的序列如SEQ ID NO:2所示,Block 探针储液的浓度为10 µM;所述AFB1 1×BB缓冲液的配方为:10 mM Hepes, 120 mM NaCI, 5 mM KCI, 5 mM MgCl2, pH 7.0。
所述步骤(2)中巯基修饰探针的序列如SEQ ID NO:3所示,巯基修饰探针的缓冲溶液的配方为:1μM巯基修饰探针、1M NaCl和1mM TCEP。
所述步骤(3)中链置换探针的序列如SEQ ID NO:4所示,二茂铁标记探针如SEQ ID NO:5所示。
所述步骤(4)中的电化学检测在电化学工作站上进行,具体参数为窗口扫描宽度为0-0.5 V,脉冲宽度为50 mV,静默时间0.2 s,脉冲宽度为0.06 s。
基于链置换放大和表面临近杂交反应的AFB1电化学检测方法,作为检测作物中AFB1的应用。
本发明的有益效果在于:
(1)本发明采用AFB1核酸适配体作为分子识别元件,特异性进一步提高;同时,因核酸的合成成本非常低,且已经商业化,大大降低了AFB1的检测成本。
(2)本发明利用“化学抗体”核酸适配体的高特异性特点,结合链置换扩增信号放大策略,同时采用表面临近杂交的信号输出方式,构建了一种测定黄曲霉毒素B1的电化学核酸适配体传感器,具有简单快捷、高灵敏、高特异性的优点。
(3)本发明采用丝网印刷电极作换能器,具有操作简单、易于批量分析的优点。
附图说明
图1为活化后的丝网印刷电极特征峰值图。
图2为检测原理示意图。
图3为检测方法特异性分析图。
图4为标准工作曲线及线性范围图。
具体实施方式
一种基于链置换放大和表面临近杂交反应的AFB1电化学检测方法,所述检测方法将AFB1核酸酸适配体作为分子识别元件,丝网印刷电极作为换能器,采用恒温链置换扩增方法进行信号放大后,再通过表面临近杂交反应进行信号输出。
所述AFB1核酸酸适配体的序列如SEQ ID NO:1所示。
基于链置换放大和表面临近杂交反应的AFB1电化学检测方法,包括以下步骤:
(1)磁珠的表面修饰:将生物素标记的AFB1核酸适配体和Block探针储备液,分别经95℃ 5min,0℃ 10min的预处理,然后用AFB1 1×BB缓冲液稀释至200nM,并于室温杂交30min,制得杂交混合液;同时,取50 µL磁珠用500 µL AFB1 1×BB缓冲液洗涤两次;取200µL杂交混合液于离心管中加入洗涤过的磁珠,于室温下孵育15min,最后再用500 µL AFB1 1×BB缓冲液,洗涤孵育过的磁珠两次,完成磁珠的表面修饰;
(2)丝网印刷电极的预处理及传感界面的制备:在经无水乙醇和去离子水洗涤干净的丝网印刷电极的电极表面上,滴加40 µL 0.1 M H2SO4溶液,在2V直流电压下活化60s,在活化后的丝网印刷电极上,滴加4 µL含有1μM巯基修饰探针的缓冲溶液,在30℃条件下组装3h,用AFB1 1×BB缓冲液清洗组装后的丝网印刷电极,最后滴加4 µL 1 mM6-巯基己醇溶液于室温中封闭30min,用AFB11×BB缓冲液清洗3次后,将丝网印刷电极吹干于4℃备用;
(3)AFB1结合介导的链置换和表面临近杂交反应:在AFB1靶标溶液中加入50µL步骤(1)中修饰好的磁珠,于室温下轻轻震荡孵育30 min,随后磁分离,取10 µL上清,加入10 µL 10×NEB buffer 3.1、2 µL 0.5 μM 链置换探针、2 µL 10 mM dNTPs、4 µL 2 U/µL聚合酶和2 µL 10 U/ µL切刻内切酶,用去离子水补充反应体系到100 µL,于55℃下反应1h;接着添加10 µL二茂铁标记探针,混合均匀后,取40 µL滴加到(2)中,修饰好的丝网印刷电极表面室温反应30 min,最后用1×AFB1缓冲液洗涤干净并用氮气吹干;
(4)电化学检测:向经步骤(3)处理过的丝网印刷电极表面滴加40 µL 含有10 mM MgCl2的0.1 M KClO4溶液,然后进行差示脉冲电化学检测。
所述步骤(1)中Block 探针的序列如SEQ ID NO:2所示,Block 探针储液的浓度为10 µM;所述AFB1 1×BB缓冲液的配方为:10 mM Hepes, 120 mM NaCI, 5 mM KCI, 5 mM MgCl2, pH 7.0。
所述步骤(2)中巯基修饰探针的序列如SEQ ID NO:3所示,巯基修饰探针的缓冲溶液的配方为:1μM巯基修饰探针、1M NaCl和1mM TCEP。
所述步骤(3)中链置换探针的序列如SEQ ID NO:4所示,二茂铁标记探针如SEQ ID NO:5所示。
所述步骤(4)中的电化学检测在电化学工作站上进行,具体参数为窗口扫描宽度为0-0.5 V,脉冲宽度为50 mV,静默时间0.2 s,脉冲宽度为0.06 s。
基于链置换放大和表面临近杂交反应的AFB1电化学检测方法,作为检测作物中AFB1的应用。
以下结合具体实施例,对本发明进行详细说明。
1.一种基于链置换放大和表面临近杂交策略的黄曲霉毒素B1(AFB1)电化学检测方法,包括以下步骤:
(1)磁珠的表面修饰
生物素标记的AFB1核酸适配体如SEQ IDNO:1所示,其3’端修饰有Biotin基团和10 μM Block 探针如SEQ ID NO:2所示,储备液先经过95℃ 5 min,0℃ 10 min的预处理,然后用AFB1 1×BB缓冲液(10 mM Hepes, 120 mM NaCI, 5 mM KCI, 5 mM MgCl2, pH 7.0)稀释到200 nM,并于室温杂交30 min。同时,取50 µL MP-SA-10 磁珠用AFB1 1×BB洗涤两次,500 µL/次,然后取200 µL上述杂交好的混合溶液于1 mL离心管中与洗涤干净的磁珠于室温下孵育15 min,最后用AFB1 1×BB洗涤修饰好的磁珠两次,500 µL/次,4℃存储备用。
(2)丝网印刷电极的预处理及传感界面的制备
新的丝网印刷电极先用无水乙醇和去离子水洗涤干净,滴加40 µL 0.1 M H2SO4于电极表面,并施加+2 V的直流电压活化60 S。往活化后的丝网印刷电极表面滴加40 µL 0.1 M H2SO4,进行循环伏安扫描,窗口扫描宽度为0~1.5 V,扫描速率为100 mV/s,结果如图1所示。活化后的丝网印刷电极的特征峰与多晶金电极在硫酸中的循环伏安特征峰极其相似。往活化后的电极表面立即滴加4 µL含有1μM巯基修饰探针如SEQ ID NO:3所示,3’端修饰有SH基的缓冲溶液(含有1 M NaCl和1 mM 磷酸三(2-氯乙基)酯(TCEP)),30℃下组装3 h,用AFB11×BB (10 mM Hepes, 120 mM NaCI, 5 mM KCI, 5 mM MgCI2, pH 7.0)清洗干净。最后滴加 4 µL 1 mM6-巯基己醇溶液中室温封闭30 min,用1×BB清洗3次后,将电极清洗干净后吹干4℃备用。
(3)AFB1结合介导的链置换和表面临近杂交反应及电化学检测
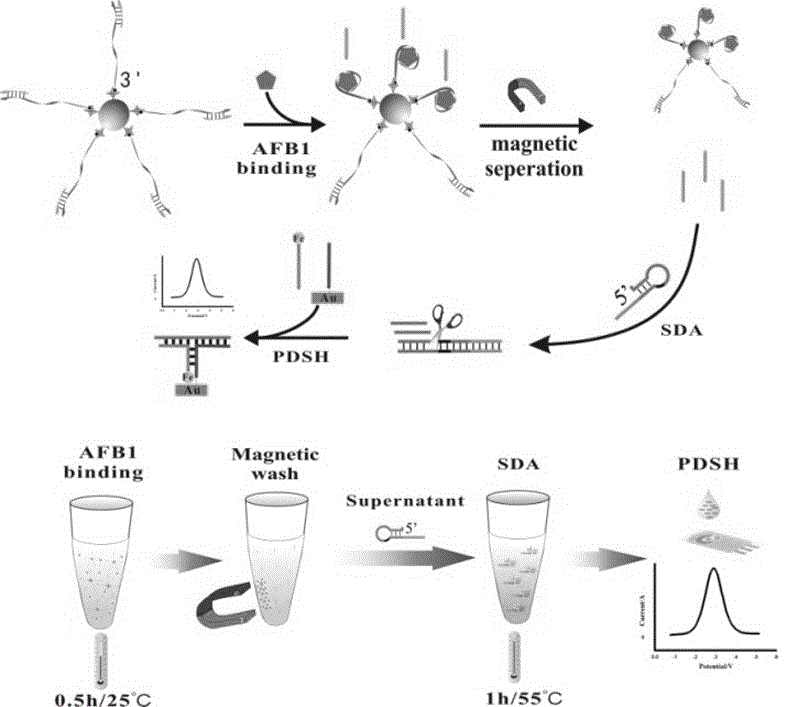
基于链置换放大和表面临近杂交策略的黄曲霉毒素B1电化学检测方法的原理如图2所示。3’端生物素标记的AFB1适配体与Block探针形成的杂交复合物预先固定在磁珠表面,AFB1存在的情况下,Block探针与AFB1竞争与适配体结合。因AFB1与适配体的结合力大于Block探针与适配体的结合力,Block探针被竞争下来。离心后,收集上清中的Block探针加入链置换扩增体系,触发启动链置换扩增反应从而产生大量的扩增子。
该扩增子能够协同参与随后的表面临近杂交反应:巯基修饰探针,二茂铁标记探针和扩增子三者的协同反应,从而在丝网印刷电极表面引入电活性探针,产生相应的电信号。如果AFB1不存在,就不会发生AFB1结合介导的链置换反应和表面临近杂交反应,自然不会产生电流信号。因此,该方法是一种signal-on检测模式。链置换扩增技术的引入,保证了该方法具有足够的灵敏度;表面临近杂交的信号输出策略将该检测原理转变成signal-on模式,从而进一步提高了方法的灵敏度;丝网印刷电极的使用,确保该方法可以大规模平行测试,保证了足够的检测通量。
具体实施步骤为:一定浓度的AFB1靶标加入50 µL上述(1)中修饰好的磁珠中,于室温下轻轻震荡孵育30 min,随后磁分离,取10 µL上清,10 µL 10×NEB buffer 3.1 (1 M NaCl, 500 mM Tris-HCl, 100 mM MgCl2, 1 mg/mL BSA, pH 7.9), 2 µL 0.5 μM 链置换探针(SDA probe,如SEQ ID NO:4所示), 2 µL dNTPs (10 mM), 4 µL Vent exo-聚合酶 (2 U/µL), 2 µL Nt.Bst NBI (10 U/ µL) 切刻内切酶,并用灭菌的去离子水调整反应体积到100 µL,55℃下反应1 h。接着添加 10 µL二茂铁标记的探针如SEQ ID NO:5所示,其5’端修饰有二茂铁基团并混合均匀,取40 µL滴加到(2)中修饰好的电极表面室温反应30 min,最后用1×AFB1缓冲液洗涤干净并用氮气吹干。
(4)电化学检测
紧接着滴加40 µL 含有10 mM MgCl2的0.1 M KClO4溶液到上述(3)修饰好的电极表面,进行差示脉冲(DPV)电化学检测。窗口扫描宽度为0~0.5 V,脉冲宽度为50 mV, 静默时间0.2 s,脉冲宽度为0.06 s。电化学检测在UI5020 型电化学工作站上于室温条件下进行:电化学实验使用通用的丝网印刷电极:工作电极为修饰好的金电极,铂电极为辅助电极,氯化银作参比电极。
为了验证方法的特异性,专门针对污染玉米中常见的共生毒素如FB1, AFB2, OTA, 和T-2 毒素进行了干扰测试,结果如图3所示。该检测方法的特异性很高,对FB1, AFB2, OTA和T-2 毒素几乎无响应;即使针对与AFB1结构极其相似的AFB2毒素,也仅仅产生大约20%的干扰信号。
(5)建立标准曲线
往修饰好的电极表面滴加40 µL 含有10 mM MgCl2的0.1 M KClO4溶液,进行DPV电化学检测,记录峰电流值。其他浓度的AFB1标准液(0.1 pM、1 pM、10 pM、100 pM、1 nM、10 nM)重复以上(3)、(4)实验操作依次进行DPV测量,并记录相应的峰电流值。以峰电流值作纵坐标,以AFB1浓度作横坐标作图,建立测定AFB1的标准曲线。
在优化条件下,对AFB1进行了定量测定,结果如图4所示,该方法的检测范围为0.1 pM~10 nM,检测限为0.1 pM (3倍背景信号强度),线性方程为y = 16.89 ln (CAFB1) + 89.63(R² = 0.991)。
(6)玉米样品分析
称取5 g已粉碎的玉米样品,加入15 mL 乙腈:水(4:6,v/v)提取液,室温振荡提取20 min,4℃离心(4000 g)10 min,上清用孔径为0.22 mm的定性滤纸过滤后用1×BB溶液稀释4倍。然后按照上述(3)、(4)操作,进行DPV电化学检测,记录峰电流值。利用上述(5)所建立的黄曲霉毒素B1标准曲线,计算出玉米样品溶液中的AFB1浓度,并与商业化的ELISA试剂盒进行对比,用于实际玉米样品的筛查分析。
<110> 河南省农业科学院农业质量标准与检测技术研究所
<120>一种基于链置换放大和表面临近杂交反应的AFB1电化学检测方法及应用
<160> 5
<210> 1
<211> 47
<212> DNA
<213> 人工序列
<220>
<221> misc_difference
<222> (1)…(47)
<400> 1
gttgggcacg tgttgtctct ctgtgtctcg tgcccttcgc taggccc 47
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<220>
<221> misc_difference
<222> (1)…(21)
<400> 2
acacgtgccc aacaatctgg t 21
<210> 3
<211> 14
<212> DNA
<213> 人工序列
<220>
<221> misc_difference
<222> (1)…(14)
<400> 3
gcagcaaaga gtcg 14
<210> 4
<211> 50
<212> DNA
<213> 人工序列
<220>
<221> misc_difference
<222> (1)…(50)
<400> 4
gcagcaacaa tctggacagt ttttgactca ccagattgtt gggcacgtgt 50
<210> 5
<211> 17
<212> DNA
<213> 人工序列
<220>
<221> misc_difference
<222> (1)…(17)
<400> 5
cgactctcaa tctggac 17
- 还没有人留言评论。精彩留言会获得点赞!