免疫突触的质量预测了嵌合抗原受体(CAR)T细胞的效能的制作方法
技术领域
本公开实施例至少涉及细胞生物学、分子生物学、免疫学和医学领域。
背景技术:
近年来,基于嵌合抗原受体修饰的过继性T细胞疗法的研究进展表明通过增强嵌合抗原受体T细胞的效能可显著提高癌症患者的治疗成功性。现有知识的主要缺陷是没有一个简单的方法来预测嵌合抗原受体T细胞的效能。具体而言,各实验室的科学家们通过微小改动生成了不同的嵌合抗原受体。然而,在这些改进后的嵌合抗原受体能够进入临床试验之前,必须通过经济的方式准确评估它们的质量、安全性的潜在效能.质量及效能的传统免疫分析工具耗时耗力,成本昂贵,而且不准确。
免疫突触(IS)最初是通过对T细胞与抗原递呈细胞(APC)之间的相互作用进行成像来描述的。通过对T细胞与含MHC-肽复合物及其它共刺激分子的玻片脂双层之间的相互作用进行成像,可进一步证实突触的结构、功能和信号转导通路。免疫学领域的普遍共识是可用玻片脂双层系统来模拟靶细胞,在高分辨率下研究突触。尽管着重于IS结构、功能、信号转导通路的基础研究取得了巨大进展,但迄今为止还没有研究涉及了嵌合抗原受体的突触如何控制嵌合抗原受体T细胞活动这一问题。
本发明为该领域如何测定治疗性免疫细胞(如:嵌合抗原受体T细胞)的效能这一长期需求提供了解决方案。
主要发明概要
本发明涉及带一个或多个抗原识别基团细胞的功效的测定系统与方法。在具体实施例中,所述基团包括嵌合抗原受体(CAR)、工程T细胞受体(TCR)以及其它自然活化受体,如:自然杀伤细胞2族成员D配体(NKG2D)免疫疗法
在某些实施例中,本发明的方法和组合物测定了特定的治疗性细胞(如:非自然治疗性免疫细胞等治疗性免疫细胞)的功效。在具体实施例中,免疫细胞可结合肿瘤抗原等特定抗原。免疫细胞可表达一个或多个嵌合抗原受体。
在具体实施例中,通过结构和功能参数(在某些实施例中还通过交互后信号转导通路),用嵌合抗原受体及其它靶抗原间的免疫突触质量来预测或测定带嵌合抗原受体的免疫细胞(如:至少为T细胞或NK 细胞)及其它细胞毒性淋巴细胞(如:NKT细胞)的效能。在具体实施例中,用成像方法来测定免疫突触以及嵌合抗原受体自身突触是如何控制嵌合抗原受体T细胞活化的。
至少在某些实施例中,免疫突触指的是免疫细胞与其它类型细胞(如:其它类型免疫细胞)间的相互作用,如:T细胞和抗原递呈细胞(APC),如:T细胞抗原受体与主要组织相容性复合物分子——肽复合物之间的相互作用。
在本发明实施例中,免疫突触预测着嵌合抗原受体(CAR)T细胞的效能,且至少在某些情况下可通过这两个互补系统中的一个或两个来实现突触的可视化。这些系统可为体外或体内系统,并且每个系统可以实现全细胞分析或非全细胞分析,如:模拟细胞膜的膜。
本发明实施例包括可确定嵌合抗原受体T细胞能否形成稳定免疫突触的方法。
某些实施例涉及量化和测定一个或多个含嵌合抗原受体细胞(如:嵌合抗原受体T细胞)的结构、信号转导及功能。在具体实施例中,在多个嵌合抗原受体T细胞上确定了多种嵌合抗原受体类型的免疫突触。在具体实施例中,可一次测定多个嵌合抗原受体效能。在某些实施例中,在单个细胞上测定了多种嵌合抗原受体,同时测定了不同嵌合抗原受体的多个细胞。此时,可利用同一系统中的不同标记来区分不同的嵌合抗原受体及其各自的抗原。
通过本领域的标准方法,系统的任何成分均可标记,如:嵌合抗原受体自身,嵌合抗原受体结合的抗原,T细胞成分,B细胞成分,共刺激受体的配体,或免疫细胞生成的所有细胞因子(如:T,B,DC 和NK细胞)等。
本发明实施例涉及一种包含了脂双层的系统,脂双层的结构和功能属性能使其模拟免疫突触。
本发明实施例包括玻片脂双层(SLB)系统。由于SLB能在形成水平界面的同时模拟靶细胞表面,因而该技术最有用的应用之一即是研究免疫突触的形成。该方法对抗原递呈细胞(APC)或免疫细胞进行了处理,这样有利于进入玻片平面脂表面的蛋白的附着以及在两个方向上的自由移动。该方法能用高分辨率荧光显微镜直接看到突触,并首次对免疫突触的结构进行“面对面”观察。
前面已大致概述了本发明的特征和技术优势,以便于更好的理解本发明详细描述。下文将描述构成本发明权利要求主题的其它特征及优势。对其它结构进行改进和设计后,本发明公开的概念及具体实施例更方便实现该用途,这一点本领域技术人员应高度重视。本领域技术人员还应认识到,该等效结构并未偏离权利要求所述的、本发明的精神与范围。将以下描述与附图结合起来可更好的理解本发明的新颖特征 (在结构和操作方法上的)以及其它目的和优点。然而,要明确的一点是,每个附图仅作说明和描述用,而并非对本发明进行限制。
附图说明
为了更全面的理解本发明,现将结合附图引用以下描述,其中,
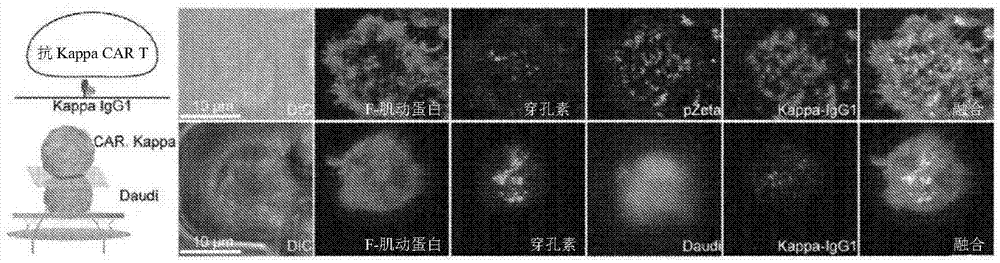
图1:嵌合抗原受体T细胞免疫突触的可视化(a)
含Alexa Fluor 647标记人kappa IgGl的脂双层图像(左),以及带Alexa Fluor 647标记人kappa IgGl 的脂双层上的CAR突触的共焦图像(右)下图显示了VCP系统的示意模型(左)、与kappa链阳性预染色 Daudi细胞(青色)共轭的kappa-CAR T细胞的共焦图像(右),(b)含Alexa Fluor 568标记CD19的脂双层图像(左)和带Alexa Fluor 568-CD19脂双层上具有代表性的kappa-CAR T细胞的共焦图像(右) 下图显示了带CD19-CAR T及其易感Raji细胞的VCP系统的示意模型(左),以及通过VCP系统与CD19阳性Rajj细胞(青色)共轭的CD19-CAT T细胞的共焦图像(右)分别对照穿孔素(绿色)、pZeta(青色)、 F-肌动蛋白(品红色),对固着的、渗透化CAR T细胞进行Ab染色。比例尺条表示10.0μιη.DIC=鉴别干涉对比
图2:4-lBB-CAR和CD28-CAR T细胞形成的IS的量化质量(a)共焦显微镜下带人kappa IgGl-Alexa Fluor 647脂双层上的kappa-4-lBB-CAR T和kappa-CD28-CAR T细胞(红)用穿孔素(绿色)、pZeta(青色)和F-肌动蛋白(品红色)对固着的、渗透化CAR T细胞进行染色。比例尺条表示25.0μιη。(b) 通过测量F-肌动蛋白、pZeta和kappa簇的平均强度以及穿孔素阳性细胞在kappa IgGl脂双层上的百分比含量对脂双层T细胞焦面上的IS进行量化。误差条显示±标准误差(s.d.)。数据代表三个独立实验。
图3:标准r51释放试验及胞内细胞因子试验无法区分4-lBB-CAR和CD28-CAR这两者的不同。用 4-h 51Cr-释放试验测量来自两个健康供体(供体#1和供体#2)的kappa-CAR T(a)和CD19-CAR(b)细胞的细胞毒性。将三个kappa阳性B细胞淋巴瘤细胞株(Daudi,JEKOl和BJAB)作为kappa-CAR T细胞的靶细胞。误差条显示±s.d.将两个CD19阳性B细胞淋巴瘤细胞株(Daudi和Raji)作为靶细胞。误差条显示±s.d.用4-IBB构建(红点)或CD28构建(黑点)的逆转录病毒转导5个个体的PBMCs。kappa-CAR (c)和CD 19(d)分泌的TNF-α和IFN-γ通过Golgistop和Brefildin A治疗,用靶细胞刺激6小时后,用流式细胞术测量CAR。测量TNF-α或IFN-γ细胞的百分比
图4:长期杀伤试验测量4-1BB CAR T细胞的超高抗肿瘤活性。(a)连续杀伤测试的实验设计图; (b和c)通过肿瘤细胞中的减少(左)和效应细胞中的增加(右)来测定kappa-CAR(b)和CD19-CAR(c) 的抗肿瘤效应。用表达荧光蛋白mCherry的Kappa阳性Daudi细胞作为靶细胞。
图5:抗肿瘤效应及IS质量间的正相关性。(a)突触质量与杀伤效率间的相关性分析(肿瘤数量曲线下的面积的倒数);(b)突触质量和增殖效率间的相关性分析(T细胞数量曲线下的面积。用F-肌动蛋白、pZeta和肿瘤抗原簇的强度以及穿孔素百分比来测量突触质量。计算皮尔森r-值。每个点表示一个供体。
图6:编码CAR的重组逆转录病毒载体的示意图。kappa-和CD19-CAR构建体均包含CD28跨膜区和zeta的胞内区。
图7:IS质量的量化将CAR T细胞加入含Alexa Fluor 647标记kappa IgGl的脂双层中。用Abs 进行细胞染色,对照穿孔素、pZeta和鬼笔环肽。根据测得的F-肌动蛋白、pZeta、kappa簇的平均强度,以及含kappa IgGl脂双层上的穿孔素阳性蛋白百分比,对脂双层下的IS进行量化。误差条显示±s.d.
图8:kappa-CAR T细胞与带kappa抗原的脂双层间的相互作用。4-1BB-和CD28-CAR T细胞的共焦图像。带Alexa Fluor 647-标记Kappa IgGl(b)或带Alexa Fluor 647-标记Lambda IgGl(a,对照) 的脂双层上的CAR T细胞。用穿孔素(绿色)、pZap70(黄色或青色)、LCK(绿色)或F-肌动蛋白(品红色)对固着CAR T细胞染色。比例尺条表示25.0μιη.(c)F-肌动蛋白、pZAP70、kappa簇的平均强度以及穿孔素百分比的量化。误差条显示±s.d.
图9:CD19特异性4-lBB.CAR T细胞中良好的IS质量。(a)共焦显微镜下CD19-Alexa Fluor 568 脂双层上带活化4-1BB或CD28的CD19-CAR T细胞。用穿孔素、pZeta对固着的、渗透化CD19-CAR T细胞进行染色,然后分别用鬼笔环肽、Alexa Fluor 532(品红色)、Alexa Fluor 647-(绿色),Alexa Fluor 488- (青色)共轭次级Abs进行培养。比例尺条表示25.0μιη。(b)通过测得的F-肌动细胞、pZeta和CD19 簇以及含CD19脂双层上穿孔素阳性细胞百分比量化脂双层下的IS。误差条显示±s.d.
图10:4-1BB.CAR T细胞具有增强的抗肿瘤活性和增殖能力。
(a)嵌合抗原受体.从四个不同的健康供体中分离出Kappa T细胞,并用4-IBB和CD28构建体进行转导。将表达荧光蛋白mCherry的靶Daudi细胞与CAR T细胞混合放置7天。流式细胞术测得的靶细胞和CAR T细胞的数量。(b)从四个不同健康供体中分离出CAR CD19T细胞,并用4-1BB和CD28构建体进行转导。将Raji-GFP靶细胞与嵌合抗原受体T细胞混合放置7天。流式细胞术测得的靶细胞与嵌合抗原受体T细胞的数量。
图11:来自5个个体的4-lBB-kappa-CAR T细胞的超高抗肿瘤活性。用4-IBB kappa-CAR(红点) 或CD28kappa-CAR(黑点)逆转录病毒转导来自5个健康供体的PBMCs。分别计算靶细胞数量曲线以下的面积倒数(杀伤效率,左)以及效应细胞数量曲线以下的面积(增殖效率,右)与kappa阳性Daudi细胞株共培养以激活转导嵌合抗原受体T细胞,由此量化抗肿瘤活性。两个独立试验的混合数据配对t检验的 P值
图12:五个个体的4-lBB-CAR T细胞表现为较高的IS质量
用kappa-4-lBB-CAR(红点)或kappa-CD28-CAR(黑点)逆转录病毒对来自五个健康供体的PBMCs进行转导。计算F-肌动蛋白、pZeta、抗原簇的MFI以及kappa-CAR T细胞的穿孔素极化百分比。用带kappa-Alexa Fluor 647的脂双层活化转导嵌合抗原受体T细胞,对质膜上的MFI进行量化以评估IS质量。两个独立试验的混合数据配对t检验的P值
具体实施方式
一.定义
根据长期的专利法公约,当在本说明书中与包括权利要求的词一起使用时,词“一个”表示“一个或多个”。本发明的一些实施例可以由本发明的一个或多个元件、方法步骤和/或方法组成或基本上由它们组成。可以想到,在不脱离本发明的精神和范围的情况下,本文所述的任何方法或复合物可以相对于本文所述的任何其它方法或复合物实施,所述方法或复合物被公开并且仍然获得类似或相似的结果。
本文所用术语“免疫突触”是指免疫细胞与任何其它类型细胞(包括另一种免疫细胞,包括另一种免疫细胞,例如抗原呈递细胞或靶细胞和淋巴细胞,例如效应T细胞)之间的界面。
二.一般实施例
本发明的实施方案涉及使用系统来确定需要确定其治疗功效的一种或多种细胞群的用途的方法和复合物。所述系统可以利用一个或两个或更多个测定方法来测试来自相同群体的细胞,并且所述测定可以是体外或体内的。在某些实施方案中,利用脂质双层系统来确定与膜内抗原结合的功效以及随后与结合的下游事件。
本文应用玻璃支持的平面脂质双层系统以高分辨率研究与其靶抗原的嵌合抗原受体突触。分析包括视觉方面,图像揭示了嵌合抗原受体突触的几个特性,包括抗原结合,抗原结合直接反映了嵌合抗原受体蛋白在嵌合抗原受体T细胞上的分布,并积聚在突触中心。多个参数预测嵌合抗原受体T细胞的有效性,并且在特定实施方案中,有效性通过长期杀伤测定期间肿瘤细胞数量和T细胞增殖中的一个或两个来测量。在另外的实施方案中,开发了一种新的成像系统,以高通量的方式水平研究嵌合抗原受体T细胞的免疫突触。垂直细胞配对系统使得嵌合抗原受体T细胞的免疫突触在固定细胞和活细胞成像的水平焦平面上成像。在具体实施方案中,免疫突触的质量可以预测嵌合抗原受体T细胞的有效性,这为免疫治疗领域提供了一种促进嵌合抗原受体T治疗发展的新策略。
三.测定基因修饰免疫细胞的功效
本发明的实施方案涉及测定任何修饰的免疫细胞,例如基因修饰的免疫细胞的功效。免疫细胞可以是任何类型,包括T细胞、NK细胞、NKT细胞或树突细胞。细胞可以通过任何方式修饰,包括例如通过表达外源添加的载体。细胞可以被修饰以表达嵌合抗原受体(嵌合抗原受体)、工程化T细胞受体等。
采用嵌合抗原受体修饰免疫细胞的过继性细胞疗法通过增强T细胞的有效性来提高恶性肿瘤患者的总体生存率。精确预测多种嵌合抗原受体T细胞的有效性是当今免疫治疗中尚未解决的关键问题之一。T细胞的最佳功能取决于免疫突触的质量。然而,由有效和不太有效的嵌合抗原受体T细胞与其易感肿瘤细胞形成的突触的关键差异仍然不清楚。在本发明中,嵌合抗原受体T细胞的有效性至少通过多种参数评估嵌合抗原受体T突触的质量来预测,所述参数例如通过F-肌动蛋白的定量、肿瘤抗原的中心聚集、溶解颗粒的极化和/或突触内关键信号分子的分布。如本文具体实施例所示,长期杀伤能力与共享相同抗原特异性的两种不同嵌合抗原受体T细胞中突触的质量正相关。在某些实施方案中,突触的质量与体外嵌合抗原受体 T细胞的性能相关。因此,在特定实施例中,用突触的质量预测嵌合抗原受体T细胞的有效性,提供了指导嵌合抗原受体T治疗的新策略。
因此,在某些实施例中,用突触的质量预测嵌合抗原受体T细胞的有效性,提供了指导嵌合抗原受体T细胞治疗的新策略。体外系统可以使用一个或多个脂质双层来模拟细胞膜,并且在这种情况下,脂质双层可以包括特定嵌合抗原受体T细胞能够结合的一个或多个部分。在具体实施方案中,标记脂质双层中的一个或多个部分,并且标记可以是任何类型,包括例如荧光、放射性或比色。在特定实施例中,脂质双层固定到基底上,并且在特定实施例中,基底是玻璃、塑料、能够支撑脂质双层的任何类型的材料(聚二甲基硅氧烷)等。
在特定实施例中,采用在两种或多种小区类型之间利用蜂窝分析的系统,并且这种系统可以是或可以不是高通量系统。高通量形式系统能够以高装载效率同时分析至少1、10、100、1000、1500或2000、 3000或更多缀合物。在特定实施例中,系统是垂直细胞配对系统(参见图1)允许使用一种或者多种类型成像方法分析嵌合抗原受体T细胞的免疫突触。在特定实施方案中,细胞类型采用嵌合抗原受体T细胞和抗原呈递细胞,例如B细胞。在某些实施例中,垂直细胞配对系统使得能够在水平焦平面中成像,并且可以固定一种或两种类型的细胞用于成像。在特定实施例中,细胞在成像时是活的。使用垂直细胞配对系统,首次提供了对嵌合抗原受体T细胞IS结构和信号的“面对面”观察。
在特定实施方案中,免疫突触的功效除了有效引发适当信号级联的能力之外,还通过多种方法确定,包括结构和功能。例如,结合到位于脂质双层内的相应肿瘤抗原的嵌合抗原受体的特定分布在结构上指示有效嵌合抗原受体。例如,可以评估嵌合抗原受体T突触的质量,包括通过定量F-肌动蛋白(强度)、肿瘤抗原的中心聚集(分布和强度)、溶解颗粒的极化(分布和定位)和/或突触内关键信号分子的分布/ 荧光强度。
在某些实施方案中,免疫突触的质量通过确定充分激活细胞内下游信号的能力来确定。可以同时或在不同时间调查各种下行信令成员,包括多于一个的下行信令成员。在特定实施方案中,测定利用针对下游信号传导的一个或多个成员的抗体(也可以使用荧光标记的信号传导分子或其它技术标记的信号传导分子,例如酶或放射性物质)。在特定实施方案中,可以测定以下一种或多种:1)嵌合抗原受体上zeta 链的磷酸化,其指示有效的嵌合抗原受体信号传导,并且pZeta是近侧嵌合抗原受体信号传导分子;2)F -肌动蛋白,显示突触稳定性;3)穿孔素,其指示溶解颗粒;4)pZAP70,远端信号通路的一部分,并指示活化T淋巴细胞的长期增殖和分化;5)Lck,远端信号通路的一部分,并指示活化T淋巴细胞的长期增殖和分化;6)测定对肿瘤细胞的杀伤活性,例如通过测定嵌合抗原受体T细胞的细胞毒性;7)细胞内细胞因子分泌(例如产生TNF-oc和/或IFN-γ和/或IL-2和/或其它细胞因子);8)增殖能力;9)杀死效率,例如杀死期望的细胞,包括癌细胞和/或T调节细胞,尽管可以通过任何手段分析嵌合抗原受体上 zeta链的磷酸化,但是在特定实施方案中,可以分析针对磷酸化位点的抗体的磷酸化,例如酪氨酸83。当特定抗体的共定位与脂质双层上的特定肿瘤抗原同步时,可以确定嵌合抗原受体在T细胞上的分布。可以确定特定的嵌合抗原受体信号。在一些实施方案中,可以将嵌合抗原受体信号与内源性T细胞抗原受体信号或其它共刺激受体信号进行比较。在将F-肌动蛋白视为嵌合抗原受体T细胞功效的直接或间接指示物的实施方案中,F-肌动蛋白在免疫突触处的强积累表明嵌合抗原受体是功能性的。基于统计分析,在特定实施方案中,F-肌动蛋白是免疫突触质量的有用预测因子。即,在特定实施方案中,F-肌动蛋白染色在免疫突触处越强,嵌合抗原受体T细胞功能越好。在特定实施方案中,使用F-肌动蛋白作为单个预测因子是有用的,例如用于体内突触研究。在具体实施方案中,免疫突触处F-肌动蛋白的荧光强度与细胞中的另一区域相关。在某些实施例中,穿孔素的极化是功能嵌合抗原受体的指示器。
在特定实施方案中,被测试的特定嵌合抗原受体的功能性在比脂质双层更高程度地模拟肿瘤细胞的复杂表面的系统中。在这样的实施例中,可以在系统中利用整个小区来确定实际小区上的特定轿厢的结构和功能有效性。这种系统可以是或可以不是高通量系统,并且在特定实施例中,该系统是通过成像研究两个或更多个细胞的相互作用的垂直细胞配对系统。在这样的系统中,可以使用多个嵌合抗原受体T细胞和多个抗原呈递细胞细胞,例如B细胞来测定肿瘤抗原在免疫突触处的积累。在一个实施例中,嵌合抗原受体T细胞是固定的,而在另一个实施例中,抗原呈递细胞是固定的。
细胞的功效可以用多种方法测量。在具体实施方案中,比较共享相同抗原特异性的多种嵌合抗原受体。通过对突触的质量进行排序,可以确定临床使用的最有效的嵌合抗原受体。在特定实施例中,定性和定量测量都被应用于确定功效。在特定实施方案中,本发明提供了一种易于使用的方法来评估嵌合抗原受体T细胞的有效性,并且在免疫治疗领域中代表了一个重要的、未解决的问题。在某些实施方案中,可以用常规免疫学分析(例如细胞因子分泌、增殖测定和细胞毒性测定)不能区分的微小修饰对多种嵌合抗原受体的预测效力进行排序。确定嵌合抗原受体T细胞效力的当前策略利用涉及细胞因子分泌、细胞毒性、增殖和/或长期杀伤测定的常规体外方法,或利用体内小鼠模式。与本公开的方法相比,这些当前可用的策略包括体外和体内常规免疫分析是耗时的、劳动密集的、昂贵的和不准确的。
尽管可以用本公开的方法研究任何类型的嵌合抗原受体,包括在嵌合抗原受体中不具有或具有一个或多个共刺激域,但是在特定实施例中,嵌合抗原受体包括至少4-IBB。
在特定实施例中,本公开的方法包括三维显微镜,包括本领域已知的显微镜方法,例如常规共焦显微镜。
四.脂质双层
本发明的实施方案包括脂质双层,用于一种或多种类型的治疗细胞的质量测试,例如表达至少具有使免疫细胞治疗的潜在活性的一种或多种特定部分的免疫细胞。在特定的实施方案中,免疫细胞是非天然的并且包含表达结合抗原的部分的受体。该部分可以是例如任何种类抗体。
在特定实施方案中,脂质双层系统被用作用于测试特定类型的细胞对于预期目的是否有效的复合物。该系统可以具有通知直接或间接用户所讨论的特定小区是否对于预期目的有效的输出。输出可以是定量的、定性的或两者兼有。输出可以是可视、比色、放射性、数字、电子等。
在某些实施方案中,脂质双层包括一种或多种被标记的抗原,并且标记可以是任何种类,包括荧光、放射性、有色等。被测试一种或多种属性的多个细胞被提供给脂质双层并允许结合。如果合适的话,所述结合是其至少一部分位于细胞外部的部分与抗原的结合。当部分结合到抗原上时,在抗原和细胞之间形成复合物。络合物可以以一种或多种方式分析,例如包括结构和/或功能。可以确定或可以不确定复合物在脂质双层内的分布。
可以用一种或多种方法测定细胞与抗原的结合。例如,可以通过测量下游信号、突触中的关键信号分子或两者来分析结合。
脂质双层可以通过本领域的标准方法产生,例如将脂质体液滴与玻璃基底融合。可以监测包括脂质双层的系统。系统可以被可视化,例如通过显微镜,包括通过共焦显微镜、表荧光显微镜等。随着各种超分辨率技术的出现,如结构照明显微镜(SIM)、光活化定位显微镜(PALM)、随机光学重建显微镜(STORM) 和受激发射损耗(STED),研究者现在能够以前所未有的细节研究这些突触结构,这反过来提供了对IS的越来越清晰的理解。因此,在特定实施例中,采用超分辨率STED/SIM/PLAM和活细胞全内反射荧光(TIRF) 显微镜(TIRFM)。
在具体实施方案中,脂质双层由l,2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC)和1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-N-cap生物素基(生物素-PE)的氯仿悬浮原液组成,以制备所需最终浓度的稀释原液。
五.用于测试的嵌合抗原受体的实例
基因工程免疫细胞(如人类T淋巴细胞)表达肿瘤导向嵌合抗原受体(嵌合抗原受体)可以产生抗肿瘤效应细胞。在本发明的某些实施方案中,存在经修饰以包含至少一种嵌合抗原受体的免疫细胞。本文所包括的用于测试嵌合抗原受体有效性的任何方法可涉及测试包含嵌合抗原受体的任何细胞的任何种类的抗原。在具体实施方案中,抗原是肿瘤抗原。
在特定情况下,细胞是细胞毒性T淋巴细胞(CTL),其包括嵌合的、非天然的并且至少部分由人的手工程化的受体。在特定情况下,工程化嵌合抗原受体具有一种、两种、三种、四种或多种组分,并且在一些实施方案中,所述一种或多种组分促进T淋巴细胞靶向或结合到包含肿瘤抗原的癌细胞。在具体实施方案中,嵌合抗原受体包括肿瘤抗原抗体、部分或全部细胞质信号传导结构域和/或部分或全部一种或多种共刺激分子,例如共刺激分子的内域。在替代实施方案中,不使用共刺激分子的内域。在具体实施方案中,抗体是单链可变片段(单链抗体)。
在某些实施方案中,胞质信号域,例如源自T细胞受体ζ链的胞质信号域,被用作嵌合受体的至少一部分,以便在嵌合受体与靶抗原接合之后产生用于T淋巴细胞增殖和效应子功能的刺激信号。实例包括但不限于来自共刺激分子如CD28、CD27、4-1BB(CD137)、OX40(CD134)、ICOS、Myd88和/或CD40 的内域。在特定实施方案中,共刺激分子用于增强抗原接合后由嵌合抗原受体产生的T细胞的活化、增殖和细胞毒性。t细胞还可以进一步遗传修饰以增强其功能。实例但不限于,包括转基因细胞因子(例如IL2、IL7、IL15)的表达、负调节因子(例如SHP-1、FAS、PD-L1)、趋化因子受体 (例如CXC 2、cc2b)、显性负受体(例如显性负TGF RII)和/或将负信号转化为正信号的所谓“信号转换器”(例如IL4/IL2嵌合细胞因子受体、IL4/IL7嵌合细胞因子受体或TGF RII/TLR嵌合受体) 的沉默。
在特定实施方案中,编码嵌合抗原受体的多核苷酸中的嵌合抗原受体组分以特定顺序排列,使得表达的嵌合抗原受体蛋白具有特定顺序的相应结构域。例如,在特定实施方案中,跨膜结构域被配置在抗体结构域和内域之间。在具体实施方案中,编码嵌合抗原受体蛋白中结构域的顺序是N-末端-抗体-跨膜结构域-内域-C末端,但是在某些情况下编码嵌合抗原受体蛋白中结构域的顺序是N-末端-内域-跨膜结构域-抗体-C末端。当然,其它结构域可以插入该构型中,注意将其置于跨膜结构域的适当侧,以位于细胞内或细胞表面。例如,需要细胞内的那些结构域需要位于内结构域所在蛋白质中跨膜结构域的侧翼。需要是胞外的那些结构域需要位于抗体所定位的蛋白质中跨膜结构域的侧翼。
例如,嵌合抗原受体可以是第一代(包括来自CD3ξ链的胞内结构域的嵌合抗原受体)、第二代(还包括来自各种共刺激蛋白受体(例如CD28、41BB、ICOS)的胞内信号结构域的嵌合抗原受体)或第三代(其中存在多个信号结构域的嵌合抗原受体,例如当信号由CDS-ζ连同由CD28和肿瘤坏死因子受体超家族成员(例如4-1BB或OX40)提供时)。然而,在特定实施例中,嵌合抗原受体包括单个共刺激域。
嵌合抗原受体可以是特异性的TAA或TSA,例如对epha 2、he2、GD2、磷脂酰肌醇蛋白聚糖-3、 5T4、8H9、α-β整合素、B细胞成熟抗原(BCMA)B7-H3、B7-H6、CAIX、CA9、CD19、CD20、CD22、κ轻链、CD30、CD33、CD38、CD44、cd44v 6、cd44v 7/8、CD70、CD123,CD138,CD171,CEA,CSPG4, EGFR,EGFRvIII,EGP2,EGP40,EPCAM,ERBB3,ERBB4,ErbB3/4,FAP,FAR,FBP,fetal AchR,Folate Receptor a,GD2,GD3,HLA-AI MAGE Al,HLA-A2,ILl lRa,IL13Ra2,KDR,Lambda,Lewis-Y,MCSP, Mesothelin,Mucl,Mucl6,NCAM,NKG2D ligands,NY-ESO-1,PRAME,PSCA,PSC1,PSMA,ROR1,Spl7, SURVIVIN,TAG72,TEM1,TEM8,VEGRR2,癌胚抗原、HMW-MAA、VEGF受体、Galectin和/或存在于肿瘤细胞外基质中的其它示例性抗原,例如纤维连接蛋白、tenascin或肿瘤坏死区的癌胚变体和其它肿瘤相关抗原或通过肿瘤的基因组分析和/或差异表达研究鉴定的可操作突变。
在某些实施方案中,将免疫细胞导向一种或多种肿瘤抗原的嵌合抗原受体包含(1)结合一种或多种肿瘤抗原的细胞外抗原结合结构域,和(2)包含提供初级T细胞活化信号的初级信号部分(例如cd3ζ链)和任选的共刺激部分(例如CD28多肽和/或4-1BB(CD137)多肽)的细胞内结构域。
尽管在一些实施方案中单链抗体是任何类型的,但在其它实施方案中单链抗体衍生自特异性单克隆抗体。
三.表达嵌合抗原受体的宿主细胞
本次公开的方法涉及任何类型的嵌合抗原受体的有效性的测量,其中嵌合抗原受体可以驻留在任何类型的细胞中,包括免疫细胞,例如治疗性免疫细胞。如本文所用,术语“细胞”、“细胞系”和“细胞培养物”可以互换使用。所有这些术语还包括它们的后代,即任何后代和所有后代。应理解,由于有意或无意的突变,所有后代可能不相同。在表达异源核酸序列的上下文中,“宿主细胞”是指能够复制载体和/或表达由载体编码的异源基因的真核细胞。宿主细胞可以并且已经被用作载体的受体。宿主细胞可以被“转染”或“转化”,这是指外源核酸被转移或引入宿主细胞的过程。转化细胞包括初级受试细胞及其后代。如本文所用,术语“工程化的”和“重组的”细胞或宿主细胞旨在指已经引入外源核酸序列如载体的细胞。因此,重组细胞可与不含重组导入核酸天然存在细胞区分。在本发明的实施方案中,宿主细胞是 T细胞,包括细胞毒性T细胞(也称为TC、细胞毒性T淋巴细胞、CTL、T杀伤细胞、细胞溶解T细胞、CD8 +T细胞、CD4+T细胞或杀伤T细胞);树突细胞、NK细胞和NKT细胞也包括在本发明中。细菌细胞,例如大肠杆菌,可用于产生编码he2-嵌合抗原受体的多核苷酸。
在一个方面,本文提供了一种细胞,其已经被遗传工程化以表达一辆或多辆嵌合抗原受体。在某些实施方案中,遗传工程化细胞是例如T淋巴细胞(T细胞)、自然杀伤(NK)T细胞或NK细胞。在某些其它实施方案中,遗传工程化细胞是非免疫细胞,例如间充质干细胞(MSC)、神经元干细胞、造血干细胞、诱导多能干细胞(iPS细胞)或胚胎干细胞。在具体实施方案中,细胞还包括工程化嵌合抗原受体或可增强其功能的任何其它遗传修饰。在特定实施方案中,嵌合抗原受体的抗原结合结构域结合hr2,尽管在某些实施方案中,嵌合抗原受体的抗原结合结构域识别不同的靶抗原。
细胞可以是自体细胞、同基因细胞、异基因细胞,甚至在某些情况下是异种细胞。
在许多情况下,人们可能希望能够杀死遗传工程化的T细胞,其中人们希望终止治疗,细胞变成肿瘤,在研究中,在细胞存在之后不存在细胞是令人感兴趣的,或其他目的。为此目的,可以提供某些基因产物的表达,其中可以在受控条件下杀死工程细胞,例如诱导自杀基因。这种自杀基因是本领域已知的,例如icaspas 9系统,其中修饰形式的caspase 9可与小分子二聚,例如AP1903。参见,例如Straathof 等人,血液105:4247-4254(2005)。
进一步设想本发明的药物复合物包含用本文定义的载体转化或转染的宿主细胞。宿主细胞可以通过将至少一种上述载体或至少一种上述核酸分子引入宿主细胞中而产生。宿主中至少一种载体或至少一种核酸分子的存在可以介导编码上述be特异性单链抗体构建体的基因的表达。
引入宿主细胞中的所述核酸分子或载体可以整合到宿主基因组中,或者可以保持染色体外。
本发明所包含的细胞还可包含蛋白质化合物,其能够为用于细胞增殖或细胞刺激的免疫效应细胞提供激活信号。根据本发明,为免疫效应细胞提供激活信号的“蛋白质化合物”可以是用于T细胞的另外的激活信号(例如另外的共刺激分子:B7家族的分子,ox40l,4-1bl),或另外的细胞因子:白细胞介素 (例如IL-2,IL-7,或IL-15),或NKG-2D结合化合物。蛋白质化合物还可以为免疫效应细胞提供激活信号,所述免疫效应细胞是非T细胞。作为非T细胞的免疫效应细胞的实例尤其包括NK细胞或 NKT细胞。
一个实施方案涉及生产本发明复合物的方法,该方法包括在允许构建体表达的条件下培养上文定义的宿主细胞,并将细胞或多个细胞提供给个体。
本领域已知培养含有允许嵌合抗原受体分子表达的表达构建体的细胞的条件,以及当需要时纯化/ 回收构建体的方法。
在一个实施方案中,宿主细胞是包含嵌合抗原受体的遗传工程化T细胞(例如细胞毒性T淋巴细胞),并且在特定实施方案中,细胞进一步包含工程化T细胞抗原受体。天然存在的T细胞受体包括两个亚基,a亚基和β亚基,每个亚基都是由每个T细胞基因组中的重组事件产生的独特蛋白质。可以筛选T 细胞抗原受体文库对特定靶抗原的选择性。“工程化T细胞抗原受体”是指天然T细胞抗原受体,其对被选择、克隆和/或随后引入用于过继免疫治疗的T细胞群中的靶抗原具有高亲和力和反应性。与工程化T 细胞抗原受体相反,嵌合抗原受体被工程化为以独立于主要组织相容性复合体的方式结合靶抗原。
六.多核苷酸编码CARs
该公开还包含可编码本文所定义的CAR的核酸序列细胞及携带核酸序列的细胞。核酸分子是在特定方面的重组核算分子,且有可能是合成的。它可能包含DNA,RNA以及PNA(肽核酸),而且它可能是其杂交体。
对于本领域技术人员显而易见的是:一种或多种调控序列可以添加至由本公开组合成的核酸分子中去。例如,激活子,转录加强子和/或序列,使得可以令本公开内容的多核苷酸的诱发表达得以实现。一个合适的诱发型系统就比如由Gossen和Bujard发明的,如所述的调节型激因表达--四环素。国家的专科院校科学美国89(1992),5547-5551)及Gossen et al.(生物技术发展趋势12(1994),58-62),或由Crook发明的地塞米松——如所述的诱发型基因(1989)EMBO J.8,513-519。
此外,设想为了进一步的核酸分子可以包含,例如,硫酯键和/或核苷酸类物质的目的这些修正也许可用于核酸分子抵抗细胞内内切核酸酶或外切核酸酶的稳定。核酸分子可以通过适当的载体转录,这种载体需要包含允许所述核酸分子在细胞中转录的嵌合基因。关于这一点,还可以理解为:这样的多核苷酸可以用于‘基因目标’或‘基因治疗’方法。在另一个实施中,核酸分子被标记。用于检测核酸的方法在业界是公知的,例如:南方印迹、北方印迹、PCR和引物延伸。该实施方式也许可用于在基因治疗期间,验证上述核酸分子成功导入的筛选方法上。
核酸分子可能是重组产生的嵌合核酸分子,包含任何前述的单独或组合的核酸分子。具体来说,核酸分子是载体的一部分。
因此,在该公示文件中还涉及在本公示中描述的核酸分子的载体的组合。
分子生物学领域的优秀技术人员已知许多合适的载体,选择主要取决于所需的功能及包含基因工程常规使用的质粒、粘粒、病毒、噬菌体等其他载体。本领域专业技术人员熟知的方法可用于建构各种质粒和载体,举例可参见Sambrook的技术描述。(1989)及Ausubel,绿色出版协会及纽约威力出版公司,分子生物学实验室指南(1989),(1994).或者,可以把本公示中的多核苷酸和载体重构成用于传递目标细胞的脂质体。克隆载体可用于分离DNA的单个序列。可将相关序列转移到需要表达特定多肽的表达载体中。典型的克隆载体包括pBluescript SK、pGEM、pUC9、pBR322及pGBT9.典型的表达载体包括pTRE、 pCAL-n-EK、pESP-l、pOP13CAT。
在具体实施中,存在包含核酸序列的载体,所述核酸序列是一个与CAR构建体定义的核酸序列编码相连接的调整的核酸序列。这种调整的序列(控制元件)是技术人员了解的,并包含启动子,剪接盒,翻译起始密码,用于将挿入物引入载体的转化和插入位点。在具体的实施中,核酸分子可实施连接至允许真核或原核细胞表达的所述表达控制序列的操作。
可设想,载体是一个包含核酸分子的表达载体,该核酸分子可编码本文定义的CAR构建体。在特定方面,载体可以是病毒载体,如慢病毒载体。慢病毒载体可通过商购获得,包括例如从Clontech(美国加州,山景城),或GeneCopoeia(美国马里兰州的罗克维尔市)
术语“调控序列”是指对影响(捆绑)编码序列表达必需的DNA序列这种控制序列的性质依宿主生物体的不同而不同。在原核生物中,控制序列通常包括启动子,核糖体结合位点,及终止子。在真核生物中,通常,控制序列包括启动子,终止子和在一些情况下可能用到增强子,反式激活因子,或转录因子。术语“控制序列”旨在至少包括所有的表达需要其存在的组成部分,及可能还包括额外有益的组成部分。
术语“可操作的连接”是指并置,其中如此描述的成分处于允许它们以预期方式发挥其功能的关系中。编码序列“可操作地连接”的控制序列以这样一种控制序列的方式连接,即在编码序列表达与控制序列相容的条件下实现。在控制序列是启动子的情况下,显然技术人员会优选使用双链核酸。
因此,在某些实例中,所述的载体是表达载体。“表达载体”是可用于转化选定宿主并提供所选宿主编码序列的表达。表达载体可以是例如克隆载体,二元载体或整合载体。表达包含核酸分子优选转录为可转化的mRNA.调控元件确保了在原核生物和/或真核细胞中的表达,这一点是本领域技术人员熟知的。在真核细胞情况下,它们通常包含确保转录起始的启动子和任选的确保转录终止和转录稳定化的poly-A信号。允许原核宿主细胞中表达的可能调控元件需包括,例如,大肠杆菌中的PL,lac,trp或者tac启动子,以及允许在真核宿主细胞中表达的调节元件的例子是比如酵母中的AOX1或GAL1启动子或 CMV-,SV40-,RSV-启动子(劳氏肉瘤病毒),CMV增强子或哺乳动物或其他动物细胞中的珠蛋白内含子。
除了负责转录起始的元件外,这种调控元件还可以包含多核苷酸下游的转录终止信号,例如SV40 聚A位点或tk聚A位点。此外,取决于所使用的表达系统,能够将多肽引导至细胞区室或将其藏匿在培养基中的前导序列可以被添加至所述的核酸序列编码序列中。这一点为业界公知。前导序列与转化,起始,终止序列以合适的相位装配,然后优选地,一个能够指导蛋白或其一部分转化藏匿的前导序列,进入到周质空间或胞外培养基中。任选地,异源序列可编码包含赋予所需特征的N端识别肽的融合蛋白,如,稳定或简化表达的重组产物的提纯化,见上文。在本文中,适合的表达载体是业界熟知的,例如,Okayama-Berg cDNA表达载体pcDVI(Pharmacia)、pEF-Neo、pCDM8、pRc/CMV、pcDNAl、pcDNA3(Invitrogen),pEF-DHFR 及pEF-ADA(Raum et al.癌症免疫学疗法(2001)50(3),141-150)或pSPORTl(GIBCO BRL)。
在一些实施方案中,表达控制序列是能够转化真核宿主细胞载体中的真核启动子程序,但也可以使用源和宿主的控制程序。一旦载体被嵌入整合到合适的宿主中,宿主就保持在一个适合高水平表达核苷酸序列的状态下,且根据需要,继续收集和纯化在本公示中提及的多肽。
其他调控元件可能包括转录和可转化增强子。有利地,本公示中提及的上述载体包含可选的和/或可评分的标记。用于选择转化细胞的选择标记基因对于业界技术员来说是熟知的,且包含,例如以抗代谢物耐药性作为基础的针对dhfr的选择,其赋予对甲氨蝶呤的抗性(Reiss,植物生理学)(生命科学病毒.)13 (1994),143-149);npt,其赋予对氨基糖苷类新霉素的抗性,卡那霉素和巴龙霉素(Herrera-Estrella, EMBO J.2(1983),987-995)及潮霉素,赋予潮霉素抗性(Marsh,Gene 32(1984),481-485).另外,已经描述了另外可选基因,叫做trpB,其允许细胞利用吲哚代替色氨酸;hisD,其允许细胞利用组胺醇代替组氨酸。(Hartman,Proc.)国家的专科院校科学USA 85(1988),8047);允许细胞利用甘露糖的甘露糖 -6-磷酸异构酶(WO 94/20627)及ODC(鸟氨酸脱羧酶)其赋予对鸟氨酸脱羧酶抑制剂的抗性2-(二氟) -DL-鸟氨酸,DFMO(McConlogue,1987,In:分子生物学的当前通讯,冷泉港实验室编)或来自土曲霉的脱氨酶,其赋予对杀稻瘟菌素(Blasticidin S)的抗性(Tamura,Biosci.生物技术.生物化学59(1995), 2336-2338)。
有用的可标记标记也是业界技术员熟知的,且是可以商购获得的。有利的是,所述标记是编码荧光素酶的激因(Giacomin,PI.科学116(1996),59-72;Scikantha,J.Bact.178(1996),121),绿色、红色、荧光蛋白(Gerdes,FEBS Lett.389(1996),44-47)或β-葡萄糖醛酸(Jefferson,EMBO J.6(1987), 3901-3907)。该实施方案对含有所述载体的细胞,组织和生物体的简单、快速的筛选的实现特别有用。
如上所述,所述核酸分子可以单独用于细胞,或作为载体的一部分用于在细胞中表达编码的多肽。将含有编码本文所述任何一种CAR构建体的DNA序列的核酸分子或载体导入细胞中,所述细胞继而产生有益的多肽。所列举的核酸分子和载体可以设计用于直接引入或通过脂质体或病毒载体(例如腺病毒,逆转录病毒)引入细胞。在某些实施方案中,所述细胞例如是T细胞,CAR T细胞,NK细胞,NKT细胞,MSC,神经元干细胞或造血干细胞。
根据上文,本公开涉及衍生载体,特别是在基因工程中常规使用的包含编码本文所定义的CAR的多肽序列的核酸分子的质粒,粘粒,病毒和噬菌体的方法。在某些情况下,所述载体是表达载体和/或基因转移或目标载体。来源于病毒如逆转录病毒,牛痘病毒,腺伴随病毒,疱疹病毒或牛乳头瘤病毒的表达载体可用于将所述多核苷酸或载体递送到目标细胞群中。可以使用界内技术员熟知的方法来构建重组载体,例如参见Sambrook等所述的技术工艺。(loc cit.),Ausubel(1989,loc cit.)或其他标准教科书。或者,可以将所述核酸分子和载体重构成脂质体以递送至目标细胞。含有本公示的核酸分子的载体可以通过众所周知的方法转移到宿主细胞中,这些方法根据细胞宿主的类型而变化。例如,氯化钙转染通常用于原核细胞,而磷酸钙处理或电穿孔可用于其他细胞宿主;参见上文的Sambrook。
六.公开试剂盒(成套工具)
本文所述的任何组合物可以包含在试剂盒中。在非限制性实例中,用于产生双层,标记,抗原,载体,底物等的细胞,脂双层或试剂可包含在试剂盒中。
试剂盒的组分可以以水性介质或冻干形式包装,并且它们可能需要冷冻。试剂盒的容器装置通常将包括至少一个小瓶,试管,烧瓶,瓶子,注射器或其他容器装置,组分可以放置在其中,也可优选合适地等分。如果套件中有多个组件,套件通常还会包含第二个,第三个或其他额外的容器,其中可以单独放置额外的组件中。然而,不同的
组分的组合可以包含在小瓶中。本发明的试剂盒通常还包括用于容纳封闭部件的装置,考虑到方便商品销售。这种容器可以包括注入或吹塑的塑料容器,其中保留了所需的小瓶。
试剂盒的组分也可能会以干粉的形式提供。当试剂和/或组分以干粉形式提供时,可以通过添加合适的溶剂来重构粉末。可以设想,溶剂也可以在另一个容器装置中提供。
举例
以下实施例用以说明本发明的优选实施方式。业界技术人员应该可以理解,以下实施例中公开的技术代表本发明人发现的在本发明的实践中发挥良好作用的技术,因此可以被认为是构成其实践的优选模式。然而,根据本公示内容,业界技术人员应该理解,可以在所公开的具体实施方式中做出许多改变,并且仍然获得相似或类似的结果,而不偏离本发明的主旨和范围。
实施例1
两个互补系统对嵌合抗原受体T突触可视化研究
为了测试嵌合抗原受体T细胞是否能够形成稳定的IS,将κappa-嵌合抗原受体和CD19-嵌合抗原受体分别加入到载有荧光标记的kappa和CD19肿瘤抗原的玻璃支持的平面脂质双层中。嵌合抗原受体构造已在前面描述。简而言之,逆转录病毒载体含有抗cd19分子或kappa链蛋白的单链抗体、与4-lBB内域连接的CD28胞内域(以下称为CD28-嵌合抗原受体)或CD28胞内域(以下称为4-lBB-嵌合抗原受体) 和T细胞抗原受体的zeta链。kappa-嵌合抗原受体和CD19-嵌合抗原受体共享相同的胞内结构域,如图 11所示。嵌合抗原受体的分布通过三维(3D)超分辨率显微镜成像(图1)。脂质双层上的固定嵌合抗原受体T细胞图像显示,每个嵌合抗原受体T细胞下有κappa和cd19的中心聚集,这使人想起突触处T细胞受体(T细胞抗原受体)和B细胞受体(BCR)的中心簇。除突触结构外,还研究了细胞内下游信号分子 pZeta(嵌合抗原受体信号的关键分子)和F-肌动蛋白(维持突触稳定性的必要成分)以及穿孔素(溶解颗粒的标记物)。为了观察zeta链磷酸化的分布,使用针对酪氨酸83(Y83)处磷酸化zeta链的Ab来染色 IS处的pZeta。如预期的,pZeta与kappa或CD19抗原共定位,kappa或CD19抗原是脂质双层上的配体,其可以直接反映嵌合抗原受体在T细胞上的分布。同时,在IS处观察到F-肌动蛋白的强烈积累和穿孔素的极化,表明在玻璃支持的平面脂质双层上形成功能性嵌合抗原受体突触。
考虑到玻璃支持的平面脂质双层系统不能完全模拟肿瘤细胞的复杂表面。为了进一步证明在玻璃支撑的平面脂质双层上观察到的突触构造可以在嵌合抗原受体T细胞上与它们的真正易感肿瘤细胞再现,开发了高通量VCP成像装置,其允许以高分辨率的方式在垂直焦平面上可视化嵌合抗原受体T与其易感肿瘤细胞之间的IS。首先将κ链阳性Daudi细胞系装载到该VCP装置中,然后装载嵌合抗原受体T细胞。类似地,固定嵌合抗原受体T细胞的图像显示在IS处κappa和CD19都积累。F-肌动蛋白和穿孔素在嵌合抗原受体T是极化的(图1)。因此,嵌合抗原受体T细胞可以形成功能性IS,通过结构、信号和通过在两个互补系统上成像来测量功能性IS。
优质的是由4-1bb嵌合抗原受体T细胞组成
嵌合抗原受体的不同胞内结构域可以介导不同的抗肿瘤活性。鉴于上述在两种不同的嵌合抗原受体T细胞中形成嵌合抗原受体突触,认为由4-lBB-嵌合抗原受体构建的免疫(其结构、信号和功能的定量) 的质量不同于CD28-嵌合抗原受体T细胞的质量。为了检验这一假设,发明人定量地比较了IS的结构、信号和功能。引人注目的是,与来自相同供体的CD28-嵌合抗原受体T细胞相比,在4-1BB-嵌合抗原受体T 细胞中观察到更强的F-肌动蛋白、pZeta和肿瘤抗原的中心簇染色(图2)。
有趣的是,4-lBB-嵌合抗原受体T细胞和CD28-嵌合抗原受体T细胞都能在脂质双层上积累κappa抗原。尽管kappa簇在这两种嵌合抗原受体中的分布相似,但kappa簇在4-IBB-嵌合抗原受体T细胞中的平均荧光强度显著高于CD28-嵌合抗原受体T细胞(图2b),这表明4-1bb共刺激结构域介导的抗肿瘤活性更好。总结了来自其他四个捐助者的kappa-嵌合抗原受体定量结果(图7)。从5个供体中的4个观察到4-1BB- 嵌合抗原受体T细胞的pZeta显著增加。作为对照,将嵌合抗原受体T细胞添加到带有荧光标记的lambda IgGl的双层中(图8a)。没有细胞与含有lambda IgGI的脂质双层相互作用(图8a)。在4-lBB或CD28- 嵌合抗原受体T细胞中均未观察到对lambda IgGI反应的聚集,这表明嵌合抗原受体T细胞在携带其易感肿瘤抗原的脂质双层上特异性相互作用和突触形成。
除了pZeta(近侧嵌合抗原受体信号分子)外,还研究了嵌合抗原受体T突触处更远侧嵌合抗原受体信号通路、pZAP70(zeta链相关蛋白70)和Lck(淋巴细胞特异性蛋白酪氨酸激酶)。正如所预期的,脂质双层上的κIgGl蛋白触发了pZAP-70和Lck(图8b,c)。这两种信号分子参与活化T淋巴细胞的长期增殖和分化。CD19-嵌合抗原受体也获得了类似的结果(图9),这证实了4-lBB共刺激结构域的广泛的、优越的效果。数据显示,与CD28-嵌合抗原受体T细胞相比,4-lBB-嵌合抗原受体T细胞诱导的突触质量更高。
实施例2
标准cr51释放试验和细胞因子分泌不能区分4-lBB-嵌合抗原受体和CD28-嵌合抗原受体T细胞之间的差异
T细胞的最佳功能取决于突触的质量。给定由4-lBB-嵌合抗原受体T细胞构建的突触的优良质量,在一个实施方案中,4-lBB-嵌合抗原受体T细胞可引发对其易感肿瘤细胞的更好的杀伤活性。为了测试这种考虑,使用标准的4小时Cr51释放试验来测量嵌合抗原受体T细胞的细胞毒性以及细胞内细胞因子分泌。比较4-1BB-嵌合抗原受体T细胞和CD28-嵌合抗原受体T细胞的细胞毒性,4-lBB-嵌合抗原受体T细胞和CD28-嵌合抗原受体T细胞均有效地杀死其易感肿瘤细胞(图3a)。然而,4-lBB嵌合抗原受体T和 CD28-嵌合抗原受体T细胞对三种不同的κ链阳性肿瘤细胞系都显示出相似的活性:道迪、耶科尔和比贾布细胞(图3a)。在CD19-嵌合抗原受体T细胞中针对两种CD19阳性肿瘤细胞系-Raji和Daudi细胞获得类似的结果(图3b)。与此同时,五个人生产的TNF-cc和IFN-yby在CD28-嵌合抗原受体和4-lBB-嵌合抗原受体之间的kappa-嵌合抗原受体和CD19-嵌合抗原受体都具有可比性(图3c和3d)。因此,在特定实施方案中,常规细胞因子测定的4小时标准Cr51释放和分泌不能区分CD28之间的差异。车载T细胞和4-1BB 车载T细胞。
实施例3
增强4-lBB-嵌合抗原受体T细胞的抗肿瘤活性
先前的研究表明,嵌合抗原受体T细胞的抗肿瘤活性取决于嵌合抗原受体T细胞的活化、持续和增殖。为了进一步研究4-1BB-嵌合抗原受体T细胞是否具有更好的抗肿瘤活性,将嵌合抗原受体T细胞与表达红色荧光蛋白mCherry(Daudi-mCherry)的易感靶Daudi细胞或表达绿色荧光蛋白(GFP)(Raji-GFP) 的Raji细胞共培养,这不仅可以测量肿瘤细胞的根除,而且可以测量嵌合抗原受体T细胞的增殖。在一周的共培养期间,通过流式细胞术(图4a)对两种残留肿瘤细胞数(下文称为“肿瘤杀伤活性”)进行定量并扩增嵌合抗原受体T细胞数(下文称为“效应细胞增殖”)。正如所预期的,4-lBB-嵌合抗原受体T 细胞和CD28-嵌合抗原受体T细胞有效地消除了κ链阳性Daudi细胞(图4b)或Raji细胞(图4c)。有趣的是,4-lBB-嵌合抗原受体T细胞能更快地消灭其易感肿瘤细胞。同时,嵌合抗原受体T细胞的增殖能力是衡量嵌合抗原受体T细胞有效性的关键参数。在患者体内持续时间较长的嵌合抗原受体T细胞可增强其有效性。通过定量嵌合抗原受体T细胞在与其易感肿瘤细胞共培养期间的数量,进一步测量嵌合抗原受体 T细胞的增殖能力。与CD28共刺激结构域嵌合抗原受体T细胞相比,来自不同κ-嵌合抗原受体和CD19- 嵌合抗原受体特异性的4-IBB嵌合抗原受体T细胞的增殖能力显著增加(图4)。其他四个捐助国的类似结果获得了嵌合抗原受体T细胞(图10a)和用于CD19-嵌合抗原受体T细胞的四个其它供体(图10b)。来自5个人的定量数据进一步显示,与CD28-嵌合抗原受体T细胞相比,4-IBB嵌合抗原受体T细胞的抗肿瘤活性显著增强(图11)。综上所述,4-1bb共刺激区增强了抗肿瘤活性。
实施例4
IS的质量与体外培养的嵌合抗原受体T细胞的有效性呈正相关
给定在4-IBB嵌合抗原受体T细胞中观察到的更高质量的IS(IS内结构和信号分子的定量),在至少某些实施方案中,认为IS的质量与嵌合抗原受体T细胞的有效性正相关。如果是这样,可以通过评价IS的质量来预测κappa-嵌合抗原受体-T和CD19-嵌合抗原受体-T细胞的有效性。为了测试这种考虑,使用pZeta和F-肌动蛋白的积累、肿瘤抗原簇和溶解颗粒的极化来测量IS的质量,同时测量来自相同供体的嵌合抗原受体T细胞的抗肿瘤活性。为了定量嵌合抗原受体T细胞的有效性,在长期杀伤试验中使用肿瘤细胞数曲线下的面积(以下称为“杀伤效率”)和T细胞数曲线下的面积(以下称为“增殖效率”)的倒数。来自5个人的定量数据进一步显示,与CD28-嵌合抗原受体T细胞相比,4-lBB-嵌合抗原受体T细胞中的IS质量显著更高(图12)。来自5个供体的4-IBB嵌合抗原受体T细胞显示IS的质量与杀伤效率(图 5a)以及增殖效率(图5b)之间正相关。因此,IS的质量与嵌合抗原受体T细胞的有效性正相关。因此,在本公开的特定实施例中,IS的质量可以预测嵌合抗原受体T细胞的有效性。
某些实施例的意义
自从外科医生威廉·柯利1891年开始给癌症患者注射细菌(化脓性链球菌)以来,癌症免疫疗法已经被研究了124年多。嵌合抗原受体T细胞免疫治疗的最新进展为治疗各种癌症带来了希望。目前,用于解释嵌合抗原受体T细胞有效性的机制主要集中于细胞因子分泌、细胞毒性、增殖和归巢到肿瘤部位的能力。然而,单细胞水平上的确切分子机制仍不清楚。特别地,嵌合抗原受体T与其易感靶细胞之间的突触尚未被研究,尽管在基础免疫学领域已经研究了30多年。本文首次提供了有关嵌合抗原受体突触的详细信息。CD19-嵌合抗原受体和Kappa-嵌合抗原受体T细胞均在玻璃支撑的平面脂质双层上形成稳定的载有相应的肿瘤抗原如CD19和Kappa分子以及它们的敏感靶细胞的新型VCP成像装置。重要的是,突触的质量可以用于直接预测体外嵌合抗原受体T细胞的有效性,这为临床医生以经济有效的方式评估嵌合抗原受体T细胞提供了一种新的策略。同时,VCP系统可以利用传统的成像方法(例如共焦显微镜)获得高分辨率图像,而不需要超分辨率显微镜。因此,本发明人不仅证明了嵌合抗原受体突触的独特特征,而且为免疫治疗领域提供了预测嵌合抗原受体T细胞体外有效性的新方法。
嵌合抗原受体突触和T细胞抗原受体介导的突触之间的共性是耐人寻味的。嵌合抗原受体和T细胞抗原受体都聚集在突触的中心。在刺激嵌合抗原受体时,CD19-嵌合抗原受体和κ-嵌合抗原受体聚集在突触中心。在嵌合抗原受体T细胞上表达的表面人工受体积累后,这些集中的嵌合抗原受体可触发下游信号级联反应。观察到关键信号分子如pZeta的强烈积累,这使人想起T细胞活化的一个标志性特征,即近侧T细胞抗原受体信号分子的积累。在IS处F-肌动蛋白的积累在T细胞突触形成中起着重要作用,并且在嵌合抗原受体突触处也观察到了这种积累。F-肌动蛋白在突触处积累的关键结果之一是裂解颗粒向靶细胞的极化。类似地,在两个互补系统中,在活化的嵌合抗原受体T细胞中观察到溶解颗粒的极化。嵌合抗原受体和T细胞抗原受体均在突触处诱导F-肌动蛋白环,但在突触中心处F-肌动蛋白并未完全耗竭,这与以前在人NK细胞中观察到的结果一致。因此,嵌合抗原受体T细胞使用与细胞毒性淋巴细胞类似细胞毒性机制。
本文提供的是对CD28-和4-lBB-嵌合抗原受体(通用的第二代嵌合抗原受体)之间的质量进行比较的研究。通过定量脂质双层(嵌合抗原受体突触结构)上肿瘤抗原的平均强度、关键信号分子的平均强度(嵌合抗原受体突触处的信号级联)、F-肌动蛋白的积累和溶解颗粒的极化(嵌合抗原受体突触的功能) 来评价其质量。用4-IBB-嵌合抗原受体构建的突触在结构、信号和功能上均优于CD28-嵌合抗原受体,说明4-IBB-嵌合抗原受体免疫治疗具有更好的肿瘤控制和临床疗效。
体内持续和扩增采用转移的嵌合抗原受体T细胞对于获得持续的临床反应至关重要。准确预测和评价嵌合抗原受体T细胞的质量和有效性是免疫治疗领域的主要研究方向。4小时Cr51释放试验是测定淋巴细胞细胞毒性的标准方法,已广泛用于评价淋巴细胞的细胞毒性。然而,该测定不能有效区分CD28- 和4-lBB-嵌合抗原受体T细胞之间的有效性差异。在具体的实施方案中,长期杀伤试验用作评价嵌合抗原受体T细胞有效性的更好的方法。CD28-和4-lBB-嵌合抗原受体在控制肿瘤细胞数量和T细胞扩增方面存在显著差异,这与突触质量呈正相关。总之,本文提供的不仅是通过量化IS的质量来预测嵌合抗原受体T 细胞有效性的新工具,而且是对嵌合抗原受体T突触的首次描述。
实施例5
材料和方法的实例
细胞系
使用以下细胞系:达乌迪,耶科尔,BJAB和Raji(CD19+Burkitt淋巴瘤细胞系)。所有细胞系均购自美国类型培养物保藏中心(manasas,VA,美国)。在RPMI-1640(美国旧金山Gibco)中维持细胞系,向其供应10%胎牛血清(美国马萨诸塞州Waltham的Hyclone)和2mm L-谷氨酰胺(Gibco)。
质粒构建及逆转录病毒生产
车辆构造已在前面描述。简而言之,kappa和cd19单链抗体序列都是在具有人IgGl铰链和人T 细胞抗原受体/CD3复合物ζ链的SFG逆转录病毒骨架中克隆的(图6)。所有构建体都含有CD28的跨膜结构域以确保嵌合抗原受体构建体的平等表达。逆转录病毒前体通过用含有嵌合抗原的质粒、编码rd114 包膜的RDF质粒和编码MoMLV gag-pol的pegpam 3质粒的组合转染293t细胞产生,如前所述。
嵌合抗原受体改装T细胞的产生
外周血单个核细胞(PBMCs)根据批准的方案从健康供体获得。为了转导PBMCs,用1μg/ml抗 CD3(克隆,OKT3,邻位生物技术,布里奇沃特,NJ,美国)和用100U/ml重组人IL-2(Proleukin; Chiron,Emeryville,加利福尼亚州,美国),在10%的FBS RPMI-1640介质中。活化的T细胞在第3天用逆转录病毒上清液在包被有重组纤连蛋白片段(FN CH-296;后连接蛋白;日本大津高拉舒佐)。转导后,用IL-2扩增T细胞,然后用于测定。
Cr51释放试验
为了评价嵌合抗原受体“1”T淋巴细胞的细胞毒性活性,使用标准的4-h 51Cr释放测定法。简而言之,靶细胞在37℃用51Cr标记1小时,然后在含有10%FBS的RPMI培养基中以1×10 5/ml的速度重新悬浮。将1×10 4个靶细胞与系列稀释的嵌合抗原受体“1”T细胞在37℃孵育4小时。离心后,收集上清液,并用γ计数器测量释放的cr51
(芬兰图尔库瓦拉克)。细胞毒性(%)计算如下:(样品-自发释放)/(最大释放-自发释放)X100。
细胞内细胞因子染色
将嵌合抗原受体T细胞悬浮于预温热的R10培养基中,R10培养基含有布雷菲尔德素A(20μ1/ ml,Sigma-Aldrich)和高尔基停止(1.4μψ/ml,BD)。将靶细胞加入孔中以在培养箱中刺激嵌合抗原受体T细胞6小时。刺激后,细胞用活性染料染色,然后用CD3(克隆OKT3,Biolegend,圣地亚哥,加利福尼亚州,美国)、CD4(克隆OKT4,Biolegend,圣地亚哥,加利福尼亚州,美国)和CD8(克隆RPA-T8, Biolegend,圣地亚哥,加利福尼亚州,美国)抗体进行表面染色。用PBS洗涤后,在室温下用BD细胞固定/辛基操纵缓冲液(BD)渗透细胞20分钟,然后用1×BD/洗涤缓冲液洗涤两次。细胞用细胞内抗体染色,包括TNF-a(克隆MAbl l,Biolegend,圣地亚哥,加利福尼亚州,美国)和IFN-γ(克隆B27,Biolegend,圣地亚哥,加利福尼亚州,美国)。
长期杀灭试验
为了长期评价嵌合抗原受体T细胞的抗肿瘤活性,采用长期杀伤试验。简而言之,嵌合抗原受体T 细胞与表达荧光蛋白mCherry或CD19的κ轻链阳性Daudi细胞在效应子和靶(E:t)比例为1∶2。在给定的混合天数后,用流式细胞术分析细胞。
玻璃支持的平面脂质双层
如所述,通过将脂质体小液滴与干净的玻璃盖玻片融合来制备平面脂质双层。简而言之,脂质体被捕获在μ-载玻片VI中(Ibidi,德国)。脂质双层首先用5%酪蛋白封闭30分钟,然后与6.3nM链霉亲和素(Life Technologies)孵育20分钟。在用成像缓冲液(HEPES缓冲盐水)广泛洗涤后,将双层与与 Alexa荧光染料缀合的生物素化抗体在室温温育30分钟。用成像缓冲液第二次洗涤后,用2.5μM D-生物素封闭双层,使链霉亲和素结合位点饱和。在脂质上活化细胞60分钟。
平面脂质双层共焦成像
在含有荧光标记的kappa或CD19蛋白的脂质双层上刺激嵌合抗原受体“CAR+”T细胞。如前所述,用针对穿孔素(δg9,Thermo)、pZeta(磷光体-Y83,Abcam)、LCK(3aA5,Santa Cruz)和pZAP70(Tyr 319,细胞信号)的荧光缀合抗体染色细胞。用Alexa Fluor 532缀合的鬼笔蛋白(Life Technology)对f -肌动蛋白进行染色。使用徕卡TCS SP8显微镜(德国徕卡)获得共焦图像数据。
器件共轭实验
VCP器件由两个聚二甲基硅氧烷(PDMS)层-微滴和微探针阵列组成。在接种细胞之前,在PBS中用2%牛血清白蛋白(BSA)预包被VCP装置。然后,用R10介质代替装置中的BSA溶液。将浓度范围为 10±6-10±7细胞/ml的效应细胞悬浮液10μψ加入入口。用1ml注射器取出20μl R10培养基以产生流动。接种30秒后,用培养基洗涤细胞悬浮液的剩余部分。微流体装置以2000rpm离心10分钟,以将细胞向下旋转成微滴阵列。将靶细胞用450(Ebioscience,65-0842-85)染色并加入到入口中。接种第二细胞悬浮液的参数与接种第一细胞悬浮液的参数相同。
对于固定细胞成像,将装置在37℃温育1小时以形成稳定的免疫突触。细胞-细胞缀合物用4%甲醛溶液在PBS中固定15分钟,然后用PBS洗涤5分钟。将含有5%正常驴血清(NDS)和0.5%Triton X-100 在PBS中的透化缓冲液流入该装置1小时。渗透缓冲液用PBS洗涤5分钟。然后,将含有3%NDS和0.5% Triton X-100PBS的缓冲液中的初级抗体泵入该装置。将该装置在4℃温育过夜。抗体缓冲液用PBS洗涤 5分钟。细胞在室温下用荧光标记的二次抗体染色1小时。抗体缓冲液用PBS洗涤5分钟,最后向装置中加入一滴延长金防伪试剂安装介质(Life Technologies)。
统计分析
使用棱镜软件(GraphPad Software,Inc.,La Jolla,加利福尼亚州)进行未配对或配对的双尾 t检验。用线性回归相关分析方法(GraphPad)分析IS质量与抗肿瘤活性的相关性。
尽管已经详细描述了本发明及其优点,但是应当理解,在不脱离由所附权利要求限定的本发明的精神和范围的情况下,可以在此进行各种改变、替换和变更。此外,本申请的范围不限于说明书中描述的工艺、机器、制造、物质组成、装置、方法和步骤的特定实施例。如本领域普通技术人员从本发明的公开内容将容易理解的,根据本发明,可以利用执行与本文所述的相应实施例基本相同的功能或实现与本文所述的相应实施例基本相同的结果的当前存在的或以后开发的工艺、机器、制造、物质组成、装置、方法或步骤。因此,所附权利要求旨在将这些工艺、机器、制造、物质组成、装置、方法或步骤包括在其范围内。
此外,本申请的范围不限于说明书中描述的工艺、机器、制造、物质组成、装置、方法和步骤的特定实施例。
- 还没有人留言评论。精彩留言会获得点赞!