一种检测EGFRvⅢ的免疫组化抗体试剂及检测方法与流程
本发明涉及一种检测EGFRvⅢ的免疫组化抗体试剂及检测方法,属于肿瘤标志临床应用与研究领域。
背景技术:
表皮生长因子受体(epidermal growth factor receptor,EGFR)分子量为170kD,属于受体酪氨酸激酶的Eb r B家族,由胞外区、跨膜区和胞内区组成,其正常活化可介导细胞的生长、增殖、分化、黏附以及移动等活动。许多上皮源性肿瘤与EGFR活性增加或异常有关。EGFR通常在人类不同肿瘤中过表达,而且EGFR的过表达与某些肿瘤的恶性程度相关。近年研究发现,在肿瘤的发生和发展过程中,EGFR蛋白的表达不是很稳定,常常出现基因的扩增和重排,导致基因突变使得肿瘤细胞表面的抗原表型发生调变。现研究发现EGFR存在3种胞外型突变体,即EGFRvⅠ、EGFRvⅡ和EGFRvⅢ,与这些突变的受体结合后的EGFR信号通路通常异常激活,引起细胞异常增殖。其中EGFRvⅢ是人类肿瘤中最为常见的突变形式。
EGFRvⅢ与EGFR完整结构比较,EGFRvⅢ分子量为130kD,26个外显子中第2~7个外显子被删除,导致801个碱基对缺失,其删除端由一个新的甘氨酸密码子(GGT)连接,翻译成蛋白质后,胞外区6~273氨基酸被一个甘氨酸残基替代。丧失了胞外配体结合部位的EGFRvⅢ可在没有配体结合的情况下组成性激活酪氨酸激酶,产生自体磷酸化,诱发下游的信号转导途径,引起级联反应,影响肿瘤细胞的生物学行为。
迄今为止,EGFRvⅢ尚未在正常组织中检出,被视为恶性肿瘤特异性表达的EGFR突变体,在脑胶质瘤(阳性率30~50%)、肺癌(阳性率39%)、乳腺癌(阳性率20~36%)、卵巢癌(阳性率75%)、头颈部癌(阳性率42%)、结肠癌(阳性率34%)、前列腺(阳性率100%)、肝癌(阳性率36.8%)、胃癌(阳性率35.2%))等均有发现。EGFRvⅢ只在肿瘤细胞中出现,而在正常组织细胞不表达,所以它是一种很好的肿瘤特异抗原,这使EGFRvⅢ成为一个很好的肿瘤治疗的靶标。EGFRvⅢ与肿瘤患者预后也有一定关系,肿瘤组织EGFRvⅢ的表达水平是判断预后的独立指征,EGFRvⅢ表达高者预后差。
如何准确、快速的检测出各肿瘤组织EGFRvⅢ的表达情况是靶向免疫治疗的关键因素。目前,检测EGFRvⅢ的表达情况主要采用的方法有直接测序法、实时定量PCR法及组织免疫组化法等方法。这些方法各有优势,但存在操作复杂、耗时长、成本相对较大、特异性差等不足之处,尚有改进的必要。
技术实现要素:
针对上述现有技术,本发明提供了一种检测EGFRvⅢ的免疫组化抗体试剂,以及检测方法。利用免疫组化法检测EGFRvⅢ在肿瘤的表达,EGFRvⅢ蛋白的阳性染色定位主要在细胞膜和细胞浆上,表现为棕黄色颗粒;结果采用半定量积分法,每张切片由2位阅片者在盲态情况下判读,此结果可以作为临床医生的诊断依据之一,为临床肿瘤的诊断起预后判断的作用,帮助临床肿瘤的诊断、分类、预后判断以及疗效评估。
本发明是通过以下技术方案实现的:
一种检测EGFRvⅢ的免疫组化抗体试剂,包括抗EGFR突变体Ⅲ单克隆抗体(抗体原液)和抗体稀释液;所述抗EGFR突变体Ⅲ单克隆抗体,其制备方法记载在文献Oncotarget.2016 Dec 22.doi:10.18632/oncotarget.14088.中;所述抗体稀释液,主要成分为Tris缓冲液(pH 7.2),并含有NaN3和蛋白质,由博士德生物技术有限公司生产,其商品货号为AR1016,商品名称抗体稀释液。
进一步地,所述抗EGFR突变体Ⅲ单克隆抗体(抗体原液)与抗体稀释液的体积比为1:1~5000,优选1:1000~1:4000。
一种检测EGFRvⅢ的方法(免疫组化法),为:利用上述检测EGFRvⅢ的免疫组化抗体试剂,通过免疫组化方法检测待检测标本组织(为手术或穿刺的肿瘤组织经处理后得到)中的EGFRvⅢ的表达情况,检测结果可以作为临床医生的诊断依据之一,为临床肿瘤的诊断起预后判断的作用,帮助临床肿瘤的诊断、分类、预后判断以及疗效评估(具体实施治疗方案还需再参考患者的临床表现情况)。
进一步地,所述检测结果为EGFRvⅢ的表达值,是通过以下免疫组化的评分方法得出的:EGFRvⅢ的表达值=细胞膜染色强度分值×细胞膜染色分值+细胞质染色强度分值×细胞质染色分值。所述细胞膜染色强度分值为在细胞膜上染色强度的分值,所述细胞质染色强度分值为在细胞质上染色强度的分值;所述染色强度的分值打分依据为:未染色=0,弱染色=1,中等染色=2,强染色=3。所述细胞膜染色分值的打分依据为:细胞膜染色细胞数0%~5%对应的分值为0;细胞膜染色细胞数6%~25%对应的分值为1;细胞膜染色细胞数26%~50%对应的分值为2;细胞膜染色细胞数51%~100%对应的分值为3。所述细胞质分值的打分依据为:为细胞质染色细胞数0%~5%对应的分值为0;细胞质染色细胞数6%~25%对应的分值为1;细胞质染色细胞数26%~50%对应的分值为2;细胞质染色细胞数51%~100%对应的分值为3。当EGFRvⅢ的表达值在4分以上时,判断为“EGFRvⅢ表达为阳性”,当EGFRvⅢ的表达值小于4分时,判断为“EGFRvⅢ表达为阴性”(未染色、弱染色、中等染色、强染色的判断,细胞膜染色细胞数的判断,均是本领域技术人员所掌握的常规实验技能)。
所述抗EGFR突变体Ⅲ单克隆抗体是由北京大学医学部研制开发(本申请的申请人与其合作,参与研制开发;该抗EGFR突变体Ⅲ单克隆抗体,相关内容已经发表文章,其文献信息为:Oncotarget.2016Dec 22.doi:10.18632/oncotarget.14088.,分子量为150KD,为IgG2a亚型。该抗体是抗人EGFRvⅢ蛋白的小鼠单克隆抗体,可与组织细胞上的EGFRvⅢ抗原特异性结合,并与酶标羊抗小鼠免疫球蛋白聚合物识别并结合,通过免疫组织化学染色,使组织切片中抗原位点上出现黄色或棕黄色着色,使用光学显微镜可观察组织片中EGFRvⅢ的表达情况。
本发明在抗EGFR突变体Ⅲ单克隆抗体的基础上,经过实验筛选得到了效果最佳的抗体稀释液(研制出抗EGFR突变体Ⅲ单克隆抗体后并不意味着其可以直接作为抗体试剂工作液进行应用,合适的抗体稀释液也是优质的免疫组化产品的关键),开发出了EGFRvⅢ免疫组化抗体试剂工作液,其与野生型EGFR无交叉反应,具有特异性强、敏感度高等优点,为EGFRvⅢ的靶向治疗提供了良好的前提和基础。
附图说明
图1:抗体与不同抗体稀释液组合成工作液后免疫组化检测结果示意图,其中,a:博士德(AR1016);b:北京中衫金桥(ZLI-9028);c:福州迈新(ABD-0030);d:丹麦Dako(K8007)。图中央下部的字为:F98EGFRvⅢ。
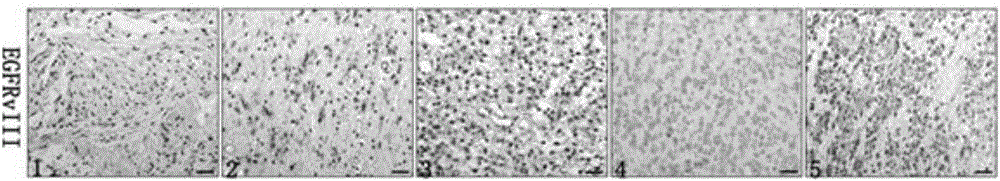
图2:脑胶质瘤的免疫组化切片,其中,1:星形细胞瘤Ⅱ级;2:少突胶质细胞瘤Ⅱ级;3:间变性星形细胞瘤Ⅲ级;4:间变性少突胶质细胞瘤Ⅲ级;5:胶质母细胞瘤。
图3:不同恶性级别的脑胶质瘤中EGFRvⅢ表达情况,其中,A:EGFRvⅢ表达与组织学类型;B:EGFRvⅢ表达与WHO分级。
图4:EGFRvⅢ与ATRX,MIB1,IDH1R132,突变P53在胶质瘤中的表达的相关性。
图5:抗EGFRvⅢ单克隆抗体的western-blot图,其中,从左至右的条带分别代表F98、F98EGFR、F98EGFRvIII、U251、U251EGFRvIII。
图6:EGFR和EGFRvⅢRT-PCR跑胶及测序分析,其中,1:F98;2:F98EGFR;3:F98EGFRvIII;4:U251;5:U251EGFRvIII。
图7:现有的靶向EGFRvⅢ的兔源多克隆抗体的免疫荧光实验结果图。
图8:抗EGFRvⅢ的单克隆抗体的免疫荧光实验结果图。
具体实施方式
下面结合实施例对本发明作进一步的说明。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
实施例1抗体稀释液的筛选
免疫组化试验步骤:组织片在60℃烤箱烤40分钟后,在二甲苯中浸泡10分钟,从而去除石蜡,然后通过在100%乙醇内浸泡2分钟两次,然后在95%的乙醇溶液内浸泡2分钟两次,在85%的乙醇溶液内浸泡2分钟和在75%的乙醇溶液内浸泡2分钟,进行水化,最后用蒸馏水洗涤2分钟,共计5次。
在高压锅内加入膜抗原修复液(225ml双蒸水:4.5ml柠檬酸:20.5ml柠檬酸三钠),高压锅开盖在电磁炉上将组织抗原修复液加热至沸腾,将切片全部浸没入修复液中,盖上锅盖,高压2分后将高压锅离火自然冷却至室温后取出切片,PBS溶液清洗5次,每次2分钟。通过新鲜配置过氧化物酶阻断液(30%H2O2:双蒸水=1:9)37℃烘箱孵育30分钟,以消除内源性过氧化物酶的活性。PBS溶液清洗5次,每次2分钟。小心甩掉并拭去组织上及周围过多的液体,在免疫组化笔圈定的组织区域内加100ul5%山羊血清37℃孵育30分钟,以封闭非特异性抗原。
勿洗,滴加一抗工作液,37℃孵育1~2小时或4℃过夜。磷酸盐缓冲液(PBS)冲洗2分钟,共5次。滴加适量辣根过氧化物酶标记二抗工作液Dako K5007,37℃孵育30分钟。磷酸盐缓冲液(PBS)冲洗2分钟,共5次。经显色剂显色1~2分钟,镜下观察适时终止显色,苏木素染核1分钟,自来水冲洗多余的苏木素后,再经脱水,透明,封片,显微镜下观察并拍片。
所述一抗工作液由一抗(实施例7制备,浓度5.3μg/μl)和抗体稀释液组成,二者体积比1:2000。
所用一抗是由北京大学医学部研制开发的(本申请的申请人与其合作,参与研制开发;该抗EGFR突变体Ⅲ单克隆抗体,相关内容已经发表文章,其文献信息为:Oncotarget.2016Dec 22.doi:10.18632/oncotarget.14088.,分子量为150KD,为IgG2a亚型。
本实施例考察了四种抗体稀释液,分别为:北京中衫金桥(ZLI-9028)、福州迈新(ABD-0030)、博士德(AR1016)、丹麦Dako(K8007)。
显微镜拍片结果如图1所示,由图可见,由博士德(AR1016)组合的抗体工作液,背景干净,染色清晰,特异性强,敏感度高,而其他三种抗体稀释液组合的抗体工作液均显现出交叉反应。因此,博士德(AR1016)是最适合抗EGFR突变体Ⅲ单克隆抗体的抗体稀释液。
F98EGFRvⅢ和F98细胞分别是EGFRvⅢ蛋白表达阳性和阴性的褐鼠脑胶质瘤细胞系,均购自美国模式培养物集存库(ATCC)。
实施例2通过免疫组化的方法获得可供读取的病理片
首先将手术或者穿刺获得的肿瘤标本固定在10%福尔马林中,接着用梯度浓度的乙醇进行充分脱水,脱水后的组织再经二甲苯透明和石蜡透蜡,之后用石蜡包埋,待蜡块凝固后,切成3μm厚的片子。免疫组化试验步骤可按实施例1执行。
计算组织病理片中的EGFRvⅢ的表达值。
EGFRvⅢ的表达值=细胞膜染色强度分值×细胞膜染色分值+细胞质染色强度分值×细胞质染色分值。所述细胞膜染色强度分值为在细胞膜上染色强度的分值,所述细胞质染色强度分值为在细胞质上染色强度的分值;所述染色强度的分值打分依据为:未染色=0,弱染色=1,中等染色=2,强染色=3。所述细胞膜染色分值的打分依据为:细胞膜染色细胞数0%~5%对应的分值为0;细胞膜染色细胞数6%~25%对应的分值为1;细胞膜染色细胞数26%~50%对应的分值为2;细胞膜染色细胞数51%~100%对应的分值为3。所述细胞质分值的打分依据为:为细胞质染色细胞数0%~5%对应的分值为0;细胞质染色细胞数6%~25%对应的分值为1;细胞质染色细胞数26%~50%对应的分值为2;细胞质染色细胞数51%~100%对应的分值为3。当EGFRvⅢ的表达值在4分以上时,判断为“EGFRvⅢ表达为阳性”,当EGFRvⅢ的表达值小于4分时,判断为“EGFRvⅢ表达为阴性”。
经计算,本实施例中,EGFRvⅢ的表达值为≥4,确定患者EGFRvⅢ表达为阳性。本发明EGFRvⅢ定位清晰,EGFRvⅢ只在细胞膜和细胞浆上检测出阳性表达,并且本发明中使用抗EGFRvⅢ单克隆抗体效价高,具有灵敏度高,特异性好的特点。
为了进一步确立本研究建立检测方法的诊断价值,在临床上进行验证。
实施例3诊断标准的确定
收集北京三博脑科医院自2011年~2016年手术切除的脑胶质瘤组织标本99例,其中男性53例,女性46例,年龄17~69岁,中位年龄43岁。患者术前均未行放化疗等任何治疗,术后经病理检查确诊的石蜡包埋病理组织标本,其中星形细胞瘤II级、间变性星形细胞瘤Ⅲ级、少突胶质细胞瘤II级和间变性少突胶质细胞瘤Ⅲ级均20例,胶质母细胞瘤19例(组织切片如图2所示)。通过免疫组化常规方法使用实施例1中的抗体工作液(抗体稀释液为博士德(AR1016))检测患者肿瘤标本的EGFRvⅢ,结果如表1、图3所示,根据公式计算出每个病理片中EGFRvⅢ的表达值(见实施例2)。
以EGFRvⅢ的表达值在4分及4分以上确定为患者EGFRvⅢ表达为阳性,当EGFRvⅢ的表达值小于4(不包含4),表示患者的EGFRvⅢ表达为阴性。根据表1和图3所示:99例脑胶质瘤EGFR阳性率为(54)54%,其中星形II级和少突II级阳性率占40%(16/40)。星形Ⅲ级和少突Ⅲ级阳性率占55%(22/40)。胶母细胞瘤阳性率占80%(16/20)。相似的,患者表达EGFRvⅢ占总数的34(34%),其中星形II级和少突II级阳性率占22.5%(9/40)。星形Ⅲ级和少突Ⅲ级阳性率占30%(12/40)。胶母细胞瘤阳性率占65%(13/20)。由此可见,EGFR高表达患者中,EGFRvⅢ阳性表达占62.96%。且EGFR和EGFRvⅢ阳性着色部位主要位于细胞膜和细胞浆。患者脑胶质瘤的恶性级别与EGFR及EGFRvⅢ的阳性率呈正相关(both P<0.01)。
为了阐明EGFRvⅢ在人神经胶质瘤中的临床意义,我们比较EGFRvⅢ表达与临床病理特征,包括年龄,性别,组织学类型,WHO级别,TP53突变,MIB1表达,IDH1R132突变状态和ATRX表达(表2)。EGFRvⅢ表达与组织学类型(P<0.001,图3A)和WHO分级(P=0.001,图3B)呈正相关。此外,TP53突变状态,ATRX表达和MIB1表达被报告为胶质瘤患者的不利的预后指标。我们的结果还表明EGFRvⅢ表达与这些指标正相关(所有P<0.05,表32,图4)。IDH1R132突变在低级胶质瘤和继发性成胶质细胞中是常见的,并且具有该突变的试剂具有更长的存活时间。本发明证实所有脑胶质瘤均为原发性肿瘤且IDH1R132突变为阴性。EGFRvⅢ表达与IDH1R132突变状态负相关(P=0.031)。这些结果表明EGFRvⅢ趋向是侵略性人类神经胶质瘤的不利因素。
表1 EGFR和EGFRvⅢ在胶质瘤中的表达
表2脑胶质瘤患者EGFRvⅢ表达与临床病理特征的相关性
实施例4抗EGFR突变体Ⅲ单克隆抗体的western-blot鉴定
提取各细胞总蛋白,Bradford法定量。上样后10%SDS-PAGE电泳后电转转移至PVDF膜上。室温下用5%的脱脂奶粉封闭2h后滴加相应一抗4℃过夜,洗膜,滴加辣根过氧化物酶标记的二抗室温2h,漂洗后进行化学发光检测,摄像。实验过程中使用能够同时识别EGFR和EGFRvⅢ蛋白的EGFR抗体和只识别EGFRvⅢ蛋白的EGFRvⅢ抗体。此实验目的用于鉴定细胞系F98、F98EGFR、F98EGFRvⅢ、U251和U251EGFRvⅢ中的EGFRvⅢ蛋白的稳定表达。
结果如图5所示,本发明的单克隆抗体western-blot鉴定结果,通过western-blot鉴定,单克隆抗体特异性地与EGFRvⅢ蛋白结合,且与野生型EGFR无交叉反应。其中,M是蛋白分子量标准(kDa)。F98EGFRvⅢ、F98EGFR和F98三种细胞分别是EGFRvⅢ蛋白表达阳性、阴性和阴性的褐鼠脑胶质瘤细胞系,均购自美国模式培养物集存库(ATCC)。U251是表达野生型EGFR阳性,U251EGFRvⅢ是表达EGFRvⅢ蛋白阳性的人脑胶质瘤细胞系,均购自北京协和医学院细胞资源中心,稳转U251EGFRvⅢ细胞。
实施例5反转录-聚合酶链反应(RT-PCR)及DNA测序分析
RT-PCR反应可以更好验证wild-typ EGFR和EGFRvⅢ的表达。Total-RNA从细胞提取后反转录为cDNA,PCR-system扩增目的片段。用于RT-PCR反应的EGFR和EGFRvⅢ引物序列为同一序列:(Forward)5'-CTT CGG GGA GCA GCG ATG CGA C-3'和(Reverse)5'-ACC AAT ACC TAT TCC GTT ACA C-3'。PCR扩增反应条件如下:95℃1min;95℃15s、60℃15s、72℃30s、72℃7min、4℃∞,共40个循环。同时Gapdh作为内参。待反应结束后2%琼脂糖凝胶电泳检测后,PCR产物进一步测序验证。每个PCR产物进行双向测序,经测序图比较,判断对应样本是否发生基因突变,并且排除是基因多态性的情况。
结果如图6所示,本发明的RT-PCR跑胶结果显示:F98EGFR和U251细胞均检测到EGFR基因表达(1044bp),F98npEGFRvⅢ细胞检测到EGFRvⅢ基因表达(243bp),而U251EGFRvⅢ细胞同时表达EGFR(1044bp)和EGFRvⅢ(243bp)基因。正常F98细胞系未检测到任何基因表达。测序图谱也可以清楚的观察到突变型EGFRvⅢ的突变位点。
实施例6抗EGFRvⅢ的单克隆抗体与现有的EGFRvⅢ的兔源多克隆抗体的免疫荧光实验
现有的靶向EGFRvⅢ的兔源多克隆抗体的免疫荧光实验结果如图7所示,本发明中抗EGFRvⅢ的单克隆抗体的免疫荧光实验结果如图8所示。市场上的靶向EGFRvⅢ的兔源多克隆抗体的免疫荧光实验,该靶向EGFRvⅢ的兔源多克隆抗体的特异性较差,该靶向EGFRvⅢ的兔源多克隆抗体除能够结合EGFRvⅢ外,亦能结合野生型F98EGFR。该靶向EGFRvⅢ的兔源多克隆抗体与野生型F98EGFR存在交叉反应。本发明的抗EGFRvⅢ的单克隆抗体具有良好的靶标特异性,其只与EGFRvⅢ结合,且不和野生型F98EGFR结合,该抗EGFRvⅢ的单克隆抗体与野生型F98EGFR无交叉反应。因此,本发明中使用的抗EGFRvⅢ的单克隆抗体的特异性好,可以很好的特异性的与EGFRvⅢ结合。
实施例7抗EGFR突变体Ⅲ单克隆抗体的制备(记载在文献Oncotarget.2016Dec 22.doi:10.18632/oncotarget.14088.中)
(一)杂交瘤细胞系的建立
步骤一、实验材料准备:
1、免疫原:以EGFRvⅢ为靶目标,采用化学合成的方式制备三条氨基酸多肽,其中三条氨基酸多肽的序列分别为LEEKKGNYVVTDHC;EKKGNYVVTDHC;KKGNYVVTDHC。每条氨基酸多肽的纯度要求大于90%,三条多肽与KLH偶联制备成免疫原。
2、培养基:DMEM培养基购于Hyclone公司;HAT、HT选择培养基、降植烷购于sigma公司。
3、实验动物:三只Balb/c小鼠分别编号为:1#、2#、3#,均为8-12周龄,雌性,SPF级动物培养。
4、其他材料:福氏完全佐剂、福氏不完全佐剂购于Sigma公司;PEG4000购于Fluka公司;HRP-山羊抗小鼠IgG抗体购于Jackson Immune公司;其余试剂均为国产分析纯产品。
步骤二、动物免疫
1)基础免疫:将抗原与福氏完全佐剂等体积混合并充分乳化,分点皮下注射,每只Balb/c小鼠每次注射量为80-120μg,较佳的为100μg。
2)加强免疫:加强免疫采用抗原与福氏不完全佐剂的乳化液。在进行细胞融合前3天,经腹腔注射含100-200ug抗原的生理盐水溶液,较佳的为150ug抗原的生理盐水溶液。
3)尾血检测:取免疫小鼠的尾血进行间接ELISA法检测。间接ELISA法的操作步骤如下:各取三条多肽100ng的包板,以三只免疫后的小鼠的尾血作为一抗进行孵育,之后每孔加1:2000HRP-山羊抗小鼠IgG 100μl,最后测定450nm OD值。
结果:以2#免疫小鼠的尾血作为一抗对所有的三条多肽反应的450nm OD读值为最高。因此选用2#免疫小鼠的脾细胞进行杂交瘤细胞的制备。
步骤三、杂交瘤细胞的制备
按常规方法收集小鼠的脾细胞与SP2/0细胞按20:1至5:1的比例以400-600g/L的PEG4000进行融合。小鼠的脾细胞与SP2/0细胞的比例,较佳的为10:1,PEG4000较佳的浓度为500g/L。用HAT培养液选择培养,融合后10~15天,取上清采用间接ELISA法筛选分泌抗抗原的杂交瘤细胞株。对所得阳性克隆杂交瘤细胞株采用有限稀释法进行亚克隆。间接ELISA法的操作步骤如下:各取三条多肽100ng的包板,用免疫小鼠尾血1:2000作为阳性对照,无克隆生长的培养基上清和正常小鼠血清作为阴性对照,每孔加1:2000HRP-山羊抗小鼠IgG 100μl,最后测定450nm OD值。凡OD450值大于阴性对照2倍以上者,即可初步判定为阳性克隆。
步骤四、杂交瘤细胞系的建立
重复步骤2,进行2次细胞融合,经过4次亚克隆和间接ELISA筛选,得到4株稳定分泌抗EGFR突变体Ⅲ(EGFRvⅢ)的单克隆抗体的杂交瘤细胞系,四株单克隆抗体杂交瘤细胞系的编号分别:4G1、4D12、7C7、1G8。
步骤五、应用上述杂交瘤细胞系所得单抗的效价检测
1)细胞培养液上清效价测定:间接ELISA法检测上述杂交瘤细胞培养上清效价为:1:50000~1:100000。其中以4G1的信号最强。
2)小鼠腹水效价测定:间接ELISA法检测上述杂交瘤细胞制备的腹水效价为:1:500000~1:1000000。其中以4G1的信号最强。
步骤六、杂交瘤细胞系的传代培养
将上述杂交瘤细胞系在含有10%胎牛血清的DMEM培养基中继续进行培养、传代,培养到10代后,杂交瘤细胞系仍然能够生长良好、稳定传代,培养液上清效价仍然可以达到1:10000以上。本发明所得杂交瘤细胞系能够稳定传代,可以持续、稳定分泌抗EGFRvⅢ的单克隆抗体。
获得产生所需的单克隆抗体的杂交瘤细胞后,将一部分杂交瘤细胞保存。保存方法如下:准备材料,细胞:取对数生长期的细胞;10%二甲基亚砜保护液(二甲基亚砜能损坏滤器,而又被高压所破坏,所以不能过滤或高压消毒。其本身就是毒品,无菌):含10%二甲基亚砜、20%灭活胎牛血清,70%RPMI-1640液;20%FBS-1640培养液:含青霉素100U/ml,链霉素100μg/ml;灭菌的2ml安瓶等。
2、操作方法,(1)去掉细胞培养瓶中的旧的培养液,加入10%FBS-1640液,使细胞悬浮。(2)1000rpm/min离心10min,去上清。细胞沉淀用10%二甲基亚砜保护液制成悬液,使成1.0×107细胞/ml。(3)取样,台盼兰染色,计数活细胞,应在95%以上。(4)用注射器将细胞分装安瓶,每瓶0.5ml~1.0ml,熔封安瓶。(5)放4℃×2h。(6)放液氮罐气态部分(-70℃)15h。(7)转入液氮部分。
(二)抗EGFRvⅢ的单克隆抗体的制备
选择成年BALB/c小鼠,腹腔接种降植烷,每只小鼠0.5ml。7-10天后腹腔接种编号为4G1的杂交瘤细胞,每只小鼠1×106~2×106个。间隔5天后,待腹部明显膨大,以手触摸时,皮肤有紧张感,即可用9号针头采集腹水。
将腹水离心(13000rpm/min 30分钟),除去细胞成分和其他的沉淀物,收集上清。用Protein G-Sepharose CL-4B进行纯化,上柱液为20mM的PBS缓冲液,柱层析洗脱液为:pH=2.7,20mM的甘氨酸缓冲液,得到抗EGFRvⅢ的单克隆抗体原液(浓度5.3μg/μl)。
附:部分缩略语、英文和关键术语定义:
EGFR:epidermal growth factor receptor。
EGFRvⅢ:epidermal growth factor receptor variantⅢ。
PBS:磷酸盐缓冲液。
术语“免疫组化”指的是应用免疫学基本原理,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色来确定组织细胞内抗原,对其进行定位、半定量研究。
术语“转移”指的是肿瘤细胞从原发部位侵入淋巴管、血管或其它器官,形成于原发部位肿瘤相同类型的肿瘤,这个过程称为转移。
术语“穿刺”指的是就是借助空心针这一器械,对器官的可疑病灶(如:肿块、增厚区域、钙化灶等)穿刺取出部分组织进行检查。
术语:“肿瘤”指的是机体在各种因素作用下,局部组织的某一个细胞在基因水平上失去对其生长的正常调控,导致其克隆性异常增生而形成的异常病变。学界一般将肿瘤分为良性和恶性两大类。
术语“患者”指的是经过根除性肿瘤切除术或者部分根除性肿瘤切除术的病人。
术语“肿瘤标本”指的是通过手术或穿刺获得的乳腺肿瘤组织,该组织接着进行固定、脱水、透明与浸蜡、石蜡包埋和再经石蜡切片获得用于免疫组化检测的肿瘤标本组织。
- 还没有人留言评论。精彩留言会获得点赞!