基于介孔颗粒的荧光适配体检测microRNA方法与流程
本发明属于生物工程技术领域,尤其涉及一种基于介孔颗粒的荧光适配体检测microRNA方法。
背景技术:
MicroRNAs(microRNAs)是一种长度为18-25nt的单链RNAs。它通过调节目的mRNA的翻译从而发挥作用,已有证明人体中有超过1000种microRNAs参与调控人类基因组中超过30%的基因,与多种生命活动有关。microRNAs的异常表达与众多疾病有关,例如心脏病,癌症,糖尿病,神经变性的疾病等,其在肿瘤细胞中的表达量与正常细胞相比有显著差异,microRNAs可被看做一种生物标志物和潜在可能的众多疾病的治疗靶标,所以对microRNAs的定量具有重要意义。但是,由于microRNAs具有低含量、极易降解等特性,很难对microRNAs进行定量检测。近些年出现了一些扩增策略和信号检测体系,例如,应用LNA探针提高检测敏感性的Northern印记法、Quantitative RT-PCR、microRNA芯片法等。但这些方法大都存在设备或试剂昂贵,检测过程复杂费时的缺陷(Chemical Reviews,113卷,6207页,2013年)。因此,建立方便、快速、灵敏、低成本的microRNAs检测技术,不仅有助于推动生命过程的研究,同时可以应用于诊断、预后或治疗诊断状况或疾病。通过适配体技术和纳米荧光猝灭剂的结合,开发新的microRNA荧光检测方法,可以显著降低荧光背景信号,增强信噪比,从而提高检测灵敏度。到目前为止,国内外研究人员已经报道了大量不同形貌和表面性质的纳米猝灭剂,例如金纳米粒子、碳纳米管、纳米氧化石墨烯、纳米金属-有机框架、二硫化钼纳米盘等,以期实现microRNA荧光检测灵敏度的提高。然而,这些纳米猝灭剂存在合成条件苛刻、合成路线复杂、部分颗粒生物相容性差的缺陷,极大地限制了体内/体外检测应用。
受贻贝粘附蛋白启发的聚多巴胺纳米粒子是一种新型的纳米材料,其制备方法简单,且具有独特的理化性质和良好的生物相容性。在荧光检测体系中,聚多巴胺纳米颗粒和生物大分子尤其是单链DNA(ssDNA)分子结合,能通过芳香环结构π电子的耦合和荧光共振能量转移高效猝灭寡核苷酸上标记的荧光染料的荧光信号(Chemical Science,5卷,3018页,2014年),因而被认为是很有潜力的microRNA荧光检测纳米猝灭剂。需要注意的是,短双链核酸的刚性棒状结构接近纳米结构表面时,会受到来自颗粒的DLVO(Derjaguin–Landau–Verwey–Overbeek)势能作用下的排斥作用力(Physical Chemistry Chemical Physics,13卷,12603页,2011年;Journal of Colloid and Interface Science,298卷,50页,2006年)。由于大部分纳米猝灭剂也具有正曲率的结合表面,受表面曲率效应的影响,猝灭剂表面和双链核酸之间的DLVO排斥作用较低,进而导致单链核酸(microRNA适配体)结合弱,或者双链核酸(microRNA及其适配体的复合体)不能有效脱离纳米猝灭剂。樊春海等研究发现(Advanced Functional Materials,23卷,4140-4148页,2013年),具有正曲率表面的纳米颗粒上,双链核酸受到较小的静电排斥作用,从而无法达到较高的脱离效率荧光响应恢复强度和信噪比(小于12)。
综上所述,现有技术存在的问题是:受纳米猝灭剂的正曲率外表面的影响,microRNA和其适配体形成的双链核酸复合体脱离颗粒受到较大的限制,microRNA识别能形成的荧光响应程度依然较低。开发具有孔结构的、能通过负曲率效应高效排斥双链核酸、对microRNA识别有高效响应性的纳米猝灭剂颗粒及检测体系,是解决这一问题的关键。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种基于介孔颗粒的荧光适配体检测microRNA方法;不同于现有技术中所用的非孔结构的纳米猝灭剂,本发明检测系统中所述的介孔纳米颗粒能通过孔结构实现对单双链核酸的亲和性差异:其一,荧光适配体在孔道内的高亲和性装载有效地猝灭单链核酸的荧光;其二,介孔聚多巴胺纳米颗粒内部孔道的负曲率,有利于表面PDA和双链核酸之间亲和性的降低,和microRNA识别之后荧光响应的提高;最终,促使基于纳米猝灭剂的microRNA检测的信噪比的提高。
本发明是这样实现的,一种microRNA纳米检测系统,所述microRNA纳米检测系统以介孔聚多巴胺纳米颗粒为载体,以荧光素标记的核酸适配体为探针,探针装载进入介孔孔道发生荧光猝灭;microRNA识别孔内探针形成的双链核酸复合体脱离颗粒形成荧光恢复;以DNA限制性内切酶I(DNase I)的特异性DNA链段剪切功能实现microRNA循环和荧光信号放大,检测microRNA的浓度范围为10pM-100nM。
进一步,所述介孔聚多巴胺纳米载体颗粒粒径为50nm~100nm,介孔孔径为4nm~40nm。
本发明的另一目的在于提供一种所述microRNA纳米检测系统的纳米载体建立方法,所述纳米载体建立方法包括以下步骤:
步骤一,在烧瓶中加入180mg~540mg嵌段共聚物F127、180mg~540mg均三甲苯、50mL~70mL无水乙醇、50mL~100mL去离子水,搅拌10min~60min后加入60mg~120mg三羟甲基氨基甲烷盐酸盐、40mg~100mg多巴胺盐酸盐,室温搅拌20小时~30小时;
步骤二:取反应原液与丙酮混匀,反应原液与丙酮的体积比5:2~5,11000rpm离心10min~20min,弃上清;加入20mL无水乙醇和10mL丙酮,超声20min~60min,11000rpm离心5min~20min,重复两次;最后收集沉淀即为介孔聚多巴胺纳米载体,将其分散于无水乙醇中保存。
本发明的另一目的在于提供一种所述纳米载体建立方法建立的纳米载体。
本发明的另一目的在于提供一种利用所述纳米载体的检测microRNA的方法,所述检测microRNA的方法包括以下步骤:
步骤一,荧光适配体的装载,在1mL检测缓冲液中加入10~120μg介孔聚多巴胺纳米颗粒和50nM羟基荧光素标记的核酸适配体,混匀30min,作为检测体系;
步骤二,microRNA样品检测,在检测体系中加入含有待检测microRNA的样品和10U~100U的DNA限制性内切酶I,37℃混匀20min~200min;将待荧光分析的溶液加入到石英比色皿中,利用荧光分光光度计检测荧光强度,激发光波长为480nm,发射光波长为523nm,以荧光强度的增加表示microRNA的量。
进一步,所述步骤一中检测缓冲液溶剂为去离子水,其溶液组分及含量为:
三羟甲基氨基甲烷盐酸盐,20毫摩尔每升;
氯化钠,140毫摩尔每升;
氯化钾,5毫摩尔每升;
氯化钙,1毫摩尔每升;
氯化镁,1毫摩尔每升;
pH为7.6。
本发明的优点及积极效果为:microRNAs检测系统以介孔聚多巴胺纳米颗粒为载体,颗粒粒径为50~100nm,介孔孔径为4~40nm;以羟基荧光素标记核酸适配体为探针。本发明可以很好地应用于microRNA检测:探针装载进入介孔孔道可以实现效率为97%的高效荧光猝灭;介孔聚多巴胺纳米颗粒内部孔道的负曲率,有利于表面PDA和双链核酸之间DLVO排斥作用力的加强和microRNA识别之后双链核酸复合体的高效脱落和荧光恢复;DNA限制性内切酶的辅助剪切功能,能实现荧光信号放大;最终,这些因素的综合作用可以使检测信噪比达到45,进而使3σ法检测限达到0.04nM,显著高于已经报导的实心非孔球形纳米猝灭剂。
附图说明
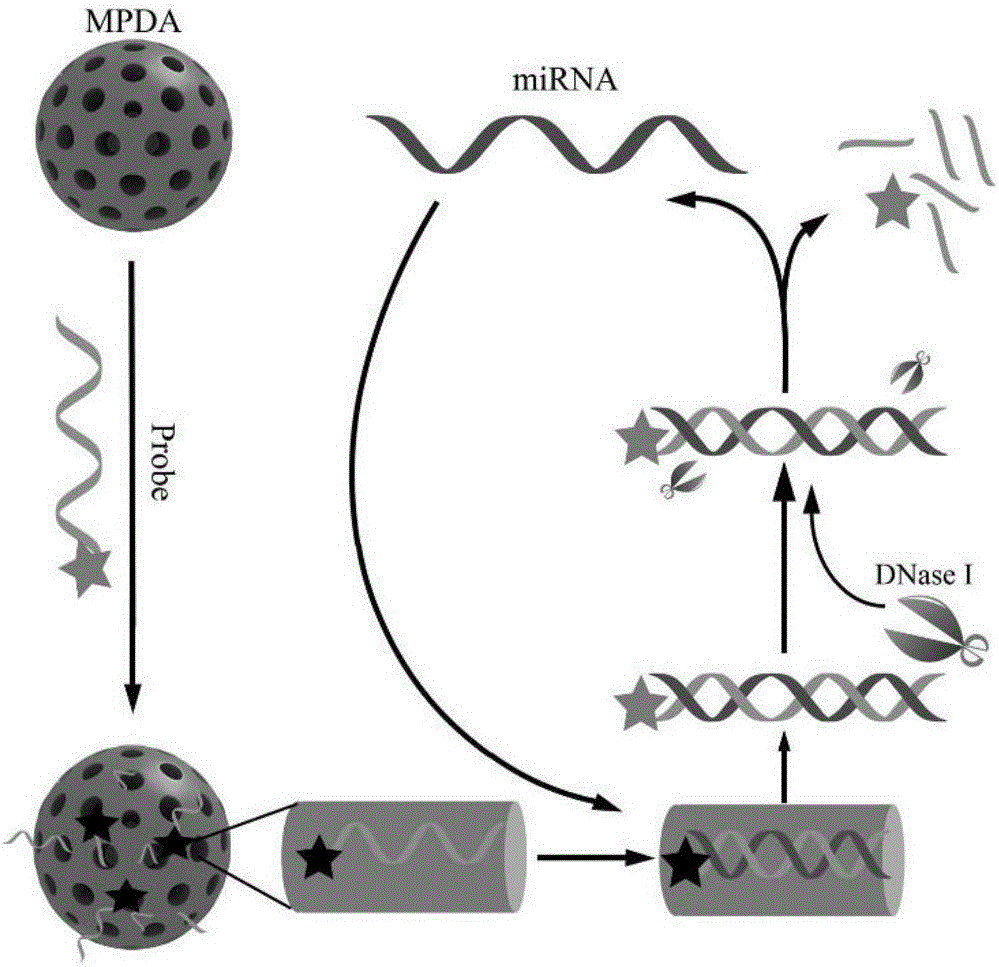
图1是本发明实施例提供的基于介孔颗粒的荧光适配体检测microRNA方法流程图。
图2是本发明实施例提供的microRNA检测方法的模拟示意图。
图3是本发明实施例提供的分析方法中介孔聚多巴胺的材料表征图。
图4是本发明实施例提供的介孔聚多巴胺纳米颗粒随时间对荧光标记核酸适配体以及适配体和microRNA复合体的猝灭动力学曲线示意图。
图5是本发明实施例提供的检测体系核酸的聚丙烯酰胺凝胶电泳图。
图6是本发明实施例提供的不同浓度介孔聚多巴胺对相同浓度荧光标记核酸适配体的猝灭效率示意图。
图7是本发明实施例提供的Let-7a的检测结果图光谱图。
图8是本发明实施例提供的Let-7a的检测线性区间示意图。
图9是本发明实施例提供的A549细胞裂解液中microRNA-21的检测线性区间示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
如图1所示,本发明实施例提供的基于介孔颗粒的荧光适配体检测microRNA方法包括以下步骤:
S101:荧光适配体的装载,在1mL检测缓冲液中加入10~120μg介孔聚多巴胺纳米颗粒(MPDA)和50nM羟基荧光素(FAM)标记的核酸适配体,混匀30min,作为检测体系;
S102:microRNA样品检测。在检测体系中加入含有待检测microRNA的样品和10~100U的DNA限制性内切酶I,37℃混匀20~200min。将上述待荧光分析的溶液加入到石英比色皿中,利用荧光分光光度计检测荧光强度,激发光波长为480nm,发射光波长为523nm,以荧光强度的增加表示microRNA的量。
在步骤S101中:其中,检测缓冲液溶剂为去离子水,其溶液组分及含量为:
三羟甲基氨基甲烷盐酸盐(Tris-HCl),20毫摩尔每升;
氯化钠,140毫摩尔每升;
氯化钾,5毫摩尔每升;
氯化钙,1毫摩尔每升;
氯化镁,1毫摩尔每升;
pH为7.6。
本发明实施例提供的microRNA检测系统,以介孔聚多巴胺纳米颗粒为载体,以荧光素标记的核酸适配体为探针,探针装载进入介孔孔道发生荧光猝灭;microRNA识别孔内探针形成的双链核酸复合体脱离颗粒形成荧光恢复;以DNA限制性内切酶I的剪切功能实现信号放大功能,检测microRNA的浓度范围为10pM-100nM。
所述介孔聚多巴胺纳米载体颗粒粒径为50~100nm,介孔孔径为4~40nm。
所述的microRNA纳米检测系统的纳米载体的建立方法包括以下步骤:
步骤一:在烧瓶中加入180~540mg嵌段共聚物F127(EO106PO70EO106)、180~540mg均三甲苯(TMB)、50~70mL无水乙醇、50~100mL去离子水,搅拌10~60min后加入60~120mg三羟甲基氨基甲烷盐酸盐(Tris-HCl)、40~100mg多巴胺盐酸盐,室温搅拌20~30小时。
步骤二:取反应原液与丙酮混匀(体积比5:2~5),11000rpm离心10~20分钟,弃上清。加入20mL无水乙醇和10mL丙酮,超声20~60min,11000rpm离心5~20min,重复两次。最后收集沉淀即为介孔聚多巴胺纳米载体,将其分散于无水乙醇中保存。
下面结合具体实施例对本发明的应用原理作进一步的描述。
如图2所示,是本发明实施例提供的基于介孔颗粒的microRNA检测系统示意图。如图3所示为本发明实施例提供的检测系统中所述的介孔聚多巴胺纳米颗粒的透射电子显微镜照片、氮气吸附等温线、孔径分布曲线,其粒径为~70nm,介孔孔径为4~40nm。
本发明实施例中所用的microRNA和适配体的核酸序列:
实施例1(Let-7a分析)
步骤一:在烧瓶中加入180~540mg嵌段共聚物F127(EO106PO70EO106)、360mg均三甲苯(TMB)、50~70mL无水乙醇、50~100mL去离子水,搅拌10~60min后加入60~120mg三羟甲基氨基甲烷盐酸盐(Tris-HCl)、40~100mg多巴胺盐酸盐,室温搅拌20~30小时。
步骤二:取反应原液与丙酮混匀(体积比5:2~5),11000rpm离心10~20分钟,弃上清。加入20mL无水乙醇和10mL丙酮,超声20~60min,11000rpm离心5~20min,重复两次。最后收集沉淀即为介孔聚多巴胺纳米载体,将其分散于无水乙醇中保存。
步骤三:在1mL检测缓冲液(20mM Tris-HCl(pH 7.6)、140mM NaCl、5mM KCl、1mM CaCl2、1mM MgCl2)中加入90μg介孔聚多巴胺纳米颗粒(MPDA)和50nM P1,混匀30min,作为检测体系。如图4所示,检测体系加入单链适配体和双链的适配体/microRNA复合体后荧光强度随时间先快后慢逐渐衰减,随后趋于平缓,在350秒时强度分别降低为3811和128,荧光强度比率30。,说明MPDA颗粒的孔结构对双链、单链核酸亲和性具有很大差异,这非常有利于适配体的高亲和性结合和适配体/microRNA复合体的低亲和性脱离。检测体系核酸的聚丙烯酰胺凝胶电泳结果如图5所示。其中泳道1为适配体(Probe);泳道2为核酸内切酶I(DNase I)作用后的Probe,发现酶剪切之后的短链核酸条带;泳道3为DNase I作用后的microRNA,DNase I对其无剪切作用;泳道4为DNase I作用后的Probe-microRNA双链核酸,再次观察到酶剪切DNA之后的小链段条带;泳道5为装载Probe后的MPDA(Probe-MPDA),泳道6位DNase I作用后的Probe-MPDA,证明了MPDA对荧光适配体的装载和孔径对其的保护作用;泳道7为加入检测目标microRNA的Probe-MPDA,泳道8为加入检测目标microRNA和DNase I的Probe-MPDA,酶切产物条带的发现说明microRNA可以有效识别适配体,杂交双链核酸可以脱离颗粒并被DNase I内切成小的核酸片段,从而验证了检测体系的可行性。图6为适配体荧光猝灭效率随颗粒浓度变化曲线图,随着颗粒浓度的增加,猝灭效率经历先快后慢的增长,当颗粒浓度超过实施例所用的90μg/mL时,猝灭效率超过97%,说明适配体探针的荧光在介孔孔道内被有效猝灭。
步骤四:在检测体系中加入含有待检测microRNAs的样品和20U的DNA限制性内切酶I,37℃混匀90min,检测荧光强度。
本发明实施例对microRNA的检测结果如图7所示,随Let-7a浓度增加(0pM-100nM),荧光强度恢复值越高。如图8所示,当Let-7a浓度在200pM-5nM区间内时,荧光强度与Let-7a浓度呈很好的线性关系(R2=0.997),荧光强度信噪比(加入和不加microRNA的荧光强度比值)在100nM浓度时达到45,由3σ法得到的检测限为0.04nM。表明本检测系统对于检测microRNA具有良好的效果。
实施例2(细胞裂解液中microRNA-21分析)
步骤一:在烧瓶中加入180~540mg嵌段共聚物F127(EO106PO70EO106)、360mg均三甲苯(TMB)、50~70mL无水乙醇、50~100mL去离子水,搅拌10~60min后加入60~120mg三羟甲基氨基甲烷盐酸盐(Tris-HCl)、40~100mg多巴胺盐酸盐,室温搅拌20~30小时。
步骤二:取反应原液与丙酮混匀(体积比5:2~5),11000rpm离心10~20分钟,弃上清。加入20mL无水乙醇和10mL丙酮,超声20~60min,11000rpm离心5~20min,重复两次。最后收集沉淀即为介孔聚多巴胺纳米载体,将其分散于无水乙醇中保存。
步骤三:在1mL检测缓冲液(20mM Tris-HCl(pH 7.6)、140mM NaCl、5mM KCl、1mM CaCl2、1mM MgCl2)中加入90μg介孔聚多巴胺纳米颗粒(MPDA)和50nM P1,混匀30min,作为检测体系。
步骤四:在1mL检测缓冲液(20mM Tris-HCl(pH7.6)、140mM NaCl、5mM KCl、1mM CaCl2、1mM MgCl2)中加入90μg介孔聚多巴胺纳米颗粒(MPDA)和50nM P1,混匀30min。加入20U的DNA限制性内切酶I和不同数量A549细胞的裂解液总RNA提取液(1万-5000万细胞),37℃恒温混匀90min,检测荧光强度。本发明实施例检测microRNA结果如图9所示,1万个细胞的RNA提取液就有荧光响应,且随细胞数目增多,其裂解液中microRNA-21含量越多,使得检测体系荧光强度恢复越大。表明本检测系统对于检测细胞裂解液中的microRNA具有良好的效果。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!