一种基于纳米孔单分子技术的手性分子识别和对映体过量检测方法与流程
本发明涉及一种基于纳米孔单分子技术的手性分子识别和对映体过量检测方法,属于单分子分析技术领域。
背景技术:
快速、灵敏、准确地识别及检测手性异构体,在催化、医学和生物技术,特别是药物设计和药代动力学等许多领域具有重要意义。但是,由于不同对映体在结合能或反应活性等方面微小的差异,使得对映体分析具有相当大的难度。目前,对映体的手性分析主要有色谱法、质谱法、核磁共振和荧光法等。
蛋白质纳米通道(纳米孔)单分子分析技术是以蛋白质通道/纳米孔(包括天然、基因工程化和化学目标修饰的蛋白质离子通道)为分析元件,借助电化学方法测量分析物通过通道时离子电流(pa级)的变化而建立的单分子分析方法。相比其它单分子分析方法如原子力显微镜(afm)和单分子荧光分析等,这种方法无需标记和复杂的样品处理,具有简单、快速和灵敏等优点。
在纳米孔单分子检测中,环糊精及其衍生物作为适配体分子以共价键或非共价键结合于纳米孔内,利用分析物和适配体主客体作用可实现对有机小分子的检测。然而,已有的报道和研究表明,β-环糊精及其衍生物适配体与许多手性小分子相互作用比较微弱,很难检测到小分子的电流信号,因此无法用于手性分子的识别。
技术实现要素:
本发明的目的是提供一种基于纳米孔单分子技术的简单、快速且灵敏的手性分子识别和对映体过量(ee)检测方法。
本发明实现过程如下:
一种纳米孔单分子手性识别和对映体过量检测方法,包括以下步骤:
(1)在电解池顺式(cis)端加入α-溶血素蛋白质,α-溶血素蛋白质插于脂双层形成蛋白质纳米单通道;
(2)在电解池反式(trans)端加入全(6-脱氧-6-氨基)-β-环糊精(am7βcd)和可溶性铜盐,在蛋白质纳米单通道内形成环糊精-铜离子复合物;
(3)在电解池顺式(cis)端加入待检测手性分子的不同异构体,记录加入手性分子前后单通道电流,d型与l型对映体在纳米孔内与环糊精-铜离子复合物发生作用,产生不同的特征电流阻塞信号,从而实现手性分子对映体的区分;
(4)测定d型与l型对映体混合物电流阻塞信号,统计d型与l型各自的特征事件数,由事件数计算得到ee值。
上述步骤(1)中,α-溶血素蛋白质浓度为0.05~0.2ng/ml。
上述步骤(2)中,全(6-脱氧-6-氨基)-β-环糊精(am7βcd)和铜盐的摩尔比为3:1~1:1,所述铜盐为氯化铜、硫酸铜、硝酸铜或醋酸铜,铜盐的浓度为5~100µm,优选为10~40µm。
上述步骤(3)中,待检测手性分子的浓度为5~100µm,优选为10~40µm。
本发明构建了具有双重识别单元的环糊精-金属二元复合物作为α-溶血素蛋白纳米孔(α-hl)适配体,该适配体与手性分子的不同异构体作用可产生特征的电流阻塞信号,由此实现对手性分子的识别和对映体过量(ee)的检测。根据本发明方法构建具有双重识别单元的α-溶血素蛋白纳米孔,可用于单分子角度的手性分子识别动力学过程分析以及手性识别机理研究,所述的手性分子包括氨基酸、合成药物或天然药物和其他有机小分子。
本发明的优点与积极效果:
(1)本发明无需对蛋白纳米孔进行化学修饰和对待测手性分子衍生化,简化了实验过程,方法简单、快速、灵敏、微量化,可同时区分多种手性分子的对映体,且具有很好的区分度;
(2)本发明可实现对映体过量的动态、实时、高准确性的随机检测,提供了从单分子角度研究氨基酸对映体的外消旋动力学过程的可能性;
(3)本发明不依赖手性分子光学等性质(如紫外可见吸收,荧光性等),具有较大的广普适用性。
附图说明
图1为纳米孔单分子手性识别示意图;
图2为l-和d-苯丙氨酸的纳米孔单分子识别;
图3为苯丙氨酸(a)、色氨酸(b)、酪氨酸(c)和三者混合物(d)的纳米孔单分子手性识别;
图4为l-和d-色氨酸的纳米孔单分子识别;
图5为l-和d-酪氨酸的纳米孔单分子识别;
图6为d-色氨酸和d-苯丙氨酸的滞留时间统计图;
图7为l-和d-酪氨酸对映体过量的检测结果。
具体实施方式
以下实施例所用实验方法如无特殊说明,均为常规方法,所使用的材料、试剂等如无特殊说明,均可从商业途径得到。实施例所涉及的仪器为单分子电子检测系统(主要包括axon200b放大器,数-模转化器和函数发生器)。本发明实施例以苯丙氨酸、色氨酸和酪氨酸等为代表性手性分子,以(6-脱氧-6-氨基)-β-环糊精(am7βcd)环糊精和铜离子为双识别元件,应用于对映体的区分和对映体过量的检测。
如图1所示,本发明一种纳米孔单分子手性识别和对映体过量检测方法,包括以下步骤:
(1)在电解池顺式(cis)端加入α-溶血素蛋白质,α-溶血素蛋白质浓度0.05~0.2ng/ml,α-溶血素蛋白质插于脂双层形成蛋白质纳米单通道;
(2)在电解池反式(trans)端加入摩尔比为3:1~1:1的全(6-脱氧-6-氨基)-β-环糊精(am7βcd)和可溶性铜盐,在蛋白质纳米单通道内形成环糊精-铜离子复合物,铜盐的浓度为10~40µm;
(3)在电解池顺式(cis)端加入浓度为10~40µm的待检测手性分子的不同异构体,记录加入手性分子前后单通道电流,d型与l型对映体在纳米孔内与环糊精-铜离子复合物发生作用,产生不同的特征电流阻塞信号,从而实现手性分子对映体的区分;
(4)测定d型与l型对映体混合物电流阻塞信号,统计d型与l型各自的特征事件数,由事件数计算得到ee值。
实施例1:l-和d-苯丙氨酸的识别
平面磷脂双层膜在直径约为120μmteflon膜小孔上形成。teflon膜将样品池分成两个隔室cis和trans。每个隔室中含有1500μl1mnacl,10mmmops缓冲溶液(ph=8.0)。将α-溶血素蛋白质(0.1ng/ml)加入cis端隔室中,将一对ag/agcl电极浸入缓冲溶液中,施加在样品池两端的跨膜电压为+100mv(指定cis端隔室为虚拟地)。待α-溶血素蛋白质自组装到磷脂双分子层膜上形成纳米通道时,将全(6-脱氧-6-氨基)-β-环糊精(40µm)和氯化铜(20µm)加入到trans端池子中,将l-和d-苯丙氨酸(20µm)分别或一起加在cis端池子中。实验中采用的pa级电流通过膜片钳放大器(axopatch200b,axoninstruments,fostercity,ca,usa)进行采集,信号通过低通贝塞尔滤波(5khz)进行过滤并将采集的模拟信号通过digidata1440aa/d转换器(axoninstruments)进行转换。采样频率为20khz。所有实验均在25℃下进行。
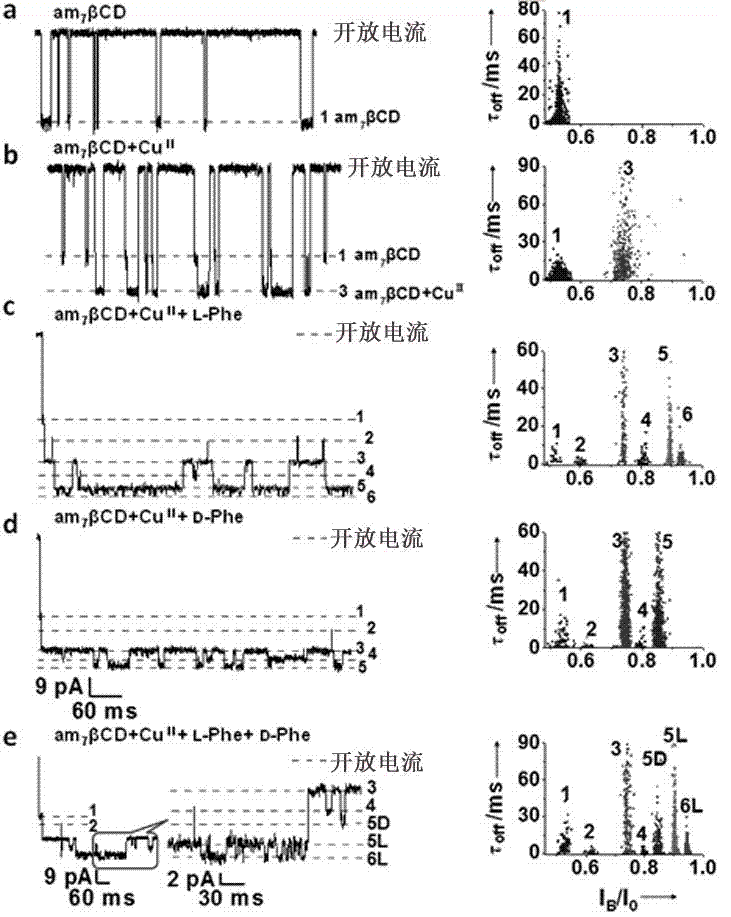
首先,发明人考察了该体系对l-苯丙氨酸的识别。如图2a所示,am7βcd从trans端嵌入(k8a/m113r)7蛋白质纳米孔中,产生51%的1号电流阻塞信号。当从trans端加入20μm铜离子后,出现一个明显的新的电流阻塞平台(3号,图2b),电流阻塞约为73.80%。文献报道,铜离子可以与环糊精上的两个氨基发生配位作用,因此发明人推测3号阻塞对应于am7βcd-cu二元复合物。而配位在环糊精小口端的铜离子如同一个开关,调制着纳米孔的电流大小。当从cis端加入20μml-苯丙氨酸(l-phe)时,又产生了4种新的电流阻塞信号,分别为2、4、5和6号事件(l-phe-2,4,5,6,图2c),对应的电流阻塞分别为为59.54%,81.48%,89.24%和93.15%。
当从cis端加入20μmd-苯丙氨酸(d-phe)时,不同于l-phe,d-phe只产生了三种新的电流阻塞信号,分别为2、4和5号事件(记作d-phe-2,d-phe-4,d-phe-5,图2d)。对比苯丙氨酸的两个对映体的阻塞电流值,发明人发现d-phe-2,d-phe-4事件的阻塞电流分别与l-phe-2,l-phe-4的相近,但是d-phe-5为85.11%,与l-phe-5有着明显差别。
随后,发明人对d-与l-phe混合物进行了检测。如图2e所示,产生了7个阻塞平台:1,2,3,4,5d,5l,6l。比较混合测定前后的电流阻塞,可以看出1和3分别对应于am7βcd和am7βcd-cu,5d为d-phe-5,6d和6l分别为l-phe-5和l-phe-6。而2和4分别为l-或者d-phe的2和4。因此,无论是从电流信号图(图2e)还是从统计图(图3a)中可以看出,通过5d、5l和6l,很容易将苯丙氨酸的两种构型区分开。
实施例2:l-和d-色氨酸(trp)的识别
实施例2与实施例1中其他实验条件不变,检测的手性分子为l-和d-色氨酸(20µm)。从电流阻塞图中可以看出:l-trp与l-phe结果相似,加入l-trp之后,同样产生了4种新的电流阻塞信号,而d-trp与d-phe结果类似,加入d-trp之后,只产生了三种信号,分别为2、4和5号事件(图4)。在l-和d-trp混合溶液中,同样可以通过5d,5l,6l对l-和d-trp进行识别。此外从统计图中可以看出l-trp-5和l-trp-5的阻塞电流分别为88.30%和96.54%,明显大于d-trp-5的85.18%(图3b)。
实施例3:l-和d-酪氨酸(tyr)的识别。
实施例3与实施例1中其他实验条件不变,检测的手性分子为l-和d-酪氨酸,对映体的浓度分别为20µm。l-和d-酪氨酸都只产生了3种新的电流阻塞信号,分别为2、4和5事件(图5)。图3c中可以看出,l-tyr-5的阻塞电流92.21%,明显比d-tyr-5的83.76%大,由此可以通过阻塞电流的不同来区分酪氨酸的对映体。
实施例4:苯丙氨酸、色氨酸和酪氨酸混合物的手性识别
实施例4与实施例1中其他实验条件不变,检测的手性分子为l-和d-苯丙氨酸、l-和d-色氨酸和l-和d-酪氨酸的混合物,各个对映体的浓度分别为20µm。对映体在混合物中的电流信号与单独检测时的相同,彼此之间产生的信号互不干扰(图3d),通过对比六种氨基酸对映体的最大电流的阻塞信号,成功的区分出了4种对映体l-trp,l-phe,l-tyr和d-tyr。而对最大电流阻塞相近的d-trp-5与d-phe-5的滞留时间的统计,也可以实现对d-trp与d-phe的区分(图6)。
实施例5:酪氨酸对映体过量的检测
由于对映体的生物效应不同,对映体纯度检测成为新的药物开发和药物设计中非常重要的研究课题。在此,发明人设计了一种精确检测酪氨酸对映体过量值(ee)的方法。实施例5与实施例1中其他实验条件不变,实施例5中检测的是l-与d-酪氨酸混合物,其总浓度固定为40μm。实验中测定l-与d-酪氨酸不同浓度比值时的电流信号,并统计l-与d-酪氨酸各自的特征事件数,得到两种对映体的浓度-事件数的校准曲线。每次实验中记录了10min,以确保足够的事件数进行统计,提高ee值测定的准确度。从图7可以看出,随着l-tyr与d-tyr的浓度比值不断增大,l-tyr-5事件数不断增多,而d-tyr-5的事件数不断减少,且事件数都随浓度比值变化呈良好的线性关系,线性方程分别为:y=-1.5+58.1c(r2=0.9917);y=-39.4+74.4c(r2=0.9966)。实验测定值ee值和配制的ee值(表1)吻合良好,因此该方法可用于对映体ee值的测定。
- 还没有人留言评论。精彩留言会获得点赞!