一种葡萄糖氧化酶活性快速测定试剂盒及其检测方法与流程
本发明涉及实验室检验领域中的一种分析试剂盒及其检测方法,具体涉及一种用于快速测定葡萄糖氧化酶活性的检测试剂盒及其检测方法。
背景技术:
葡萄糖氧化酶(Glucose oxidase,GOD),其系统命名为β-D-葡萄糖氧化还原酶(EC1.1.3.4),它能高度专一性地催化β-D-葡萄糖与氧反应,使葡萄糖氧化成为葡萄糖酸和过氧化氢。该酶广泛分布于动物、植物及微生物体内。1928年Muller首先在黑曲霉的无细胞提取液中发现葡萄糖氧化酶。1960年Kusai等、1964年Pazurp和Swoboddas分别从青霉素和黑曲霉中提纯葡萄糖氧化酶。1995年Petruccioli等用青霉素的突变株生产出葡萄糖氧化酶。我国自1986年开始研究葡萄糖氧化酶的制备提纯工艺,1998年正式投入生产。1999年农业部将其定为12种允许使用的饲料酶制剂添加剂之一。
葡萄糖氧化酶催化葡萄糖氧化生成过氧化氢(H2O2),H2O2在过氧化物酶催化下可将4-氨基安替比林和苯酚氧化缩合生成粉红色醌亚胺,基本反应如下:
测定时,在第一步的反应中,葡萄糖底物要求相对葡萄糖氧化酶绝对过量,从而催化反应为准一级反应,反应速率与加入的酶量成正比,而与底物浓度无关。第二步的反应目的是精确地测定第一步反应所释放的H2O2的量,这一步反应需要过氧化物酶相对H2O2绝对过量,使生成的H2O2迅速参加反应,以达到实时测定第一步反应速率的目的。反应液颜色的深度与过氧化物酶催化产生的醌亚胺的量成正比,而醌亚胺的的生成量与H2O2生成量成正比,H2O2生成量则与反应液中葡萄糖氧化酶的活力成正比。
如何将上述的测定原理通过对吸收波长,缓冲液类型、pH值,反应时间等进行优化,制造出一种结构简单、使用方便的葡萄糖氧化酶活性快速测定试剂盒是技术人员要解决的问题。
技术实现要素:
本发明需要解决的技术问题是提供一种快速测定葡萄糖氧化酶活性的检测试剂盒及其检测方法,旨在解决上述问题。
为了达到上述目的,本发明的技术方案是:一种葡萄糖氧化酶活性快速测定方法,其特征在于,包括以下步骤;
将液体酶液通过1000~3000RCF离心10~20min,所获得的上清液用缓冲液进行适当稀释;
吸取1.0mL磷酸盐缓冲液,置于37℃水浴保温5~10min;
吸取1.0mL经过适当稀释的酶液,置于37℃水浴保温5~10min;
吸取磷酸盐缓冲液20.0mL、苯酚溶液2.0mL、4-氨基安替比林溶液1.0mL、过氧化物酶溶液1.0mL和葡萄糖底物溶液6.0mL,总计30.0mL混匀作为测定试剂,取混合液适量置于37℃水浴保温5~10min;
取一干净比色杯,吸取3.0mL经过37℃水浴保温的测定试剂加入比色杯中,将比色杯放入分光光度计中,在波长500nm处调零,随后向比色杯中加入0.1mL经过37℃水浴保温的待测酶液,加入比色杯中同时计时,并立即吹吸使之混合均匀,以后每隔1min记录吸光值,连续记录10min;
按照公式计算酶稀释液中葡萄糖氧化酶的活力:
公式中,XD:酶稀释液中葡萄糖氧化酶的活力,单位为U/mL;ΔA500:一定时间内在波长500nm处溶液吸光值变化;Δt:吸光值变化对应的反应时间,单位为min;1:比色皿厚度,单位为cm;12.9:生成显色物醌亚胺的毫摩尔吸光系数,单位为L·mmol-1.cm-1;1/2:每1mol过氧化氢生成醌亚胺物质的量;V总:反应混合液总体积,单位为mL;:V酶酶溶液的体积,单位为mL;
按照公式计算葡萄糖氧化酶样品的酶活力,固体样品单位为酶活性单位每克(U/g),其计算公式为:液体样品单位酶活性单位每毫升(U/mL)其计算公式为: 公式中,X:葡萄糖氧化酶样品的酶活力,单位为U/g(或U/mL);Df:所取酶样品全部稀释到合适浓度对应的缓冲液体积,单位为mL;m:称取的固体酶样品质量,单位为g;V:量取的液体酶样品体积,单位为mL。
一种葡萄糖氧化酶活性快速测定试剂盒,期特征在于,包括R1、R2、R3、R4和R5试剂,各试剂组分与配比为:
R1:缓冲液100-200mmol/L;
R2:葡萄糖水溶液1000mmol/L;
R3:过氧化物酶溶液125KU/L;
R4:4-氨基安替比林溶液4mg/mL(19.68mmol//L);
R5:苯酚溶液1.5mg/mL(15.9mmol//L);
缓冲液pH5.0-7.0,
所述的缓冲液可以为但不限于磷酸盐缓冲液、乙酸盐缓冲液、Tris缓冲液、McIlvaine缓冲液,其pH为5.0-7.0。试剂盒还进一步含有非离子表面活性剂,其中非离子表面活性剂可以是吐温系列、TritonX非离子表面活性剂,用量可以是0.01-1%,主要起到增溶、澄清作用。
附图说明
图1为酶活测定线性范围回归直线
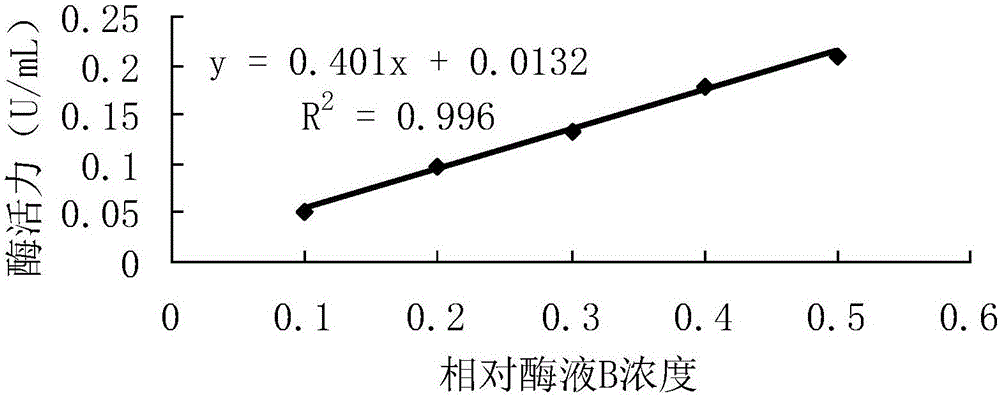
图2为酶活测定线性范围回归直线
具体实施方式
下面结合实施例对本发明进行进一步说明。
实施例1
本实施例中的一种葡萄糖氧化酶快速定量检测试剂盒为五种试剂,包括R1、R2、R3、R4和R5试剂,各试剂组分与配比为:
R1试剂:pH6.0磷酸盐缓冲液100mmol/L;
R2试剂:葡萄糖水溶液1000mmol/L;
R3试剂:过氧化物酶溶液0.5mg/L;
R4试剂:4-氨基安替比林溶液4mg/mL;
R5试剂:苯酚溶液1.5mg/mL;
上述试剂溶解后,分装入瓶,制成液体五试剂,直接按特定比例混合即可使用。
实施例2
利用实施例1中的葡萄糖氧化酶快速定量检测试剂盒检测发酵液中葡萄糖氧化酶的活性,具体操作步骤如下:
1)样品的制备
将发酵液通过2000RCF离心10min,所获得的上清液既是,然后取上清液用缓冲液进行适当稀释;
2)吸取1.0mL磷酸盐缓冲液,置于37℃水浴保温5min;
3)吸取1.0mL经过适当稀释的酶液,置于37℃水浴保温5min;
4)吸取磷酸盐缓冲液20.0mL、苯酚溶液2.0mL、4-氨基安替比林溶液1.0mL、过氧化物酶溶液1.0mL和葡萄糖底物溶液6.0mL,总计30.0mL混匀作为测定试剂,取混合液适量置于37℃水浴保温5min;
5)取一干净比色杯,吸取3.0mL测定试剂(经过37℃水浴保温)加入比色杯中,将比色杯放入分光光度计中,在波长500nm处调零;
6)随后向比色杯中加入0.1mL待测酶液(经过37℃水浴保温),加入比色杯中同时计时,并立即吹吸使之混合均匀,以后每隔1min记录吸光值,连续记录10min;根据公式
和公式进行计算葡萄糖氧化酶的活性。
实施例3
利用实施例1中的葡萄糖氧化酶快速定量检测试剂盒检测纯酶溶液葡萄糖氧化酶的活性,具体操作步骤如下:
1)样品制备:将酶样品称取试样两份,精确至0.001g,置于100mL容量瓶中,加入约40mL磷酸盐缓冲液,在电磁振荡器或恒温振荡器震荡30min,或者用磁力搅拌器搅拌30min,取出用磷酸盐缓冲液定容并摇匀,取摇匀的贮存液上离心机以4000r/min离心10min,然后取上清液用磷酸盐缓冲液进行适当稀释。液体样品可以直接用磷酸盐缓冲液进行稀释、定容;
2)吸取1.0mL磷酸盐缓冲液,置于37℃水浴保温5min;
3)吸取1.0mL经过适当稀释的酶液,置于37℃水浴保温5min;
4)吸取磷酸盐缓冲液20.0mL、苯酚溶液2.0mL、4-氨基安替比林溶液1.0mL、过氧化物酶溶液1.0mL和葡萄糖底物溶液6.0mL,总计30.0mL混匀作为测定试剂,取混合液适量置于37℃水浴保温5min;
5)取一干净比色杯,吸取3.0mL测定试剂(经过37℃水浴保温)加入比色杯中,将比色杯放入分光光度计中,在波长500nm处调零;
6)随后向比色杯中加入0.1mL待测酶液(经过37℃水浴保温),加入比色杯中同时计时,并立即吹吸使之混合均匀,以后每隔1min记录吸光值,连续记录10min;
7)固体样品单位为酶活性单位每克(U/g),按公式和公式进行计算;
液体样品单位酶活性单位每毫升(U/mL),按公式和公式进行计算。
酶活力单位U定义:在上述反应条件下,每分钟使1μmol葡萄糖氧化为葡萄糖酸和H2O2所需要的酶量,定义为一个酶活力单位。
实施例4
利用实施例1中的葡萄糖氧化酶快速定量检测试剂盒检测葡萄糖氧化酶纯酶溶液稀释液的活性,结果如下:
将葡萄糖氧化酶纯酶制剂溶解于pH7.0磷酸盐缓冲液中,适当稀释得到酶液A(0.66U),再进一步进行梯度稀释,按照连续分光光度法连续测定1-10min的吸光度变化。每个浓度重复两次,取每个时间点吸光度的平均值进行线性回归分析,利用回归分析所得直线斜率计算酶活力。结果如表1所示。
表1吸光值变化速率回归分析与检验
从表1中可以看出,酶稀释液在不同的浓度下的线性相关系数均较高,基本呈随酶液浓度增大而减小趋势,主要原因是随着酶活增大,底物对于酶活不再绝对过量,反应对一级反应动力学有所偏离。p值均小于0.01,因此在各个浓度下10min内吸光值的变化均为严格的线性变化,因此只从吸光度随时间变化难以判断酶活测定线性范围,需要进一步分析。
利用所得回归直线的斜率计算出酶活,以酶活对相对浓度进行线性回归分析,并对相对酶液A浓度0.1~0.5的范围结果作图,见说明书附图1。
表2酶活测定线性范围回归分析与检验
从表2可以看出,在相对酶液A的浓度为0.1~0.5的范围内相关系数与R2值最大,因此在这个浓度范围内酶活测定值与浓度呈严格的线性关系。浓度范围的上限增加后,虽然均有很小的p值,但是从相关系数上看,从0.1~0.5的浓度范围内线性关系更加严格,说明书附图1也印证了这一点,因此可以确定0.055~0.207U/mL在该测定方法的线性范围内。实际应用中,可以用每分钟吸光值变化的大小来方便地判定酶液浓度是否在线性范围内,从表1可看出对应的每分钟吸光值变化为0.011~0.042。
由于用线性回归的方法计算ΔA/Δt比较麻烦,降低了连续分光光度法的实用性,因此尝试对线性范围内的点采取两点法进行计算。分别选取第一组(2min和6min)、第二组(2min和8min)和第三组(2min和10min)两组吸光值进行分析,结果如表3、表4和表5所示。
表3两点法和标准方法测定结果比较(第一组)
表4两点法和标准方法测定结果比较(第二组)
表5两点法和标准方法测定结果比较(第三组)
经过分析,在线性范围内的各浓度点,取第三组的吸光值用两点法得到的酶活与标准方法测得的酶活相当接近,最大相对误差仅为0.85%,第二组测得的酶活值相对误差最大不超过1.36%,可以替代标准方法的测定值。第一组测得的酶活值相对误差最大不超过3.70%,对于要求不甚严格的分析也可以接受,并且更加快捷。因此,对于标准的连续分光光度法,两点法更加实用。
选取不同来源的3种葡萄糖氧化酶样品,适当稀释后4000rpm/min离心10min,取上清液测定酶活力。记录1~10min的吸光值,每分钟记录一次。通过公式(1)可以看出,在计算酶活力是不需要时间点和吸光值严格的对应关系,只需要一个时间段的吸光值变化数据,且ΔA/Δt在方法允许的线性范围内即可。取2~10min时的吸光值进行线性回归分析,同时用标准方法计算酶活力,并选择2min和10min时的吸光值用两点法进行计算,如表6所示。
表6样品酶活测定吸光值变化速率回归分析与酶活计算
表6表明样品酶活测定吸光值在2~10min线性关系良好,并且标准方法与两点法结果高度一致,可以直接使用两点法测定,后续工作可以以此进行。
实施例5
利用实施例1中的葡萄糖氧化酶快速定量检测试剂盒检测纯酶溶液葡萄糖氧化酶的活性,结果如下:
将葡萄糖氧化酶纯酶制剂溶解于pH6.0磷酸盐缓冲液中,适当稀释得到酶液酶液B(0.59U),再进一步进行梯度稀释,按照连续分光光度法连续测定1-10min的吸光度变化。每个浓度重复两次,取每个时间点吸光度的平均值进行线性回归分析,利用回归分析所得直线斜率计算酶活力。结果如表7所示。
表7吸光值变化速率回归分析与检验
在不同的浓度下的线性相关系数均较高,基本呈随酶液浓度增大而减小趋势,主要原因是随着酶活增大,底物对于酶活不再绝对过量,反应对一级反应动力学有所偏离。p值均小于0.01,因此在各个浓度下10min内吸光值的变化均为严格的线性变化,因此只从吸光度随时间变化难以判断酶活测定线性范围,需要进一步分析。
利用所得回归曲线的斜率计算出酶活,以酶活对相对浓度进行线性回归分析,并对相对酶液B浓度0.1~0.5的范围结果作图。
表8酶活测定线性范围回归分析与检验
从表8可以看出,在相对酶液B的浓度为0.1~0.5的范围内相关系数与R2值最大,因此在这个浓度范围内酶活测定值与浓度呈严格的线性关系。浓度范围的上限增加后,虽然均有很小的p值,但是从相关系数上看,从0.1~0.5的浓度范围内线性关系更加严格,说明书附图2也印证了这一点,因此可以确定0.050~0.209U/mL在该测定方法的线性范围内。实际应用中,可以用每分钟吸光值变化的大小来方便地判定酶液浓度是否在线性范围内,从表7可看出上述范围对应的每分钟吸光值变化约为0.010~0.042。
由于用线性回归的方法计算ΔA/Δt比较麻烦,降低了连续分光光度法的实用性,因此尝试对线性范围内的点采取两点法进行计算。分别选取第一组(2min和6min)、第二组(2min和8min)和第三组(2min和10min)两组吸光值进行分析,结果如表9、表10和表11所示。
表9两点法和标准方法测定结果比较(第一组)
表10两点法和标准方法测定结果比较(第二组)
表11两点法和标准方法测定结果比较(第三组)
经过分析,在线性范围内的各浓度点,取第二组的吸光值用两点法得到的酶活与标准方法测得的酶活相当接近,最大相对误差仅为1.68%,第三组测得的酶活值相对误差最大不超过2.15%,可以替代标准方法的测定值。第一组测得的酶活值相对误差最大不超过8.32%,对于要求不甚严格的分析也可以接受,并且更加快捷。因此,对于标准的连续分光光度法,两点法更加实用。
选取不同来源的3种葡萄糖氧化酶样品,适当稀释后4000rpm/min离心10min,取上清液测定酶活力。记录1~10min的吸光值,每分钟记录一次。通过公式可以看出,在计算酶活力是不需要时间点和吸光值严格的对应关系,只需要一个时间段的吸光值变化数据,且ΔA/Δt在方法允许的线性范围内即可。取2~8min时的吸光值进行线性回归分析,同时用标准方法计算酶活力,并选择2min和8min时的吸光值进行计算,如表12所示。
表12样品酶活测定吸光值变化速率回归分析与酶活计算
表12表明样品酶活测定吸光值变化,在2~8min线性关系良好,并且标准方法与两点法结果高度一致,可以直接使用两点法测定。
- 还没有人留言评论。精彩留言会获得点赞!