纳米免疫磁珠技术联合酶联免疫吸附快速检测鼠伤寒沙门氏菌的方法与流程
本发明涉及生物技术检测领域。更具体地,涉及一种抗鼠伤寒沙门氏菌单克隆抗体及其制备得到的纳米免疫磁珠以及纳米免疫磁珠技术联合酶联免疫吸附快速检测鼠伤寒沙门氏菌的方法。
背景技术:
鼠伤寒沙门氏菌(salmonellatyphimurium)是沙门氏杆菌属其中一个血清型,是革兰氏阴性菌,能导致多种宿主动物肠道疾病的致病菌,是引起沙门氏菌食物中毒的主要血清型之一,同时也是导致鸡肉、鸡蛋、鸭肉及相关产品污染的主要原因之一。鼠伤寒沙门氏菌可以通过被污染的食物及饮水进入人体,从而引起人体的呕吐、肠胃炎和腹泻等不同程度的疾病。鼠伤寒沙门氏菌的感染对于老人、儿童以及有免疫缺陷的人还会造成生命危险。
目前,检测鼠伤寒沙门氏菌的方法有三种:传统的生物学分离培养法包括采样、非选择性富集培养、选择性培养,生化检测和血清型鉴定,整个过程费时约3-5天;分子生物学检测法如聚合酶链式反应法(pcr)、dna分子杂交法等,但分子检测方法价格昂贵,操作专业性强;免疫检测法包括elisa和简体金免疫层析方法等,运用了抗原抗体的特异性结合原理,其中elisa方法灵敏度高,检测时间快。但现有文献中记载的elisa方法检测最低浓度为一般为103-104cfu/ml。随着人们对健康要求的不断提高,鼠伤寒沙门氏菌的检测灵敏度等也将会有更严格的要求。
因此,提供一种具有快速、灵敏度高,准确率高,低成本、高通量等优点的利用免疫学原理将富集与检测相结合来检测鼠伤寒沙门氏菌的方法,对于菌检测具有重要意义。
技术实现要素:
本发明的第一个目的在于提供一种抗鼠伤寒沙门氏菌单克隆抗体及其分泌产生该抗体的杂交瘤细胞株。
本发明的第二个目的在于提供一种由上述单克隆抗体制备得到的纳米免疫磁珠。
本发明的第三个目的在于提供一种纳米免疫磁珠技术联合酶联免疫吸附快速检测鼠伤寒沙门氏菌的试剂盒及其方法。
为达到上述目的,本发明采用下述技术方案:
本发明提供了一种抗鼠伤寒沙门氏菌单克隆抗体m11,是由保藏编号为cgmccno.10313的杂交瘤细胞株6e7分泌产生。该杂交瘤细胞株6e7已于2015年01月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址是中国北京市朝阳区北辰西路1号院3号),其保藏编号为cgmccno.10313,分类命名为产抗沙门氏菌单克隆抗体细胞株。
保藏编号为cgmccno.10313的杂交瘤细胞株也属于本发明的保护范围。
本发明还提供了一种由上述抗鼠伤寒沙门氏菌单克隆抗体制备得到的纳米免疫磁珠。
在本发明中,所述纳米免疫磁珠是抗鼠伤寒沙门氏菌单克隆抗体m11通过链霉亲和素-生物素介导偶联纳米磁珠制得的。
进一步地,所述纳米免疫磁珠是采用活泼酯的方法,将链霉亲和素与180nm磁珠偶联获得链霉亲和素磁珠,采用生物素化抗体与链霉亲和素磁珠连接制得。具体步骤为:取10mg磁珠依次用无水乙醇,依次用1mol/lnaoh,1mol/lhcl各洗涤1次,用pb(0.02mol/l,ph4.0)洗5次,mes(0.05mol/l,ph6.0)重悬。依次加入n-羟基硫代琥珀酰亚胺(nhss)0.4mg,二氯乙烷(edc)0.35mg,置于混匀仪上保持磁珠悬浮状态,37℃活化2.5h。将每毫克活化磁珠与250μg链霉亲和素偶联;获得的链霉亲和素磁珠,按每毫克链霉亲和素磁珠加入100mg生物素化鼠伤寒沙门氏菌单克隆抗体m11,置于混匀仪上37℃偶联35min。磁力架回收磁珠,pb洗涤5次,10mlpbs(含0.05g/100mlnan3,0.5g/100mlbsa,ph7.4)重悬磁珠,即得。
本发明进一步提供了所述抗鼠伤寒沙门氏菌单克隆抗体、所述杂交瘤细胞株或所述纳米免疫磁珠在检测食品中鼠伤寒沙门氏菌的应用。
本发明进一步还提供了一种纳米免疫磁珠技术联合酶联免疫吸附快速检测鼠伤寒沙门氏菌的试剂盒,所述试剂盒包括所述抗鼠伤寒沙门氏菌单克隆抗体和由所述抗鼠伤寒沙门氏菌单克隆抗体制备得到纳米免疫磁珠。
进一步地,所述试剂盒还包括:酶标抗体、阳性对照、阴性对照以及所需的酶联免疫检测试剂。
其中,所述酶标抗体为与本发明所述单克隆抗体m11配对的抗鼠伤寒沙门氏菌单克隆抗体,用辣根过氧化物酶采用过碘酸盐氧化法进行偶联所得到的;优选的,所述与本发明所述单克隆抗体m11配对的抗鼠伤寒沙门氏菌单克隆抗体为编号为58018的单克隆抗体;
所述阳性对照为灭活的鼠伤寒沙门氏菌,阴性对照为正常小鼠血清;
所述所需的酶联免疫检测试剂均为常规的酶联免疫检测试剂,包括但不限于洗涤液、显色液、终止液、封闭液。
本发明纳米免疫磁珠技术联合酶联免疫吸附快速检测鼠伤寒沙门氏菌的方法,包括以下步骤:
(1)取样增菌;
(2)取增菌上清液,加入上述制备的纳米免疫磁珠,孵育后,磁分离,弃去上清液,浓缩重悬并热处理纳米免疫磁珠,磁分离后弃去纳米免疫磁珠,得到待测样品;
(3)将所述的单克隆抗体包被到固相载体上;
(4)加待测样品:将待测样品加到步骤(3)获得的固相载体上,温育;
(5)加洗涤液洗涤;
(6)加酶标抗体,温育;
(7)加洗涤液洗涤后,加蒸馏水洗涤;
(8)加显色液显色;
(9)加终止液终止反应;
(10)测定450nm处的吸光值,即od450nm;
(11)将上述即od450nm带入方程式进行计算,即可获得样品中鼠伤寒沙门氏菌浓度;所述方程式是将已知浓度的鼠伤寒沙门氏菌进行稀释,得到待测样品,依次完成步骤(4)-(10),得到各浓度的吸光值,根据各浓度的吸光值生成标准曲线得到的。
在本发明优选的实施例中,步骤(2)中所述纳米免疫磁珠的加入量为每毫升增菌上清液加入0.15mg纳米免疫磁珠;所述纳米免疫磁珠中单克隆抗体与纳米磁珠的偶联质量比为3:50。
在本发明中,对纳米免疫磁珠的加入量进行了优化,结果表明:当纳米免疫磁珠添加量达到0.15mg时,1ml菌液捕获效率大于99%。因此,为了保证有效分离,确定在检测中每毫升菌液中加入纳米免疫磁珠0.15mg。
在本发明优选的实施例中,步骤(3)中所述单克隆抗体的包被浓度为40μg/ml;步骤(6)中所述酶标抗体的使用浓度为200-300μg/ml。
在本发明中,通过棋盘滴定法确定m11作为包被抗体以及酶标抗体的最佳工作条件,结果显示当m11以40μg/ml浓度包被,且酶标抗体使用浓度为200μg/ml或300μg/ml,其od值(1.087和0.988)接近1.0,且阴性对照较低,p/n值比较大,所以选定所述单克隆抗体的包被浓度为40μg/ml;所述酶标抗体的使用浓度为200-300μg/ml。
在本发明优选的实施例中,所述单克隆抗体、待测样品和酶标抗体的用量比为1:1:1。
本发明的有益效果如下:
本发明将纳米免疫磁珠分离技术与elisa相结合,通过纳米磁珠偶联抗体,形成免疫磁珠进而富集捕获菌体,再将捕获的菌体进行基于双抗体夹心原理的elisa体系检测,这种方法具有用时少、准确率高、检测费用低、不需要专业操作人员,且灵敏度高,可达到50cfu/ml。因此,本方法特别很适于快速定量检测鼠伤寒沙门氏菌。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
图1示出本发明纳米免疫磁珠富集捕获菌体过程示意图。
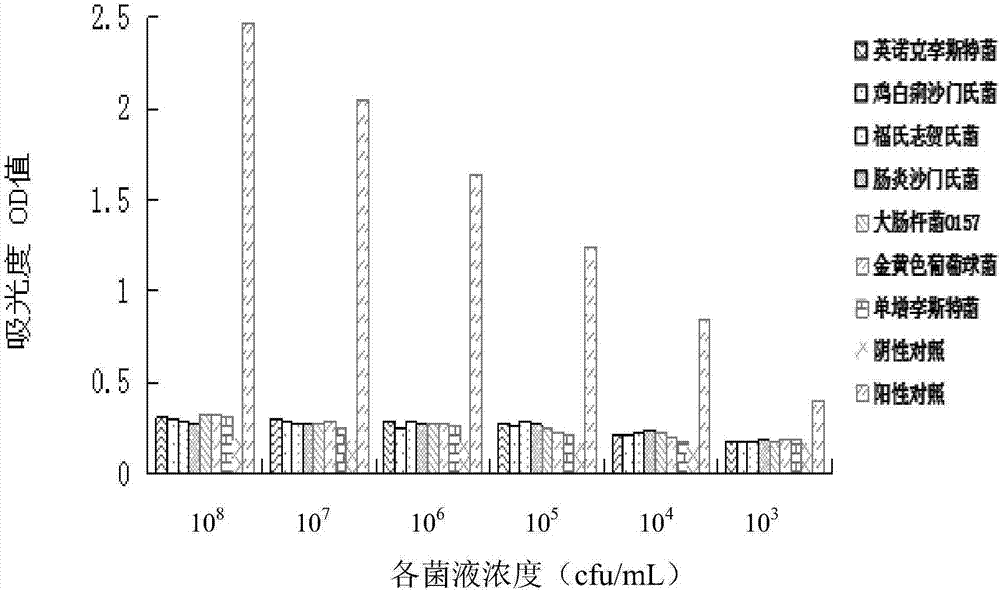
图2示出特异性检测结果。
图3示出elisa标准曲线。
图4示出elisa灵敏度检测结果。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
实施例1纳米免疫磁珠的制备及捕获富集沙门氏菌菌体
1、抗体的制备与纯化
以高压灭菌处理鼠伤寒沙门氏菌体作为抗原免疫8周龄健康balb/c雌性小鼠,按常规的杂交瘤技术和极限稀释法制备和筛选出单克隆抗体细胞株,进而将抗鼠伤寒沙门氏菌的特异性抗体细胞株增殖培养,注射到小鼠体内制备腹水,所得腹水经辛酸-硫酸铵沉淀法进行抗体纯化,-20℃保存。
其中,分泌产生抗鼠伤寒沙门氏菌的单克隆抗体m11的杂交瘤细胞株6e7已于2015年01月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址是中国北京市朝阳区北辰西路1号院3号),其保藏编号为cgmccno.10313,分类命名为产抗沙门氏菌单克隆抗体细胞株。
2、纳米磁珠与抗体的偶联
采用活泼酯的方法,将链霉亲和素与纳米磁珠偶联获得链霉亲和素磁珠,采用生物素化抗体与链霉亲和素磁珠连接制成链霉亲和素纳米免疫磁珠。具体地,取10mg180nm磁珠依次用无水乙醇,用1mol/lnaoh,1mol/lhcl各洗涤1次,用pb(0.02mol/l,ph4.0)洗5次,mes(0.05mol/l,ph6.0)重悬。依次加入n-羟基硫代琥珀酰亚胺(nhss)0.4mg,二氯乙烷(edc)0.35mg,置于混匀仪上保持磁珠悬浮状态,37℃活化2.5h。将每毫克活化磁珠与250μg链霉亲和素偶联;获得的链霉亲和素磁珠,按每毫克链霉亲和素磁珠加入100mg生物素化鼠伤寒沙门氏菌单克隆抗体m11,置于混匀仪上37℃偶联35min。磁力架回收磁珠,pb洗涤5次,10mlpbs(含0.05g/100mlnan3,0.5g/100mlbsa,ph7.4)重悬磁珠,即得纳米免疫磁珠,于4℃冰箱保存备用。
3、纳米免疫磁珠捕获富集沙门氏菌菌体
取1ml105cfu/ml的鼠伤寒沙门氏菌菌液于2ml的离心管中,取60mg/g(单克隆抗体/磁珠)偶联比制备的纳米免疫磁珠0.15mg于上述离心管。室温下在dynal-mix1旋转混合仪上37℃反应30min(10r/min)后取下,将离心管插入磁力架分离2min,弃去上清液。用1mlpb(0.02%吐温-20)浓缩重悬磁珠,85℃水浴15min,磁分离后弃去磁珠,得到待测样品(具体步骤如图1所示)。
实施例2纳米免疫磁珠添加量的确定及捕获富集沙门氏菌菌体效果
1、纳米免疫磁珠添加量的确定
取1ml105cfu/ml的鼠伤寒沙门氏菌菌液于2ml的离心管中,取60mg/g(单克隆抗体/磁珠)偶联比制备的纳米免疫磁珠0.15mg于上述离心管,另设对照组。室温下在dynal-mix1旋转混合仪上37℃反应30min(10r/min)后取下,将离心管插入磁力架分离2min,吸出上清液。加1mlpb(0.02%吐温-20)洗涤2遍,分离后吸出洗涤液,最后用1mlpb浓缩重悬磁珠,将上清液、洗涤液、磁珠重悬液及对照组作合适倍数稀释,取100μl涂布于鼠伤寒沙门氏菌选择性培养基,平行6个样品,37℃培养12h,选择菌落数在20-200范围内的进行计数,按公式计算其捕获效率(ce):ce(%)=(c1-c2-c3)/c1*100%(c1为对照组菌落总数,c2为上清液菌落总数,c3为洗涤液菌落总数)
当纳米免疫磁珠添加量达到0.15mg时,1ml105cfu/ml菌液捕获效率大于99%。为了保证有效分离,确定在检测中每毫升菌液中加入纳米免疫磁珠0.15mg。
2、纳米免疫磁珠在肉样中捕获富集沙门氏菌菌体效果
称取25g市售鸡肉切碎置于无菌的三角瓶内,添加培养好的鼠伤寒沙门氏菌模拟污染,至目标菌浓度约为100cfu/g,然后加入225ml肉汤,37℃160r/min摇床培养8h,取1ml上层清液到离心管里,各添加0.15mg本发明纳米免疫磁珠,在旋转混合仪上室温反应30min,结束后放入磁场分离2min。将对照组、分离上清液、洗涤液、磁珠重悬液作合适倍数稀释,取100μl涂布于鼠伤寒沙门氏菌选择性培养基上,(对照组同时涂布琼脂培养基计算菌落总数),平行制备6个样品。37℃培养12h后,对鼠伤寒沙门氏菌和杂菌分别计数,计算捕获效率。同时,购买商品磁珠进行同一实验,并计算其捕获效率。在鸡肉样中的捕获效果:本发明纳米免疫磁珠鸡猪肉样品中的捕获效率为98.9%,而商品性免疫磁珠在猪肉样品中的捕获效率为97.5%。说明本发明纳米免疫磁珠比商品性免疫磁珠在样品中的捕获效率要高,本发明纳米免疫磁珠可达到要求,可以进行检测使用。
实施例3elisa体系的建立以及鉴定
1、相关溶液的配制
洗涤液(含0.05%tween20的pbs):1lpbs中加入tween-20500μl。
封闭液(含1%牛血清白蛋白,0.1%tween20的pbs):10mlpbs中加入100mgbsa,10μltween-20。
酶标抗体:将辣根过氧化物酶与编号为58018的单克隆抗体(产自英国abcam公司)采用过碘酸盐氧化法进行偶联。
显色液:底物显色a液与b液等量混合,避光保存,现用现配。底物显色a液:ch3coona13.6g,柠檬酸1.6g,30%h2o20.3ml,蒸馏水加至500ml。底物显色b液:乙二胺四乙酸二钠0.2g,柠檬酸0.95g,丙三醇50ml,0.15gtmb·2hcl蒸馏水加至500ml。
终止液:2mol/lh2so4。
2、elisa体系的建立
运用棋盘滴定法确定m11作为包被抗体以及酶标抗体的最佳工作条件,酶标抗体为与编号为58018的单克隆抗体,从表1中可以看出,当m11以40μg/ml包被,且酶标抗体使用浓度为200μg/ml和300μg/ml,其od值(1.087和0.988)接近1.0,且阴性对照较低,p/n值比较大,所以以上条件为elisa系统最佳工作量。
表1棋盘滴定实验结果
3、elisa体系交叉反应测定
(1)以40μg/mlm11100μl/孔进行提前包被到板上。
(2)加待测样品:将待测样品100μl/孔加到已包被的板上。阳性对照为灭活的鼠伤寒沙门氏菌,阴性对照为正常小鼠血清。以相同的剂量加入对应的孔中,加盖37℃恒温箱温育30min。
(3)用洗涤液洗3次,甩干。
(4)加酶标抗抗体:200μg/ml酶标抗体,100μl/孔,加盖37℃恒温箱温育30min。
(5)用洗涤液洗5次,蒸馏水洗2次。
(6)显色:加新鲜配制的显色液100μl/孔,室温暗处放置15min,显示蓝色。
(7)终止反应、比色:加50μl/孔终止液。颜色变黄。
(8)用酶标仪测定450nm处各孔的吸光值即od450nm。
以配对的抗体进行双抗体夹心elisa检测特异性,经酶标仪在吸光度450nm处检测,结果见图2,从图2中可以看出:两个抗体夹心检测的特异性很好,与英诺克李斯特菌、鸡白痢沙门氏菌、福氏志贺氏菌、肠炎沙门氏菌、大肠杆菌、金黄色葡萄球菌、单增李斯特菌及空白对照几乎没有反应。
实施例4elisa体系灵敏度反应测定
将已知浓度的鼠伤寒沙门氏菌稀释,浓度分别设置为0、1000、2000、3000、4000、5000、6000、7000、8000cfu/ml,用elisa体系反应后测得相应浓度的450nm吸光度值,用数据处理软件以浓度为横坐标、吸光度为纵坐标自动生成标准曲线和对应的方程,如图3。取鸡肉将其用不同浓度鼠伤寒沙门氏菌污染,检测灵敏度,结果见图4,从图4中可以看出,该elisa体系灵敏度为500cfu/g。
实施例5纳米免疫磁珠富集联合酶联免疫吸附确定本发明检测灵敏度
取10g鸡肉按每克加0,10,50,102,103,104,105cfu鼠伤寒沙门氏菌来进行模拟污染,各取出10ml加入1.5mg本发明纳米免疫磁珠。室温下,在旋转混合仪上孵育30min,磁分离后用弃去上清液,用1mlpb浓缩重悬磁珠,85℃水浴15min,磁分离后吸出100μl上清进行elisa检测,结果表明,经过免疫磁珠分离富集反应,浓度为102cfu/g和103cfu/g(od值为0.428和0.901,阴性对照为0.112)菌液的检测结果为强阳性;浓度为50cfu/g检测结果为弱阳性(od值为0.321,阴性对照为0.112),可以表明浓度为50cfu/g的鼠伤寒沙门氏菌经过免疫磁珠分离富集后能通过elisa检出,该方法大大减少了增菌时间,可将取样后的增菌时间缩短至4-5小时,对于检测机构和相关企业有重要意义。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!