共振波导光栅表面结构及使用该结构检测分子间相互作用的方法与流程
本申请涉及共振波导光栅技术,具体涉及一种分子之间相互作用的共振波导光栅表面结构及使用该结构进行亲和力鉴定的方法。
背景技术:
20世纪50年代印度新德里发生了因饮用水污染造成的急性病毒性肝炎爆发。当时人们认为是由甲型肝炎病毒(hepatitisavirus,hav)引起的,多年后的回顾性研究发现:患者血清内缺乏甲型肝炎病毒感染指标,提示有另一种能引起流行性急性肝炎的病原存在,人们把这种不明原因的病毒性肝炎命名为肠道非甲非乙型肝炎(entericallytransmittednon-anon-bhepatitis,et-nanbh)。该病毒的首次病原学鉴定是1983年balayan等从一名志愿者的研究得到的。
利用免疫电镜技术在该志愿者的急性期粪便和康复期血清中发现一种直径约27nm(27~34nm)的无包膜病毒颗粒,并发现该病毒可成功感染食蟹猴。1990年reyes等将et-nanbh正式命名为戊型肝炎,而相应的致病病原体则被命名为戊型肝炎病毒(戊肝病毒,heptatitisevirus,hev)。
戊型肝炎病毒(hfv)引起的戊型肝炎在临床症状上与甲肝相似,但病死率较高,妊娠晚期病死率可高达15-25%。一直以来,戊肝在世界各地爆发不断。1986~1988年在我国新疆曾发生了一起累积发病11万余人、死亡近千人的戊肝大爆发,造成了极其严重的社会影响。卫生部公布资料显示,我国近年戊肝发病迅速增长,2002年全年戊肝发病报告6830例,2003年上升为9655例,2004年上升为16436例,已经成为普遍流行、危害严重的疾病之一。
hev是一种无包膜的单股正链全长大约7.2kb的rna病毒,主要通过消化道传播。bradley等通过免疫电镜观察hev为大小约27-34nm的二十面体对称结构球形病毒颗粒(bradley,d.w.etal.,procnatlacadsciusa,1987,84(17):6277-6281)。hev含3个部分重叠的开放读码框架(orf),其中orf2编码660个氨基酸的多肽,为病毒主要结构蛋白,组成病毒衣壳,是病毒进入细胞时的关键蛋白(pandask,thakraldetal.,revmedvirol,2007,17:151)。hev的orf2与orf1间隔41个核苷酸,全长1980bp,编码660个氨基酸的多肽porf2,为病毒的主要结构蛋白,porf2能通过非二硫键的方式自组装成病毒衣壳(capsid)。orf2的翻译初始产物为一个82kd的前体蛋白(pporf2),其蛋白n端(aa1-aa36)存在一个典型的信号肽序列,通过信号肽识别蛋白(signalpeptiderecognitionprotein,srp)进入内质网(endoplasmicreticulum,fr),在进入过程中n端信号肽被剪切从而形成成熟的porf2蛋白(72kd)。信号肽之后是一个富含精氨酸的区域,这一强正电区被认为参与了病毒组装过程中基因组rna的衣壳化(encapisidation)。目前已有多种表达系统能够表达orf2编码的蛋白(jameel,s.etal.,jvirol.,1996,70(1):207-216;tyagi,s.etal.,biochembiophysrescommun,2001,284(3):614-621;torresi,j.etal.,jgenvirol.,1999,80(pt5):1185-1188;panda,s.k.etal.,jc1inmicrobiol,1995,33(10):2653-2659;torresi,j.etal.,jvirolmethods,1997,69(1-2):81-91;mcatee,c.p.etal.,jchromatogrbbiomedappl,1996,685(1):91-104;robinson,r.a.etal.,proteinexprpurif,1998,12(1):75-84;carl,m.etal.,clindiagnlabimmunol,1994,1(2):253-256),表达的porf2蛋白能够形成不为β-巯基乙醇解聚但可被沸水浴破坏的非共价同源二聚体(zafrullah,m.etal.,jvirol.,1999,73(5):4074-4082),表明porf2能够形成同源二聚体,这种同源二聚体很可能是组成病毒衣壳的最基本单位。
hev的衣壳蛋白基因相对稳定,但随着编码基因的进一步变异可能引起病毒表面抗原表位的变化,从而导致血清型的差异,因此科学家们用结构蛋白编码区(orf2)进行了基因分型。即将orf2区的核酸变异不超过20%的分离株归为一个基因型。根据这个标准,hev至少可分为4个主要的基因型,其中1、3、4型为主要流行株,2型则只在墨西哥及非洲少数地区流行。
长期依赖,hev衣壳蛋白的检测被认为是一种理想的hev病毒诊断靶标,其具有简便、快速、经济和特异性强的有点,但该检测方法中提高敏感性的关键在于所采用的与衣壳蛋白具有高度亲和力的抗体,现有技术中鉴定分子间相互作用的亲和力的方法有多种,大致分为标记和非标记两种技术。经典的免疫学方法,如酶联免疫吸附试验(enzymelinkedimmunoabsorbent,elisa)、免疫荧光技术(immunofluorescenceassay,ifa)和蛋白印迹(westernblot,wb)等是标记的方法,需要在抗体连接上显色剂、荧光素、同位素等标记物以报告检测的蛋白。到目前为止,这些标记的技术仍广泛、有效地应用于生物、制药等各种领域。然而,由于标记物有可能改变蛋白质分子结构和功能,导致一些假阳性和假阴性的结果,因此,基于光学、电化学、碳纳米管场效应的非标记技术越来越成为检测分子之间相互作用的理想工具。目前,生物传感器使光学标记物独立检测技术能够用于检测生物传感器上的生物分子相互作用,包括蛋白质-蛋白质相互作用等。现有技术中已经存在如wo2006/108183a1中所公开的基于共振波导光栅技术的无标记生物传感器进行细胞相关检测的应用。然而传统的采用生物传感器检测分子相互作用不适用微量培养,因此影响了高通量筛选的使用。
本申请将共振波导光栅检测手段应用于微量培养板,实现单克隆抗体的亲和力动力学分析中,以克服现有标记筛选技术中存在的问题,从而构建一种新型、高效的检测分子间相互作用的平台和方法。
技术实现要素:
为克服现有技术中传统的检测分子间相互作用的方法存在的困难,本申请将共振波导光栅检测手段应用于微量培养板,实现单克隆抗体的亲和力动力学分析中,从而构建一种新型、高效的检测分子间相互作用的平台和方法。
本发明首先提供一种共振波导光栅表面结构,其从上到下包括:侧链偶氮聚合物层、正弦形tio2波导光栅、sub镀层和ito玻璃基底。
其中,侧链偶氮聚合物为聚甲级丙烯酸缩水甘油酯-对硝基偶氮苯胺,其化学结构式为:
其中,所述光栅的周期λ为640nm,深度d为210nm。
其中,在本发明所述的共振波导光栅表面结构上采用沉积技术形成参比区和样品区。
其中,所述共振波导光栅表面结构包括一个以上的参比区和/或一个以上的样品区。
其中,所述参比区和样品区通过如下步骤设置:用反应性试剂涂覆所述共振波导光栅表面,将去活化试剂沉积到所述涂覆表面的预定区域以形成参比区;和使所述共振波导光栅表面接触靶分子,所述靶分子结合于未用活化试剂处理的所述涂覆表面的预定区域形成样品区。
其中,所述反应性试剂包括edc和sulfo-nhs,具体为400mmedc和100mmsulfo-nhs等量混合而成;
其中,所述去活化试剂可以为乙醇胺、乙二胺或聚乙二醇1900da。
本发明另一方面提供一种微量培养板,其包括许多形成在其中的孔的框架,每个孔包含一个共振波导光栅表面结构,所述共振波导光栅表面结构具有参比区和样品区。包括参比区和样品区的所述共振波导光栅表面结构能够利用样品区来检测生物分子结合事件,并能利用参比区来去除对生物分子结合时间的检测造成不良影响的变化。
本发明还提供利用本发明所述构造的微量培养板对分子之间相互作用进行检测的方法。
其中,分子之间的相互作用具体为单克隆抗体亲和力的检测,其具体步骤包括:
在微量培养板各孔中加入靶蛋白,4℃过夜固定;
封闭洗板后,用仪器读取微板各孔的基线值,然后在微孔板中加入用pbs缓冲液梯度稀释的待测单克隆抗体,并将无关小鼠igg抗体作为阴性对照,37℃孵育2小时;
孵育结束后,继续用仪器读取其终止值,根据上述基线值和终止值进行动力学分析,获得待测抗体的解离速率常数kd,结合数率常数ka和平衡解离常数kd。
其中,靶蛋白为hevorf2重组蛋白抗原。
除非另外定义,这里所用的所有技术和科学名词都表达的是在本发明涉及领域里的熟练技术人员所理解的通常含义。这里所用的命名和在细胞培养、分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。
如本文中所使用的,术语“戊型肝炎病毒抗原”(其在本文中简称为hfvag或hev-ag)是指,由hev表达的具有抗原性的蛋白。如本领域技术人员已知的,hev基因组长7.6kb,包含3个开放阅读读框(0rf);其中,orf1主要编码非结构蛋白,orf2主要编码核衣壳蛋白,orf3主要编码病毒结构蛋白。因此,hev表达的抗原蛋白主要由hev的orf2和orf3编码。hevorf2和orf3的完整基因序列可从各种公共数据库(例如ncbi)获得,参见例如aj272108、jq655736、ab177373、kj001824、jn995570等。根据这些已知的基因序列,可容易地确定hevorf2和orf3编码的抗原蛋白。
本发明中的“抗体”一词指任意一种免疫球蛋白,包括能结合特异性抗原的单抗、多抗、双特异性或多特异性抗体。一个完整的抗体包含两条重链和两条轻链。每条重链含有一个可变区和第一、第二、第三等三个恒定区;每条轻链包含一个可变区和一个恒定区。抗体呈“y”型,“y”型结构的颈部含有两条重链的第二和第三恒定区,其通过二硫键结合形成。“y”型结构的每条臂含有其中一条重链的第一恒定区和可变区,和一条轻链的可变区和恒定区。轻链和重链的可变区决定抗原的结合;每条链的可变区均含有三个高变区,称互补决定区(cdr)(轻链(l)的cdr包含lcdr1、lcdr2、lcdr3,重链(h)的cdr包含hcdr1、hcdr2、hcdr3(其由kabat等人命名,见sequencesofproteinsofimmunologicalinterest,fifthedition(1991),第1-3卷,nihpublication91-3242,bethesdamd)。其中,三个cdr由构架区(fr)间隔开。构架区比cdr区更保守并形成一个架子状结构支撑超变区。重链和轻链的恒定区与抗原结合无关,但具有多种效应功能。抗体依据重链恒定区的氨基酸序列可以分成几类,主要是:iga、igd、ige、igg和igm,其中有些类还进一步分成亚类,如igg1、igg2、igg3、igg4、iga1或iga2等。
可以采用kohler等在nature256:495(1975)中报道的杂交瘤制备方法来制备单抗。首先将免疫原(必要时候添加佐剂)免疫注射小鼠或其它合适的宿主动物。免疫原或佐剂的注射方式通常为皮下多点注射或腹腔注射。免疫原预先藕联到某些已知蛋白,如血清白蛋白或大豆胰酶抑制剂上,可能会有助于增强抗原在宿主内的免疫原性。佐剂可以利用福氏佐剂或mpl-tdm等。动物受免疫后,体内会有分泌特异性结合免疫原的抗体的淋巴细胞产生。另外,淋巴细胞也可以利用体外免疫获得。收集目的淋巴细胞与骨髓瘤细胞并用合适的融合剂,如peg,进行融合以获得杂交瘤细胞(goding,monoclonalantibodies:principlesandpractice,pp.59-103,academicpress,1996)。
上述制备的杂交瘤细胞可以接种到合适的培养液中生长,培养液中最好含有一种或多种能够抑制未融合的、母体骨髓瘤细胞生长的物质。例如,对缺乏次黄嘌呤鸟嘌呤磷酸转移酶(hgprtorhprt)的母体骨髓瘤细胞,在培养液中添加次黄嘌呤、氨基喋呤和胸腺嘧啶(hat培养基)等物质将可以抑制hgprt-缺陷细胞的生长。
优选的骨髓瘤细胞应该具有融合率高,抗体分泌能力稳定,对hat培养液敏感等能力。其中,骨髓瘤细胞首选鼠源骨髓瘤,如mop-21andmc-11小鼠肿瘤衍生株(thesalkinstitutecelldistributioncenter,sandiego,calif.usa),和sp-2/0orx63-ag8-653细胞株(americantypeculturecollection,rockville,md.usa)。另外也有研究报道利用人骨髓瘤和人鼠异源骨髓瘤细胞株制备人单抗
(kozbor,j.immunol.,133:3001(1984);brodeuretal.,monoclonalantibodyproductiontechniquesandapplications,pp.51-63,marceldekker,inc.,newyork,1987)。
杂交瘤细胞生长的培养液用于检测针对特异抗原的单抗的产生。测定杂交瘤细胞产生的单抗的结合特异性有免疫沉淀或体外结合试验,如放射免疫试验(ria)、酶联免疫吸附试验(elisa)。例如,利用munson等在anal.biochem.107:220(1980)描述的scatchard分析法可用来测定单抗的亲和力。
当杂交瘤产生的抗体的特异性、亲和力和反应性确定之后,目的细胞株可以通过(goding,monoclonalantibodies:principlesandpractice,pp.59-103,academicpress,1996)所描述的标准的有限稀释法进行亚克隆化。合适的培养液可以是dmem或rpmi-1640等。另外,杂交瘤细胞还可以腹水瘤的形式在动物体内生长。
利用传统的免疫球蛋白纯化方法,如蛋白a琼脂糖凝胶、羟基磷灰石层析、凝胶电泳、透析或亲和层析等,可以将亚克隆细胞分泌的单抗从细胞培养液、腹水或血清中分离出来。
如本文中所使用的,术语“免疫学测定”是指,利用抗原-抗体之间的特异性相互作用/结合亲和力来进行的测定,其一般可用于检测特定抗原或者抗体在样品中的存在或水平。此类免疫学测定是本领域技术人员公知的,包括但不限于,elisa测定,western印迹,表面等离子共振法,elispot测定等。关于免疫学测定的详细描述,可参见例如,fundamentalimmunology,ch.7paul,w.,ed.,第2版,ravenpress,n.y.(1989)。
如本文中使用的,术语“特异性结合”是指,两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。在某些实施方式中,特异性结合某抗原的抗体(或对某抗原具有特异性的抗体)是指,体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的亲和力(kd)结合该抗原。
如本文中所使用的,术语“kd”是指特定抗体-抗原相互作用的解离平衡常数,其用于描述抗体与抗原之间的结合亲和力。平衡解离常数越小,抗体-抗原结合越紧密,抗体与抗原之间的亲和力越高。通常,抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的解离平衡常数(kd)结合抗原,例如,如使用表面等离子体共振术(spr)在biacore仪中测定的。
如本文中所使用的,术语“受试者”包括但不限于各种动物,特别是哺乳动物,例如人。
有益的技术效果
本申请将共振波导光栅检测手段用于单克隆抗体的亲和力动力学分析中,从而构建一种新型、高效的检测分子间相互作用的平台和方法。
附图说明
图1:本发明所述共振波导光栅表面结构示意图;
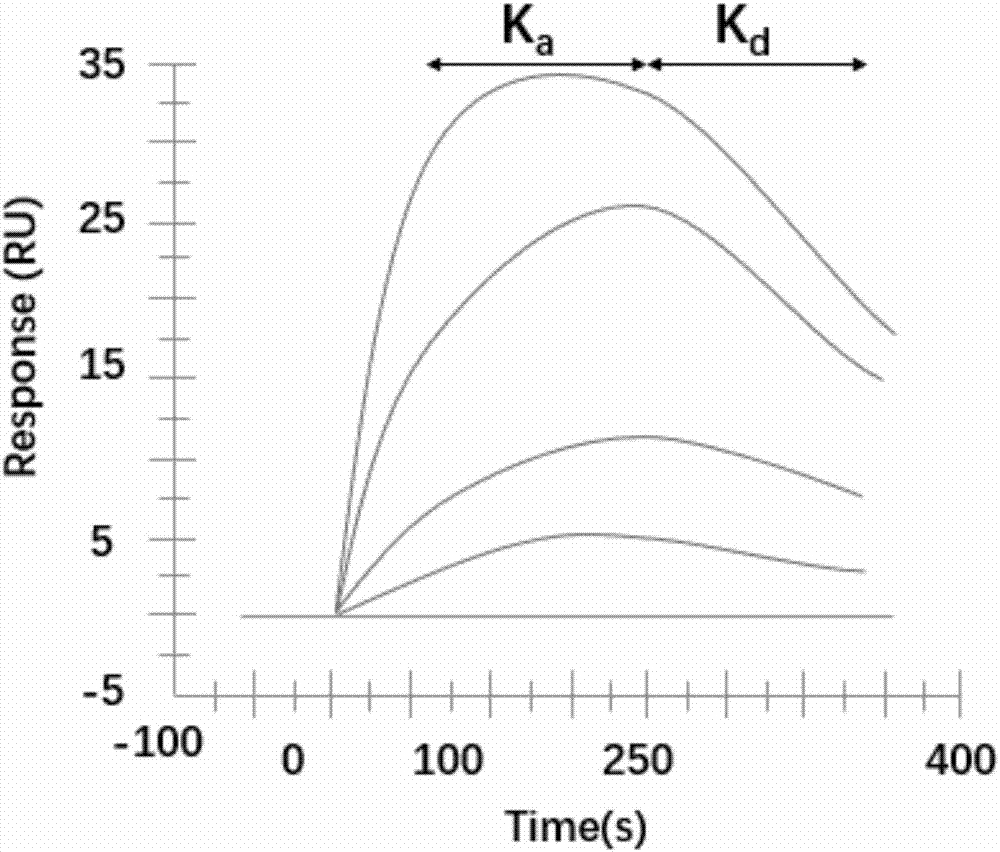
图2:hevorf2单克隆抗体和orf2蛋白相互作用的动力学反应图。
具体实施方式
本发明首先提供一种共振波导光栅表面结构,其从上到下包括:侧链偶氮聚合物层、正弦形tio2波导光栅、su8镀层和ito玻璃基底。
侧链偶氮聚合物可以市售产品,也可以采用常规方法制备而成,侧链偶氮聚合物为侧链上设置偶氮基团的聚合物,可以为聚(甲基)丙烯酸酯型偶氮聚合物、聚酯型偶氮聚合物、聚苯乙烯型偶氮聚合物,优选聚甲级丙烯酸缩水甘油酯-对硝基偶氮苯胺,其化学结构式进一步优选为:
所述聚甲级丙烯酸缩水甘油酯-对硝基偶氮苯胺的制备方法为已知常规方法,具体如下:
第一步,对硝基偶氮苯胺的制备,将3g对硝基苯胺溶解在50ml蒸馏水中,加入市售37%的浓盐酸5ml,室温搅拌溶解,待硝基苯胺完全溶解后在0℃的温度下缓慢滴加1.8g亚硝酸钠配置的水溶液(水使用量为40ml),滴加完毕后继续搅拌1小时,获得重氮盐,在另一个反应容器中加入50ml蒸馏水,随后加入2g苯胺,滴加0.5ml市售37%的浓盐酸,搅拌均匀,在0℃条件下将前面获得的重氮盐滴加其中,保持0℃反应1小时,随后常温搅拌2.5小时,抽滤,固体洗涤至中性,得到2.61g对硝基偶氮苯胺;
第二步,聚甲基丙烯酸缩水甘油酯的合成,将带回流冷凝管的三口烧瓶通氮气20min,加入10ml水、80ml无水乙醇和3g聚乙烯毗咯烷酮,搅拌均匀,加热至70℃,随后加入0.2gaibn和10g甲基丙烯酸缩水甘油酯,搅拌反应12h。产物先过滤,滤液再离心分离,接着分别将滤饼和滤液离心得到的组分合并,真空干燥,获得聚甲基丙烯酸缩水甘油酯;
第三步,聚甲级丙烯酸缩水甘油酯-对硝基偶氮苯胺的制备,将0.6g聚甲基丙烯酸缩水甘油酯溶于20mln-甲基吡咯烷酮中,搅拌20分钟,待聚甲级丙烯酸缩水甘油酯完全溶解,将2g第一步制备的对硝基偶氮苯胺加入上述溶液当中,搅拌过夜,12小时后油浴升温,于80℃下搅拌两小时,将烧瓶内的混合液倒入大量蒸馏水中,过滤,接着沉淀用大量蒸馏水洗,滤饼再用大量无水乙醇浸泡过夜,过滤得到最终产物,于40℃下真空干燥12小时。
所述光栅的周期λ为640nm,深度d为210nm。
在本发明所述的共振波导光栅表面结构上采用沉积技术形成参比区和样品区。
所述共振波导光栅表面结构包括一个以上的参比区和/或一个以上的样品区。
所述参比区和样品区通过如下步骤设置:用反应性试剂涂覆所述共振波导光栅表面,将去活化试剂沉积到所述涂覆表面的预定区域以形成参比区;和使所述共振波导光栅表面接触靶分子,所述靶分子结合于未用活化试剂处理的所述涂覆表面的预定区域形成样品区。
所述反应性试剂包括edc和sulfo-nhs,具体为400mmedc和100mmsulfo-nhs等量混合而成;
所述去活化试剂可以为乙醇胺、乙二胺或聚乙二醇1900da。
本发明另一方面提供一种微量培养板,其包括许多形成在其中的孔的框架,每个孔包含一个共振波导光栅表面结构,所述共振波导光栅表面结构具有参比区和样品区。包括参比区和样品区的所述共振波导光栅表面结构能够利用样品区来检测生物分子结合事件,并能利用参比区来去除对生物分子结合时间的检测造成不良影响的变化。
本发明还提供利用本发明所述构造的微量培养板对分子之间相互作用进行检测的方法。
分子之间的相互作用具体为单克隆抗体亲和力的检测,其具体步骤包括:
在微量培养板各孔中加入靶蛋白,4℃过夜固定;
封闭洗板后,用仪器读取微板各孔的基线值,然后在微孔板中加入用pbs缓冲液梯度稀释的待测单克隆抗体,并将无关小鼠igg抗体作为阴性对照,37℃孵育2小时;
孵育结束后,继续用仪器读取其终止值,根据上述基线值和终止值进行动力学分析,获得待测抗体的解离速率常数kd,结合数率常数ka和平衡解离常数kd。
靶蛋白为hevorf2重组蛋白抗原。
除非另外定义,这里所用的所有技术和科学名词都表达的是在本发明涉及领域里的熟练技术人员所理解的通常含义。这里所用的命名和在细胞培养、分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。
如本文中所使用的,术语“戊型肝炎病毒抗原”(其在本文中简称为hevag或hev-ag)是指,由hev表达的具有抗原性的蛋白。如本领域技术人员已知的,hev基因组长7.6kb,包含3个开放阅读读框(orf);其中,orf1主要编码非结构蛋白,orf2主要编码核衣壳蛋白,orf3主要编码病毒结构蛋白。因此,hev表达的抗原蛋白主要由hev的orf2和orf3编码。hevorf2和orf3的完整基因序列可从各种公共数据库(例如ncbi)获得,参见例如aj272108、jq655736、ab177373、kj001824、jn995570等。根据这些已知的基因序列,可容易地确定hevorf2和orf3编码的抗原蛋白。
本发明中的“抗体”一词指任意一种免疫球蛋白,包括能结合特异性抗原的单抗、多抗、双特异性或多特异性抗体。一个完整的抗体包含两条重链和两条轻链。每条重链含有一个可变区和第一、第二、第三等三个恒定区;每条轻链包含一个可变区和一个恒定区。抗体呈“y”型,“y”型结构的颈部含有两条重链的第二和第三恒定区,其通过二硫键结合形成。“y”型结构的每条臂含有其中一条重链的第一恒定区和可变区,和一条轻链的可变区和恒定区。轻链和重链的可变区决定抗原的结合;每条链的可变区均含有三个高变区,称互补决定区(cdr)(轻链(l)的cdr包含lcdr1、lcdr2、lcdr3,重链(h)的cdr包含hcdr1、hcdr2、hcdr3(其由kabat等人命名,见sequencesofproteinsofimmunologicalinterest,fifthedition(1991),第1-3卷,nihpublication91-3242,bethesdamd)。其中,三个cdr由构架区(fr)间隔开。构架区比cdr区更保守并形成一个架子状结构支撑超变区。重链和轻链的恒定区与抗原结合无关,但具有多种效应功能。抗体依据重链恒定区的氨基酸序列可以分成几类,主要是:iga、igd、ige、igg和igm,其中有些类还进一步分成亚类,如igg1、igg2、igg3、igg4、iga1或iga2等。
可以采用kohler等在nature256:495(1975)中报道的杂交瘤制备方法来制备单抗。首先将免疫原(必要时候添加佐剂)免疫注射小鼠或其它合适的宿主动物。免疫原或佐剂的注射方式通常为皮下多点注射或腹腔注射。免疫原预先藕联到某些已知蛋白,如血清白蛋白或大豆胰酶抑制剂上,可能会有助于增强抗原在宿主内的免疫原性。佐剂可以利用福氏佐剂或mpl-tdm等。动物受免疫后,体内会有分泌特异性结合免疫原的抗体的淋巴细胞产生。另外,淋巴细胞也可以利用体外免疫获得。收集目的淋巴细胞与骨髓瘤细胞并用合适的融合剂,如peg,进行融合以获得杂交瘤细胞(goding,monoclonalantibodies:principlesandpractice,pp.59-103,academicpress,1996)。
上述制备的杂交瘤细胞可以接种到合适的培养液中生长,培养液中最好含有一种或多种能够抑制未融合的、母体骨髓瘤细胞生长的物质。例如,对缺乏次黄嘌呤鸟嘌呤磷酸转移酶(hgprtorhprt)的母体骨髓瘤细胞,在培养液中添加次黄嘌呤、氨基喋呤和胸腺嘧啶(hat培养基)等物质将可以抑制hgprt-缺陷细胞的生长。
优选的骨髓瘤细胞应该具有融合率高,抗体分泌能力稳定,对hat培养液敏感等能力。其中,骨髓瘤细胞首选鼠源骨髓瘤,如mop-21andmc-11小鼠肿瘤衍生株(thesalkinstitutecelldistributioncenter,sandiego,calif.usa),和sp-2/0orx63-ag8-653细胞株(americantypeculturecollection,rockville,md.usa)。另外也有研究报道利用人骨髓瘤和人鼠异源骨髓瘤细胞株制备人单抗
(kozbor,j.immunol.,133:3001(1984);brodeuretal.,monoclonalantibodyproductiontechniquesandapplications,pp.51-63,marceldekker,inc.,newyork,1987)。
杂交瘤细胞生长的培养液用于检测针对特异抗原的单抗的产生。测定杂交瘤细胞产生的单抗的结合特异性有免疫沉淀或体外结合试验,如放射免疫试验(ria)、酶联免疫吸附试验(elisa)。例如,利用munson等在anal.biochem.107:220(1980)描述的scatchard分析法可用来测定单抗的亲和力。
当杂交瘤产生的抗体的特异性、亲和力和反应性确定之后,目的细胞株可以通过(goding,monoclonalantibodies:principlesandpractice,pp.59-103,academicpress,1996)所描述的标准的有限稀释法进行亚克隆化。合适的培养液可以是dmem或rpmi-1640等。另外,杂交瘤细胞还可以腹水瘤的形式在动物体内生长。
利用传统的免疫球蛋白纯化方法,如蛋白a琼脂糖凝胶、羟基磷灰石层析、凝胶电泳、透析或亲和层析等,可以将亚克隆细胞分泌的单抗从细胞培养液、腹水或血清中分离出来。
如本文中所使用的,术语“免疫学测定”是指,利用抗原-抗体之间的特异性相互作用/结合亲和力来进行的测定,其一般可用于检测特定抗原或者抗体在样品中的存在或水平。此类免疫学测定是本领域技术人员公知的,包括但不限于,elisa测定,western印迹,表面等离子共振法,flispot测定等。关于免疫学测定的详细描述,可参见例如,fundamentalimmunology,ch.7paul,w.,ed.,第2版,ravenpress,n.y.(1989)。
如本文中使用的,术语“特异性结合”是指,两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。在某些实施方式中,特异性结合某抗原的抗体(或对某抗原具有特异性的抗体)是指,体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的亲和力(kd)结合该抗原。
如本文中所使用的,术语“kd”是指特定抗体-抗原相互作用的解离平衡常数,其用于描述抗体与抗原之间的结合亲和力。平衡解离常数越小,抗体-抗原结合越紧密,抗体与抗原之间的亲和力越高。通常,抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的解离平衡常数(kd)结合抗原,例如,如使用表面等离子体共振术(spr)在btac0rf仪中测定的。
如本文中所使用的,术语“受试者”包括但不限于各种动物,特别是哺乳动物,例如人。
以下采用实施例和附图来详细说明本发明的实施方式,借此对本发明如何应用技术手段来解决技术问题,并达成技术效果的实现过程能充分理解并据以实施。
实施例1:本发明所述共振波导光栅表面结构的构建
本发明中的共振波导光栅表面结构从上到下包括:侧链偶氮聚合物层、正弦形tio2波导光栅(市售)、su8镀层(市售)和ito玻璃基底(市售)。其中,侧链偶氮聚合物为azo多聚物,具体为聚甲级丙烯酸缩水甘油酯-对硝基偶氮苯胺,其化学结构式为:
所述聚甲级丙烯酸缩水甘油酯-对硝基偶氮苯胺的制备方法为:
将3g对硝基苯胺溶解在50ml蒸馏水中,加入市售37%的浓盐酸5ml,室温搅拌溶解,待硝基苯胺完全溶解后在0℃的温度下缓慢滴加1.8g亚硝酸钠配置的水溶液(水使用量为40ml),滴加完毕后继续搅拌1小时,获得重氮盐,在另一个反应容器中加入50ml蒸馏水,随后加入2g苯胺,滴加0.5ml市售37%的浓盐酸,搅拌均匀,在0℃条件下将前面获得的重氮盐滴加其中,保持0℃反应1小时,随后常温搅拌2.5小时,抽滤,固体洗涤至中性,得到2.61g对硝基偶氮苯胺;聚甲基丙烯酸缩水甘油酯的合成,将带回流冷凝管的三口烧瓶通氮气20min,加入10ml水、80ml无水乙醇和3g聚乙烯毗咯烷酮,搅拌均匀,加热至70℃,随后加入0.2gaibn和10g甲基丙烯酸缩水甘油酯,搅拌反应12h。产物先过滤,滤液再离心分离,接着分别将滤饼和滤液离心得到的组分合并,真空干燥,获得聚甲基丙烯酸缩水甘油酯;将0.6g聚甲基丙烯酸缩水甘油酯溶于20mln-甲基吡咯烷酮中,搅拌20分钟,待聚甲级丙烯酸缩水甘油酯完全溶解,将2g第一步制备的对硝基偶氮苯胺加入上述溶液当中,搅拌过夜,12小时后油浴升温,于80℃下搅拌两小时,将烧瓶内的混合液倒入大量蒸馏水中,过滤,接着沉淀用大量蒸馏水洗,滤饼再用大量无水乙醇浸泡过夜,过滤得到最终产物,于40℃下真空干燥12小时。
所述波导光栅的周期λ为640nm,深度d为210nm。并且在共振波导光栅表面结构上采用沉积技术形成参比区和样品区,共振波导光栅表面结构包括一个以上的参比区和/或一个以上的样品区。
实施例2:hev单克隆抗体的制备
(1)用做抗原的hevorf2的制备
以人戊型肝炎病毒hev全基因(genbank序号:d11092)为模板,orf2fp:5’-atgcgccctcggcca-3’为正向引物,orf2rp:5’-aaataaactataactcccga-3’为反向引物,在pcr热循环仪(biometrat3)按照如下条件进行pcr反应:94℃5分钟;随后是94℃50秒,57℃50秒,72℃2分30秒的25个循环,最后为72℃延伸10分钟。得到特异的2kb左右大小的用做制备本发明多肽之模板的hevorf2的dna片段。将上述获得的pcr产物与商售的pmd18-t载体(takara公司生产)连接,经bamhi/hindiii酶切鉴定,得到插入orf2基因的阳性克隆。在上海博亚生物工程公司,利用m13(+)/(-)引物,测得经过上述方法制备的用做制备本发明多肽的目的基因序列。然后将目的基因与pet-28a(+)载体同时用bamhi和xholi进行双酶切,t4连接酶连接,构建重组表达质粒ft-orf2-268。
将阳性重组表达质粒转化到大肠杆菌表达宿主菌rosetta(de3)中,挑取阳性单克隆于37℃摇床225rpm加入iptg1mm诱导表达6h。菌液5000r/min离心10min,弃上清,重悬沉淀。然后超声破碎菌体,工作时间1s,间隙时间3s,全程时间15min,总共225次。超声后,12000r/min离心10min,收集包涵体沉淀。用5ml4m尿素溶解包涵体,室温孵育1h。将其用0.22μm的滤膜过滤,然后利用ni柱进行蛋白的纯化。利用人hev抗体阳性血清作为一抗,westernblot鉴定得到了目的蛋白的正确表达。纯化的样品冻存于-20℃备用。
(2)小鼠的免疫
a)免疫原的乳化(弗氏佐剂):
将纯化蛋白与佐剂按照1∶1(v/v)混合,然后在振荡器上震荡乳化,将乳化好的免疫原滴一滴在预冷的水中,30分钟不扩散为乳化完全。
b)免疫程序
选择6-8周的babl/c小鼠作为免疫动物。每次免疫前尾部静脉采血,两次免疫间隔为2周。第一次用弗氏完全佐剂,蛋白剂量为75μg/只,腹腔注射,总剂量200μl/只。第二次用弗氏不完全佐剂,蛋白剂量仍为75μg/只。参考第二次相同的剂量和方式进行第三次免疫。融合前加强免疫一次。
(3)细胞融合
免疫好的balb/c小鼠,无菌取免疫小鼠的脾细胞与sp2/0骨髓瘤细胞按5∶1在1ml50%peg下融合,然后利用hat培养基进行选择培养。
(4)阳性细胞的筛选及亚克隆
以纯化的人hevorf2蛋白为抗原包板,吸取细胞培养上清以间接elisa方法筛选阳性的细胞克隆,对结果显示阳性孔,则继续做亚克隆,同时扩大培养并冻存。采用有限稀释法对所选择的杂交瘤细胞进行2次亚克隆。经两次亚克隆,得到与hevorf2具有反应性的单克隆抗体24株。
实施例3:rgw法检测orf2蛋白和单克隆抗体相互作用的亲和力
在本发明所述的微量培养板各孔中加入hevorf2蛋白,4℃过夜固定;封闭洗板后,用读数仪读取微板各孔的基线值,然后在微孔板中加入用pbs缓冲液梯度稀释的待测单克隆抗体,并将无关小鼠igg抗体作为阴性对照,37℃孵育2小时;孵育结束后,继续用仪器读取其终止值,根据上述基线值和终止值采用biaevaluation软件进行动力学分析,获得待测抗体的解离速率常数kd,结合数率常数ka和平衡解离常数kd,其中kd=kd/ka,并且单抗结合反应值pm=kd值/单抗的浓度m。
表1:rwg方法测得的反应性单克隆抗体对orf2亲和力的范围
*指单克隆抗体的亲和力过低,处于rwg检测的范围之外。
所有上述的首要实施这一知识产权,并没有设定限制其他形式的实施这种新产品和/或新方法。本领域技术人员将利用这一重要信息,上述内容修改,以实现类似的执行情况。但是,所有修改或改造基于本发明新产品属于保留的权利。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!