检测β‑淀粉样蛋白的电化学发光免疫传感器及其构建的制作方法
本发明涉及一种电化学发光免疫传感器,尤其是涉及一种快速高灵敏检测β-淀粉样蛋白的电化学发光免疫传感器及其构建方法和应用。
背景技术:
β-淀粉样蛋白(amyloidβ-protein,aβ)由β-淀粉样前体蛋白(β-amyloidprecursorprotein,app)水解而来,由细胞分泌,在细胞基质沉淀聚积后具有很强的神经毒性作用,而且可以激活一系列病理事件。β-淀粉样蛋白沉积形成的细胞外老年斑被认为是阿尔茨海默症(alzheimer’sdisease,ad)病人脑内老年斑周边神经元变性和死亡的主要原因。ad是一种脑部疾病,会造成脑部神经细胞逐渐丧失。患者起病和精神改变隐匿,主要表现为渐进性记忆障碍、人格改变及语言障碍等神经精神症状,被认为是一种主要的社会大众健康问题。目前临床上对于阿尔茨海默症的治疗尚无特效疗法。而对于β-淀粉样蛋白的准确检测能够在一定程度上监测阿尔茨海默症的病发程度和治愈情况。因此,设计创建一种对于β-淀粉样蛋白的简单、灵敏的检测方法是十分有必要的。
目前临床上对β-淀粉样蛋白的检测主要有酶联免疫吸附法(elisa)和放射免疫分析法等等。虽然这些传统的方法可信度高,但在临床应用方面依然面临着耗时耗力、操作复杂、现象不明显、灵敏度不高以及设备昂贵等缺陷。与上述检测方法相比,电化学发光(ecl)技术具有灵敏度高、线性范围宽、背景信号低、操作简单快速等显著优点。电化学发光综合了电化学与光学的双重优点,电化学发光免疫传感器具有操作简单、灵敏度高、检测迅速和背景噪音低等优点。构建新型的夹心结构电化学发光免疫传感器是基于抗原–抗体之间及抗原–适配体之间特异性免疫反应的一种生物传感器,是指某种蛋白有选择性地被其对应的抗体捕获后又与其相应的适配体结合,之后将这个夹心体系与分子探针结合修饰到电极上,通过一定的电化学发光表征手段来间接检测蛋白的量,从而利用高灵敏的电化学发光传感技术将蛋白的浓度转换为相应程度的电化学发光信号,应用于各类生物活性蛋白的检测。
目前,现有技术中已公开了很多种夹心式电化学发光免疫传感器,如中国专利zl201310111897.0公开的一种快速高灵敏检测视黄醇结合蛋白的新型电化学发光免疫传感器,采用双抗夹心法,利用多壁碳纳米管大的比表面积和良好的导电性以及sio2良好的生物相容性和表面规则的孔状结构、大的吸附容量等优点,在玻碳电极表面构建一个双重信号放大的电化学发光免疫传感器,并对人体液中rbp进行电化学发光检测。但是,目前仍未见到有任何用于检测β-淀粉样蛋白的电化学发光免疫传感器的报道。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种快速高灵敏检测β-淀粉样蛋白的电化学发光免疫传感器及其构建。
本发明的目的可以通过以下技术方案来实现:
一种检测β-淀粉样蛋白的电化学发光免疫传感器,包括磁性玻碳电极,以及依次复合在磁性玻碳电极表面的fe3o4-epoxy、介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料、待检测β-淀粉样蛋白和金纳米棒-β-淀粉样蛋白适配体纳米复合材料。
一种检测β-淀粉样蛋白的电化学发光免疫传感器的构建方法,包括以下步骤:
(1)介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料的制备
(1-1)取介孔碳分散于nafion-乙醇混合溶液中,搅拌反应,得到nafion包裹的介孔碳复合材料,离心得到nafion@介孔碳粒子,分散于溶液中备用;
(1-2)搅拌条件下,取三联吡啶钌溶液与步骤(1-1)得到的nafion@介孔碳粒子混合,反应,离心,即得到介孔碳@ru(bpy)32+复合材料,冲洗后分散于溶液中备用;
(1-3)取步骤(1-2)得到的介孔碳@ru(bpy)32+复合材料溶液与β-淀粉样蛋白抗体溶液摇床混合,即得到介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料,保存备用;
(2)金纳米棒-β-淀粉样蛋白适配体纳米复合材料的制备
(2-1)取氯金酸溶液,搅拌条件下加入ctab溶液,混合均匀后再加入硼氢化钠溶液,搅拌混合,静置,得到金纳米种子溶液备用;
(2-2)取硝酸银溶液加入ctab溶液中,搅拌,再依次加入氯金酸溶液、抗坏血酸溶液,搅拌均匀后迅速加入步骤(2-1)的金纳米种子溶液,搅拌反应,静置,离心,洗涤,即得到金纳米棒,备用;
(2-3)室温下,取金纳米棒分散于蒸馏水中,加入β-淀粉样蛋白适配体,摇床反应,离心洗涤,即得到金纳米棒-β-淀粉样蛋白适配体纳米复合材料,分散于溶液中备用;
(3)夹心型磁性电化学发光免疫传感器的组装
(3-1)取环氧基功能化的fe3o4溶液滴加到预处理后的磁性玻碳电极表面,避光干燥;
(3-2)取步骤(1)制成的介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料溶液滴加到预处理后的磁性玻碳电极表面,避光干燥,继续滴加bsat溶液,孵育,冲洗后干燥;
(3-3)接着往磁性玻碳电极表面滴加不同浓度待检测抗原β-淀粉样蛋白,避光干燥,随后滴加bsat溶液,孵育,冲洗后干燥;
(3-4)最后再滴加步骤(2)制成的金纳米棒-β-淀粉样蛋白适配体纳米复合材料,避光条件下干燥,清洗,即构建成磁性玻碳电极/fe3o4-epoxy/介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料/金纳米棒-β-淀粉样蛋白适配体纳米复合材料的夹心型磁性电化学发光免疫传感器。
以10mg介孔碳为计量基准,
步骤(1-1)中,nafion-乙醇混合溶液的浓度为3-7wt%,加入量为3-7ml;
步骤(1-2)中,三联吡啶钌溶液的浓度为15-25mm,加入量为0.5-2ml,制得的介孔碳@ru(bpy)32+复合材料分散于2mlpbs中避光保存;
步骤(1-3)中,介孔碳@ru(bpy)32+复合材料溶液的加入量为500μl,β-淀粉样蛋白抗体的浓度为2-3μg/ml,加入量为500-600μl。
步骤(2-1)中,氯金酸溶液的浓度为0.5-1mmol/l,加入量为5ml,ctab溶液的加入量为0.05-0.2mol/l,加入量为8ml,硼氢化钠溶液的浓度为0.005-0.02mol/l,加入量为0.5ml;
步骤(2-2)中,硝酸银的加入量为(4-8)×10-6mol,ctab的加入量为(2-3)×10-3mol,氯金酸的加入量为(3-5)×10-5mol,抗坏血酸的加入量为(3-5)×10-5mol,金纳米种子溶液的加入量为100μl,制得的金纳米棒分散于1mlpbs中备用;
步骤(2-3)中,金纳米棒溶液的加入量为0.5-1.5ml,β-淀粉样蛋白适配体的加入量为10-15μg,制得的金纳米棒-β-淀粉样蛋白适配体纳米复合材料分散于2mlpbs中备用。
步骤(3-1)中,环氧基功能化的fe3o4溶液的浓度为1mg/ml,滴加量为3-8μl;
步骤(3-2)介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料溶液的滴加量为3-8μl,bsat溶液的加入量为2-5μl;
步骤(3-3)中,抗原β-淀粉样蛋白的滴加量为3-7μl,bsat溶液的滴加量为2-5μl;
步骤(3-4)中,金纳米棒-β-淀粉样蛋白适配体纳米复合材料溶液的滴加量为3-7μl;
所述的bsat溶液为bsat与tween-20的混合溶液,加入量为2-5μl,其中,bsa的浓度为0.2-0.8wt%,tween-20的浓度为0.5-1.5wt%。
步骤(1-1)中,搅拌反应的工艺条件为:在冰水浴条件下,搅拌3-6h;
步骤(1-2)中,反应的工艺条件为:在冰水浴条件下,搅拌反应18-30h;
步骤(1-3)中,介孔碳@ru(bpy)32+复合材料与β-淀粉样蛋白抗体摇床混合的时间为5-8h。
步骤(2-1)中,静置的温度为25-30℃,时间为2-4h;
步骤(2-2)中,硝酸银溶液加入ctab溶液后,搅拌的工艺条件为:温度25-30℃,时间为10-20min;加入金纳米种子溶液后,搅拌时间为0.5-1.5h,静置时间为24h;
步骤(2-3)中,摇床反应的时间为4-8h。
步骤(3-1)、步骤(3-2)和步骤(3-3)中,避光干燥的温度为35-40℃,滴加bsat溶液后,孵育的时间为1-3h。
步骤(1)中离心的工艺条件为:转速为10000-15000rpm,温度为2-6℃。
磁性玻碳电极的预处理方法为:分别用0.3μm,0.05μm的al2o3进行抛光,再依次在二次蒸馏水和乙醇中各超声2min,最后用n2吹干。
本发明基于电化学发光共振能量转移的原理,使用介孔碳(mocs)作为抗体的基底材料,利用介孔碳良好的亲水性、生物相容性及大量的孔道结构等优点,在阳离子选择性透过膜nafion的作用下与电化学发光物质ru(bpy)32+形成稳定的复合材料,可有效减弱电化学发光物质ru(bpy)32+的毒性,而且还可以实现对电化学发光物质ru(bpy)32+的有效固定,可以节约试剂,提高电化学发光效率。然后在介孔碳的表面利用静电作用力实现对抗体的固定;使用表面环氧基团功能化的磁性四氧化三铁纳米颗粒作为负载材料,抗体分子的氨基与环氧基团可实现牢固且有效的共价结合,从而将抗体纳米复合材料固定在磁性四氧化三铁纳米颗粒的表面;加入抗原β-淀粉样蛋白后,利用抗原抗体特异性免疫反应,成功捕获β-淀粉样蛋白;使用金纳米棒通过au-s键固定适配体,当适配体与抗原β-淀粉样蛋白之间进行抗原抗体特异性免疫反应结合后,ru(bpy)32+的电化学发光可被金纳米棒通过电化学发光共振能量转移有效地淬灭,从而构建了一种淬灭型新型夹心结构的电化学发光传感器,可实现对于β-淀粉样蛋白的超灵敏检测。
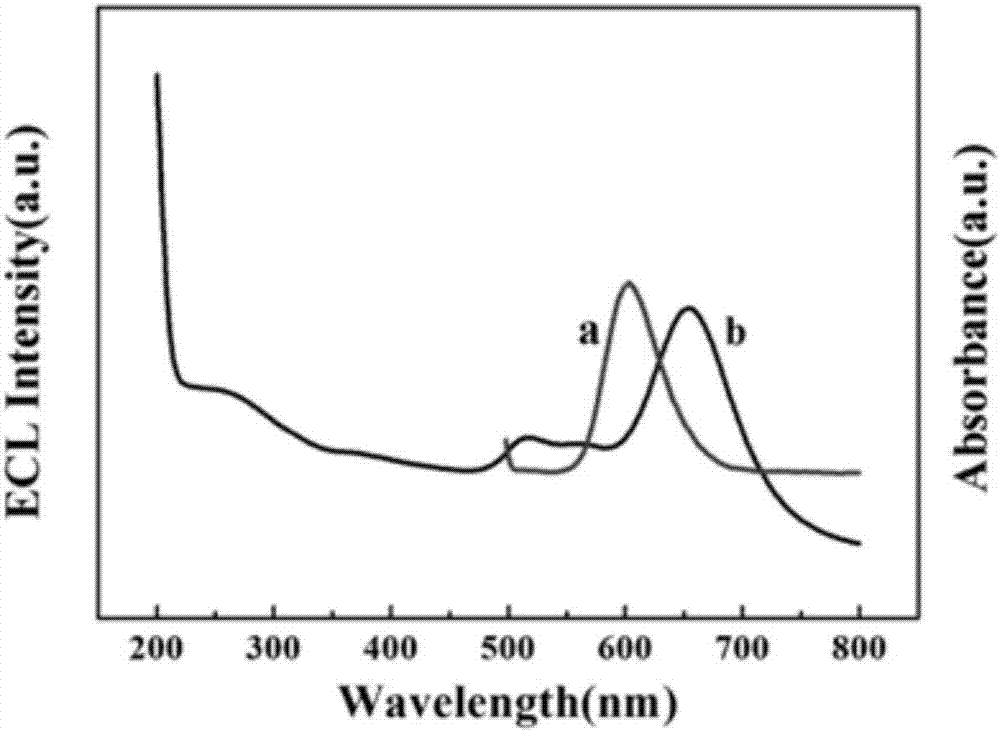
本发明中使用的金纳米棒的表面等离子体共振会引起其对可见与近红外波段特定波长光的散射和吸收,而且金纳米棒的表面等离子体共振波长可以随长宽比变化,从可见(550nm)到近红外(1550nm)连续可调。本发明使用十六烷基三甲基溴化铵(ctab)作为表面活性剂、利用种子诱导生长法合成了在620nm附近有最大紫外可见吸收峰的金纳米棒纳米材料。由于金纳米棒的紫外可见吸收光谱与三联吡啶钌(ru(bpy)32+)的电化学发光光谱存在极大的重叠面积,根据电化学发光共振能量转移的基本原理,金纳米棒的加入可有效淬灭ru(bpy)32+的电化学发光。
与现有技术相比,本发明的基于电化学发光共振能量转移的新型夹心结构电化学发光磁性免疫传感器具有以下优点:
1)使用表面环氧基团功能化的磁性四氧化三铁纳米颗粒作为负载材料,具有超顺磁性、大的比表面积、极大的负载量、空间位阻小且易于实现物理分离等优点。此外,环氧基团与抗体表面基团反应的速度与结合的牢固程度均强于传统的抗体结合方法;
2)使用具有极大空腔结构的介孔碳作为抗体的基底材料,利用nafion的阳离子选择性透过作用得到电化学发光物质ru(bpy)32+与介孔碳的稳定复合材料,减弱电化学发光物质ru(bpy)32+的毒性。同时在介孔碳的表面利用静电作用力实现对抗体的固定,从而可用于构建夹心型电化学发光磁性免疫传感器;
3)利用电化学发光物质ru(bpy)32+的电化学发光图谱与金纳米棒的紫外可见吸收图谱存在极大的重叠面积(如图2所示),两者之间存在电化学发光共振能量转移的可能性极大,因此使用金纳米棒通过au-s键固定适配体。当适配体与抗原β-淀粉样蛋白之间进行抗原抗体特异性免疫反应结合后,ru(bpy)32+的电化学发光可有效被淬灭,从而实现对于β-淀粉样蛋白的超灵敏检测。
4)利用捕获抗体与抗原进行抗原抗体特异性免疫反应后,再与其特异性的适配体进行结合构建新型夹心结构的电化学发光免疫传感器。适配体可在体外进行筛选、价格相对低廉、结合时间大幅缩短、传感器的有效时间大幅延长,并且其稳定性得到改善。同时适配体具有与抗体相同的抗原亲和力和特异性。
本发明的一种新型夹心结构的用于快速高灵敏检测阿尔茨海默症标志物β-淀粉样蛋白的电化学发光免疫传感器的制备方法具有以下优点:
5)利用nafion的阳离子选择性透过作用形成nafion@介孔碳-ru(bpy)32+的复合材料,并利用静电作用力实现在介孔碳的表面对抗体的固定。抗体分子的氨基与表面环氧基团功能化的磁性四氧化三铁纳米颗粒的环氧基团可实现共价结合,从而将抗体纳米复合材料固定在磁性四氧化三铁纳米颗粒的表面。
6)加入抗原β-淀粉样蛋白后,利用抗原抗体特异性免疫反应,成功捕获β-淀粉样蛋白;使用金纳米棒通过au-s键固定适配体,当适配体与抗原β-淀粉样蛋白之间进行抗原抗体特异性免疫反应结合后,ru(bpy)32+的电化学发光可有效被淬灭(如图3所示),从而制得对β-淀粉样蛋白抗原具有靶向特异性检测的夹心型磁性电化学发光免疫传感器。
7)用pbs溶液逐级稀释法配制成不同浓度的抗原β-淀粉样蛋白溶液。用上述电化学发光免疫传感器对抗原β-淀粉样蛋白进行捕获,采用电化学发光的方法对β-淀粉样蛋白进行定量检测。
基于电化学发光共振能量转移原理及介孔碳抗体复合材料的新型夹心结构电化学发光免疫传感器的特点及其应用,本发明的电化学发光生物传感器具有构建方法简便,对阿尔茨海默症标志物(β-淀粉样蛋白等)检测具有检测速度快、灵敏度高、特异性强、检测限低和检测范围宽等优点。该电化学发光免疫传感器的应用为阿尔茨海默症早期诊断及其他疾病标志物的检测提供了新方法。
附图说明
图1为本发明的介孔碳和金纳米棒的扫描电镜图,其中,a为介孔碳的表征图,b为金纳米棒的表征图;
图2为本发明的三联吡啶钌的电化学发光图谱(曲线a)和金纳米棒的紫外-可见吸收光谱(曲线b);
图3为本发明的不同修饰电极的电化学发光图谱;
图4为本发明构建的传感器对不同浓度β-amyloid的电化学发光检测强度图(a)及相应的校准曲线(b)。
具体实施方式
本发明中实验试剂如无特别说明,均为市售产品,其中,六水合二氯三联吡啶钌[ru(bpy)3cl2·6h2o](>98.0%)购买自上海生物工程股份有限公司。环氧基功能化四氧化三铁(fe3o4)购买自上海阿拉丁生化科技股份有限公司,其溶液为直接溶于蒸馏水配成。无水乙醇(ch3ch2oh,ar)购买自上海化学试剂品有限公司。三丙胺(tpa,≥98.0%)和阳离子交换膜nafion(5wt%)购自西格玛奥德里奇(sigma-aldrich)有限公司。牛血清白蛋白(bsa,纯度>99.8%,分子量68000)购买自厦门星隆达化学试剂有限公司。β-淀粉样蛋白(amyloidβ-protein)和β-淀粉样蛋白抗体(anti-amyloidβ-protein)购买自上海信裕生物科技有限公司。吐温20(tween20)、铁氰化钾、磷酸二氢钾和磷酸氢二钠均购自国药化学试剂公司。β-淀粉样蛋白适配体(amyloidβ-proteinaptamer)购买自上海生工生物有限公司。人绒毛膜促性腺激素hcg,甲胎蛋白afp,癌胚抗原cea,糖抗原ca19-9及相应的抗体均购买自上海领潮生物有限公司。不同ph的pbs缓冲溶液是利用磷酸二氢钾和磷酸氢二钠按照一定比例混合形成的。该工作中的所有试剂都是分析纯试剂,实验所用水为去离子水(18.2mω)。此外,免疫材料均溶于ph为7.4的pbs溶液,其它材料在使用时分散在双蒸水中。
下面结合附图和具体实施例对本发明进行详细说明。
实施例1
aβ抗体-nafion@介孔碳-ru(bpy)32+纳米复合材料的制备
首先合成nafion@介孔碳-三联吡啶钌复合材料,其过程如下:将10mg介孔碳(如图1a所示)分散在5ml5wt%nafion-乙醇的混合溶剂中,冰水浴条件下搅拌4小时,得到nafion包裹的介孔碳复合材料。离心(12000rpm,4℃)后得到nafion@介孔碳粒子,用pbs缓冲溶液进行冲洗,分散在2mlpbs中备用。
在持续搅拌条件下,将1ml20mm三联吡啶钌溶液与上述nafion@介孔碳复合材料溶液充分混合,冰水浴中搅拌反应24小时,离心(12000rpm,4℃)去掉过量未反应物,即得介孔碳@ru(bpy)32+包合物,用pbs缓冲溶液进行冲洗,分散在2mlpbs中4℃避光保存备用。
将500μl上述介孔碳@ru(bpy)32+复合材料与550μl2.5μg/mlβ-淀粉样蛋白抗体摇床混合6小时,利用静电吸附和nafion对抗体的包合作用将β-淀粉样蛋白抗体固定在介孔碳纳米材料的表面。从而制得介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料。
实施例1-1
首先合成nafion@介孔碳-三联吡啶钌复合材料,其过程如下:将10mg介孔碳分散在3ml3wt%nafion-乙醇的混合溶剂中,冰水浴条件下搅拌3小时,得到nafion包裹的介孔碳复合材料。离心(12000rpm,4℃)后得到nafion@介孔碳粒子,用pbs缓冲溶液进行冲洗,分散在2mlpbs中备用。
在持续搅拌条件下,将0.5ml25mm三联吡啶钌溶液与上述nafion@介孔碳复合材料溶液充分混合,冰水浴中搅拌反应18小时,离心(12000rpm,4℃)去掉过量未反应物,即得介孔碳@ru(bpy)32+复合材料,用pbs缓冲溶液进行冲洗,分散在2mlpbs中4℃避光保存备用。
将500μl上述介孔碳@ru(bpy)32+复合材料与500μl2μg/mlβ-淀粉样蛋白抗体摇床混合5小时,利用静电吸附和nafion对抗体的包合作用将β-淀粉样蛋白抗体固定在介孔碳纳米材料的表面。从而制得介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料。
实施例1-2
首先合成nafion@介孔碳-三联吡啶钌复合材料,其过程如下:将10mg介孔碳分散在7ml7wt%nafion-乙醇的混合溶剂中,冰水浴条件下搅拌4小时,得到nafion包裹的介孔碳复合材料。离心(12000rpm,4℃)后得到nafion@介孔碳粒子,用pbs缓冲溶液进行冲洗,分散在2mlpbs中备用。
在持续搅拌条件下,将2ml15mm三联吡啶钌溶液与上述nafion@介孔碳复合材料溶液充分混合,冰水浴中搅拌反应24小时,离心(12000rpm,4℃)去掉过量未反应物,即得介孔碳@ru(bpy)32+复合材料,用pbs缓冲溶液进行冲洗,分散在2mlpbs中4℃避光保存备用。
将500μl上述介孔碳@ru(bpy)32+复合材料与600μl3μg/mlβ-淀粉样蛋白抗体摇床混合6小时,利用静电吸附和nafion对抗体的包合作用将β-淀粉样蛋白抗体固定在介孔碳纳米材料的表面。从而制得介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料。
实施例1-3
首先合成nafion@介孔碳-三联吡啶钌复合材料,其过程如下:将10mg介孔碳分散在6ml6wt%nafion-乙醇的混合溶剂中,冰水浴条件下搅拌6小时,得到nafion包裹的介孔碳复合材料。离心(10000rpm,6℃)后得到nafion@介孔碳粒子,用pbs缓冲溶液进行冲洗,分散在2mlpbs中备用。
在持续搅拌条件下,将1.5ml20mm三联吡啶钌溶液与上述nafion@介孔碳复合材料溶液充分混合,冰水浴中搅拌反应30小时,离心(10000rpm,6℃)去掉过量未反应物,即得介孔碳@ru(bpy)32+复合材料,用pbs缓冲溶液进行冲洗,分散在2mlpbs中4℃避光保存备用。
将500μl上述介孔碳@ru(bpy)32+复合材料与540μl2.5μg/mlβ-淀粉样蛋白抗体摇床混合8小时,利用静电吸附和nafion对抗体的包合作用将β-淀粉样蛋白抗体固定在介孔碳纳米材料的表面。从而制得介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料。
实施例1-4
首先合成nafion@介孔碳-三联吡啶钌复合材料,其过程如下:将10mg介孔碳分散在4ml4wt%nafion-乙醇的混合溶剂中,冰水浴条件下搅拌5小时,得到nafion包裹的介孔碳复合材料。离心(15000rpm,2℃)后得到nafion@介孔碳粒子,用pbs缓冲溶液进行冲洗,分散在2mlpbs中备用。
在持续搅拌条件下,将1ml25mm三联吡啶钌溶液与上述nafion@介孔碳复合材料溶液充分混合,冰水浴中搅拌反应20小时,离心(15000rpm,2℃)去掉过量未反应物,即得介孔碳@ru(bpy)32+复合材料,用pbs缓冲溶液进行冲洗,分散在2mlpbs中4℃避光保存备用。
将500μl上述介孔碳@ru(bpy)32+复合材料与580μl2μg/mlβ-淀粉样蛋白抗体摇床混合7时,利用静电吸附和nafion对抗体的包合作用将β-淀粉样蛋白抗体固定在介孔碳纳米材料的表面。从而制得介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料。
实施例2
金纳米棒-β-淀粉样蛋白适配体纳米复合材料的制备
利用种子诱导生长法合成金纳米棒,首先将0.25ml15mmol/l氯金酸溶液用去离子水稀释至5ml,不断搅拌条件下加入8ml0.1mol/lctab溶液,持续搅拌5分钟,混合均匀后加入0.5ml0.01mol/l预冷的硼氢化钠溶液,剧烈搅拌3分钟以充分混合,在28℃条件下放置3小时后备用。
然后,将1.0ml0.006mol/l硝酸银溶液加入25ml0.1mol/lctab溶液中,在28℃条件下恒温持续搅拌10分钟,依次加入2.5ml15mmol/l氯金酸溶液、0.50ml0.0788mol/l抗坏血酸溶液,搅拌均匀后,迅速加入100μl上述金纳米种子溶液。缓慢搅拌1小时后,静置24小时,离心洗涤3次,即得金纳米棒(如图1b所示),分散于1mlpbs中,室温保存备用。
最后,将1ml上述金纳米棒溶液在室温条件下分散在1mlpbs中,加入1.5ml8μg/mlβ-淀粉样蛋白适配体至上述分散液中,超声分散均匀,室温条件下摇床反应6小时后离心洗涤,即得金纳米棒-β-淀粉样蛋白适配体纳米复合材料,分散于2mlpbs中,保存备用。
实施例2-1
金纳米棒-β-淀粉样蛋白适配体纳米复合材料的制备
利用种子诱导生长法合成金纳米棒,首先将0.25ml10mmol/l氯金酸溶液用去离子水稀释至5ml,不断搅拌条件下加入8ml0.05mol/lctab溶液,持续搅拌5分钟,混合均匀后加入0.5ml0.005mol/l预冷的硼氢化钠溶液,剧烈搅拌3分钟以充分混合,在28℃条件下放置3小时后备用。
然后,将1.0ml0.004mol/l硝酸银溶液加入25ml0.08mol/lctab溶液中,在28℃条件下恒温持续搅拌10分钟,依次加入2.5ml20mmol/l氯金酸溶液、0.50ml0.06mol/l抗坏血酸溶液,搅拌均匀后,迅速加入100μl上述金纳米种子溶液。缓慢搅拌1小时后,静置24小时,离心洗涤3次,即得金纳米棒(如图1b所示),分散于1mlpbs中,室温保存备用。
最后,将0.5ml上述金纳米棒溶液在室温条件下分散在1mlpbs中,加入1.0ml10μg/mlβ-淀粉样蛋白适配体至上述分散液中,超声分散均匀,室温条件下摇床反应6小时后离心洗涤,即得金纳米棒-β-淀粉样蛋白适配体纳米复合材料,分散于2mlpbs中,保存备用。
实施例2-2
金纳米棒-β-淀粉样蛋白适配体纳米复合材料的制备
利用种子诱导生长法合成金纳米棒,首先将0.25ml20mmol/l氯金酸溶液用去离子水稀释至5ml,不断搅拌条件下加入8ml0.2mol/lctab溶液,持续搅拌5分钟,混合均匀后加入0.5ml0.02mol/l预冷的硼氢化钠溶液,剧烈搅拌3分钟以充分混合,在28℃条件下放置3小时后备用。
然后,将1.0ml0.008mol/l硝酸银溶液加入25ml0.12mol/lctab溶液中,在28℃条件下恒温持续搅拌10分钟,依次加入2.5ml12mmol/l氯金酸溶液、0.50ml0.1mol/l抗坏血酸溶液,搅拌均匀后,迅速加入100μl上述金纳米种子溶液。缓慢搅拌1小时后,静置24小时,离心洗涤3次,即得金纳米棒(如图1b所示),分散于1mlpbs中,室温保存备用。
最后,将1.5ml上述金纳米棒溶液在室温条件下分散在1mlpbs中,加入1.5ml10μg/mlβ-淀粉样蛋白适配体至上述分散液中,超声分散均匀,室温条件下摇床反应6小时后离心洗涤,即得金纳米棒-β-淀粉样蛋白适配体纳米复合材料,分散于2mlpbs中,保存备用。
实施例2-3
金纳米棒-β-淀粉样蛋白适配体纳米复合材料的制备
利用种子诱导生长法合成金纳米棒,首先将0.25ml18mmol/l氯金酸溶液用去离子水稀释至5ml,不断搅拌条件下加入8ml0.15mol/lctab溶液,持续搅拌10分钟,混合均匀后加入0.5ml0.02mol/l预冷的硼氢化钠溶液,剧烈搅拌2分钟以充分混合,在25℃条件下放置4小时后备用。
然后,将1.0ml0.005mol/l硝酸银溶液加入25ml0.09mol/lctab溶液中,在25℃条件下恒温持续搅拌20分钟,依次加入2.5ml10mmol/l氯金酸溶液、0.50ml0.08mol/l抗坏血酸溶液,搅拌均匀后,迅速加入100μl上述金纳米种子溶液。缓慢搅拌0.5小时后,静置24小时,离心洗涤3次,即得金纳米棒(如图1b所示),分散于1mlpbs中,室温保存备用。
最后,将1.0ml上述金纳米棒溶液在室温条件下分散在1mlpbs中,加入1.5ml10μg/mlβ-淀粉样蛋白适配体至上述分散液中,超声分散均匀,室温条件下摇床反应4小时后离心洗涤,即得金纳米棒-β-淀粉样蛋白适配体纳米复合材料,分散于2mlpbs中,保存备用。
实施例2-4
金纳米棒-β-淀粉样蛋白适配体纳米复合材料的制备
利用种子诱导生长法合成金纳米棒,首先将0.25ml12mmol/l氯金酸溶液用去离子水稀释至5ml,不断搅拌条件下加入8ml0.15mol/lctab溶液,持续搅拌8分钟,混合均匀后加入0.5ml0.02mol/l预冷的硼氢化钠溶液,剧烈搅拌2分钟以充分混合,在30℃条件下放置2小时后备用。
然后,将1.0ml0.005mol/l硝酸银溶液加入25ml0.1mol/lctab溶液中,在30℃条件下恒温持续搅拌15分钟,依次加入2.5ml10mmol/l氯金酸溶液、0.50ml0.08mol/l抗坏血酸溶液,搅拌均匀后,迅速加入100μl上述金纳米种子溶液。缓慢搅拌1.5小时后,静置24小时,离心洗涤3次,即得金纳米棒(如图1b所示),分散于1mlpbs中,室温保存备用。
最后,将1.2ml上述金纳米棒溶液在室温条件下分散在1mlpbs中,加入1.5ml10μg/mlβ-淀粉样蛋白适配体至上述分散液中,超声分散均匀,室温条件下摇床反应8小时后离心洗涤,即得金纳米棒-β-淀粉样蛋白适配体纳米复合材料,分散于1mlpbs中,保存备用。
实施例3
夹心型磁性电化学发光免疫传感器的组装
首先将磁性玻碳电极(mgce,直径3.0mm)分别用0.3μm,0.05μmal2o3进行抛光,依次在二次蒸馏水和乙醇中各超声2min,以除去残留在电极表面的al2o3颗粒,用n2吹干。将5μl1mg/ml环氧基功能化的fe3o4溶液滴加到预处理后的磁性玻碳电极表面,避光干燥。再将5μl实施例1制成的介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料滴加到预先处理的磁性玻碳电极表面,避光环境37℃条件下干燥。随后滴加3μlbsat溶液(0.5%bsa,1%tween-20)孵育2h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加5μlβ-淀粉样蛋白抗原,避光环境37℃条件下干燥。随后滴加3μlbsat溶液(0.5%bsa包含1%tween-20)孵育2h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加5μl实施例2制成的金纳米棒-β-淀粉样蛋白适配体纳米复合材料,避光环境37℃条件下干燥。用pbs溶液轻轻冲洗多次,即构建成mgce/fe3o4-epoxy/mesoporouscarbon@ru(bpy)32+/β-amyloidantibody/β-amyloid/aunrs-β-amyloidaptamer夹心型磁性电化学发光免疫传感器,放置于4℃冰箱中备用。
实施例3-1
夹心型磁性电化学发光免疫传感器的组装
首先将磁性玻碳电极(mgce,直径3.0mm)分别用0.3μm,0.05μmal2o3进行抛光,依次在二次蒸馏水和乙醇中各超声2min,以除去残留在电极表面的al2o3颗粒,用n2吹干。将3μl1mg/ml环氧基功能化的fe3o4溶液滴加到预处理后的磁性玻碳电极表面,避光干燥。再将3μl实施例1制成的介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料滴加到预先处理的磁性玻碳电极表面,避光环境37℃条件下干燥。随后滴加2μlbsat溶液(0.2wt%bsa,0.5wt%tween-20)孵育2h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加3μlβ-淀粉样蛋白抗原,避光环境37℃条件下干燥。随后滴加2μlbsat溶液(0.2wt%bsa,0.5wt%tween-20)孵育2h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加3μl实施例2制成的金纳米棒-β-淀粉样蛋白适配体纳米复合材料,避光环境37℃条件下干燥。用pbs溶液轻轻冲洗多次,即构建成mgce/fe3o4-epoxy/mesoporouscarbon@ru(bpy)32+/β-amyloidantibody/β-amyloid/aunrs-β-amyloidaptamer夹心型磁性电化学发光免疫传感器,放置于4℃冰箱中备用。
实施例3-2
夹心型磁性电化学发光免疫传感器的组装
首先将磁性玻碳电极(mgce,直径3.0mm)分别用0.3μm,0.05μmal2o3进行抛光,依次在二次蒸馏水和乙醇中各超声2min,以除去残留在电极表面的al2o3颗粒,用n2吹干。将8μl1mg/ml环氧基功能化的fe3o4溶液滴加到预处理后的磁性玻碳电极表面,避光干燥。再将8μl实施例1制成的介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料滴加到预先处理的磁性玻碳电极表面,避光环境37℃条件下干燥。随后滴加5μlbsat溶液(0.8wt%bsa,1.5wt%tween-20)孵育2h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加7μlβ-淀粉样蛋白抗原,避光环境37℃条件下干燥。随后滴加2μlbsat溶液(0.8wt%bsa,1.5wt%tween-20)孵育2h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加3μl实施例2制成的金纳米棒-β-淀粉样蛋白适配体纳米复合材料,避光环境37℃条件下干燥。用pbs溶液轻轻冲洗多次,即构建成mgce/fe3o4-epoxy/mesoporouscarbon@ru(bpy)32+/β-amyloidantibody/β-amyloid/aunrs-β-amyloidaptamer夹心型磁性电化学发光免疫传感器,放置于4℃冰箱中备用。
实施例3-3
夹心型磁性电化学发光免疫传感器的组装
首先将磁性玻碳电极(mgce,直径3.0mm)分别用0.3μm,0.05μmal2o3进行抛光,依次在二次蒸馏水和乙醇中各超声2min,以除去残留在电极表面的al2o3颗粒,用n2吹干。将5μl1mg/ml环氧基功能化的fe3o4溶液滴加到预处理后的磁性玻碳电极表面,避光干燥。再将5μl实施例1制成的介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料滴加到预先处理的磁性玻碳电极表面,避光环境35℃条件下干燥。随后滴加3μlbsat溶液(0.5wt%bsa,1.0wt%tween-20)孵育1h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加7μlβ-淀粉样蛋白抗原,避光环境35℃条件下干燥。随后滴加3μlbsat溶液(0.5wt%bsa,1.0wt%tween-20)孵育1h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加4μl实施例2制成的金纳米棒-β-淀粉样蛋白适配体纳米复合材料,避光环境35℃条件下干燥。用pbs溶液轻轻冲洗多次,即构建成mgce/fe3o4-epoxy/mesoporouscarbon@ru(bpy)32+/β-amyloidantibody/β-amyloid/aunrs-β-amyloidaptamer夹心型磁性电化学发光免疫传感器,放置于4℃冰箱中备用。
实施例3-4
夹心型磁性电化学发光免疫传感器的组装
首先将磁性玻碳电极(mgce,直径3.0mm)分别用0.3μm,0.05μmal2o3进行抛光,依次在二次蒸馏水和乙醇中各超声2min,以除去残留在电极表面的al2o3颗粒,用n2吹干。将5μl1mg/ml环氧基功能化的fe3o4溶液滴加到预处理后的磁性玻碳电极表面,避光干燥。再将5μl实施例1制成的介孔碳@ru(bpy)32+/β-淀粉样蛋白抗体纳米复合材料滴加到预先处理的磁性玻碳电极表面,避光环境40℃条件下干燥。随后滴加3μlbsat溶液(0.5wt%bsa,1.0wt%tween-20)孵育3h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加7μlβ-淀粉样蛋白抗原,避光环境40℃条件下干燥。随后滴加3μlbsat溶液(0.5wt%bsa,1.0wt%tween-20)孵育3h,以封闭修饰电极表面非特异性位点。用pbs溶液轻轻冲洗多次,干燥后滴加4μl实施例2制成的金纳米棒-β-淀粉样蛋白适配体纳米复合材料,避光环境40℃条件下干燥。用pbs溶液轻轻冲洗多次,即构建成mgce/fe3o4-epoxy/mesoporouscarbon@ru(bpy)32+/β-amyloidantibody/β-amyloid/aunrs-β-amyloidaptamer夹心型磁性电化学发光免疫传感器,放置于4℃冰箱中备用。
实施例4
首先分别将5μl不同浓度抗原β-淀粉样蛋白滴加于组装好的电化学发光免疫捕获探针(mgce/fe3o4-epoxy/mocs@ru(bpy)32+/β-amyloidantibody/bsat修饰电极)表面,并置于恒温培育箱中孵育2h,利用抗原抗体的特异性识别,将抗原β-淀粉样蛋白结合固载到修饰电极表面。然后用pbs溶液轻轻冲洗,以去除未吸附的β-淀粉样蛋白抗原。滴加5μl金纳米棒-β-淀粉样蛋白适配体纳米复合材料,避光环境37℃条件下干燥。用pbs溶液轻轻冲洗多次。在最佳条件下,将构建好的免疫传感器用于电化学发光定量检测。
本实验中抗原β-淀粉样蛋白的检测浓度范围为10fg/ml~100ng/ml,随着抗原β-淀粉样蛋白浓度的增大,根据适配体与抗原之间的特异性免疫识别反应,被捕获的金纳米棒-β-淀粉样蛋白适配体纳米复合材料会相应增加。同时由于金纳米棒与电化学发光物质ru(bpy)32+之间能够发生有效的电化学发光共振能量转移,因此ru(bpy)32+的电化学发光信号被淬灭的程度逐渐增大,整个电化学发光传感器的电化学发光响应值表现为逐渐减弱,抗原β-淀粉样蛋白的浓度与传感器的发光信号成线性关系。
如图4所示,经电化学发光测定,随着β-amyloid抗原浓度的增加,电化学发光强度不断减小。电化学发光强度与β-amyloid抗原浓度的对数值呈线性关系,检测范围为10fg/ml~100ng/ml,线性相关系数为0.997,检测限为3.5fg/ml,表明该传感器适用于对阿尔兹海默症生物标志物的定量灵敏检测。与传统的免疫传感检测相比,构建的新型电化学发光传感器具有制备简单、灵敏度高、稳定性良好和特异性强等特点。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种固定三联吡啶钌及电化学发光检测亮蓝的方法与制造工艺
- 一种基于双极电极阵列的可视化电化学发光传感器检测葡萄糖的方法与制造工艺
- 一种电化学发光快速检测抗生素ZwittermicinA浓度的方法与制造工艺
- 一种纳米金铜猝灭硫化锌镉电致发光胰岛素传感器的制备方法与制造工艺
- 一种基于CdSe/ZnS量子点纳米簇的电化学发光生物传感器及其制法和应用的制造方法与工艺
- 一种Fe3O4固载Ru(bpy)32+检测刀豆凝集素A的电化学发光传感器的制造方法与工艺
- 一种基于纸电化学发光芯片的POCT装置的制造方法
- 免疫分析系统及其开盖装置的制造方法
- 一种电化学发光免疫分析仪及其固体废物装置的制造方法
- 一种电化学发光免疫分析仪及其搅拌装置的制造方法