基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器的制作方法
本发明属于分析化学技术领域,涉及基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器。
背景技术:
蛋白质检测是分析化学中的一个重要课题,其在医药学中的应用也已得到广泛重视,特别是在疾病标志物的诊断、药物筛查、疾病的预后监测等方面具有重要意义。然而,由于目标分析物结构的多样性和复杂性,蛋白质的检测成为一个极具挑战性的难题。阵列传感器,也称为“化学鼻/舌”,利用多个传感单元与被分析物之间的交叉响应形成的指纹图谱,实现对多种物质及复杂混合物的识别,具有快速简便、选择性高、灵敏度高、稳定性好等优点,为蛋白质的检测提供了一个理想策略。在过去几年中,几种基于不同光学策略的蛋白质检测阵列传感器已经被开发出来,例如荧光和荧光共振能量转移(FRET)。然而,这些系统普遍需要激发光源,不可避免地收到背景基质的干扰且不具备发展成为便携式设备的可能性,不利于实现传感器的器件化。因此,开发一种具有高准确性、高灵敏度且简单便携的新型蛋白检测阵列传感器仍然是极具挑战性的。
近几年,生物发光共振能量转移技术,简称BRET技术,备受关注,广泛应用于蛋白质相互作用的研究。BRET是指当两个蛋白分子相互作用时,一个蛋白融合表达的供体萤光素酶蛋白酶学反应产生的发光信号光谱与另一个蛋白标记的受体荧光基团的激发光谱相重叠,诱发受体分子发出荧光。BRET技术可克服荧光和FRET技术存在的问题,具有无需激发光,背景更低,便于实现传感器的器件化;真实反映待测蛋白表面性质,对样品破坏性小;避免自发荧光的干扰;数据窗口更宽等优点,在蛋白质的检测中有很大应用前景。常见BRET供体主要有萤火虫萤光素酶、细菌萤光素酶和海肾荧光素酶等,受体通常选择与供体生物发光光谱相匹配的荧光蛋白、量子点或荧光基团。
苝酰亚胺是一种具有强烈荧光的稠环芳香烃化合物,具有很好的光、热、化学稳定性以及较高的荧光量子产率。近年来,苝酰亚胺衍生物已经开始应用在生物成像、生物标记以及基因载体等领域。所以亟需一种利用氨基酸修饰的苝酰亚胺多臂聚合物作BRET受体与蛋白质结合来鉴别蛋白的方法。
技术实现要素:
有鉴于此,本发明的目的之一在于提供一种基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器,本发明的目的之二提供利用蛋白质生物发光成像传感器来检测蛋白的方法。
为达到上述目的,本发明提供如下技术方案:
1.一种基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器,其特征在于,所述蛋白质生物发光成像传感器为BRET受体、BRET供体萤光素酶及萤光素酶底物,所述BRET受体为苝酰亚胺多臂聚合物。
进一步,所述BRET供体萤光素酶是萤火虫萤光素酶,萤光素酶底物是D-荧光素。
进一步,所述苝酰亚胺多臂聚合物结构如通式I所示,n为10-20的整数;R独立为其中当R为时将苝酰亚胺多臂聚合物命名为P1,其中当R为将苝酰亚胺多臂聚合物命名为P2,其中当R为时将苝酰亚胺多臂聚合物命名为P3,其中当R为时将苝酰亚胺多臂聚合物命名为P4,其中当R为时将苝酰亚胺多臂聚合物命名为P5,其中当R为时将苝酰亚胺多臂聚合物命名为P6;
进一步,所述苝酰亚胺多臂聚合物P1至P6的制备方法为如下步骤:1当量诱发剂N,N'-二(2,6-二异丙基苯基)-1,6,7,12-四[4-(2-溴异丁酸乙酯)苯氧基]苝-3,4,9,10-四羧酸二酰亚胺中加入400当量对应氨基酸修饰的单体,2000当量丁酮,1000当量甲醇和1000当量水;反应容器用冷冻解冻泵循环法脱气3次,加入80当量五甲基二乙烯基三胺和28当量溴化亚铜;氮气保护,18-25℃下搅拌10分钟后,60℃聚合反应过夜后用液氮猝熄反应,溶液倒入过量乙醚中沉淀聚合物,除去乙醚液,将沉淀溶于水中并透析3天后冷冻干燥,得苝酰亚胺多臂聚合物P1至P6,所述氨基酸修饰的单体分别为苯丙氨酸单体、丝氨酸单体、天冬氨酸单体、亮氨酸单体、组氨酸单体、或组氨酸甲酯单体。
进一步,萤光素酶的终浓度为500nM,苝酰亚胺多臂聚合物P1,P2,P3,P4,P5和P6的终浓度分别为500nM,50nM,50nM,250nM,167nM和100nM,萤光素酶底物浓度为0.04M。
2.利用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测蛋白的方法,所述方法包括如下步骤:
(1)构建传感单元,所述传感单元为BRET受体苝酰亚胺多臂聚合物和BRET供体萤光素酶,采用滴定法确定BRET受体与BRET供体萤光素酶的化学计量比例,使萤光素酶浓度一定,逐渐增大聚合物浓度,记录BRET效率变化情况,当曲线趋于平稳不再上升时,取BRET效率最大值时BRET受体与BRET供体萤光素酶的化学计量比例构建传感单元,按检测所需构建传感单元数量;不同苝酰亚胺多臂聚合物构成不同种类的传感单元;
(2)将已知蛋白和未知蛋白都稀释至同一水平,分别各加入到不同传感单元中孵育20~40min,加入已知蛋白的构建为训练集,加入未知蛋白的构建为测试集;
(3)分别在训练集和测试集中加入终浓度为0.04M的萤光素酶底物,通过小动物生物发光成像仪检测BRET信号变化,其检测波长为555nm和610nm;
(4)采用统计软件选择分析方法对步骤(3)得到BRET信号变化数据进行分析,计算测试集未知蛋白与训练集已知蛋白的马氏距离的平方值,未知蛋白归类为与已知蛋白马氏距离的平方值最小的那种蛋白。
进一步,还包括检测步骤(5)由稀释水平计算得未知蛋白的初始浓度。
进一步,步骤(1)中所述BRET供体萤光素酶是萤火虫萤光素酶,所述BRET受体苝酰亚胺多臂聚合物为P1-P6中的任意一种,所述传感单元中萤光素酶的终浓度为500nM,所述苝酰亚胺多臂聚合物P1,P2,P3,P4,P5和P6对应的终浓度分别为500nM,50nM,50nM,250nM,167nM和100nM。
进一步,所述BRET信号变化,简称BR,计算方式如下:
其中,R为加入蛋白质时受体发光强度与供体发光强度的比值,R0为未加入蛋白质时受体发光强度与供体发光强度的比值。
进一步,所述传感单元体系为pH 7.8的0.01M磷酸钠缓冲液,所述同一水平是蛋白在280nm下的紫外吸收值均为0.005。
本发明的有益效果在于:采用氨基酸修饰的苝酰亚胺多臂聚合物模拟蛋白质,与萤火虫荧光素酶相互作用,构建基于BRET技术的传感器,成功区分了不同种蛋白质,正确率达到100%,在蛋白质样品的检测中具体高度吻合性,正确率高达95%。本技术方案方法具有以下优点:1、光源来源于生物发光,无需激发光,简单便携;2、以氨基酸修饰的苝酰亚胺多臂聚合物模拟蛋白质,既可以模拟蛋白质的尺寸又可以模拟蛋白质的相互作用,对蛋白样品无破坏性,更真实反映每种蛋白的特性;3、检测波长在610nm,可避免生物基质干扰;4、仅需简单加样、拍照,再经数理统计方法分析就能得到判别结果,快速方便,成本低廉;5、在检测未知蛋白样品的应用中,最低检测浓度达到110nM(细胞色素C),正确率高达95%,说明本方法灵敏度高、特异性强、稳定性好。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为本发明提供的基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测蛋白示意图;
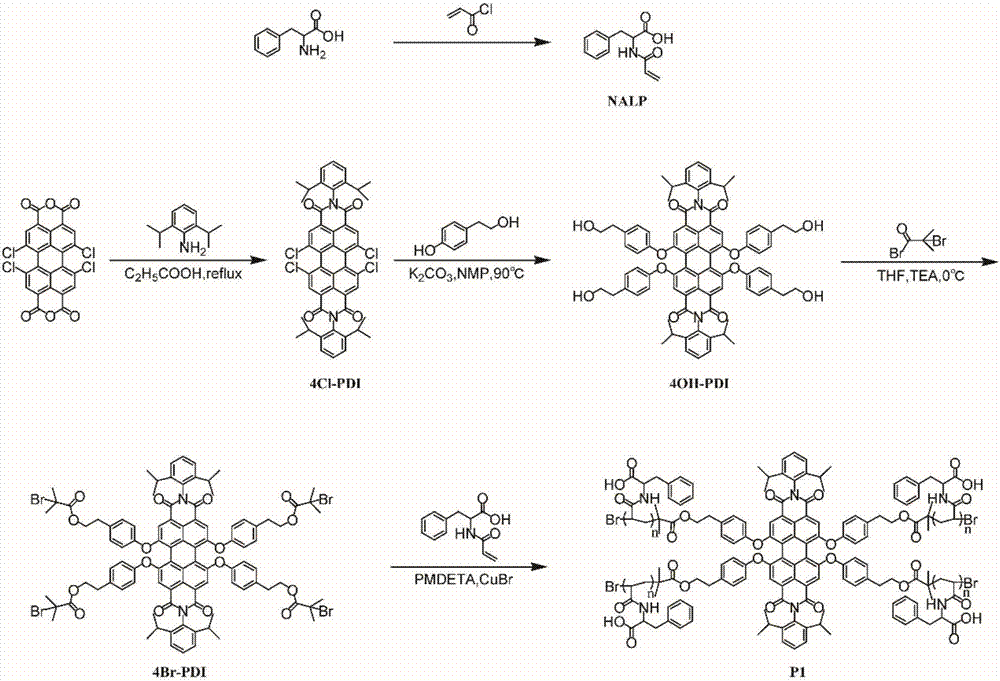
图2为苝酰亚胺多臂聚合物P1合成路线图;
图3为苝酰亚胺多臂聚合物P1核磁表征谱图;
图4为苝酰亚胺多臂聚合物P2核磁表征谱图;
图5为苝酰亚胺多臂聚合物P3核磁表征谱图;
图6为苝酰亚胺多臂聚合物P4核磁表征谱图;
图7为苝酰亚胺多臂聚合物P5核磁表征谱图;
图8为苝酰亚胺多臂聚合物P6核磁表征谱图;
图9A为本发明实施例提供的萤光素酶发射光谱与聚合物激P1-P6发光谱重叠情况谱图,图9B为检测波长为500-700nm波段检测BRET信号的结果图;
图10为本发明实施例3提供的6种聚合物的滴定曲线图;
图11为本发明实施例3提供的96孔板生物发光成像结果图;
图12A为本发明实施例4提供的使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测蛋白质的BRET响应模式图,图12B为本发明实施例4提供的使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测蛋白质的LDA得分图;
图13A为本发明实施例5提供的使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测未知蛋白样品的BRET响应模式图,图13B为本发明实施例5提供的使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测未知蛋白样品的LDA得分图;
图14为实施例4加样设计表。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
本发明提供的基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测蛋白示意图如图1所示。
实施例1:苝酰亚胺聚合单体的制备。
(1)N-丙烯酰-L-苯丙氨酸(NALP)的制备:将3.3038g苯丙氨酸(0.02mol),0.01g 2,6-二叔丁基对甲酚,0.8g NaOH(0.02mol)和20mL蒸馏水置于100ml圆底烧瓶中,得到澄清溶液(pH12),冰浴搅拌,向该溶液中滴加1.63ml丙烯酰氯(0.02mol)。滴加完毕后,使混合液升温至室温,并在室温下搅拌1小时。然后将澄清的水溶液用浓盐酸酸化至pH 1-2。将沉淀物过滤并重结晶,产率:62%。
(2)N-丙烯酰-L-丝氨酸(NALS),N-丙烯酰-L-天冬氨酸(NALA),N-丙烯酰-L-亮氨酸(NALL)和N-丙烯酰-L-组氨酸(NALH)的制备均使用0.02mol相应的氨基酸为原料,遵循与NALP相同的制备步骤。需要特别说明的是,NALA的制备额外多加一点NaOH来中和天冬氨酸的β羧基,使初始pH为12,产率分别为:28%,37%,38%和54%。
(3)N-丙烯酰-L-组氨酸甲酯(NALHH)的制备:氮气保护,在冰浴下向3.3836g组氨酸甲酯盐酸盐(0.02mol)溶液中加入50mL新蒸二氯甲烷和12.46mL三乙胺(90mmol,4.5当量)。在1小时内滴加1.63ml丙烯酰氯(0.02mol)。滴加完毕后,将混合物升至室温,再搅拌4小时。反应液用盐酸酸化,并用3.5%的盐酸洗涤。分离有机层,用饱和Na2CO3溶液洗涤三次。将分离的有机相用无水MgSO4干燥并减压除去溶剂,产率:37%。
实施例2:苝酰亚胺多臂聚合物P1-P6的制备。
6种苝酰亚胺多臂聚合物,即P1、P2、P3、P4、P5和P6,其制备方法如下:
P1的制备:聚合反应在严格干燥的Schlenk管中进行,向其中加入引发剂4Br-PDI(10mg,5.4×10-3mmol,1当量),NALP(508mg,2.16mmol,4×100当量)和丁酮/甲醇/水(2:1:1,总计2.0mL)。反应管经过三次冷冻-泵-解冻循环脱气,然后加入五甲基二乙烯基三胺(77.8mg,0.45mmol,4×21当量)和CuBr(21.4mg,0.15mmol,4×7当量)。在室温下搅拌10分钟以确保催化剂完全形成络合物后,氮气保护在60℃下进行聚合。反应5小时后,用液氮猝熄反应,将反应混合物倒入过量乙醚中沉淀,沉淀溶于水中并透析3天。减压除去溶剂,产物真空干燥,得P1苝酰亚胺多臂聚合物,产率:63%;图2为苝酰亚胺多臂聚合物P1合成路线图。
P2以2.16mmolNALS为原料,其它试剂和步骤同P1。
P3以2.16mmolNALA为原料,其它试剂和步骤同P1。
P4以2.16mmolNALL为原料,其它试剂和步骤同P1。
P5以2.16mmolNALH为原料,其它试剂和步骤同P1。
P6以2.16mmolNALHH为原料,其它试剂和步骤同P1。
P1-P6结构如通式I所示,分别对应R为不同氨基酸取代基的苝酰亚胺多臂聚合物,n为10-20的整数,各聚合物的基本结构和物理性质见表一所示。
表一聚合物基本结构和物理性质
本发明实施例提供的聚合物P1的核磁表征谱图见附图3,聚合物P2的核磁表征谱图见附图4,聚合物P3的核磁表征谱图见附图5,聚合物P4的核磁表征谱图见附图6,聚合物P5的核磁表征谱图见附图7,聚合物P6的核磁表征谱图见附图8。
实施例3:基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器
萤光素酶发射光谱与聚合物P1-P6激发光谱重叠情况谱图见附图9A,检测波长为500-700nm波段检测BRET信号的结果图如图9B所示。
构建传感单元,所述传感单元为BRET受体苝酰亚胺多臂聚合物和BRET供体萤光素酶,采用滴定法确定BRET受体苝酰亚胺多臂聚合物与供体萤光素酶的化学计量比例,使萤光素酶浓度一定,逐渐增大聚合物浓度,记录BRET效率变化情况,当曲线趋于平稳不再上升时,该点的BRET效率即为最大BRET效率,取BRET效率最大值时BRET受体与BRET供体萤光素酶的化学计量比例构建传感单元,按检测所需构建传感单元数量。
96孔板中,每孔加2mM萤火虫萤光素酶50μL,再分别加入不同浓度梯度的苝酰亚胺多臂聚合物P1-P6,孵育15min,加入0.2M萤光素酶底物D-荧光素50μL,1分钟后,用酶标仪检测555nm处的生物发光信号,记录聚合物和萤火虫萤光素酶不同浓度比下的BRET效率,其结果如表二所示。
表二苝酰亚胺多臂聚合物P1-P6和萤火虫萤光素酶滴定数据
6种聚合物的滴定曲线见附图10,根据表二结果得出P1-P6聚合物最大BRET效率及化学计量比,如表三所示:
表三聚合物最大BRET效率及化学计量比
最后根据实验所用荧光分光光度计的灵敏度确定每孔萤光素酶终浓度为500nM,再分别加入苝酰亚胺多臂聚合物P1-P6中的一个为一种传感单元,取1-6种聚合物对应的传感单元为一组,依据上述化学计量比,P1,P2,P3,P4,P5和P6的终浓度分别为500nM,50nM,50nM,250nM,167nM和100nM,所用缓冲液为pH为7.8(萤光素酶最适pH)的0.01M磷酸钠缓冲液,共同孵育15min,每组传感单元加入同一待测蛋白孵育30min,后再加入终浓度为0.04M的萤光素酶底物D-荧光素。每种蛋白对不同1-6种传感单元的响应信号共同组成了其独特的响应模式,类似于指纹图谱,用以进行鉴别。
实施例4:训练集的建立
待测蛋白通过氢键、疏水、π–π堆叠和静电作用等非共价作用竞争性地与受体结合,将供体荧光素酶置换下来,从而导致BRET信号发生变化。再通过小动物生物发光成像仪检测BRET信号变化(BR),采用统计软件选择合适的分析方法对数据进行分析。
基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测已知蛋白样品,本实施例选用表四中所示10种蛋白进行实验,实验蛋白终浓度均为500nM,但不应将此理解为本发明应用范围仅限于以下的实例:
表四本实施例检测蛋白品种及蛋白基本性质
基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测已知蛋白样品,步骤如下:
(1)向96孔板中加入2000nM的萤光素酶50μL,再分别按图14所示加样设计表各孔加入2000nM的聚合物P1,200nM的P2、200nM的P3、1000nM的P4、668nM的P5或400nM的P6,各50μL,孵育15min;实际加样可以根据实验自行设计加样顺序,取1-6种聚合物都可以组合为一组传感单元,再根据所得数据进行线性判别分析;
(2)向上述孔内加入各种对应的1000nM待测蛋白溶液100μL,共同孵育30min,此时孔内萤光素酶的终浓度为500nM,P1,P2,P3,P4,P5和P6的终浓度分别为500nM,50nM,50nM,250nM,167nM和100nM,待测蛋白终浓度为500nM;
(3)加入0.2M萤光素酶底物D-荧光素50μL,1分钟后,用小动物活体光学成像仪进行96孔板成像,拍摄波长为555nm和610nm,所得结果见附图11;
(4)用Living Image软件对成像图进行分析,得到每个孔的平均辐射强度用于计算BR,BR计算方法为:
其中,R为加入蛋白质时受体在610nm平均辐射发光强度与供体在555nm平均辐射发光强度的比值,R0为未加入蛋白质时受体在610nm平均辐射发光强度与供体在555nm平均辐射发光强度的比值。进行6次平行实验,得到10种蛋白的响应模式,如附图12A所示;
(5)表五为本实施例中10种蛋白质的BRET响应模式及LDA判别得分,对上述数据进行线性判别分析,得到附图12B所示判别得分图,成功鉴别了10种蛋白质。
表五本实施例中10种蛋白质的BRET响应模式及LDA判别得分
实施例5:测试集的建立和计算
基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测未知蛋白样品,本实施例选用表四中所示10种蛋白进行实验,但不应理解为本发明应用范围仅限于此。
基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测未知蛋白样品,步骤如下:
(1)将已知蛋白标准品稀释至同一水平,使其在280nm下的紫外吸收值均为0.005,按实施例4所述使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测已知蛋白质的方法构建训练集;
(2)随机配制表四所示的10种蛋白不同浓度的80个蛋白样品,作为未知蛋白样品进行盲实验;
(3)将上述80个未知蛋白样品稀释至同一水平,使其在280nm下的紫外吸收值均为0.005,按实施例4所述使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测已知蛋白质的方法得到测试集,计算测试集与本实施例训练集中每种已知蛋白的马氏距离的平方,待测样本将归类为马氏距离的平方值最小的那类蛋白;
(4)由稀释水平结合郎伯比尔定律,通过简单计算反推出未知蛋白质的初始浓度,80个未知样品中有76个得到正确鉴别,正确率达95%,浓度偏差均在±10%以内,其检测数据如表六所示。
计算方法:C=nA/εl
n为蛋白溶液稀释倍数,ε为该蛋白的摩尔吸光系数,A为紫外280吸光度(此处取0.005),l为吸收层厚度(通常为1cm)。
图13A为本实施例提供的使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测未知蛋白样品的BRET响应模式图,图13B为本实施例提供的使用基于苝酰亚胺多臂聚合物的蛋白质生物发光成像传感器检测未知蛋白样品的LDA得分图;
表六80个样品参数及测试数据
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!