人血浆中泮托拉唑的手性LC‑MS/MS高通量检测方法与流程
本发明涉及一种生物样品中泮托拉唑及其对映异构体的分析检测方法,尤其涉及一种人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法。
背景技术:
手性药物是指药物分子结构中引入手性中心后得到的一对互为实物与镜像的对映异构体,手性药物对映异构体的理化性质基本相似,仅仅旋光性不同,但它们的药效学、药动学和毒理学可能存在很大的差异,比如质子泵抑制剂类药物具有相似的结构特征,分子中存在一个手性硫原子中心为一对对映体组成的混合物,此类药物的药效学和药动学表现出对映体的差异性。现有技术普遍存在的问题是大部分技术只对泮托拉唑等质子泵抑制剂消旋体定量,极少对其单独的对映异构体定量,并且大部分技术没有使用氘代内标,这影响了分析的准确性和重现性,还有的方法采用了液相色谱-紫外检测技术,这一技术灵敏度不能满足低剂量人体药动力学研究的要求,有少数文献报道了手性液相色谱-串联质谱法(lc-ms/ms)检测技术,但由于对应异构体的结构差别很小,色谱分离常常需要较长的时间,大大降低了分析的效率,不适合对动辄数千的大批量的临床样品分析。
目前手性检测血浆中的s-(-)-泮托拉唑和r-(+)-泮托拉唑的技术主要为两种,即液相色谱-紫外技术和液相色谱-串联质谱技术,由于液相色谱-紫外技术需要非常长的色谱分离时间,每天分析样品量低于50个,大大限制了分析通量,且灵敏度较差,定量下限通常在100ng/ml以上,不能满足目前泮托拉唑临床药动学研究的需要,因此,亟待开发一种简便快速、精确度高的样品前处理方法,结合lc-ms/ms色谱技术,缩短运行时间的同时实现高通量。
技术实现要素:
本发明目的在于提供了一种简便快速、精度高,适合大批量样品检测的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法。
为了实现上述目的,本发明提供了一种人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法,包括以下步骤:
s1、血浆样品前处理:取50.0μl血浆,加入500μl内标溶液作为蛋白质沉淀剂,涡流并离心后,取上清液,得到待测样品;
s2、采用lc-ms/ms法测定待测样品中s-(-)-泮托拉唑、r-(+)-泮托拉唑、s-(-)-泮托拉唑-d6和r-(+)-泮托拉唑-d6的浓度:
i.lc条件:luxcellulose-4柱:250mm×4.6m,5μm;柱温:40℃;进样体积:2μl;流动相a:10mm醋酸铵水溶液;流动相b:乙腈,采用体积比为10:90的a:b相等梯度洗脱,流动相的流速为1.3ml/min;
ii.ms条件:离子源:大气压化学电离源apci;雾化电流:3.0μa;离子源温度:550℃;离子源气体n2:55psi,气帘气体n2:40psi;扫描模式:正离子多反应监测+mrm;
s3、标准曲线的绘制:称取s-(-)-泮托拉唑以甲醇溶解并定容,配制成s-(-)-泮托拉唑浓度约为1.00mg/ml的贮备液,称取r-(+)-泮托拉唑以甲醇溶解并定容,配制成r-(+)-泮托拉唑浓度约为1.00mg/ml的贮备液,吸取贮备液并以人空白血浆逐级稀释得到混合标准系列样品,以上述lc-ms-ms条件分别检测所述标准液,并根据检测结果绘制相应的标准曲线。
进一步的,所述步骤s1中涡流的时间均为2min,涡流转速为4500rpm。
进一步的,所述步骤s1中所述内标溶液为分别用s-(-)-泮托拉唑-d6和r-(+)-泮托拉唑-d6标准品以甲醇溶解并定容配制内标浓度为0.8mg/ml的内标贮备液,精密吸取上述各内标贮备液适量,加乙腈稀释,获得s-(-)-泮托拉唑-d6和r-(+)-泮托拉唑-d6的浓度均为50.0ng/ml的混合内标溶液。
进一步的,所述步骤s2中色谱柱的洗脱时间为5.5min。
进一步的,所述步骤s2采用柱后分流,将色谱柱后流出的流动相分流为第一流动相和第二流动相,第一流动相以0.4ml/min的流速进入质谱,第二流动相以0.9ml/min的流速进入排废管路。
进一步的,所述步骤s2中的lc条件还包括自动进样器温度为室温。
进一步的,所述步骤s2中正离子多反应监测的s-(-)-泮托拉唑和r-(+)-泮托拉唑经apci电离后产生前体离子的m/z为384.1,主要碎片离子为m/z200.1,s-(-)-泮托拉唑-d6和r-(+)-泮托拉唑-d6产生的前体离子为m/z390.2,主要碎片离子为m/z206.1,碰撞能量均为18ev。
进一步的,所述步骤s3中混合标准系列样品空白血浆中s-(-)-泮托拉唑和r-(+)-泮托拉唑的浓度范围均为0.0150-15.0μg/ml。
本发明建立检测人血浆中s-(-)-泮托拉唑和r-(+)-泮托拉唑的手性液相色谱-串联质谱方法,前处理方法采用的蛋白沉淀法与已有技术中常使用的液-液提取法相比,预处理步骤少、通量高、更环保,更适合检测大批量临床样品,采用高流速和柱后分流的方法,同时满足了高通量的色谱分离,以及稳定的质谱检测,色谱分析时间短,最终色谱分离时间仅为5.5min,约为已有技术的一半左右,s-(-)-泮托拉唑和r-(+)-泮托拉唑保留时间分别为3.9和4.5min,两个异构体达到基线分离,仪器检测通量提升1倍,每天可分析200个临床样品,提高仪器使用效率的同时大大减少了检测的时间成本。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例详细说明如后。
附图说明
图1是本发明提供的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法中泮托拉唑的离子扫描质谱图;
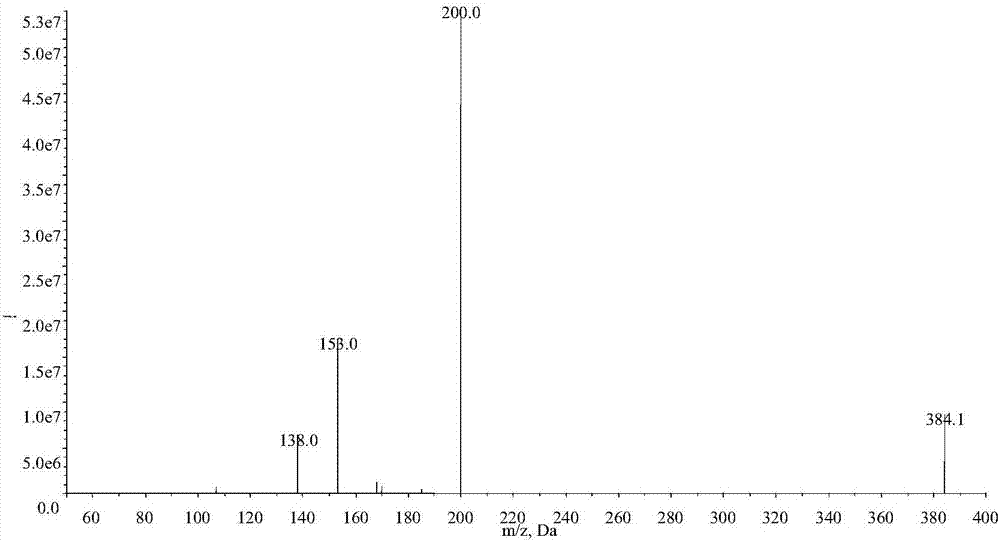
图2本发明提供的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法中泮托拉唑质谱断裂方式的质谱图;
图3本发明提供的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法中同位素内标物泮托拉唑-d6的离子扫描质谱图;
图4本发明提供的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法中泮托拉唑-d6质谱断裂方式的质谱图;
图5是实施例一中空白血浆样品中泮托拉唑和泮托拉唑-d6的mrm色谱图;
图6是实施例一中lloq样品以及加入内标的lloq样品的mrm色谱图;
图7是实施例一中空白血浆中仅加入内标的mrm色谱图;
图8是实施例一中血液样品以及加入内标的血液样品的mrm色谱图;
图9是实施例二中受试者静脉滴注80mg泮托拉唑钠的血液样品中平均药物浓度-时间曲线;
图10是实施例二中受试者静脉滴注40mg左旋泮托拉唑钠的血液样品中平均药物浓度-时间曲线。
具体实施方式
下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例一人血浆中s-(-)-泮托拉唑和r-(+)-泮托拉唑的手性lc-ms/ms测定方法的建立
1、溶液及样品的配制
1.1标准系列样品:称取s-(-)-泮托拉唑以甲醇溶解并定容,配制成s-(-)-泮托拉唑浓度约为1.00mg/ml的贮备液,称取r-(+)-泮托拉唑以甲醇溶解并定容,配制成r-(+)-泮托拉唑浓度约为1.00mg/ml的贮备液,吸取贮备液并以人空白血浆逐级稀释得到混合标准系列样品,s-(-)-泮托拉唑和r-(+)-泮托拉唑浓度范围均为0.0150-15.0μg/ml,以上述lc-ms-ms条件分别检测所述标准液,并根据检测结果绘制相应的标准曲线;
1.2质控样品:采用与标准系列样品相似的方法配制四个浓度水平混合质控样品和对映体选择性质控样品,定量下限lloq浓度为0.150μg/ml,低质控lqc浓度为0.450μg/ml,中质控mqc浓度为2.25μg/ml,高质控mqc浓度为11.5μg/ml,对映体选择性质控样品r-(+)-泮托拉唑/s-(-)-泮托拉唑浓度分别为1.00/0.100和0.100/1.00μg/ml;
1.3内标溶液:分别精密称取s-(-)-泮托拉唑-d6和r-(+)-泮托拉唑-d6内标对照品适量,以甲醇溶解并定容,配制内标浓度约为0.8mg/ml的内标贮备液,精密吸取上述各内标贮备液适量,加乙腈稀释,获得s-(-)-泮托拉唑-d6和r-(+)-泮托拉唑-d6的浓度均为50.0ng/ml的混合内标溶液。
2、血浆样品前处理
取50.0μl血浆,加入500μl内标溶液作为蛋白质沉淀剂,涡流2min,在4500rpm下离心10min后,取上清液,得到待测样品,置于自动进样器内,进行lc-ms/ms分析,进样体积为2.00μl。
3、检测仪器及分析条件
3.1日本岛津公司lc-30ad快速液相色谱系统,串联配有大气压化学电离源(apci)的加拿大sciex公司提供的5500型三重四极杆串联质谱仪。
3.2分析条件
3.2.1色谱条件:色谱柱采用美国phenomenex公司的luxcellulose-4柱,250mm×4.6mm,5μm,柱温:40℃,预柱采用美国phenomenex公司的luxcellulose-4保护柱,4.0×3.0mm,自动进样器设置为室温,进样体积:2μl;流动相a:10mm醋酸铵水溶液;流动相b:乙腈,采用体积比为10:90的a:b相等梯度洗脱,流动相的流速为1.3ml/min,采用柱后分流,将色谱柱后流出的流动相分流为第一流动相和第二流动相,第一流动相以0.4ml/min的流速进入质谱,第二流动相以0.9ml/min的流速进入排废管路;
3.2.2质谱条件:离子源:大气压化学电离源apci,雾化电流:3.0μa,离子源温度:550℃,离子源气体n2:55psi,气帘气体n2:40psi,扫描模式为正离子多反应监测(+mrm),扫描范围:m/z50~400,s-(-)-泮托拉唑和r-(+)-泮托拉唑经apci电离后产生前体离子[m+h]+峰质荷比(m/z)为384.1,得到泮托拉唑的扫描质谱图1,对m/z384.1离子进行产物离子扫描cid,主要碎片离子为m/z200.0,获得泮托拉唑质谱断裂方式的质谱图2;同位素内标物s-(-)-泮托拉唑-d6和r-(+)-泮托拉唑-d6产生的前体离子为m/z390.2,获得扫描质谱图3,主要碎片离子为m/z206.1,获得泮托拉唑-d6质谱断裂方式的质谱图4。
4、方法学验证
按照美国fda指导原则对本方法进行了方法学验证,内容包括稳定性、选择性、线性、准确度、精密度、回收率基质效应。
4.1选择性
取六个不同来源的空白血浆和一个溶血血浆及各自配制的lloq样品处理后进样分析,色谱共流出空白血浆中待测物保留时间处色谱峰面积不高于lloq色谱峰面积的20%,空白血浆中内标保留时间处色谱峰面积不高于内标色谱峰面积的5%,获得空白血浆样品中泮托拉唑和泮托拉唑-d6的mrm色谱图5、lloq样品以及加入内标的lloq样品的mrm色谱图6、空白血浆中仅加入内标的mrm色谱图7和受试者血液样品以及加入内标的血液样品的mrm色谱图8,s-(-)-泮托拉唑和r-(+)-泮托拉唑保留时间分别约为3.9min和4.5min,保留时间附近未见共流出干扰峰。
4.2标准曲线
以待测物理论浓度为横坐标(x),待测物与内标物的峰面积比为纵坐标(y),进行回归分析计算的直线回归方程(权重因子w=1/x2)。方法验证每一分析批对标准曲线样品双样本分析,lloq样品测得值与理论值相对偏差在±20%之内,其它浓度样品在±15%之内,至少75%标准曲线样品应满足上述条件,且标准曲线的lloq和定量上限双样本样品中须至少保证一样本满足上述条件,标准曲线的相关系数的平方值(r2)>0.99。获得测定人血浆中待测物标准曲线直线平均回归方程(n=3)分别为:
s-(-)-泮托拉唑:y=(2.26±0.087)x+(0.000585±0.00195)(r=0.9996±0.0004),
r-(+)-泮托拉唑:y=(2.21±0.102)x+(0.000659±0.001351)(r=0.9996±0.0002),
表示s-(-)-泮托拉唑和r-(+)-泮托拉唑在0.0150-15.0μg/ml的浓度范围内线性关系良好。
4.3精密度和准确度
方法验证每一分析批测定四浓度质控样本各六样本,lloq批内、批间精密度以相对标准差(cv)计算小于20%方可接受,准确度偏差以相对偏差计算(re)在±20%之间方可接受,其余各浓度水平的qc样品各成分日内、日间精密度需小于15%方可接受,准确度偏差在±15%之间方可接受,s-(-)-泮托拉唑lloq批间精密度均小于6.8%,批内精密度均小于3.3%,准确度偏差在-11.0~3.1%范围内,其余浓度qc样品日内精密度均不大于3.0%,日间精密度均不大于5.4%,准确度偏差在-8.9~2.0%范围内,结果见表1;r-(+)-泮托拉唑lloq日间精密度均小于6.1%,批内精密度均小于3.8%,准确度偏差在-7.0~6.3%范围内,其余浓度qc样品日内精密度均不大于2.3%,日间精密度均不大于6.1%,准确度偏差在-7.5~6.4%范围内,结果见表2。
表1.测定人血浆中s-(-)-泮托拉唑精密度和准确度
表2.测定人血浆中r-(+)-泮托拉唑精密度和准确度
4.4对映体选择性
测定对映体选择性质控样本各六样本,各浓度水平的qc样品各成分浓度比批内精密度需小于15%方可接受,准确度在±15%之间方可接受。测量结果显示,对映体选择性浓度比cv均小于1.5%,准确度偏差在-4.3~0.7%范围内,结果见表3。
表3.对映体选择性质控样品检测的精密度和准确度
4.5回收率
取低、中、高三个浓度质控血浆样品,其中s-(-)-泮托拉唑和r-(+)-泮托拉唑在血浆中的浓度分别为0.450、2.25和11.5μg/ml,每一浓度进行六样本分析,取空白血浆按照实施例1步骤2中的血浆样品前处理操作,以乙腈替代内标,平行制备多份,将获得空白上清液合并后配制低、中、高三浓度回收率样品,其中s-(-)-泮托拉唑和r-(+)-泮托拉唑在血浆中的浓度分别为0.450、2.25和11.5μg/ml,内标血浆浓度为5.00μg/ml,每浓度进行六样本分析,以每一浓度两种处理方法的峰面积比值计算回收率。内标回收率以两种处理方法下所有样品的内标峰面积比值计算,lqc、mqc和hqc浓度水平:s-(-)-泮托拉唑的提取回收率分别为106%、105%和105%,s-(-)-泮托拉唑-d6为107%;r-(+)-泮托拉唑的提取回收率分别为105%、102%和108%,r-(+)-泮托拉唑-d6为106%。
4.6基质效应
分别取6个不同来源空白血浆和1份溶血空白血浆,取空白血浆按照实施例1步骤2中的血浆样品前处理操作,以乙腈替代内标,平行制备多份,将获得空白上清液合并后配制低、高两浓度基质样品,其中s-(-)-泮托拉唑和r-(+)-泮托拉唑浓度分别为0.0450和11.5μg/ml,内标血浆浓度为5.00μg/ml,每一来源的每一浓度水平进行三样本分析,同时用水代替空白血浆,用同样的方法操作后进行三样本分析,分别计算两种处理方式下待测物和内标各自基质因子,并以此计算内标归一化后的基质因子,以归一化基质因子的变异程度评价分析方法的基质效应,基质因子cv小于15%方可接受。lqc、hqc浓度水平下s-(-)-泮托拉唑的基质因子分别为102%和103%,cv均不大于1.7%;r-(+)-泮托拉唑的基质因子分别为101%和102%,rsd均不大于2.0%。以上结果表明,基质不干扰待测物定量分析。
实施例二测定人血浆中的s-(-)-泮托拉唑和r-(+)-泮托拉唑
应用实施例一建立的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法定量检测血浆中的s-(-)-泮托拉唑和r-(+)-泮托拉唑,用于评价注射用左旋泮托拉唑钠的药动学特征,健康受试者分别静脉滴注不同剂量的左旋泮托拉唑钠和阳性对照泮托拉唑钠,分别于给药前(0h)、给药后10min、20min、30min、35min、45min、60min、90min、2.0h、3.0h、4.0h、5.0h、6.0h、8.0h和12h以及第2-4天每天早上给药前采集血样本,静脉取血5ml,置于肝素抗凝离心管中,在3500rpm和4℃下离心,5min后分离血浆,在75±10℃保存,应用实施例一中建立的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法进行检测,获得典型健康受试者静脉滴注80mg泮托拉唑钠的血液样品中平均药物-时间浓度曲线图9和健康受试者静脉滴注40mg左旋泮托拉唑钠的血液样品中平均药物-时间浓度曲线图10。
本发明提供的人血浆中泮托拉唑的手性lc-ms/ms高通量检测方法与现有的液相色谱-紫外检测技术以及液相色谱-串联质谱检测技术相比,分析能力大幅提升,另外,目前文献报道的检测方法,多以液-液提取为样本处理方法,这种方法的操作比较复杂,提取试剂不能直接检测,需要将提取试剂浓缩并复溶解,这大大降低了样本处理效率,进而影响样品的检测速度;由于泮托拉唑临床多以静脉给药方式,且剂量较高,其体内暴露量大,药物的血浆浓度较高,因此对检测的灵敏度需求较低,通常在ng/ml级即可满足要求,样品提取时不需要进行浓缩,因此,采用蛋白沉淀法仅须一步提取过程即可,将样本前处理时间由原来的1个多小时缩短为现在30min左右,样品处理通量大大提高。
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!