本发明属于病毒检测技术领域,特别涉及一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒。
背景技术:
水貂阿留申病(aleutianminkdisease,amd)是由水貂阿留申病毒(aleutianminkdiseasevirus,amdv)引起的水貂慢性传染性疾病,主要侵害水貂的免疫系统,以浆细胞弥漫性增生和持续性病毒血症为特征。该病在欧洲、美洲、亚洲等国家均有发生,我国的东北地区以及山东、新疆、内蒙古等地普遍流行,阳性率在20%~30%,个别可达71%。amd不仅能引起一定程度的死亡,还可导致水貂的繁殖力和毛皮质量严重下降,造成不可弥补的经济损失,是危害水貂养殖业健康发展的重要疫病之一。
水貂阿留申病毒(aleutianminkdiseasevirus,amdv)属于细小病毒科(parvoviridae)、细小病毒亚科(parvovirinae)、阿留申貂病毒属(amdovirus)。该病毒粒子分为结构蛋白和非结构蛋白两类,其中结构蛋白vp2是amdv的主要免疫原性抗原,与致病性密切相关,vp2基因也已成为研究amdv毒力、致病性、抗原性和建立检测方法的首选基因。由于amd特殊的致病机理,至今尚无有效预防该病的常规疫苗,也无有效治疗该病的特异性药物。目前防控该病的主要手段是通过检疫淘汰策略净化种群,因此建立一种快速有效的诊断方法对amd的控制和清除具有重要意义。
申请公布号为cn105242042a的发明专利公开了一种水貂阿留申病毒抗体快速检测试剂盒,可以通过间接elisa法对水貂amdv病毒抗体进行检测,其特异性较传统的对流免疫电泳法(ciep)更高,但是间接elisa法和ciep法的检测靶标是抗体,需要对貂群进行频繁采血,而对貂采血难度较大、对貂的应激也较大,因此适用范围有限。而双抗体夹心elisa(das-elisa)的灵敏性和特异性均较高,更重要的是,该方法只需采集貂粪即可进行检测,适用于兽医临床样品的大规模检测。因此,对于amdv检测的das-elisa方法进行探索和优化,以提供最佳的检测条件和方法,成为本领域技术人员急需解决的技术问题。
技术实现要素:
为了解决上述技术问题,本发明提供了一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒。
本发明具体技术方案如下:
本发明提供了一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,包括包被有捕捉抗体的酶标板、检测抗体、酶标抗体以及显色液,其中:
所述捕捉抗体为鼠抗阿留申病毒vp2蛋白单克隆抗体,包被浓度为5~20μg/ml;所述单克隆抗体由adv-1g5杂交瘤细胞株分泌产生,所述adv-1g5杂交瘤细胞株的保藏编号为cgmccno.13829;
所述检测抗体为兔抗阿留申病毒vp2蛋白多克隆抗体,浓度为4~40μg/ml;
所述酶标抗体为辣根过氧化物酶标记的山羊抗兔igg。
所述捕捉抗体由经4次免疫的balb/c小鼠脾细胞和sp2/0细胞融合形成的adv-1g5杂交瘤细胞产生,所述检测抗体由经3次免疫的兔脾细胞产生,均具有良好的特异性,适于应用;经与对照组比较,捕捉抗体和检测抗体在上述范围内时具有较好的检测效果。
进一步地,所述捕捉抗体的包被浓度为10μg/ml,所述检测抗体的浓度为8μg/ml。
实验例表明,上述浓度分别为捕捉抗体和检测抗体的最佳工作浓度。
进一步地,所述酶标板的包被方法如下:用0.05mol/l的碳酸盐缓冲液对所述捕捉抗体进行稀释,包被温度为4~37℃,包被时间为1~12h。
通过上述方法进行包被,可显著提高包被的稳定性、降低包被浓度,节约捕捉抗体的用量。
进一步地,所述酶标板的包被温度为4℃,包被时间为12h。
实施例表明,上述条件为酶标板的最佳包被条件。
进一步地,所述酶标抗体的使用方法如下:将酶标抗体用1%的脱脂奶粉稀释2000~8000倍,在37℃下作用30~90min。
在上述条件下,酶标抗体具有较好的灵敏性,与检测抗体的结合率较高、牢固程度较好。
进一步地,所述试剂盒还包括封闭液、洗涤缓冲液、显色液以及终止液中的至少一种。
进一步地,所述封闭液为5%脱脂奶粉、5%胎牛血清、5%马血清、3%bsa或5%bsa中的一种。
进一步地,所述封闭液为5%的脱脂奶粉。
封闭液的作用是将酶标板中未被吸附的位点进行封闭,以降低非特异性吸附,避免吸附杂质对实验结果造成干扰,降低假阳性结果发生的概率。
进一步地,封闭条件为37℃下1~3h。
该条件下封闭液可以起到较好的封闭效果,降低本底干扰。
进一步地,所述显色液为tmb显色液,显色时间为5~20min。
显色时间在该范围内时,可以使显色充分、提高实验结果的准确性和显色效率。
本发明的有益效果如下:本发明提供了一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,利用amdv-vp2蛋白分别免疫小鼠和家兔,制成鼠抗amdv单克隆抗体和兔抗amdv多克隆抗体,分别作为捕捉抗体和检测抗体,对病毒抗原进行双向夹持,通过对酶标二抗与检测抗体结合的检测,实现了对amdv抗原的检测;通过对实验方法进行优化,确定了最佳反应条件。本研究建立的das-elisa检测方法具有敏感、特异、稳定、简便等优点,适用于一线检疫人员进行大规模病原检测。
附图说明
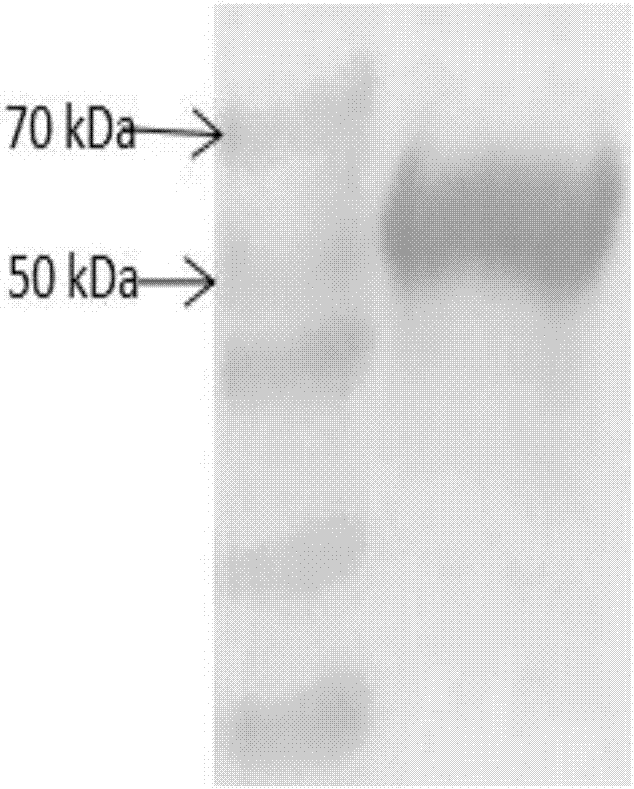
图1为实验例1中vp2重组表达蛋白sds-page电泳图;
图2为实验例1中vp2重组表达蛋白westernblotting分析结果;
图3为实验例2中pab和mab的ifa检测结果;
其中:a:pab感染crfk细胞的ifa检测结果;b:pab产生细胞的ifa检测结果;c:mab感染crfk细胞的ifa检测结果;d:mab产生细胞的ifa检测结果;
图4为实验例3中阳性样品组的棋盘法实验结果;
图5为实验例3中阴性样品组的棋盘法实验结果;
图6为实验例6中特异性实验的结果;
图7为实验例7中敏感性实验的结果;
图8为实验例8中das-elisa和pcr实验结果比较。
具体实施方式
下面结合附图和以下实施例对本发明作进一步详细说明。
实施例1
一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,包括包被有捕捉抗体的酶标板、检测抗体以及酶标抗体,其中:
所述捕捉抗体为鼠抗阿留申病毒vp2蛋白单克隆抗体,包被浓度为5μg/ml;
所述检测抗体为兔抗阿留申病毒vp2蛋白多克隆抗体,浓度为4μg/ml;
所述酶标抗体为山羊抗兔igg-hrp。
实施例2
一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,包括包被有捕捉抗体的酶标板、检测抗体以及酶标抗体,其中:
所述捕捉抗体为鼠抗阿留申病毒vp2蛋白单克隆抗体,包被浓度为20μg/ml;
所述检测抗体为兔抗阿留申病毒vp2蛋白多克隆抗体,浓度为40μg/ml;
所述酶标抗体为山羊抗兔igg-hrp。
实施例3
一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,包括包被有捕捉抗体的酶标板、检测抗体以及酶标抗体,其中:
所述捕捉抗体为鼠抗阿留申病毒vp2蛋白单克隆抗体,用0.05mol/l的碳酸盐缓冲液将捕捉抗体稀释为10μg/ml,包被条件为37℃、1h;
所述检测抗体为兔抗阿留申病毒vp2蛋白多克隆抗体,浓度为8μg/ml;
所述酶标抗体为山羊抗兔igg-hrp,用1%的脱脂奶粉稀释2000倍。
实施例4
一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,包括包被有捕捉抗体的酶标板、检测抗体以及酶标抗体,其中:
所述捕捉抗体为鼠抗阿留申病毒vp2蛋白单克隆抗体,用0.05mol/l的碳酸盐缓冲液将捕捉抗体稀释为10μg/ml,包被条件为37℃、2h;
所述检测抗体为兔抗阿留申病毒vp2蛋白多克隆抗体,浓度为8μg/ml;
所述酶标抗体为山羊抗兔igg-hrp,用1%的脱脂奶粉稀释8000倍。
实施例5
一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,包括包被有捕捉抗体的酶标板、检测抗体以及酶标抗体,其中:
所述捕捉抗体为鼠抗阿留申病毒vp2蛋白单克隆抗体,用0.05mol/l的碳酸盐缓冲液将捕捉抗体稀释为10μg/ml,包被条件为4℃、12h;
所述检测抗体为兔抗阿留申病毒vp2蛋白多克隆抗体,浓度为8μg/ml;
所述酶标抗体为山羊抗兔igg-hrp,用1%的脱脂奶粉稀释5000倍。
实施例6
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为5%脱脂奶粉。
实施例7
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为5%胎牛血清。
实施例8
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为5%马血清。
实施例9
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为3%bsa。
实施例10
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为5%bsa。
实施例11
如实施例6所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括tmb显色液。
对照例1
如实施例3所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,其中所述捕捉抗体的包被条件为37℃、0.5h。
对照例2
如实施例3所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,其中所述捕捉抗体的包被条件为4℃、14h。
对照例3
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为1%bsa。
对照例4
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为8%bsa。
对照例5
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,还包括封闭液,所述封闭液为3%胎牛血清。
对照例6
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,其中所述酶标抗体用1%的脱脂奶粉稀释1000倍。
对照例7
如实施例5所述的一种水貂阿留申病毒双抗体夹心elisa抗原检测试剂盒,其中所述酶标抗体用1%的脱脂奶粉稀释10000倍。
实验例1
阿留申病毒vp2抗原的制备与鉴定
(1)选取vp2基因600~1755nt区域进行合成并连接pet-30a(+)载体,阳性质粒转化bl21感受态细胞,挑取单克隆,进行摇瓶培养,提取质粒后进行测序;
(2)选取测序结果为阳性的菌于37℃摇床培养过夜,摇起的菌液以1﹕100接种量转入kanamycinlb液体培养基,37℃培养至od600nm值为0.4~0.6时,加入iptg至终浓度为1mmol/l,37℃继续培养4h;
(3)收集诱导的菌体,1×pbs洗涤1次后重悬,利用超声波细胞破碎仪破碎菌体后离心,分别取上清和沉淀进行sds-page分析,确定目的蛋白表达情况;
(4)将表达的带组氨酸标签的vp2蛋白利用ni-ntaagarose进行纯化后,对包涵体蛋白进行复性,以amdv阳性血清作为一抗进行westernblotting分析,超滤浓缩后-80℃保存备用。
sds-page结果如图1所示,重组菌经iptg诱导获得高效表达,包涵体中出现55kda左右的目的蛋白条带,与预期结果相符;westernblotting结果如图2所示,显示目的蛋白与amdv阳性血清呈特异性反应,说明重组表达的vp2蛋白具有良好的免疫原性。
实验例2
抗体的制备与鉴定
1.捕捉抗体的制备与鉴定
(1)将阿留申病毒vp2抗原与fca等体积混合,按照60ug/只的剂量,对10只6周龄spf级雌性balb/c小鼠进行皮下注射免疫;
(2)此后每隔14d免疫一次,剂量为30ug/只,以ifca为佐剂;
(3)于第4次免疫后的第7d进行眼眶取血,用间接elisa法检测血清抗体效价,并用50ug抗原对免疫血清效价最高的小鼠进行腹腔冲击;
(4)腹腔冲击3d后,取免疫后小鼠脾细胞,采用peg法将其与sp2/0细胞进行融合,融合细胞采用hat半固体培养基筛选培养,得到adv-1g5杂交瘤细胞;
(5)以阿留申病毒为包被抗原建立间接elisa方法,对杂交瘤细胞上清进行检测;阳性杂交瘤细胞株鉴定亚类后扩大培养,以此制备腹水;
腹水采用辛酸-硫酸铵联合沉淀法纯化,通过间接elisa测定mab效价,并用ifa法鉴定mab的特异性。
2.鉴定抗体的制备与鉴定
(1)将阿留申病毒vp2抗原与fca等体积混合,按照1mg/只的剂量,对若干只新西兰大白兔进行皮下多点注射免疫;
(2)14d后进行第二次免疫,剂量为1mg/只,以ifca为佐剂;
(3)再次间隔14d后进行第三次免疫,剂量为1mg/只,无佐剂;
(4)于第三次免疫后的第7d进行耳缘静脉采血,收获兔血清,通过间接elisa检测pab的效价,并用间接免疫荧光(ifa)检测pab反应活性。
实验结果显示,以纯化的vp2蛋白作为包被抗原,间接elisa方法检测pab和mab的效价分别为1﹕12800和1﹕204800。经southernbiotech亚类鉴定试剂盒鉴定,mab为igg2aκ亚型。ifa检测结果如图3所示,pab和mab均能与感染amdv的crfk细胞反应,出现绿色荧光,与未感染的crfk细胞则无反应,表明得到的pab和mab均具有较好的特异性。
实验例3
das-elisa实验方法的建立
1.捕捉抗体和检测抗体最佳工作浓度的确定
通过棋盘滴定法确定两者的最佳工作浓度。将mab按倍比稀释为40μg/ml、20μg/ml、10μg/ml、5μg/ml、2.5μg/ml包被酶标板,将pab倍比稀释为4000μg/ml、800μg/ml、400μg/ml、80μg/ml、40μg/ml、8μg/ml、4μg/ml和0μg/ml,加入1:5000稀释的山羊抗兔igg-hrp,进行das-elisa试验检测纯化amdv抗原,同步设立crfk细胞抗原为阴性对照。选择od450nm值接近1,p/n值最大孔所对应的mab和pab浓度作为最佳工作浓度。
实验结果如图4和图5所示,最佳工作浓度为:mab的包被浓度为10μg/ml,pab的浓度为8μg/ml
2.包被条件的确定
用ph9.6、0.05mol/l碳酸盐缓冲液稀释mab,分别按照实施例3~5和对照例1~2提供的包被条件对酶标板进行包被。在捕捉抗体和检测抗体的最佳工作浓度条件下,确定mab的最佳包被条件。
结果显示,实施例1~3提供的条件较对照例1~2提供的条件更佳,其中最佳包被条件为实施例5提供的4℃、12h。
3.封闭液和封闭时间的确定
捕捉抗体和检测抗体为最佳工作浓度,包被条件最佳,分别采用实施例6~10和对照例3~5中提供的封闭液,于37℃下分别作用0.5h、1h、2h、3h、4h、5h,测定od450nm的值,确定最佳封闭液和封闭时间。
结果显示,最佳封闭液为实施例6提供的5%脱脂奶粉,最佳封闭时间为1h。
4.抗原最佳作用时间的确定
在已确定的最佳反应条件下,包被、封闭后,采用实施例6所述的试剂盒,加入纯化的amdv,37℃分别反应15min、30min、60min、90min、120min、150min,进行das-elisa试验,确定待检抗原的最佳作用时间。
结果显示,抗原的最佳作用时间为60min。
5.酶标抗体稀释度和作用时间的确定
在上述确定的最佳试验条件下,将山羊抗兔igg-hrp分别按照实施例3~5和对照例6~7中提供的方法进行稀释,于37℃下分别作用15min、30min、60min、90min、120min,测定od450nm的值,确定酶标抗体的最佳稀释度和作用时间。
结果显示,酶标抗体的最佳稀释倍数为实施例5提供的1:5000,最佳作用时间为30min。
6.显色时间的确定
在上述优化的最佳反应条件下,每孔加入100μl的实施例11提供的tmb显色液,室温条件下分别避光显色1min、3min、5min、10min、15min、20min、30min后,每孔加入100μl浓度为2mol/l的h2so4终止反应,分别检测od450nm,确定最佳显色时间。
结果显示,最佳显色时间为5min。
实验例5
判定标准的确定
采用上述经优化的das-elisa方法检测30份经pcr确定为阴性的样品,计算od450nm的平均值和标准差(sd),根据公式cut-off即可确定阳性判定标准。
根据实验结果,cut-offvalue=0.134+3*0.025=0.21,即当od450nm>0.21时,则判定样品为amdv阳性。
实验例6
特异性试验
以优化的最佳检测条件同步检测cpv、cdv、mev3种病毒,同时设立amdv阴、阳性对照和crfk细胞培养物的空白对照,检验该方法的特异性。
实验结果如图6所示,只有amdv的检测结果为阳性,其他3种病毒及crfk细胞培养物的检测结果均为阴性,说明该方法特异性良好,不易产生假阳性结果。
实验例7
敏感性试验
将纯化的amdv用pbs稀释至64μg/ml、32μg/ml、16μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml,采用建立的das-elisa方法对其进行检测,以amdv的稀释度为横坐标,读取的od450nm值为纵坐标,绘制标准曲线,分析该方法的敏感性。
实验结果如图7所示,当amdv浓度为2μg/ml时结果仍为阳性,而当浓度为1μg/ml时结果则为阴性,说明该方法的最低检出量可以达到2μg/ml,敏感性较好。
实验例8
符合率试验
取102份临床肛拭子样品,利用建立的das-elisa与pcr方法同时对其进行检测,比较两者的检测结果,确定符合率。
实验结果如图8所示,其中阴性样品的符合率100%,阳性样品的符合率93.75%,总符合率96.875%,批间和批内变异系数均小于10%。表明该方法重复性较好,适宜用于对大批量样品进行分析。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。