高敏检测T细胞及功能的试剂盒、方法及其应用与流程
本发明属于生物技术领域,具体涉及一种用于高敏检测t细胞及功能的试剂盒、检测方法、及其应用。
背景技术:
近年来,生物医学领域的研究使一些癌症和慢性感染性疾病的治愈成为可能,其中t细胞相关的免疫疗法成为明星策略,通过多种途径激活t细胞尤其是特异性t细胞,使其在体内游走巡查,并分泌效应性的细胞因子ifn-γ、tnf-α、il-2找到肿瘤或病原体发挥抗癌和抗感染作用,因此,t细胞治疗具有巨大的潜力和市场。理论上来说,t细胞需要达到一定的足够多大数量才能发挥效能;疗效的评估是治疗策略的可行性和不断优化的关键。
由于慢性感染和肿瘤内存在抑制性的内环境,t细胞的数量很低,通常低于普通的检测下限,无法进行检测;因此需要进行t细胞培养,达到一定数量的扩增,再进行功能检测。传统t细胞和特异性t细胞数量和功能的检测主要有以下两种方法(以慢性肝炎为例):方法1:外周血分离获得的淋巴细胞(pbmc)直接进行t细胞数量和功能检测;或者将由外周血获得的t细胞培养后进行检测;方法2:t细胞与肝细胞共培养后进行检测。然而,以上方法均不能达到良好的检出率,无法判别患者体内的t细胞免疫状态,从而妨碍了疾病进程评估和疗效评价。
技术实现要素:
本发明的一个目的是针对以上要解决的技术问题,提供一种能够高敏检测t细胞数量及其功能的试剂盒。
本发明的另一个目的是提供一种能够高敏检测t细胞数量及其功能的方法。
本发明的再一个目的是提供以上试剂盒的用途。
为此,本发明提供了以下技术方案。
一种高敏检测t细胞数量和功能的试剂盒,其包括:微孔滤膜双室培养皿、用于双室滤膜体系的培养基、t细胞培养液、包被了抗人ifn-γ、tnf-α、il-2、cd4、cd8单克隆抗体的elispot培养板和纤维素膜的96孔板、鼠抗人cd3单克隆抗体溶液、ap酶标记链亲和素(streptavidin-ap)、以及显色液。
本发明还提供了一种用于高敏检测t细胞数量和功能的方法,其包括以下步骤:
步骤1:组装双室滤膜体系(即,微孔滤膜双室培养体系),在上室铺待检测的相应的单层细胞。如果检测肝病相关,则使用肝细胞,如果肺病检测,使用肺细胞;以此类推。
步骤2:配制用于所述双室滤膜体系的培养基:以aim-v培养液为基础培养基,其成份含:okt3200ug/ml、cd28抗体100ug/ml、il-2300iu/ml、以及白蛋白2.0-2.5%(体积百分比)。用人淋巴细胞分离液分离新鲜外周血中单核细胞pbmc,重悬细胞于所述培养基中,浓度为1.0~3.0×106细胞/ml。
步骤3:将步骤2所得细胞混匀后加入到所述双室滤膜体系的上室,向所述双室滤膜体系的上下室分别加入t细胞培养液0.3-0.8ml(优选为0.4ml)、5%(体积浓度)二氧化碳培养箱于37℃孵育24小时。
步骤4:收集所述双室滤膜体系中由上室转移到下室的细胞,洗涤后重悬于无血清培养液中至浓度为1.0~3.0×106细胞/ml,加入到96孔板中,每孔加入0.1ml无血清培养液。上述96孔板为包被了抗人ifn‐γ、tnf-α、il‐2、cd4、cd8单克隆抗体的elispot培养板和纤维素膜。
步骤5:阳性对照采用无血清培养基溶解配制的鼠抗人cd3单克隆抗体溶液为阳性质控,加入反应孔浓度为20-45μg/ml。
步骤6:5%(体积浓度)二氧化碳培养箱于37℃孵育18-20小时,用pbs缓冲液洗涤后,拍干水分,每孔注入生物素标记的ifn-γ、tnf-、il-2、cd4、cd8分别检测抗体,室温孵育1小时;再用pbs缓冲液洗涤后,加入ap酶标记链亲和素,室温孵育1小时;再用pbs缓冲液洗涤后,拍干水分,加入底色显色液,避光孵育15-35分钟后计数斑点。
作为本发明的一种优选实施方式,在所述步骤1中,在培养皿中安装微孔滤膜培养小室,形成上下两层培养系统,膜的孔径为8μm至12μm(优选为8μm),在上室底部膜上进行单层细胞培养。
本发明还提供了所述试剂盒用于高敏检测特异性t细胞的用途。
本发明组装和利用双室滤膜体系模拟人体内t细胞行驶功能的状态:(1)上下室培养基是有助于t细胞增殖活化的细胞环境;(2)上室底部的单层细胞和滤膜以及膜孔相当于人体细胞的细胞膜和膜上的缝隙,可进行物质交换和小分子的穿行;(3)孔径大小设计正好利于t细胞在其中穿行。一般来说,只用功能良好淋巴细胞才容易穿过滤膜上的孔径,转移至下室;这样,就可以对功能较强,即可以穿越微孔滤膜的t细胞群进行富集,从而增强t细胞数量和功能的检出率。一方面,这有助于目前疾病的评估,另一方面,通过对免疫治疗疗效的评价来优化新治疗策略的开发,以及该治疗策略的适用人群的界定。
实验结果表明,装备用于高敏检测慢性感染和肿瘤患者外周血t细胞的体系能精确划分功能良好的t细胞和功能低下的t细胞。应用本发明的方法,可显著提高患者体内t细胞主要的两个亚群cd4和cd8、以及代表t细胞功能的三大主要因子ifn-γ、tnf-α、il-2的检出率,对免疫治疗疗效和新策略的评价具有重要意义。本发明能够提供:(1)慢性感染和肿瘤患者体内t细胞状态(数量和功能)评估;(2)预测这些免疫相关性疾病的预后;(3)评价治疗疗效;(4)作为新治疗手段疗效评估的重要体系,有助于新疗法的优化。
附图说明
图1是用三种方法进行t细胞功能检测的流程示意图。
图2是图1的t细胞的功能检测敏感性对比结果。
图3是elispot检测结果的代表图。
图4是应用本发明的方法检测细胞因子效率的结果。
图5显示了t细胞迁移肝细胞后免疫表型的改变。
具体实施方式
以下详细介绍本发明的高敏检测特异性t细胞数量和功能的试剂盒以及具体检测方法。
本发明使用了高敏检测t细胞数量和功能的试剂盒,其包括:微孔滤膜双室培养皿、用于双室滤膜体系的培养基、t细胞培养液、包被了抗人ifn-γ、tnf-α、il-2、cd4、cd8单克隆抗体的elispot培养板和纤维素膜的96孔板、鼠抗人cd3单克隆抗体溶液、ap酶标记链亲和素、以及显色液。
使用上述试剂盒检测100例采集新鲜外周血中的t细胞,步骤如下:
1、组装微孔滤膜双室培养体系:
采用微孔膜孔径为8μm至12μm(优选为8μm)的transwell小室,放在12或24孔培养板中,组装成为双室培养系统。然后把细胞(如肝细胞等)按1×105个/cm2接种于铺有1%明胶的顶层小室微孔膜上,待细胞长至融合后,改用无酚红无血清dmem继续培养24h,使细胞获得同步生长并处于静止期。光镜下观察,可见细胞间隔以及单个细胞轮廓,展示微孔膜上一薄层细胞,备用。
2、配制“双室滤膜体系”培养基,人淋巴细胞分离液分离新鲜外周血pbmc,重悬细胞于上述培养基中,浓度在1.0‐3.0x106细胞/ml,混匀后加入“双室滤膜体系”上室,并在上下室加入“双室滤膜体系”培养基0.3‐0.8ml、5%(体积浓度)二氧化碳培养箱37℃培养24小时,取移到下室的细胞,洗涤后调整至浓度为1.0-3.0x106细胞/ml,进行下一步实验。关于上述培养基,aim-v培养液为基础培养基,其成份含:okt3200ug/ml、cd28抗体100ug/ml、il-2300iu/ml、以及白蛋白2.0-2.5%(体积百分比)。在包被了抗人ifn‐γ、tnf-α、il‐2、cd4、cd8单克隆抗体的elispot培养板和纤维素膜的96孔板中每孔加入下室收集的细胞溶液0.1ml。
3、阳性对照孔加入无血清培养基溶解配制的鼠抗人cd3单克隆抗体溶液为阳性质控;补充无血清培养液,使细胞浓度为1.0-3.0x106细胞/ml,阳性对照加入反应孔浓度为20-45μg/ml。阴性对照为空白对照:无细胞的培养基。
4、5%二氧化碳培养箱37度孵育18-20小时。用pbs缓冲液反复洗涤三次,拍干水分,每孔注入生物素标记的ifn-γ、tnf-、il-2、cd4、cd8分别检测抗体,室温孵育1小时;再洗涤三次,加入ap酶标记链亲和素(streptavidin-ap),室温孵育1小时。
5、用pbs再次洗涤6次,拍干水分,加入底色显色液bcip/ntp,避光孵育15-35分钟后,计数所得斑点与阴性斑点的差值,则为实际斑点数,并计算均数。
实验结果如下:
检测结果包括:
(1)cd4+t细胞数量
(2)cd8+t细胞数量
(3)ifn-γ水平
(4)tnf-水平
(5)il-2水平
其中10个患者结果如下表所示:
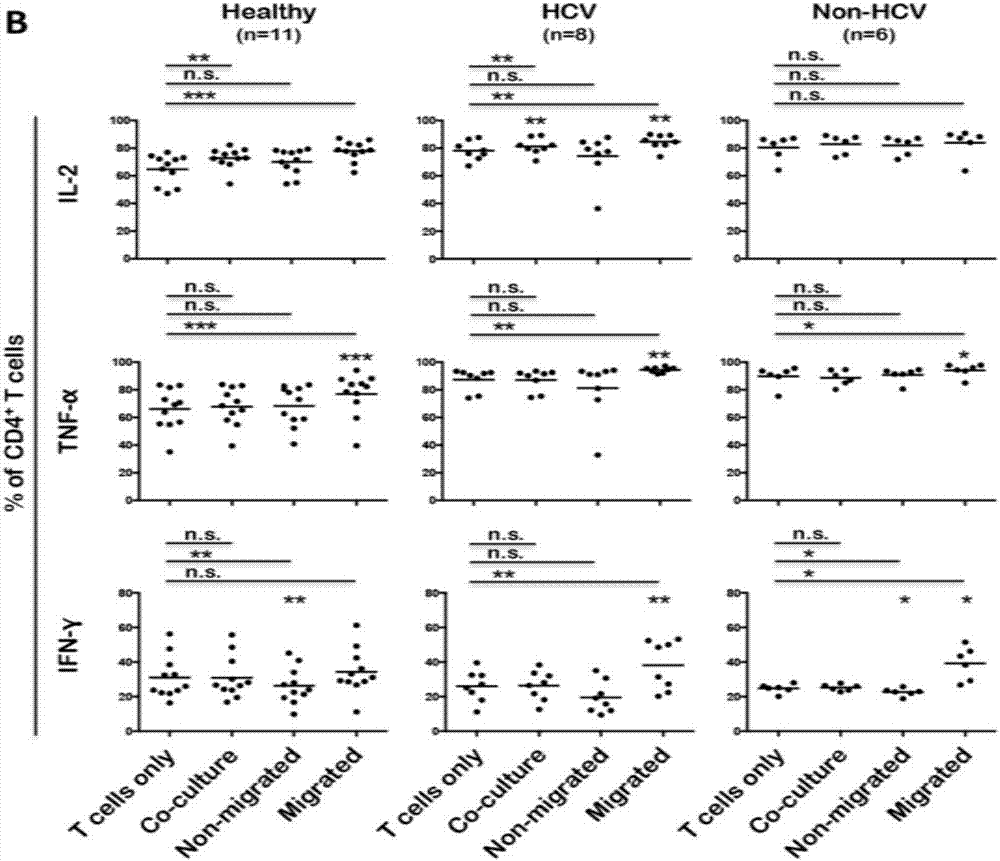
如图1至图3所示,本发明的方法在检出率和精确度方面均高于现有方法。其中,图1中显示用三种方法进行t细胞功能检测的结果:左1图为方法一:t细胞单独培养,即t细胞或pbmc在普通细胞培养基中培养24小时;左2图为方法二:t细胞或pbmc与肝细胞培养;左3图为方法三:t细胞或pbmc在“双室滤膜体系”中进行培养,18小时后部分细胞由上室迁移至下室;左4图为收集左1-3图的细胞,部分做流式检测,部分做elispot检测;左5图为流式检测t细胞功能的代表图。图2为以上图1不同方法比较,t细胞的功能检测敏感性对比,可以看到无论健康人还是肝病病人,经过“双室滤膜体系”处理的细胞检出效率明显提高。图3为elispot检测结果的代表图,进一步确定本发明能有效提高t细胞及其功能的检测效率:(1)阴性对照为12a-h和4a-h和8a-h、阳性对照为a9-11;d9-11;e9-11;h9-11;(2)方法一结果显示在:e1-3和c1-7;(3)方法二结果显示在:c1-3、c9-11、d1-3;(4)其余的结果为方法三,即本发明所得。图4进一步说明,本“双室滤膜体系”富集的t细胞,进行流式检测其他细胞因子的效率也明显升高,这提示,本发明中的“双室滤膜体系”可扩展到其他t细胞功能的鉴定。图5表明,通过“双室滤膜体系”处理后t细胞亚群cd8+t细胞的检出效率明显提高。
- 还没有人留言评论。精彩留言会获得点赞!