一种犬C反应蛋白胶体金免疫层析试纸条的制作方法
本发明涉及生物检测领域,特别是涉及一种犬c反应蛋白胶体金免疫层析试纸条,其特别适用于犬的crp检测。
背景技术:
c反应蛋白(crp)是机体非免疫系统的组成成分,在多种哺乳动物疾病的急性期有重要的诊断警示作用。crp在肝脏的合成反应主要由il-1、il-6和tnf-α等炎症因子所调节。crp浓度受年龄、性别和体重的影响不大。在人类临床医学诊断中,crp作为炎性或非炎性疾病的诊断标志物进行检测已超过30年。在兽医临床上,犬crp的检测在临床应用中也比较广泛,包括急性感染性疾病的诊断和鉴别诊断、手术后感染的监测、抗生素疗效的观察、病程监测及预后判断等。犬crp对疾病敏感度高,能在疾病早期快速升髙,及时反映病情;而且crp的浓度不受到抗生素及免疫抑制剂的影响,在治疗中可以准确地对疾病的发展进行监测,在临床诊疗中具有很高的价值。因此作为炎症标记物,crp在兽医临床上的作用日趋显著,检测犬crp对临床诊断、疗效及预后观察等具有重要价值。
crp是由肝脏合成的一种能与肺炎链球菌c多糖反应形成复合物的急性时相反应蛋白。它由5个相同的亚基单位以非共价方式联接,与人crp不同,犬crp的5个亚基中有两个被糖基化。研究表明,各种抗其他物种crp蛋白的抗血清,都不能和急性期犬血清或者分离的犬crp发生交叉反应,说明人和犬crp没有共同的抗原性,这种现象也说明犬crp的快速检测方法不能依赖于人的商品化crp快速检测试纸条。目前,临床中快速检测犬crp的方法多是依赖于临床检测仪器,这在普通宠物医院并不具备。而且,对于动物疫病诊断行业,很多情况下,对于疾病的诊断需要在野外进行,这对于现行犬crp检测方法是没有办法完成的。胶体金免疫层析是一种建立在胶体金层析技术和抗原-抗体特异性免疫反应基础上的一种免疫检测技术。胶体金免疫层析试纸一般包括依次设于底板上且紧密搭接的样品吸收垫、结合垫、反应膜和吸水垫,底板设于塑料卡内,塑料卡上设有分别与样品吸收垫与反应膜配合的加样孔和显示窗口。
技术实现要素:
鉴于以上所述现有产品的技术缺点,本发明的目的在于提供一种犬crp胶体金免疫层析试纸条及其制备方法和用途,用于解决现有技术中的问题。
为实现上述目的及其他相关目的,本发明采取了以下技术方案:
一种犬c反应蛋白胶体金免疫层析试纸条,由样品吸收垫、结合物释放垫、反应膜、吸水垫、底板依次组成,所述结合物释放垫上包被有鼠抗犬c反应蛋白单克隆抗体-胶体金标记物,所述反应膜上包括检测区和质控区,所述检测区包被有鸡抗犬c反应蛋白多克隆抗体,所述质控区包被有羊抗鼠抗抗体。
所述结合物释放垫1/3~1/2被覆盖于样品吸收垫下。
所述鼠抗犬c反应蛋白单克隆抗体和鸡抗犬c反应蛋白多克隆抗体是以昆虫细胞杆状病毒载体系统所表达的犬c反应蛋白作为抗原制备获得。
本发明的另一个目的是提供一种制备上述试纸条的方法,该方法包括以下步骤:
1)制备喷涂有鼠抗犬c反应蛋白单克隆抗体-胶体金标记物的结合物释放垫;
2)制备包被有鸡抗犬c反应蛋白多克隆抗体的检测区和包被有羊抗鼠抗抗体的质控区的反应膜;
3)将1)和2)制备好的结合物释放垫、反应膜与样品吸收垫、吸水垫和底板组装成试纸条。
本发明的另一个目的是提供一种检测犬c反应蛋白的方法,该方法包括以下步骤:
1)样品前处理;
2)用上述的犬c反应蛋白胶体金免疫层析试纸条进行检测;
3)分析检测结果。
所述检测样品是犬全血、犬血清或犬血浆中的一种或多种物质。
本发明的有益效果为:
本发明所提供的犬crp胶体金免疫层析试纸条可用于对犬全血、血清或血浆的检测,兼具高灵敏性和高特异性,能够快速检测犬crp。此外,所述犬crp胶体金免疫层析试纸条具有操作快速简便、结果准确、经济适用等特点。
附图说明
图1为试纸条剖面结构示意图。
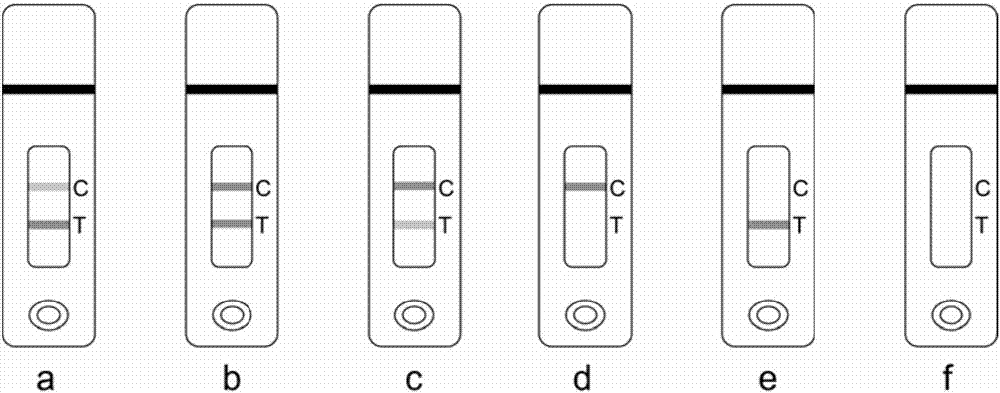
图2为试纸条检测结果判定图。
图3为犬c反应蛋白样本相关性统计图。
图1中:1:样品吸收垫;2:结合物释放垫;3:反应膜;4:吸水垫;5:检测区;6:质控区;7:底板。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
实施例1、犬crp胶体金免疫层析试纸条的构成
所述试纸条是由底板、样品吸收垫、结合物释放垫、反应膜和吸水垫组成(图1);
所述样品吸收垫1、结合物释放垫2、反应膜3、吸水垫4依次按顺序黏贴在所述底板7上,结合物释放垫从起始端有1/3区域被样品吸收垫覆盖,结合物释放垫的末端与反应膜的始端连接,反应膜的末端与吸水垫的始端相连,样品吸收垫的始端与底板的始端对齐,吸水垫的末端与底板的末端对齐。
所述反应膜上有检测区5和质控区6,检测区和质控区均呈与所述试纸条的长相垂直的条状带;检测区位于靠近结合物释放垫的末端的一侧;质控区位于远离结合物释放垫的末端的一侧。检测区包被有鸡抗犬crp多克隆抗体,质控区包被有羊抗鼠抗抗体。
底板为pvc底板;样品吸收垫为吸滤纸,吸水垫为吸水纸;反应膜为硝酸纤维素膜。
上述试纸条在2~30℃的环境中储存,有效期为12个月。
实施例2、实施例1中所述试纸条的制备方法
试纸条的制备:
该试纸条的制备方法主要包括如下步骤:
a)制备喷涂有鼠抗犬c反应蛋白单克隆抗体-胶体金标记物的结合物释放垫;
b)制备具有包被鸡抗犬crp多克隆抗体的检测区和包被羊抗鼠抗体的质控区的反应膜;
c)将a)制备好的结合物释放垫和b)制备好的反应膜与样品吸收垫、底板、吸水垫组装成试纸条。
下面分布详细叙述:
1、犬crp的表达及纯化
利用bactobac杆状病毒载体表达系统将经优化后的犬crp基因(nm.001314116.1)和蜂素信号肽基因(hbm)经过重叠pcr进行连接,并设计用于纯化的his标签,得到h-犬c反应蛋白基因。将h-犬crp基因克隆至转移载体pfastbac1中,得到重组质粒pfast-犬c反应蛋白-yh,再将其转化进入含穿梭载体bacmid的受体菌dh10bac中发生转座作用,得到含h犬crp基因的重组穿梭载体bacmid-h-crp。分离提取重组bacmiddna,并转染培养的昆虫细胞sf9,得到重组病毒。经酶切和pcr鉴定,犬crp基因正确地插入到病毒基因组的多角体蛋白基因启动子下,将上清培养液经sdspage分析,证明表达蛋白的分子量为23kd左右,crp在昆虫细胞sf9中得到了大量高效的表达。使用镍离子柱对细胞培养上清进行纯化,sds-page分析可见纯化后在23kd处获得单一条带,即为犬crp蛋白,蛋白置于4℃保存备用。
2、抗体制备(单克隆抗体和多克隆抗体)
2.1动物免疫
免疫动物为5周龄雌性balb/c小鼠。以犬crp作为抗原,按照10mg/只/次进行免疫。将犬c反应蛋白和佐剂混合至总体积为0.5ml,经超声充分乳化后,腹腔注射免疫小鼠。第1次免疫所用佐剂为弗氏完全佐剂,3周后改为弗氏不完全佐剂注射。以同样方法处理抗原,对小鼠分别进行第2和第3次免疫。融合前3天以免疫复合物10mg/只,不加弗氏佐剂再追加一次。
以同样的方式处理抗原,按照250mg/只/次,采用胸部多点注射的方法免疫成年雌性白色来航鸡。第三次免疫后,收集鸡蛋,保存于4℃,检测抗体效价。
2.2细胞融合和克隆化
在第3次免疫4周后,采用不含佐剂犬crp对小鼠进行最后追加免疫。脱颈椎处死小鼠,取出脾脏,分离脾细胞。融合当日收集处于对数生长期的sp2/0骨髓瘤细胞,按2∶1比例将骨髓瘤细胞与脾细胞混合,1000r/min离心10min,弃上清,混匀2种细胞。缓慢加入peg,边加边轻轻搅拌进行细胞融合,用dmem培养基终止peg的作用。离心,将细胞悬浮于预热的hat培养基。按150μg/孔接种于96孔细胞培养板中,置于37℃,5%co2培养箱中培养。
2.3单克隆抗体的制备
采用间接竞争酶联免疫分析方法测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,得到并建立稳定分泌犬crp抗体的杂交瘤细胞株。采用体内诱生法,将balb/c小鼠(8周龄)腹腔注入灭菌石蜡油0.5ml/只,7天后腹腔注射杂交瘤细胞5×105个/只,7天后采集腹水。用辛酸-饱和硫酸铵法进行纯化,得到犬crp单克隆抗体溶液(-20℃保存)。
2.4鸡抗犬crp多克隆抗体的提取和纯化
取3ml卵黄,加入2倍体积pbs缓冲液和质量浓度为3.5%的peg-6000,震荡混匀10min,4℃、10000r/min离心20min过滤,将滤液转移至新的离心管中,加入质量浓度为8.5%的peg-6000,震荡混匀60min,4℃、10000r/min离心20min,弃上清,加入10mlpbs缓冲液重悬沉淀,加入1.2gpeg-6000,震荡混匀10min,4℃、10000r/min离心20min,弃上清,沉淀即为。加入1mlpbs缓冲液重悬沉淀后,0.1%生理盐水搅拌透析过夜后换用pbs缓冲液透析4h。使用超滤离心管将得到的溶液浓缩至1.5ml。
3、犬crp单克隆抗体-胶体金标记物的制备
3.1胶体金的制备
用双蒸去离子水将1%氯金酸(sigma,t09041)稀释成0.01%(质量百分比),置磁力加热搅拌器搅拌煮沸,每100ml0.01%氯金酸加入25ml1%柠檬酸三钠,继续搅拌加热反应至液体呈红色时停止加热,冷却至室温后补足失水。制备好的胶体金外观纯净、透亮、无沉淀和漂浮物。
3.2犬crp单克隆抗体-胶体金标记物的制备
在磁力搅拌下,用0.2mol/l碳酸钾溶液调胶体金的ph至7.2,按每毫升胶体金溶液中加入10μg的标准向胶体金溶液中加入犬crp单克隆抗体,搅拌混匀,室温静置10~30min,加入10%牛血清白蛋白(bsa),使其在胶体金溶液中的终浓度为0.5%(体积百分含量),静置10min,11000r/min,4℃离心10~30min,弃上清液,沉淀用复溶缓冲液洗涤两次,用体积为初始胶体金体积1/10的复溶缓冲液将沉淀重悬,置4℃备用。
复溶缓冲液:含cas的质量分数为0.1%、吐温-20的质量分数为0.5%、0.02mol/l、ph7.2的磷酸盐缓冲液。
4、结合物释放垫的制备
将结合物释放垫浸泡于含0.2%cas(质量分数)、ph7.2的0.02mol/l磷酸盐缓冲液中,均匀浸湿2h,37℃烘干备用。用biodot划膜仪将制备好的鼠抗犬c反应蛋白单克隆抗体-胶体金标记物均匀喷涂在结合物释放垫上,每1cm结合物释放垫喷涂0.3ml鼠抗犬c反应蛋白单克隆抗体-胶体金标记物后,置于37℃环境中(湿度<20%)2h后取出,置于干燥环境(湿度<20%)中保存备用。
5、反应膜的制备
将鸡抗犬crp多克隆抗体包被到反应膜上构成检测区,将羊抗鼠抗抗体包被在反应膜上构成质控区。
包被过程:用磷酸缓冲液将鸡抗犬crp多克隆抗体稀释到400μg/ml,用biodot划膜仪将其包被于硝酸纤维素膜上的检测区(t),包被量为1.0μl/cm;用0.01mol/l、ph7.2的磷酸盐缓冲液将羊抗鼠抗抗体稀释到200μg/ml,用biodot点膜仪将其包被于硝酸纤维膜上的质控区,包被量为1.0μl/cm。将包被好的反应膜置于37℃条件下干燥2h,备用。
6、样品吸收垫的制备
将样品吸收垫用含0.1%酪蛋白(质量分数)、ph7.2的0.02mol/l磷酸盐缓冲液浸泡2h,37℃下烘干2h备用。
7、试纸条的组装
将样品吸收垫、结合物释放垫、反应膜、吸水垫依次按顺序粘贴在pvc底板上;结合物释放垫从起始端有1/3区域被样品吸收垫覆盖,结合物释放垫的末端与反应膜的始端连接,反应膜的末端与吸水垫的始端相连,样品吸收垫的始端与pvc底板的始端对齐,吸水垫的末端与pvc底板的末端对齐;所述反应膜上有检测区和质控区,检测区(t)和质控区(c)均呈与所述试纸条的长相垂直的条状带;检测区位于靠近结合物释放垫的末端的一侧;质控区位于远离结合物释放垫的末端的一侧;将试纸条用机器切成3.95mm宽的小条,装在特制的塑料制卡壳中,以铝箔袋密封,2~30℃条件下可保存12个月。
实施例3、试纸条的应用
本发明的试纸条可以检测犬血清、全血和血浆样品,一般检测方法如下:
1、样本的制备
(1)血浆样本:用抗凝管采血,将采集血液加入并缓慢摇匀,3000~5000r/min室温离心10~30min,吸取上层黄色清亮液体即为血浆样本。
(2)血清样本:将采集血液加入采血管内(不含抗凝剂),室温倾斜放置,待上层有黄色清亮液体析出时3000~5000r/min室温离心10~30min,吸取上层黄色清亮液体即为血清样本。
(3)样本稀释:取已恢复至室温上述样本(1、2),以移液器准确吸取5μl加入样本稀释管(含1500μl,ph7.2的0.02mol/l磷酸盐缓冲液)内,充分混匀,此为待测液,垂直放置,待测。
2、检测方法
用移液器取待测液70μl垂直滴于加样孔中,液体流动开始计时,反应5min,判定结果。
3、检测结果判定
(1)目测判定
犬crp在样品中浓度高于或等于试纸条最低检测限时,单克隆抗体-胶体金标记物与犬crp结合形成金标抗体-犬crp抗原抗体复合物,复合物在检测区再与检测抗体(多克隆抗体)结合从而出现红色条带,质控区出现红色条带,呈阳性(图2a、图2b、图2c)。阴性样品在检测过程中不能和单克隆抗体-胶体金标记物结合,在检测区不会出现红色条带,质控区出现红色条带,呈阴性(图2d)。当质控区不出现红色条带时,表示结果无效(图2e、图2f)。
(2)仪器判定
将犬crp抗原标准品用正常犬血清稀释液配制系列浓度标准品:0ng/ml、2.5mg/l、5mg/l、10mg/l、25mg/l、50mg/l、100mg/l、250mg/l、500mg/l,取70μl滴加到试纸条的加样孔中,5min后通过胶体金读数仪读出检测区与质控区信号强度的比值,即t/c值(每个浓度点分别测定4次,取平均值),绘制相应的标准曲线。
利用上述标准曲线检测临床样品,将绘制的标准曲线y=(a-d)/[1+(x/c)b]+d中的a、b、c、d值输入胶体金读数仪即可在测定实际样品时直接得出实际样品中的犬crp的含量。根据检测结果,建议如下:
实施例4、试纸条的评价
1、检测限的测定
根据标准曲线计算可知,本试纸条对crp浓度小于5.0mg/l的样本只能部分检出,对5.0mg/l的样本全部检出,其最低检测限为5.0mg/l,并在5~500mg/l的范围具有良好的线性,t线的颜色深浅与样本中crp的浓度成正比。
2、精密度测定
将犬crp抗原标准品用正常犬血清稀释液配制系列浓度标准品:5ng/ml、50ng/ml、250ng/ml,分别用试纸条进行检测(每个浓度每批次分别检测24次平行,共检测三批)。
各浓度的批内最大cvs为5.8%,平均cvs为4.2%;各浓度的批间最大cvs为6.3%,平均cvs为5.2%,表明本发明所提供的试纸条具有良好的重复性。
3、稳定性测定
将制备好的试纸条放在4℃、25℃、37℃、45℃环境中进行加速试验。分别在7d、14d、21d及28d取出试纸条,并用其检测实际样品中犬crp的浓度。对实测浓度和实际样品浓度数值进行误差分析,得到cv值在5%以内的结果。
4、抗干扰测定
准备一份实际样品(由动物医院提供),其犬crp含量为14.6mg/l,取部分样品,向其中加入犬crp抗原标准品,经测定其浓度为46.5mg/l。向上述两种血清样品中分别加入浓度为病理样本的最高浓度的干扰物,使用本发明所制试纸条进行测定,每个浓度测定8次。结果见下表,干扰物对本试纸条的干扰均在3%以内。
5、相关性测定
使用本发明的试纸条和对照icl公司的试剂盒,对85份犬血清样本同时进行测定,对测定值进行相关性分析(spss18.0,结果见图3)。
结果显示,两个方法的相关系数为r2=0.964,表明本试纸条与进口试剂测定病犬血清相关性良好,具有很好的特异性和准确性。
- 还没有人留言评论。精彩留言会获得点赞!