一种检测血清中异常脱羧凝血酶原的蛋白芯片、试剂盒及其制备方法与流程
本发明涉及蛋白检测技术,特别涉及一种检测血清中异常脱羧凝血酶原的蛋白芯片、试剂盒及其制备方法。
背景技术:
脱-r-羧基凝血酶原(des--carboxy-prothrombin,dcp)是肝细胞癌产生的异常凝血酶原,与正常凝血酶原相比,dcp的分子结构特点是其丙氨酸结构域(gladomain)中的一个或者多个谷氨酸(glu)残基没有被完全羧化成为gla,从而失去凝血功能。正常的凝血酶原是在肝细胞微粒体内,主要依赖维生素k的γ谷氨酰羧化酶及辅酶和vitaminkreductase参与下,将结构gladomain中的第6,7,14,16,19,20,25,26,29和32位的10个glu残基羧化为gla,成为有活性的凝血酶原,上述任何一位点或多位点的glu残基羧化不全,都可形成dcp,使凝血酶原失去凝血功能。
研究表明,原发性肝癌血清中的dcp明显升高。陆枫林等人发表的《去γ-羧基凝血酶原对原发性肝细胞癌的诊断价值》中国肿瘤临床2009年07期,其揭示,dcp值与肿瘤大小呈正相关关系。因此,准确监测血清中dcp水平对于临床医生判断预后、选择治疗方案以及观测疗效具有重要意义。由于临床检测中,对于医院,每天需要检测大量的样本,高通量芯片检测可大幅度提高检测效率。即低成本、快速高效、准确、高通量检测手段是最好的选择,但是目前没有关于高通量检测dcp的报道。
现有检测方法中检测血清dcp的方法有:电化学发光免疫分析技术、液相亲和免疫方法、免疫沉淀法、westernblot、elisa等。本领域技术人员知道,临床血清非常复杂,不仅仅包含其它肝癌的其它标志物,而且由于血清中dcp非常低,待测血清dcp受多种非特异物理吸附或者非特异结合的影响,比如凝血素、凝血酶和纤维素及其类似物等的干扰较大。
因此,为了保证检测结果的准确性,灵敏性和特异性,上述采用免疫原理的检测方法中,都有一个共同的特点,即每个检测反应所采用的血清量少则50-100ul,多则3-5ml,对应地,每个检测就需要大量抗体完成,例如cn101377505a中公开的微孔板化学发光免疫分析测定方法,每孔中需要加入含有dcp抗体的包被液150ul,所需血清样品量需要50ul,而且,虽然该文件中公开其最低检测限可达到4.37mau/ml,但是其记载的实验中并未采用真正的临床血清来验证其检测特异性和准确性,其检测数据来自于正常血清中加入标准品而得的人工样品。而且这些方法的检测时间长达3-4小时,由于依据这些方法,做成高通量芯片的话,用于每个样品的检测斑或捕获斑的尺寸将会做得很大,成本非常高,失去了做成集成芯片的意义,即无法实现高通量及低成本的目的,在门诊中普及并不现实。实现dcp高通量检测,需要进行更多探索。
技术实现要素:
本发明基于蛋白芯片领域在检测血清dcp的空白,提供了一种适合于检测血清中dcp的高通量蛋白芯片、试剂盒及其制备方法,在保证检测准确性,灵敏性和特异性的前提下,最大限度地节省了抗体、血清用量,适合于临床使用,具有省时、经济、准确、便捷的优点。
本发明的技术方案如下:
本发明一方面提供一种检测血清异常脱羧凝血酶原的蛋白芯片,其特征在于:
所述蛋白芯片的基质载片上设置多个检测亚区,每个所述检测亚区用于检测一份血清样品;所述每个所检测亚区内设置有检测斑区域和对照斑区域,所述检测斑区域有通过喷涂微量dcp特异性抗体形成的检测斑,所述对照斑区域内有通过喷涂牛血清白蛋白形成的对照斑;同一个检测斑区域内的所有检测斑上的物质的浓度相同;
形成每一个所述检测斑的dcp特异性抗体的总量为3-5l,浓度为3-5mg/ml,每个检测斑通过非接触式点样仪分6-10次,喷涂300-500pl的方式形成,检测斑直径为0.5-1mm。
优选地,每个所述检测斑区域包括排列成1排的4-8个相互分隔的检测斑,所述对照斑区域包括排列成1排的4-8个相互独立分隔的对照斑;所述检测斑和对照斑排成平行的两列。
优选地,芯片的长、宽、厚度为76.4mm、25.2mm、1mm,所述基质载片上设置10个所述检测亚区。
优选地,所述检测亚区之间设置有凸起作为物理隔断。
优选地,所述dcp的特异性单克隆抗体为鼠抗人dcp。
本发明另一方面提供一种用于检测异常脱羧凝血酶原的蛋白芯片的制备方法,其特征在于:
用于形成每一个所述检测斑的dcp特异性抗体的总量为3nl,浓度为4mg/ml,所述dcp特异性抗体分6-10次喷涂且每次喷涂300-500pl形成一个所述检测斑,检测斑直径为0.5-1mm。
优选地,上述制备方法中,喷涂过程中采用的所述dcp特异性抗体的温度为4-8摄氏度。
优选地,采用非接触式点样仪进行喷涂点样。
本发明基于上述蛋白芯片,还提供一种检测血清异常脱羧凝血酶原的试剂盒,其特征在于:包括上述任一蛋白芯片,以及hrp标记的凝血酶原多克隆抗体,hrp化学发光底物液;所述hrp标记的凝血酶原多克隆抗体为兔源抗体,与所述检测斑上固定的dcp特异性抗体来源于不同物种。
一种检测血清中异常脱羧凝血酶原的方法,其特征在于:采用上述任一蛋白芯片,且包括如下步骤:
将待测血清样本稀释后滴加在所述蛋白芯片的检测亚区上,孵育后,用pbst洗涤检测亚区,去除非特异结合物;
加入用pbs稀释的hrp标记的凝血酶原抗体,孵育后,用pbst洗涤,去除非特异结合物;
加入hrp底物发光液,用化学发光扫描仪对蛋白芯片进行扫描,分别得到稀释后待测血清样本中的dcp发光像素值;
所述孵育指37℃孵育30分钟。
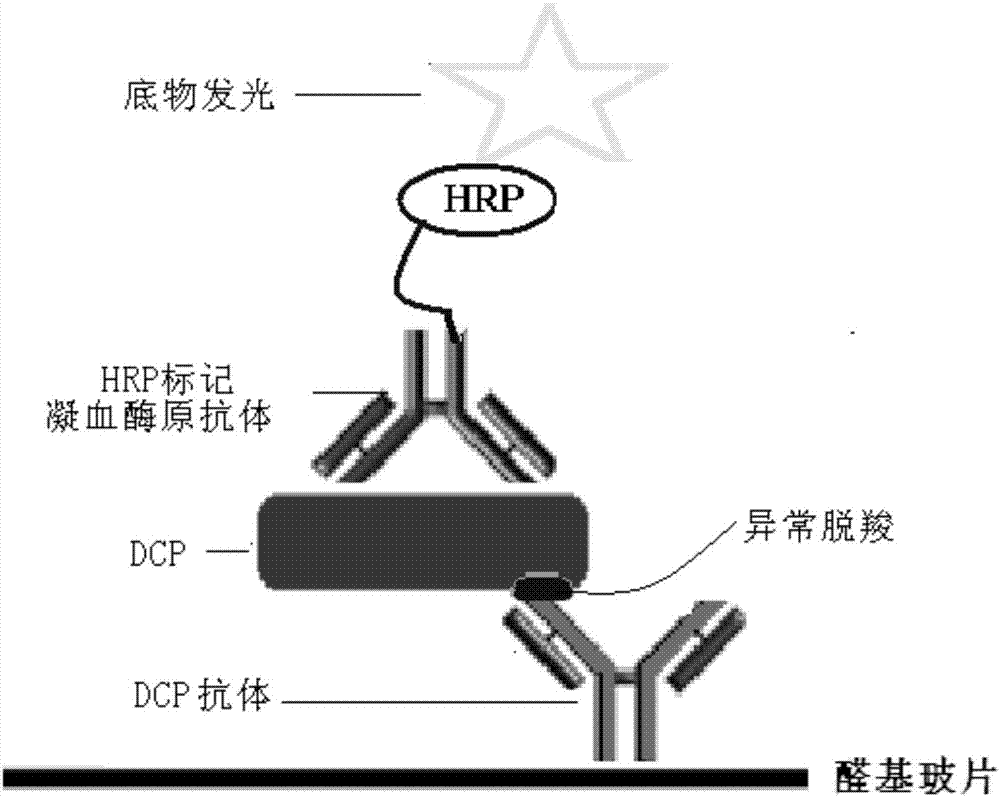
本发明提供一种检测dcp的化学发光蛋白芯片,基于抗体抗原抗体夹心反应原理及化学发光原理,将dcp特异性抗体喷涂在芯片载片上形成检测斑,用于结合血清中的dcp(凝血酶原的异常脱羧部位),同时设置有对照斑点。
发明人发现,按照常规免疫原理的检测方法,将捕捉抗体包被在芯片基质载片上,每个检测斑10ul,浓度4mg/ml(检测斑直径在5-10mm),采用血清中添加系列梯度浓度标准品溶液(标准品血清0mau/ml、5mau/ml、10mau/ml,20mau/ml、40mau/ml80mau/ml、160mau/ml、320mau/ml、640mau/ml)作为检测样品,制作标准曲线,每个检测亚区滴加50ul血清标准品,用pbst洗涤检测亚区,去除非特异结合物;加入用pbs稀释的hrp标记的凝血酶原抗体,孵育后,用pbst洗涤,去除非特异结合物;加入hrp底物发光液,用化学发光扫描仪对蛋白芯片进行扫描获得像素值。以标准品血清的浓度为横坐标,像素值为纵坐标,绘制标准曲线,并生成标准曲线回归方程,但是,结果显示,标准曲线回归方程的相关系数偏低,多次重复,r2值都在0.6-0.7之间,说明芯片的检测准确性不稳定,受到干扰较多。采用配制的另一批不同浓度的检验标准品血清验证标准曲线,得出的结果与检验标准品血清本身浓度相差悬殊,而且其中浓度低于80mau/ml的检验标准品血清的检测数值多次重复都低于30mau/ml,呈假阴性。
发明人在偶然的调整中发现,对捕获抗体的点样量,以及点样形成的检测斑的大小举行调整,会显著引起标准曲线回归方程的相关系数的变动。进一步发现,将点样量从10ul逐级缩,而且采用非接触式点样方式,标准曲线回归方程的相关系数几乎逐级提高,到10nl以下时,回归方程相关系数r2升高到0.65-0.75之间,采用检验标准品血清检验的数值也越来越准确。但是点样量继续降低的实验中,检测相关系数r2反而有降低趋势。
标准曲线回归方程相关系数r2在0.65-0.75并不理想。发明人经各种尝试之后,偶然发现点样抗体分多次喷涂的方式,例如将3-5nl的捕获抗体分6-10次喷涂到检测斑位置上。发现所得的芯片制作的标准曲线方程相关系数r2升高至0.95以上,用检验标准品血清和临床血清检测获得准确的结果,最低检测线可以低到4mau/ml。
综上,本发明的蛋白芯片针对的靶标为结构gladomain中的第6,7,14,16,19,20,25,26,29和/或32位的10个glu残基羧化不全形成的没有活性的凝血酶原。上述任何一点或多个glu残基羧化不全,都将可能形成dcp包括血清中第6,7,14,16,19,20,25,26,29和/或32位的10个glu残基异常脱羧的凝血酶原,为了提供能够准确定性检测血清中是否存在脱-r-羧基凝血酶原(dcp)的高通量蛋白芯片,发明人从芯片点样工艺、检测斑抗体浓度及点样量的选择和优化入手,确保芯片的检测准确性。推测,本发明的芯片的多次少量点样方式使得抗体能够均一稳定地粘附在基片上,避免检测斑空心现象,检测斑直径的大小,确保检测斑位置上抗体的密度合理,从而为抗体提供了充分的空间来维持其三纬结构和活性,同时不会过于稀疏导致低浓度样品的检测像素值过低,形成假阴性结果。检测斑上捕获抗体的用量、点样次数、检测斑大小三个因素对最终的检测结果产生了直接影响。
如图1所示,本发明的一个优选实施例中,一个所述检测亚区2内包括4个固定dcp特异抗体的检测斑3和4个对照斑4;检测斑3和对照斑4各排成平行的两列。
另一方面,本发明还提供了上述芯片的制备方法。
再另一方面,本发明还提供一种检测dcp的化学发光试剂盒,其中包括上述蛋白芯片以及化学发光的常规试剂。
本发明蛋白质芯片的使用有三方面的优势:
一、检测血清中的dcp。
二、允许同时检测多个样品。多个重复的样品,或者不同时间点取的样品以获得动态值,或者各个不同的样品,总之,实现高通量检测。整体上降低检测成本和提高检测效率。
三、采用本发明的蛋白质芯片需要的血样及抗体量都大为减少。每个点样斑采用每次喷点300-500pl,每点喷涂6-10次,共计3nl点样抗体。每个检测亚区设置4个检测斑,需要12nl捕获抗体,点样均一性得到了保证,有效的降低了空心现象的发生。并且仅需原始血清量或稀释后血清10ul,而现有其它免疫原理的检测方法中,不仅抗体使用了大,而且需原始血清量或稀释后血清至少50ul。
最后,本发明还提供了利用所述试剂盒对血清举行dcp检测的方法。
本发明提供的检测血清dcp的方法,是在上述蛋白芯片上,利用抗体和抗原特异性结合的特点,芯片上固定的dcp抗体与血清或者血浆中的dcp(异常脱羧凝血酶原的异常脱羧部位)结合;然后加入hrp标记的凝血酶原多克隆抗体,凝血酶原多克隆抗体与dcp(异常脱羧凝血酶原)异常脱羧部位以外的抗原表位结合;最后加入hrp发光底物,通过化学发光扫描仪对发光信号进行扫描量化。
实验结果证明,本发明的方法可通过发光强度对凝血酶原和dcp进行检测。与elisa方法进行对比,敏感性和特异性均优于elisa方法,从时间上比较,elisa检测至少需要3小时,本发明仅需要1.5小时;从检测血清需要量上比较,仅需原始血清量或稀释后血清10ul,而elisa方法检测需原始血清量或稀释后血清至少50ul;从捕获抗体用量上比较,需要量远远低于elisa方法,本发明的芯片使用非接触式喷墨式喷点方法,每个检测斑每次喷点
300-500pl,每点喷涂6-10次,共计3nl点样抗体,检测斑直径为0.5-1mm。每个检测方格4个检测点,需要12nl捕获抗体;精确控制喷点体积,多次喷点,点样均一性得到了保证,有效的降低了空心现象的发生,大大提高了检测准确率,并节省了抗体使用量和血清用量,降低了检测成本和费用。
因此,本发明提供的试剂盒和检测方法具有灵敏度高、省时、经济等特点,可以大大地降低血液蛋白检测的成本和时间。
综上,本发明的方法结合了异常脱羧特异抗体、化学发光检测方法以及蛋白芯片技术的应用,确保了利用试剂盒进行dcp检测结果的高灵敏性,准确性、高效性和低成本。本发明提供的检测方法一种可行、可靠、经济,且简单、省时的方法。本发明的技术方案将为大规模、高通量检测血清中dcp提供了一种经济、可靠的试剂盒和检测方法。
附图说明
图1.dcp蛋白质芯片结构图,其中1-基质载片,2-检测亚区,3-检测斑,4-对照斑,5-物理隔断。
图2.dcp抗体夹心法蛋白质芯片流程图。
图3.dcp抗体点样芯片检测肝癌和正常血清样本扫描图,
其中1-8:肝癌血清;9健康对照血清;10空白对照。
具体实施方式
下面结合具体实施方式对本发明作进一步的详细说明,但并不限制本发明的范围。如无特殊说明,下述实施例中使用的操作均为常规方法,所采用的试剂均可以商购获得。
实施例1蛋白质芯片1-4的制备及验证
主要仪器设备
化学发光扫描仪,由美国ge公司。
主要试剂及其来源
鼠源单克隆抗体dcp抗体(日本富士瑞必欧株式会社公司)、醛基芯片(上海百傲公司)、hrp标记的凝血酶原兔源抗体(美国fitzgerald公司)、hrp化学发光底物液a液和b液,按照1:1比例混合,新鲜配置。(美国millipore公司)。
异常凝血酶原标准品:日本富士瑞必欧株式会社公司。
实验所用试剂和仪器:dcp抗体(日本富士瑞必欧株式会社);hrp标记的兔源抗体(美国fitzgerald公司);化学发光扫描仪。(美国ge公司)
pbs配方:氯化钠(nacl)8g,氯化钾(kcl)0.2g,磷酸氢二钠(na2hpo4)1.44g,磷酸二氢钾(kh2po4)0.24g,调ph7.4,定容1l
pbst配方:pbs,1l+tween-20,1ml
基质载片1为醛基芯片(上海百傲公司),每张芯片包含10个检测方格(检测亚区),每个方格检测一份血清,一次检测10份血清,长×宽×厚为76.4×25.2×1mm。
步骤1.制备芯片1-4
每个检测亚区2内,将鼠dcp抗体依次点在芯片上,dcp抗体点样浓度4mg/ml。
每个检测亚区2内设置有检测斑区域和对照斑区域,所述检测斑区域有通过喷涂微量dcp特异性抗体形成的检测斑3,所述对照斑区域有通过喷涂浓度4mg/ml的牛血清白蛋白形成的对照斑4。
点样方案如下:
芯片1:每个检测方格内,鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑10ul抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑10ul;
芯片2:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑5ul抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑5ul;
芯片3:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑1ul抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑1ul;
芯片4:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑100nl抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑100nl;
采用常规接触式点样方式。
步骤2.采用标准曲线和标准品验证芯片
标准品制备:
在正常血清中添加系列梯度浓度异常凝血酶原标准品和检验用的标准品血清:
标准品血清:0mau/ml、5mau/ml、10mau/ml,20mau/ml、40mau/ml80mau/ml、160mau/ml、320mau/ml、640mau/ml):
检验用的标准品血清:0mau/ml、2mau/ml、4mau/ml,8mau/ml,16mau/ml、35mau/ml50mau/ml、70mau/ml,90mau/ml、120mau/ml、150mau/ml、300mau/ml):
蛋白芯片操作流程:
用待测样品10ul(可以是2.5ul血清用pbs稀释4倍而得)滴加在芯片的每个检测亚区内,37℃孵育30分钟,利用抗原抗体相结合的特性,使血清中的dcp与dcp抗体结合形成抗原抗体复合物。
用pbst洗涤4次,去除非特异结合,再加入pbs稀释的hrp标记兔源一抗,37℃孵育30分钟。兔源抗体与抗原结合,形成dcp抗体-dcp-兔源hrp标记凝血酶原抗体复合物。
用pbst洗涤4次,去除非特异结合,加入hrp发光底物,37℃孵育30分钟,化学发光扫描仪进行扫描得到检测斑像素值。
固相载体上的化学发光像素与标本中受检抗原的量成正向相关,芯片捕获点样抗体(鼠源一抗)和检测用的抗体(兔源一抗)分别取自不同种属的动物,针对凝血酶原的不同抗原表位。如图示2抗体夹心法蛋白芯片流程图。
以标准品血清的浓度为横坐标,像素值为纵坐标,绘制标准曲线,并生成标准曲线回归方程。
芯片1-4得出的标准曲线回归方程的相关系数的平方值r2在0.55-0.6之间,标准品浓度和像素值之间线性相关性较差。
采用配制的另一批不同浓度的检验标准品血清验证标准曲线,发现得出的结果与检验标准品血清本身的浓度相差悬殊,而且其中浓度低于80mau/ml的检验标准品血清的检测数值多次重复都低于30mau/ml,低于诊断界定值40mau/ml,呈假阴性。
步骤3.采用已知dcp含量的临床血清验证这些芯片,血清样本如下:
35份肝癌血清:来源于首都医科大学附属佑安医院标本库,已知其异常脱羧凝血酶原浓度高于诊断界定值40mau/ml(lmau/ml=1ng/ml);
28份正常健康人血清;异常脱羧凝血酶原浓度低于异常脱羧凝血酶原浓度
7份空白对照(空白对照为1×pbs),检测结果统计如下表1:
表1芯片1-4检测结果
表1的结果可以看出:空白对照9份没有检测到dcp;健康血清28份,没有检测到dcp;35份肝癌血清中仅20-24份检测到dcp高于临界值,即这几个芯片具有(20~24)/35=57.1%~68.6%的检出灵敏性,漏检比例非常高。
实施例2.芯片5-7的制备和验证
步骤1制备芯片
芯片5:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑10nl抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑10nl;
对照芯片6:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑5nl抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑5nl;
对照芯片7:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑2nl抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑2nl;
对照芯片5‐7采用德国gesim公司nano‐plotternp2.1型号非接触式皮升级点样仪,采用压电点样针,控制点样仪内舱温度4‐8摄氏度。
步骤2步骤和实验试剂同实施例1。
芯片5-7得出的标准曲线回归方程的相关系数的平方值r2逐渐升高到6.5-7.5之间,可以看到标准品浓度和像素值之间线性关系在显著改善。
采用配制的另一批不同浓度的检验标准品血清验证标准曲线,发现得出的结果与检验标准品血清本身的浓度相差在缩小,最低检测限可到4mau/ml。
步骤3.采用已知临床血清验证芯片
血清同实施例1的步骤3,检测结果统计如表2.
表2芯片5-7检测结果
表2的结果可以看出:空白对照9份没有检测到dcp;健康血清28份,没有检测到dcp;35份肝癌血清中27-30份检测到dcp高于临界值,即这几个芯片具有(27~30)/35=77.1%~85.7%的检出灵敏性,检出率显著提高,但是仍然存在相当比例的漏检。结合步骤2中检验标准品血清的验证情况,可以初步决定是检测限不够导致的漏检。
在平行实施例中,进一步降低点样量,但是制备所得的标准曲线中,未进一步观察到标准品浓度和像素值之间线性关系的改善。对检验标准品血清及临床血清的检验,也并未比芯片5-7显著改善。
实施例3.芯片8-10的制作和验证
发明人从抗体纯化、试剂配方到检测温度、时间等多维度尝试,均未观察到标准品浓度和像素值之间线性关系的进一步改善,检出率难以突破90%。在偶然的试验中,发明人尝试了抗体点样分为少量多次进行地进行点样,以此得出的芯片,相对于实施例2其它条件不变的情况下标准曲线相关系数r2出人预料地跃升到0.9-0.95,检出率也相应提高到92-95%,具体如下:
步骤1.芯片8和9的制作
芯片8:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑3nl抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑5nl;应用德国gesim公司nano-plotternp2.1型号非接触式皮升级点样仪,采用压电点样针,控制点样仪内舱温度4-8摄氏度,每次喷点300pl-500pl,每点喷涂3-5次,共计3nl点样抗体,检测斑直径为0.5-1mm,芯片结构如图1所示。
芯片9:鼠dcp单克隆抗体点样浓度4mg/ml,每个检测斑5nl抗体;10%牛血清白蛋白(bsa)作为阴性对照,每个对照斑5nl;应用德国gesim公司nano-plotternp2.1型号非接触式皮升级点样仪,采用压电点样针,控制点样仪内舱温度4-8摄氏度,每次喷点300pl-500pl,每点喷涂6-10次,共计3nl点样抗体,检测斑直径为0.5-1mm。
步骤2步骤和实验试剂同实施例1。
芯片8或9得出的标准曲线回归方程的相关系数的平方值r2跃升到9.2-9.5之间,标准品浓度和像素值之间线性关系极其明显地改善。
采用配制的另一批不同浓度的检验标准品血清验证标准曲线,发现得出的结果与检验标准品血清本身的浓度仅有微小差异属于误差允许范围,其中浓度为60mau/ml的检验标准品血清的检测结果低于界定值,呈假阴性。仍然存在明显的假阴性。
步骤3.采用已知临床血清验证芯片
血清同实施例1的步骤3,检测结果统计如表3.
表3芯片8和9检测结果
表1的结果可以看出:空白对照9份没有检测到dcp;健康血清28份,没有检测到dcp;35份肝癌血清中33份检测到dcp高于临界值,即这几个芯片具有(33~34)/35=94.3%~97.1%的检出灵敏性,检出率几乎达到100%。
最终确定的最优芯片方案如下
每个检测方格(检测亚区)内,将鼠dcp抗体依次点在芯片上,dcp抗体点样浓度4mg/ml,点成一排四个检测斑;10%牛血清白蛋白(bsa)作为阴性对照,同样点样四次,点成对照斑;
应用德国gesim公司nano‐plotternp2.1型号非接触式皮升级点样仪,采用压电点样针,控制点样仪内舱温度4‐8摄氏度,每次喷点300pl‐500pl,每点喷涂6‐10次,共计3‐5nl点样抗体,每个检测亚区4个检测点,需要12nl捕获抗体,检测斑直径为0.5‐1mm。
实验例最优芯片方案应用效果
标准曲线回归方程相关系数r2为0.98.
血清样本:
8份肝癌血清:来源于首都医科大学附属佑安医院标本库(已知其异常脱羧凝血酶原浓度高于诊断界定值40mau/ml(lmau/ml=1ng/ml);
1份正常健康人血清;
1份空白对照(空白对照为1×pbs)。
本芯片的检测结果:
空白对照和健康对照没有检测到异常凝血酶原:说明本实验采用的芯片有效。正常人体内没有异常凝血酶原,健康血清没有检测到凝血酶原。说明本发明提供的芯片及方法检测的假阳性为0,检测结果能准确区分肝癌血清和正常血清。
8份肝癌血清的检测斑扫描及计算结果显示阳性,说明8份肝癌血清中尤其是晚期肝癌患者体内有异常脱羧凝血酶原,8个阳性检测亚区的检测斑显示出不同程度的亮度,说明8份肝癌血清含有不同浓度的异常脱羧凝血酶原如图3,其中3和5显示弱阳性,检测斑亮度微弱,而1,2,4,6,7,8都显示强阳性。检测结果说明本发明的蛋白芯片能够准确检测肝癌血清,而且能够半定量地检测血清中异常脱羧凝血酶原的浓度。上述数据说明,本发明的芯片和方法准确性和可靠性良好。
在另外的数十份门诊确定为肝癌的患者血清检测中,检测灵敏度和特异性在90%以上。本发明的试剂盒:
包括如实施例3所示的芯片,其中一些芯片优选检测亚区2之间设置有凸起作为物理隔断5
以及hrp标记的凝血酶原多克隆抗体,hrp化学发光底物液;所述hrp标记的凝血酶原多克隆抗体为兔源抗体,与所述检测斑上固定的dcp特异性抗体来源于不同物种。
- 还没有人留言评论。精彩留言会获得点赞!