一种肺癌筛查试剂盒的制作方法
本发明涉及一种肺癌筛查试剂盒。
背景技术:
在恶性肿瘤的发病率及死亡率中,肺癌分别占13.0%和19.4%,居恶性肿瘤第一位。且受中国人口老龄化形势的加剧、吸烟人群的年轻化等因素的影响,肺癌患者的人群基数仍在上升。由于肺癌的异质性,同一治疗手段对肺癌的治疗效果往往是南辕北辙,由此,肺癌领域的临床研究和临床处理,重要的一环是对肺癌进行分类和分期以尽量减少其异质性,提高治疗效率。
目前,根据各型肺癌的分化程度和形态特征,可将肺癌分为小细胞肺癌、腺癌、鳞癌等。其中,鳞癌、腺癌均为高发类型,分别占原发性肺癌的50%、25%,是肺癌防治和研究的重点。鳞癌以中央型肺癌多见,并有向管腔内生长的倾向,常早期造成支气管狭窄,引起肺不张,或阻塞性肺炎。癌组织易变性、坏死,形成空洞或癌性肺脓肿。腺癌多生长在肺边缘小支气管的黏液腺,在周围型肺癌中最为常见。腺癌倾向于管外生长,但也可沿肺泡壁蔓延,常在肺边缘部形成直径2~4cm的肿块。腺癌含有非常多的血管,故局部浸润和血行转移较鳞癌早。易转移至肝、脑和骨,更容易累及胸膜而造成胸水。
与其它恶性肿瘤一样,早发现、早治疗是降低肺癌包括鳞癌和腺癌死亡率的关键。但肺癌在早期并没有什么特殊症状,经常在疾病发展到晚期才表现出肺癌症状,错过了最佳手术时机,即使手术,多数患者仍会死于肺癌复发的侵袭或转移。因此肺癌的早期诊断和进行有效的筛查至关重要。
肺癌发生发展的分子生物学机制至今仍不清楚,探寻有效的肺癌分子生物学检测标志物,不仅对阐明肺癌细胞侵袭和转移的分子机制提供依据,也为肺癌的病理诊断、治疗方案的选择具有重要的理论意义和临床应用价值。
骨硬化蛋白(sclerostin、sost),是一种c-末端具有ctck结构域的分泌性蛋白,由sost基因进行编码,一般认为是由骨细胞特异性表达,研究表明,sost可结合lrp5/6受体并抑制wnt信号通路,进而发挥抑制成骨细胞分化和骨形成的作用。目前,未见sost在肺癌中表达情况的报道。
技术实现要素:
发明人对肺癌进行了详细研究,发现了sost蛋白可以作为其分子标志物,并且,sost蛋白在肺组织中的表达水平与肺鳞癌、腺癌相关。因此,通过检测肺组织中的sost蛋白表达水平,不仅可以预测待检者患肺癌的风险,而且可以预测其肺癌分型。
据此,本发明提供了一种肺癌筛查试剂盒,以及检测sost蛋白的表达水平的试剂在制备肺癌筛查试剂中的用途。
本发明公开了一种肺癌筛查试剂盒,它包括任选的用于检测sost蛋白表达水平的试剂。
其中,所述试剂是用于检测肺组织中sost蛋白表达水平的试剂。
其中,所述检测sost蛋白表达水平的试剂为免疫组化检测方法用试剂。
其中,所述检测sost蛋白表达水平的试剂为westernblot或elisa检测方法用试剂。
其中,所述肺癌为肺腺癌和/或肺鳞癌。
本发明还提供了检测sost蛋白表达水平的试剂在制备肺癌筛查用试剂中的用途。
其中,所述试剂是用于检测肺组织中sost蛋白表达水平的试剂。
其中,所述检测sost蛋白表达水平的试剂为免疫组化检测方法用试剂。
其中,所述检测sost蛋白表达水平的试剂为westernblot或elisa检测方法用试剂。
其中,所述肺癌为肺腺癌和/或肺鳞癌。
本发明试剂盒通过检测肺异常者的肺部异常部位与正常部位的sost表达水平,可以判断肺异常者的sost表达水平差异,进而判断待检者患肺癌的风险:若sost的表达水平高,则患肺腺癌的风险低、患肺鳞癌的风险高;若sost的表达水平低,两种肺癌类型的患病风险相反,可用于临床肺癌的辅助诊断,临床应用前景良好。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
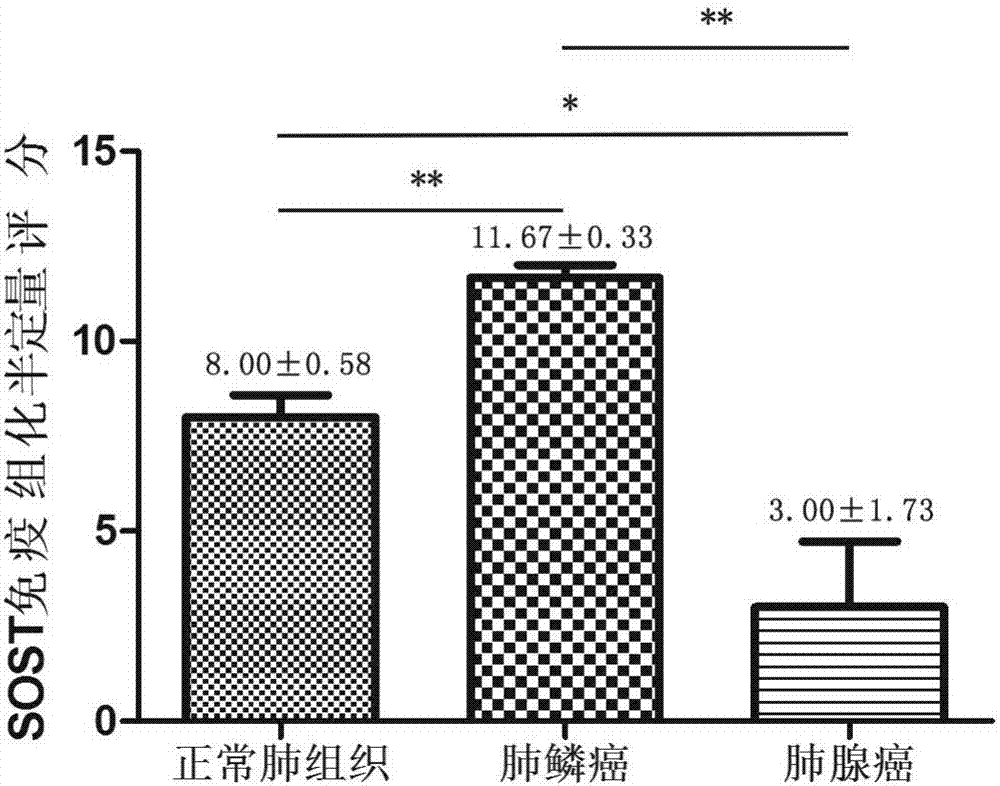
图1sost在肺癌组织样本中表达。
图2sost的表达水平,其中,**代表p<0.01;*代表p<0.05。
具体实施方式
实施例1检测sost在肺癌的表达水平
一、实验材料
肺癌组织微阵列(hlugs060cd01和hlug-ade050cd-01)购买自上海芯超生物。微阵列含肺癌组织病理切片,其中:
hlugs060cd01组织芯片为肺鳞癌病程芯片:包含正常人肺5例、癌旁/肺鳞癌原发灶(临床1期、2期、3期、4期)各22例、肺鳞癌转移灶3例、肺鳞癌的阴性/阳性淋巴结各4例。
hlug-ade050cd-01组织芯片为肺腺癌病程芯片:包含正常人肺5例、癌旁/肺腺癌原发灶(临床1期、2期、3期、4期)各14例、肺腺癌转移灶4例、阴性淋巴结7例/阳性淋巴结6例。
抗sost多克隆抗体获自proteintechgroup,inc(中国武汉)。
所有其他试剂盒或试剂购买自碧云天生物技术有限公司(中国上海)。
二、sost表达水平的检测
使用免疫组化方法进行检测,具体如下:
1.石蜡切片脱蜡至水:(石蜡切片染色前应置60℃1小时)。
(1)二甲苯i、ii,各10分钟。
(2)梯度酒精:100%,2分钟→95%,2分钟→80%,2分钟→70%2分钟。
(3)蒸馏水洗:5分钟,2次(置于摇床)。
2.过氧化氢封闭内源性过氧化物酶:3%h2o2,室温10分钟(避光)。
3.蒸馏水洗:5分钟,2次(置于摇床)。
4.抗原修复:高压热修复法:枸橼酸钠缓冲液(10mm,ph6.0),淹没切片,盖上锅盖,高压锅内煮沸,上汽3分钟后缓慢冷却。
附:抗原修复液(10mmph6.0枸橼酸钠缓冲液)的配制
(1)储备液的配制:
a液:枸橼酸三钠-2h2o29.41g+蒸馏水1000ml
b液:枸橼酸21g+蒸馏水1000ml
(2)工作液的配制:a液82ml+b液18ml+蒸馏水900ml
抗原修复的方法:
5.pbs:5分钟,2次(置于摇床)。
6.正常血清封闭:从染片缸中取出切片,擦净切片背面水分及切片正面组织
周围的水分(保持组织呈湿润状态),滴加正常兔血清处理,37℃,15分钟。
附:正常血清配制(或按试剂盒规定的浓度配制)
按1:20比例,用pbs配制,每张切片需要量按50μl+5μl(10%抛洒量)计算。
7.滴加第一抗体:用滤纸吸去血清,不洗,直接滴加anti-sost(用pbs按1:200稀释抗体),4℃冰箱过夜。
8.pbs:5分钟,2次(置于摇床)。
9.滴加生物素化的二抗(用pbs按1:5000稀释二抗),37℃,40分钟。
10.pbs:5分钟,2次(置于摇床)。
11.滴加三抗(sab复合物),37℃,40分钟。
12.pbs:5分钟,2次(置于摇床)。
13.dab显色,镜下观察,适时终止(自来水冲终止)。
附:dab的配制
储备液(dab25mg/ml)的配制:dab250mg+pbs10ml,待完全溶解后分装成1ml,100μl,50μl,20μl等,—20℃,冻存。
(2)工作液:dab储备液20μl+pbs1000μl+3%h2o25μl
14.自来水(细水)充分冲洗。
15.苏木素复染,室温,30秒,自来水冲洗。
16.自来水冲洗返蓝,15分钟。
17.梯度酒精脱水:
80%,2分钟→95%,2分钟→100%,2次,5分钟。
18.二甲苯透明:
i,ii(二甲苯)各5分钟
19.封片:加拿大树胶(或中性树胶)封片。
20.显微镜拍照,拍照后对sost免疫组化染色进行半定量分析,其中,
荧光强度为:阴性:0;弱阳性:1;阳性:2;强阳性:3;
阳性百分比为:0%:0;0-25%:1;25%-50%:2;50%-75%:3;75%-100%:4。
半定量评分=荧光强度x阳性百分比,
半定量得分为0-12。
使用graphpad5.0对各组半定量评分进行统计学分析,p<0.05为有统计学意义。
二、实验结果
肺癌组织与正常组织对照中sost的表达检测结果见图1-2。
由图1-2可见,正常肺组织中,sost的免疫组化平均得分为8.00±0.58,肺鳞癌组织中,sost的平均得分为11.67±0.33,与正常肺组织相比,表达水平差异具有统计学意义(p<0.01),sost在肺鳞癌组织中显著升高;肺腺癌组织中,sost的平均得分为3.00±1.73,与正常肺组织相比,表达水平差异具有统计学意义(p<0.05),sost在肺腺癌组织中显著降低。
可见,与正常肺组织相比,肺腺癌组织的sost表达水平显著降低、肺鳞癌组织的sost表达水平显著升高,说明肺癌与sost表达水平相关。由于正常肺组织的sost水平可反映正常人肺组织的sost水平,因此,对肺部异常者,可分别取异常部位、正常部位组织,比较sost表达水平,进而评价其患肺腺癌、鳞癌的可能性,作为临床肺癌的辅助诊断手段。
综上,本发明试剂盒通过检测sost的表达水平,可以判断肺异常者的肺部异常部位与正常部位的sost表达水平差异,进而筛查待检者患肺癌的风险:若sost的表达水平低,则患肺腺癌的风险高、患肺鳞癌的风险高,反之,结论相反,可用于临床肺癌的辅助诊断,为患者采取相关的治疗措施或者决策提供有效的依据,临床应用前景良好。
- 还没有人留言评论。精彩留言会获得点赞!