一种体液蝶呤谱检测试剂盒及其使用的制作方法
本发明涉及化学分析及及临床医学及医学领域。具体涉及一种新的蝶呤类代谢物组合标志物及在制备筛查高苯丙氨酸血症亚型的试剂盒中的应用。
背景技术:
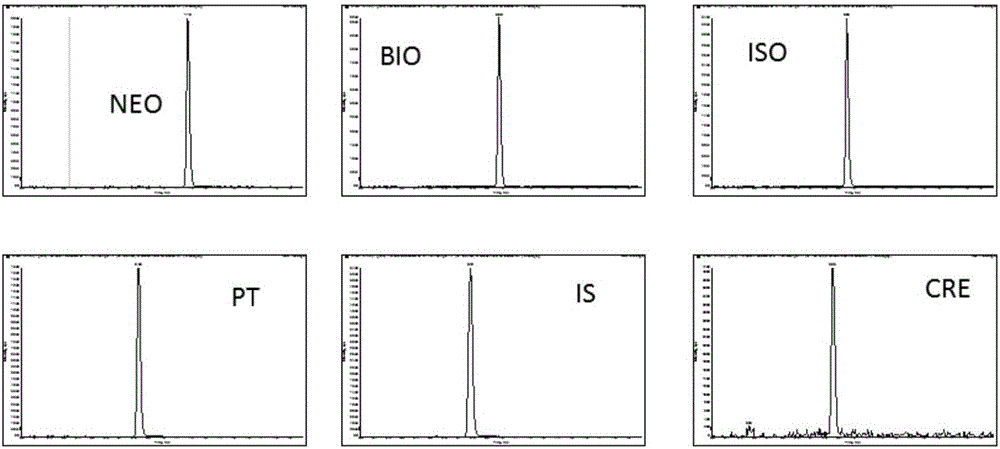
:蝶呤类化合物是蝶啶的衍生物,在人体中广泛分布于血液、尿液、脑脊液等体液中,但含量甚微。蝶呤类化合物在细胞代谢过程中有重要的辅助作用。健康人体液中蝶呤类化合物含量低且稳定,当免疫系统被某些疾病如癌症(如肾癌、乳腺癌)等激活后,蝶呤类化合物含量显著改变。高苯丙氨酸血症(hpa)是一类常见的常染色体隐性遗传性代谢病,可导致严重智能障碍。遗传变异位点的差异导致hpa分为多种亚型,主要包括苯丙酮尿症(pku)和四氢生物蝶呤(bh4)缺乏症,其中bh4缺乏症又包含不同亚型,不同亚型的hpa的预后和治疗方法截然不同。其中6-丙酮酰四氢蝶呤合成酶(6-pyruvoyl-tetrahydropterinsynthase,ptps)缺乏症是国内主要的bh4缺乏症亚型,因此本发明中未经特别指出,所述bh4缺乏症均为ptps缺乏症亚型。bh4是苯丙氨酸,酪氨酸,色氨酸羟化酶的辅酶,其中合成代谢中任何一种合成酶或还原酶的缺乏,均可导致bh4生成不足或者缺乏。因此,bh4缺乏症患者的体液蝶呤谱也会发生显著改变。现阶段国内主要采用荧光法或串联质谱法测定血苯丙氨酸浓度进行hpa筛查,并采用高效液相色谱-荧光检测法测定氧化后尿样中的新蝶呤(neo)和生物蝶呤(bio)含量及bio的比例来进行判断。但是,尿样中的蝶呤谱组成相当复杂,除上述的neo和bio外,还有二氢新蝶呤(7,8-dihydroneopterin,nh2),二氢生物蝶呤(7,8-dihydrobiopterin,bh2),异黄蝶呤(isoxanthopterin,iso),蝶呤(pterin,pt)等多种蝶呤类物质,其相互关系涉及多个酶的作用。因此,仅根据氧化后尿样的neo和bio的含量,很难准确地对bh4缺乏症所有亚型进行鉴别诊断。另一方面,基于hplc-荧光检测的方法,目前主要用于测定neo和bio,但对于复杂的尿样中其他蝶呤类物质而言,灵敏度和特异性均不高。在尿液等体液中,生物蝶呤主要以bh4、bh2、bio三种不同的形态存在,采用目前常用的酸性氧化法,bh4和bh2均能以一定比例氧化成bio。但是,在体内或者体外特定条件下,bh4可以被氧化成pt,且pt可以进一步被氧化成iso。因此,无论是hpa筛查阶段还是治疗阶段,都需要更加灵敏、特异、准确的尿液等体液蝶呤谱分析方法,用于hpa亚型筛查和辅助鉴别诊断。技术实现要素:本发明旨在提供一种灵敏、特异、准确的体液蝶呤谱测定方法。在本发明的第一方面,提供了一种体液蝶呤谱检测试剂盒,所述试剂盒包括蝶呤混合标准品和肌酐。在另一优选例中,所述试剂盒还包括内标、氧化剂、酸化剂、和流动相。在另一优选例中,所述蝶呤混合标准品的组成是新蝶呤、生物蝶呤、异黄蝶呤、蝶呤。在另一优选例中,所述内标为6-甲基蝶呤。在另一优选例中,所述氧化剂选自二氧化锰、碘化物、高锰酸钾;所述酸化剂为盐酸。在另一优选例中,所述流动相包括甲醇-水体系、乙腈-水体系。在另一优选例中,所述体液选自尿液、血液、脑脊液。在本发明的第二方面,提供了一种如上所述的本发明提供的试剂盒在测定蝶呤谱的应用。在本发明的第三方面,提供了一种测定体液中蝶呤谱的方法,所述体液选自尿液、血液、脑脊液,所述方法包括步骤:(1)配制标准品溶液和肌酐溶液;所述标准品包括蝶呤混合标准品和内标;(2)在样品溶液中加入氧化剂和酸化剂使样品氧化;(3)通过液-质联用测定标准品溶液、肌酐溶液和经过氧化的样品中的新蝶呤、生物蝶呤、异黄蝶呤、蝶呤和肌酐量;和(4)分别计算新蝶呤/肌酐的值、生物蝶呤+蝶呤/肌酐的值、和异黄蝶呤/肌酐的值。在另一优选例中,步骤(2)中的氧化时间为1-10分钟;更优选为2-5分钟。在另一优选例中,步骤(3)中液相色谱的流动相包括流动相a和流动相b;所述流动相a为含有乙酸铵、氨水和水的乙腈溶液;所述流动相b为含有乙酸铵、氨水和乙腈的水溶液。据此,本发明提供了一种更加灵敏、特异、准确的尿液等体液蝶呤谱分析方法,可用于hpa亚型筛查和辅助鉴别诊断。附图说明图1是四种蝶呤代谢物、内标及肌酐的选择离子流图。四种蝶呤标准品包括bio、neo、iso和pt,内标(is)为6mpt,肌酐为cre。图2是尿液氧化条件优化。四种蝶呤neo,bio,iso,pt的质谱响应峰面积在氧化时间为2min后检测值达到稳态,确定氧化时间为5min。图3是实施例5中neo/cre,iso/cre,bio%,(bio+pt)%在各实验组的检测及计算值。图4是实施例5中各组合标志物在试验中判别健康对照组、pku组和bh4缺乏症组的诊断结果图。其中prob1和prob2分别为采用neo/cre、(bio+pt)/cre组合标志物,neo/cre、(bio+pt)/cre、iso/cre组合标志物判别健康对照组和bh4缺乏症组的概率;prob3和prob4分别为采用neo/cre、(bio+pt)/cre组合标志物,neo/cre、(bio+pt)/cre、iso/cre组合标志物判别健康对照组和健康对照组和pku组的概率;prob5和prob6分别为采用neo/cre、(bio+pt)/cre组合标志物,neo/cre、(bio+pt)/cre、iso/cre组合标志物判别pku组和bh4组的概率。具体实施方式本发明所要解决的问题是提供一种新的蝶呤类代谢物组合标志物,以解决现有遗传代谢病质谱筛查技术无法区分高苯丙氨酸血症的各种亚型,为临床诊断提供参考。本发明对前处理方法和质谱检测方法进行了优化,并同时对尿液中4种蝶呤及尿肌酐进行检测。根据蝶呤的相互转化关系,并依据实际样品检测结果进行统计分析得,确定了以neo、bio、pt、iso作为联合诊断标志物。采用下述3个指标中两种或三种的组合:neo、(bio+pt)、iso,首次实现了仅采用蝶呤谱检测就能有效区分健康对照组、pku组和bh4缺乏症组,为临床上hpa亚型的筛查和辅助鉴别诊断提供了有效的检测手段。本发明提供了一种能够用于区分hpa各种亚型的代谢物的组合,该组合包括neo、bio、pt、iso四种蝶呤代谢物。优选地,所述组合包括下述3个指标中两种或三种的组合:neo、(bio+pt)、iso。基于质谱检测数据的判断模型:首先,基于健康对照组和bh4缺乏症组数据建立了判别健康对照组和bh4缺乏症组的模型i和模型ii,回归方程如式1和式2:模型ix1=-19.881+12.057*a-46.727*bprob1=1/(1+e-x1)(截点值(cutoff)=0.5)(式1)模型iix2=-18.504+11.907*a-45.819*b–5.498*cprob2=1/(1+e-x2)(截点值(cutoff)=0.5)(式2)其中a、b、c分别为neo、(bio+pt)、iso在取自受试者的尿液样本中蝶呤代谢物浓度与尿肌酐浓度的比值,即neo/cre、(bio+pt)/cre、iso/cre,单位均为(mmol/mol)。prob1和prob2表示判断为bh4缺乏症患者的概率,截点值(cutoff)=0.5,即当prob1或prob2值大于0.5时,判断所述受试者患有bh4缺乏症。其次基于健康对照组和pku组数据建立了判别健康对照组和pku组的模型iii和模型iv,回归方程如式3和式4:模型iiix3=-9.528-0.823*a+5.976*bprob3=1/(1+e-x3)(截点值(cutoff)=0.5)(式3)模型ivx4=-13.228-1.469*a+8.148*b–3.99*cprob4=1/(1+e-x4)(截点值(cutoff)=0.5)(式4)其中a、b、c分别为neo、(bio+pt)、iso在取自受试者的尿液样本中蝶呤代谢物浓度与尿肌酐浓度的比值,即neo/cre、(bio+pt)/cre、iso/cre,单位均为(mmol/mol)。prob3和prob4表示判断为pku患者的概率,截点值(cutoff)=0.5,即当prob3或prob4值大于0.5时,判断所述受试者患有pku。最后基于pku组和bh4缺乏症组数据建立了判别pku组和bh4缺乏症组的模型v和模型vi,回归方程如式5和式6:模型vx5=9.301+2.789*a–17.809*bprob5=1/(1+e-x5)(截点值(cutoff)=0.5)(式5)模型vix6=10.617+2.215*a–19.624*b+8.46*cprob6=1/(1+e-x6)(截点值(cutoff)=0.5)(式6)其中a、b、c分别为neo、(bio+pt)、iso在取自受试者的尿液样本中蝶呤代谢物浓度与尿肌酐浓度的比值,即neo/cre、(bio+pt)/cre、iso/cre,单位均为(mmol/mol)。prob5和prob6表示判断为bh4缺乏症患者的概率,截点值(cutoff)=0.5,即当prob5或prob6值大于0.5时,判断所述受试者患有bh4缺乏症。另一方面,本发明公开了一种基于上述四种蝶呤(neo、bio、pt、iso)标志物组合,能够用于筛查判别高苯丙氨酸血症各亚型的串联质谱法蝶呤检测试剂盒,其包含蝶呤混合标准品、氧化剂、酸化剂、流动相等。在一些实施例中,所述氧化剂包括二氧化锰、碘三离子、高锰酸钾,其中优选为二氧化锰;在一些实施例中,所述酸化剂包括盐酸、三氯乙酸、次氯酸,其中优选为盐酸;在一些实施例中,所述流动相为梯度或等度洗脱,其中梯度洗脱包括甲醇-水体系、乙腈-水体系,优选为:流动相a为乙腈(含1mm乙酸铵和20mm氨,5%水),流动相b为水(含1mm乙酸铵和20mm氨,5%乙腈)。在一些实施例中,所述串联质谱法蝶呤检测试剂盒还包括u型耐热96孔萃取板、v型底96孔检测板、粘性微孔板封套和检测板铝箔。在一些实施例中,所述串联质谱法蝶呤检测试剂盒还包括蝶呤混标标质控溶液。本发明还公开了所述串联质谱法蝶呤检测试剂盒的使用方法,包括以下步骤:1.标准曲线系列标准品溶液配制:标准品溶液包括4种蝶呤标准品混标:新蝶呤、生物蝶呤、异黄蝶呤、蝶呤4种内源性蝶呤;6-甲基蝶呤作为内标;肌酐。详细见表1。表1待测代谢物名称及缩写蝶呤英文名称缩写生物蝶呤biopterinbio新蝶呤neopterinneo蝶呤pterinpt异黄蝶呤isoxanthopteriniso6-甲基蝶呤6-methylpterin6mpt肌酐creatininecre其中4种蝶呤标准品混标溶液中bio,neo,iso,pt浓度均为10μg/ml;内标6mpt母液浓度1μg/ml;肌酐母液浓度为1mg/ml。不同浓度系列标曲溶液配制:稀释配制蝶呤及肌酐混合标准工作溶液,其中含bio,neo,iso,pt浓度梯度依次为:0.1、0.3、0.6、1、3、6、10、30、60、100、300、1000ng/ml,含肌酐浓度梯度依次为1、3、6、10、30、60、100、300、600、10000ng/ml。2.称取氧化剂根据待测样品数依次将氧化剂加入96孔板对应孔中。3.取样将空白、质控样品、待测样品在96孔板排序。若是尿液等液体样品,直接加入u型底耐热96孔萃取板中;若是尿片等干滤纸片样品,用3.2mm打孔器按顺序将尿片打入u型底耐热96孔萃取板中。4.氧化以尿样为例,在96孔板中根据不同类型样品,补加入适量超纯水,使得每孔中溶液总体积为200μl;加入50μl的1m盐酸溶液,用粘性贴膜密封96孔板,室温下振荡反应5min,4℃下12000rpm离心5min。5.样本上机检测打开密封膜。用移液器每孔移出100μl上清液,按顺序移入新96孔板。用铝箔密封96孔板,放入液相自动进样器中,供质谱检测。6.液相质谱联用检测所述不同样品为体液,所述体液为尿液、血液、血浆、血清或脑脊液中之一。本发明所述串联质谱法蝶呤检测试剂盒灵敏度高,操作简单,分析时间短,对提高遗传代谢病的筛查水平有重要意义。本发明提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。本发明的主要优点在于:1、本发明采用串联质谱方法对尿样蝶呤谱进行检测,解决了目前采用液相色谱-荧光检测法灵敏度和特异性不高的缺点。2、本发明在检测尿样中4种蝶呤的同时,对尿肌酐进行检测。节约了检测成本和检测时间。3、目前的检测方法仅检测bio和neo两种蝶呤,而bio在体液中稳定性较差。本发明增加对pt和iso的检测,可以对因体内或运输贮存过程中bio降解而导致的含量降低进行补偿。4、现有判断标准:计算尿液样本中neo和bio的含量,并计算bio%:bio/(neo+bio)×100%。当bh4合成酶即ptps缺乏时,尿neo明显增加,bio明显降低,bio%<10%,甚至<5%或测不出。以上判断标准仅以neo和bio作为诊断标志物,本发明提出改进的判断标准,将neo、bio、pt、iso作为联合诊断标志物。5、本发明以neo、bio、pt、iso作为联合诊断标志物有几大优势:(a)计算(bio+pt)%:(bio+pt)/(neo+bio+pt)×100%代替现有的bio%,可以降低由于bio降解后bio%<10%导致的假阳性率。(b)采用下述3个指标中两种或三种的组合:neo、(bio+pt)、iso。采用本发明诊断标志物构建的诊断模型效果良好,灵敏度高特异性好,适合用于遗传代谢病筛查。以下结合具体实施例,进一步阐述本发明。应用试剂盒对109例新生儿尿样标本进行检测。下列实施例中未注明具体条件的实验方法,通常按照常规条件或者按制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域专业人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。仪器、材料与试剂串联质谱仪:watersuplc超高压液相色谱(waters,美国)串联api5500三重四极杆质谱仪(sciex,美国)。全自动高速冷冻离心机5810r(eppendorf,德国);纯水仪milli-q(millipore,美国);十万分之一电子分析天平(cpa225d,sartorius,德国)。蝶呤标准品:新蝶呤、生物蝶呤、异黄蝶呤、蝶呤;肌酐、氢氧化钠、盐酸;抗坏血酸;肌酐标准品;甲醇、乙腈、甲酸、乙酸铵、氨水(≥25%nh3)均为hplc级。nunc聚苯乙烯ps透明96孔板和nunc丙烯酸96孔板,聚酯密封贴膜铝箔nunc(theromoscientific)。试剂盒的使用方法,包括下列步骤:1.标准曲线系列标准品溶液配制:标准品溶液包括4种蝶呤标准品混标:新蝶呤、生物蝶呤、异黄蝶呤、蝶呤4种内源性蝶呤;6-甲基蝶呤作为内标;肌酐。详细见表1。其中4种蝶呤标准品混标溶液中bio,neo,iso,pt浓度均为10μg/ml;内标6mpt母液浓度1μg/ml;肌酐母液浓度为1mg/ml。不同浓度系列标曲溶液配制:稀释配制蝶呤及肌酐混合标准工作溶液,其中含bio,neo,iso,pt浓度梯度依次为:0.1、0.3、0.6、1、3、6、10、30、60、100、300、1000ng/ml,含肌酐浓度梯度依次为1、3、6、10、30、60、100、300、600、10000ng/ml。2.称取氧化剂每份称取5mg二氧化锰,根据待测样品数依次加入96孔板对应孔中。3.取样将空白、质控样品、待测样品在96孔板排序。若是尿液等液体样品,直接加入u型底耐热96孔萃取板中;若是尿片等干滤纸片样品,用3.2mm打孔器按顺序将尿片打入u型底耐热96孔萃取板中。4.尿样氧化在96孔板中根据不同类型样品,补加入适量超纯水,使得每孔中溶液总体积为200μl;加入50μl的1m盐酸溶液,用粘性贴膜密封96孔板,室温下振荡反应5min,4℃下12000rpm离心5min。5.样本上机检测打开密封膜。用移液器每孔移出100μl上清液,按顺序移入新96孔板。用铝箔密封96孔板,放入液相自动进样器中,供质谱检测。6.色谱条件:色谱柱(hypercarb,2.1×30mm,3μm,thermo,美国);柱温,室温;流速,0.45ml/min;进样体积,10μl;自动进样器温度,4℃;流动相a为乙腈(含1mm乙酸铵和20mm氨,5%水),流动相b为水(含1mm乙酸铵和20mm氨,5%乙腈)。梯度洗脱(0到2.5min流动相b从5%线性增加至45%,2.5到3min流动相b从45%线性增加至95%,并保持0.2min,0.01min内回到5%保持比例平衡0.79min)。7.质谱条件:离子源:电喷雾离子源(esi);检测方式:多离子反应监测(mrm);喷雾电压:4500v;扫描模式:负离子模式;离子源温度(tem):450℃;气帘气压力(cur):30psi;雾化器压力(gs1):60psi;辅助气压力(gs2):60psi;射入电压(ep):-10v;碰撞室射出电压(cxp):-17v。数据的采集及处理通过analyst1.5分析软件(sciex,美国)完成。蝶呤及内标、肌酐的离子对及参数如表2所示:表2四种组合标志物、肌酐及内标的质谱检测参数实施例1尿液氧化条件的优化为考察尿液中蝶呤在酸性二氧化锰条件下的最优氧化时间,按操作步骤取一定量的尿样加入氧化剂和酸化剂,分别反应0,1,2,5,10,15,20,25min,通过比较不同氧化处理时间下,四种蝶呤neo,bio,iso,pt的质谱响应峰面积。结果表明(图1),氧化时间为2min后蝶呤检测值达到稳态,考虑到实验操作的便利,后续确定使用氧化时间为5min。实施例2流动相配方的确定按照表3配方对四种蝶呤标准品溶液及实际尿液样品进行分析,考察相应的色谱峰分离度,以及相应的灵敏度和线性范围,均能完成对实际尿液样本的检测。较优地,采用c18反相色谱柱,流动相采用表3中配方6时,获得较优的灵敏度和较宽的线性范围。表3流动相配方的优化实施例3一种串联质谱法蝶呤检测试剂盒3.1一种串联质谱法蝶呤检测试剂盒包括四种蝶呤混合标准品:冻干粉,干燥,1瓶,-20度保存;一种蝶呤标准品(内标):冻干粉,干燥,1瓶,-20度保存;四种蝶呤混合标准品质控品(含尿液基质):冻干粉,干燥,3种浓度,3瓶,-20度保存;二氧化锰粉末:干燥,1瓶(2g);盐酸溶液(1mhcl):1瓶(50ml);流动相:2瓶(各1l),流动相a为乙腈(含1mm乙酸铵和20mm氨,5%水),流动相b为水(含1mm乙酸铵和20mm氨,5%乙腈);u型底,耐热微孔板,96孔,2板;v型截底,洁净微孔板,96孔检测板,2板;粘性微孔板封套:5张铝箔微孔板封套:5张微孔板条形码标签:10份3.2一种串联质谱法蝶呤检测试剂盒包括四种蝶呤混合标准品:冻干粉,干燥,1瓶,-20度保存;一种蝶呤标准品(内标):冻干粉,干燥,1瓶,-20度保存;四种蝶呤混合标准品质控品(含尿液基质):冻干粉,干燥,3种浓度,3瓶,-20度保存;二氧化锰粉末:干燥,1瓶(2g);盐酸溶液(1mhcl):1瓶(50ml);流动相:2瓶(各1l),流动相a为乙腈(含20mm乙酸铵和10mm氨,5%水),流动相b为水(含20mm乙酸铵和10mm氨,5%乙腈);u型底,耐热微孔板,96孔,2板;v型截底,洁净微孔板,96孔检测板,2板;粘性微孔板封套:5张铝箔微孔板封套:5张微孔板条形码标签:10份3.3一种串联质谱法蝶呤检测试剂盒包括四种蝶呤混合标准品:冻干粉,干燥,1瓶,-20度保存;一种蝶呤标准品(内标):冻干粉,干燥,1瓶,-20度保存;四种蝶呤混合标准品质控品(含尿液基质):冻干粉,干燥,3种浓度,3瓶,-20度保存;二氧化锰粉末:干燥,1瓶(2g);盐酸溶液(1mhcl):1瓶(50ml);流动相:2瓶(各1l),流动相a为乙腈(含10mm乙酸铵和10mm氨,5%水),流动相b为水(含10mm乙酸铵和10mm氨,5%乙腈);u型底,耐热微孔板,96孔,2板;v型截底,洁净微孔板,96孔检测板,2板;粘性微孔板封套:5张铝箔微孔板封套:5张微孔板条形码标签:10份3.4一种串联质谱法蝶呤检测试剂盒包括四种蝶呤混合标准品:冻干粉,干燥,1瓶,-20度保存;一种蝶呤标准品(内标):冻干粉,干燥,1瓶,-20度保存;四种蝶呤混合标准品质控品(含尿液基质):冻干粉,干燥,3种浓度,3瓶,-20度保存;二氧化锰粉末:干燥,1瓶(2g);盐酸溶液(1mhcl):1瓶(50ml);流动相:2瓶(各1l),流动相a为甲醇(含0.1%甲酸),流动相b为水(含0.1%甲酸);u型底,耐热微孔板,96孔,2板;v型截底,洁净微孔板,96孔检测板,2板;粘性微孔板封套:5张铝箔微孔板封套:5张微孔板条形码标签:10份3.5一种串联质谱法蝶呤检测试剂盒包括四种蝶呤混合标准品:冻干粉,干燥,1瓶,-20度保存;一种蝶呤标准品(内标):冻干粉,干燥,1瓶,-20度保存;四种蝶呤混合标准品质控品(含尿液基质):冻干粉,干燥,3种浓度,3瓶,-20度保存;碘粉末:棕色瓶,干燥,1瓶(3g);碘化钾粉末:棕色瓶,干燥,1瓶(5g);盐酸溶液(1mhcl):1瓶(50ml);流动相:2瓶(各1l),流动相a为乙腈(含1mm乙酸铵和20mm氨,5%水),流动相b为水(含1mm乙酸铵和20mm氨,5%乙腈);u型底,耐热微孔板,96孔,2板;v型截底,洁净微孔板,96孔检测板,2板;粘性微孔板封套:5张铝箔微孔板封套:5张微孔板条形码标签:10份实施例4试剂盒评价实验4.1线性范围、最低检出限及最低定量限采用已优化好的分析条件,对待测物的标准曲线样品浓度进行分析。蝶呤(neo、bio、iso、pt)和肌酐(cre)的质量浓度分别在0.1-300ng/ml和1-3000ng/ml范围内,其质谱响应和浓度间呈现良好的线性关系(r>0.998)。蝶呤(neo、bio、iso、pt)和肌酐(cre)的线性回归方程、最低检出限(s/n>3)和最低定量限(s/n>10)见表4。表4尿样中蝶呤(neo、bio、iso、pt)和肌酐(cre)的线性回归方程、最低检出限和最低定量限4.2精密度和准确度采用已优化好的分析条件,对蝶呤低、中、高三个qc浓度的样品分别进行日内(n=6)、日间(n=18)的精密度和准确度考察。如表4所示,测定结果以相对标准偏差表示,日内精密度和日间精密度分别在1.44%~5.61%和3.23%~9.02%范围内(表4),表明方法具有良好的可重复性。方法的准确度通过测定浓度与标准浓度间的标准偏差(re)表示,日内准确度(re)在90.7%~107%和日间准确度(re)在92.8%~113%范围内(表5)。本方法的精密度和准确度均符合生物样品定量检测要求。表5尿样中蝶呤(neo、bio、iso、pt)和肌酐(cre)的日内、日间准确度和精密度。4.3基质效应采用已优化好的分析条件,对蝶呤及肌酐进行基质效应考察,结果如表5所示,蝶呤(neo、bio、iso、pt)和肌酐(cre)的相对基质效应1(加标代替基质与标准浓度溶液比较)分别在85.8%~106%范围内,相对基质效应2(尿样加标与加标代替基质比较)分别在85.1%~103%范围内(表6)。表6目标分析物的基质效应基质效应1%,样品中化合物峰面积/吸附基质中化合物峰面积。基质效应2%,吸附基质中化合物峰面积/纯溶液中化合物峰面积。实施例5筛查和临床标本验证应用试剂盒对109份新生儿尿样标本进行检测。各组人群中neo/cre、bio/cre、bio%、(bio+pt)/cre、(bio+pt)%以及iso/cre值见表6及图3。根据现有的诊断标准,计算bio%:bio/(neo+bio)×100%,当bio%<10%时为疑似bh4缺乏症患者,如图3及表6所示,健康对照组中,有一例(no.44)的bio%为9.21%,低于10%,另有一例(no.3)的bio%为10.24%,接近临界值。仅计算bio%值会得到假阳性的结果。计算(bio+pt)%:(bio+pt)/(neo+bio+pt)×100%代替现有的bio%,上述两例的(bio+pt)%值分别为16.88%(no.44)和29.38%(no.3),避免了假阳性的判断。因此,采用(bio+pt)%<10%作为判断标准代替现有的bio%<10%标准,可以降低由于bio在体内或运输贮存过程中降解导致的假阳性率。同时,根据各标志物的相对含量(表7)计算对应的回归方程式(式1-6)中,计算出概率,概率值及分布见图4。采用的截点值为0.5,即概率大于0.5则认为是阳性结果。模型i和模型ii在区分健康对照组和bh4缺乏症组时,其正确诊断率均为100%,组合标志物的auc均为1;模型iii在区分健康对照组和pku组时,其正确诊断率分别为95.7%(45/47)、93.9%(46/49),组合标志物的auc为0.997;模型iv在区分健康对照组和pku组时,其正确诊断率分别为97.9%(46/47)、95.9%(47/49),组合标志物的auc为0.998;模型v和模型vi在区分pku组和bh4组时,其正确诊断率均为100%,组合标志物的auc均为1。表7临床标本检测结果以上所述仅为本发明的较佳实施例而已,并非用以限定本发明的实质技术内容范围,本发明的实质技术内容是广义地定义于申请的权利要求范围中,任何他人完成的技术实体或方法,若是与申请的权利要求范围所定义的完全相同,也或是一种等效的变更,均将被视为涵盖于该权利要求范围之中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1