可同时检测土壤多种植物激素的方法与流程
本发明涉及土壤检测技术领域,具体涉及一种可同时检测土壤多种植物激素的方法。
背景技术:
植物激素是植物体内自身合成的一系列痕量有机化合物,在极低的浓度条件下就能参与调控种子的休眠、萌发、生长、生殖、成熟到衰老以及外界的应激反应等植物的生理发育过程(Davies,2010)。
植物激素属于痕量有机化合物,现有方法多采用液相色谱法进行研究植物中的植物激素,李艳等(李艳等,2014)采用高效液相色谱——三重四极杆质谱法同时测定羊栖菜5个部位中10中植物激素的含量,具体方法如下:准确称取新鲜羊栖菜样品1g,冷冻、干燥、液氮冰浴研磨后,用1ml甲醇:水:甲酸(15:4:1,V、V/V/V)(含0.5% BHT)超声提取植物激素,于-20℃冰箱浸提16 h,然后在4℃、10000r/min条件下离心10 min,吸取上清液置于4ml棕色样品瓶中,用0.5ml甲醇:水:甲酸(15:4:1,V、V/V/V)(含0.5%BHT)再提取两次,合并上清液,于35℃下减压蒸发至干,用0.5ml甲醇:水:乙酸(90:10:0.05,V/V/V)复溶,于4℃、10000r/min条件下离心10 min,取上清液供LC-MS分析。结果表明,10种植物激素在线性范围内的相关系数为0.9989~1.0000;检出限为0.0012~4.6512ug/l;加标回收率在72.24%~91.31%之间,相对标准偏差均不高于6.59%;在羊栖菜5个部位鲜样中10种植物激素的含量范围为未检出至4041.431ng/g。本方法不足之处在于样品提取需要过夜浸提,且需要重复提取3次,提取时间长。
Xiangqing Pan等(Xiangqing Pan et al,2010)采用液相色谱串联质谱法测定天然植物中的主要植物激素。具体方法如下:(1)用液氮冰冻植物组织,并用研钵磨碎,准确称取50mg磨碎后的样品于2ml离心管;(2)加入50ul的内标;(3)加入500 ul异丙醇:水:浓盐酸(2:1:0.002,V/V/V)作为提取剂;(4)100 rpm、4℃条件下摇床震荡30 min;(5)加入1ml二氯甲烷,4℃条件下摇床震荡30 min;(6)13000 g、4℃条件下离心5 min,转移上清液;(7)上清液用氮气吹干,并用甲醇复溶;(8)复溶的上清液保存在-20℃待测。结果表明:植物激素在线性范围内的相关系数均大于0.9;检出限为0.001~10 pg/g;回收率在85%~98%之间;在拟南芥中18种植物激素的含量范围为未检出至500ng/g。本方法不足之处在于采用同位素内标法进行定量,实验成本高,而且计算过程复杂。
近年来,大量的研究发现,从土壤中分离培养的微生物能够分泌多种植物激素,如生长素、赤霉素、细胞分裂素等,并认为分泌植物激素是微生物影响植物生长发育的重要机制(张国辉等,2011)。然而,由于能人工培养的微生物只占土壤微生物的很少一部分,且培养所用的条件与土壤中的实际环境相差甚远,因此,微生物作为一个整体能够产生哪些植物激素,在土壤中的含量分别是多少等基础科学问题尚不清楚,严重阻碍了相关领域的发展。
鉴于建立同时检测土壤中多种植物激素的分析方法是研究土壤植物互作机理和评价土壤生物肥力的基础;因此,迫切需要建立一种灵敏度高、能同时检测土壤中多种植物激素的方法。
目前的检测方法检出限相对较高,而且目前的方法所能检测的植物激素种类少,对于多种植物激素的测定费用高。
技术实现要素:
本发明要解决的技术问题是提供一种可同时检测土壤多种植物激素的方法。以克服现有检测土壤植物激素成本高、种类少和检测限低的不足。
为解决上述技术问题,本发明采用如下技术思路:
为尽量多的提取土壤中微生物分泌的植物激素,选择可提取多种植物激素的含异丙醇、水和甲酸的联合提取剂高效地提取土壤中的植物激素,结合超高效液相色谱串联质谱法可同时检测多种样品,在优化的液相色谱和质谱的条件下对土壤中多种植物激素进行检测,得到一种可同时检测多种植物激素、检出限高、检测范围大的检测方法。
具体技术路线如下:
设计一种可同时检测土壤多种植物激素的方法,包括以下步骤:
(1)取土壤样品加入含异丙醇、水和甲酸的提取剂进行预处理,得到植物激素提取液;
(2)将步骤(1)所述提取液浓缩至干,复溶后过滤获得植物激素待测液;
(3)将步骤(2)所述待测液通过超高效液相色谱串联质谱法进行检测,所述色谱检测条件为:
色谱柱:ACQUIT UPLC ®HSS T3 1.8um 2.1 ×150mm;流动相A:含0.1%甲酸的0.3mmol/L甲酸铵溶液,流动相B:乙腈,含0.1%甲酸的0.3mmol/L甲酸铵溶液;
所述质谱检测条件为:
离子源:电喷雾离子源;扫描方式:正/负离子扫描;检测方式:多反应监测。
优选的,在所述步骤(1)中,所述提取剂中异丙醇、水和甲酸的体积比为70~90:10~20:1~5。
进一步的,在所述步骤(1)中,所述提取剂中异丙醇、水和甲酸的体积比为75~85:15~20:1~3。
进一步的,在所述步骤(1)中,所述提取剂中异丙醇、水和甲酸的体积比为80:19:1。
优选的,在所述步骤(1)中,所述土壤样品与提取剂的质量体积比为10:1。
优选的,在所述步骤(2)中,所述复溶的溶剂为甲醇。
优选的,在所述步骤(2)中,所述过滤的滤膜孔径为0.22um。
优选的,在所述步骤(3)中,所述色谱检测条件为:
进样体积为5ul;柱温为30℃;梯度洗脱程序为:0~2min,90%A;2~4min,90%~80%A;4~6min,80%~60%A;6~8min,60%~50%A;8~10min,50%~40%A;10~11min,40%~30%A;11~12min,30%~20%A;12~14min,20%~15%A;14~18min,15%~90%A;18~20min,90%A。
优选的,所述步骤(3)中所述质谱检测条件为:
干燥气温度35℃;流速:0.3ml/min;雾化气压为:0.5torr;毛细管电压:4500V;碰撞电压和MRM参数如下表1所示。
与现有技术相比,本发明的有益技术效果在于:
1. 本发明可同时检测土壤中20种植物激素,包括脱落酸(ABA)、赤霉素(GA3)、茉莉酸(JA)、3-吲哚乙酸(IAA)、反式玉米素(tZ)、玉米素核苷(tZR)、异戊烯基腺嘌呤(IPR)、3-吲哚丁酸(IBA)、N6-异戊烯基腺嘌呤(IP)、脱氧独脚金内酯(2′-SL)、独角金内酯(SL)、顺式玉米素(cZ)、二氢玉米素核苷(DZR)、3-吲哚丙酸(IPA)、3-吲哚乙酸甲酯(MeIAA)、水杨酸(SA)、二氢玉米素(DZ)、吲哚-3-羧酸(ICA)、茉莉酸甲酯(MeJA)、油菜素内酯(BL)。
2. 本发明的方法回收率高,ABA的回收率为77%~117%,IP的回收率为95%~108%,2′-SL的回收率为81%~88%,SL的回收率为80%~88%,cZ的回收率为87%~101%,DZR的回收率为83%~93%,IPA的回收率为99%~109%,MeIAA的回收率为70%~105%,SA的回收率为91%~110%,DZ的回收率为73%~75%,GA3的回收率为88%~116%,ICA的回收率为94%~110%,MeJA的回收率为71%~94%,BR的回收率为88%~98%,JA的回收率为78%~114%,IAA的回收率为92%~105%,tZ的回收率为73%~96%,tZR的回收率为92%~113%,IPR的回收率为91%~113%,IBA的回收率为77%~91%。
3. 本发明的方法灵敏度高,能测出极微的量。
4. 本发明在保证高回收率的同时不需要过夜浸提、不需要过纯化柱,简化植物激素提取步骤,缩短植物激素提取时间,测定周期短,以免加入激素的浓度改变。
5. 本发明的方法采用外标法进行定量,方法简便,测量精确,计算相对简单,费用低,大大节约实验成本,提高检测效率。
附图说明
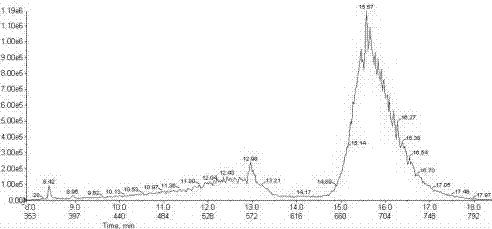
图1为20种植物激素混合标准液在正离子扫描模式下总离子流图;
图2为20种植物激素混合标准液在负离子扫描模式下总离子流图;
图3为ABA(1)、GA3(2)、JA(3)、IAA(4)的色谱图;
图4为tZ(1)、tZR(2)、IPR(3)、IBA(4)的色谱图;
图5为IP(1)、2′-SL(2)、SL(3)、cZ(4)的色谱图;
图6为DZR(1)、IPA(2)、MeIAA(3)、SA(4)的色谱图;
图7为DZ(1)、ICA(2)、MeJA(3)、BL(4)的色谱图。
具体实施方式
下面结合附图和实施例来说明本发明的具体实施方式,但以下实施例只是用来详细说明本发明,并不以任何方式限制本发明的范围。
在以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂如无特别说明,均为市售常规试剂;所涉及的实验方法,如无特别说明,均为常规方法。
实施例一:检测方案设计
(1)采集中国科学院植物研究所玉米根际土壤,对土壤样品进行预处理,得到植物激素提取液;
(2)将植物激素提取液用真空离心浓缩仪浓缩至干,用甲醇复溶后过0.22um滤膜获得植物激素待测液;
(3)将植物激素通过优化的超高效液相色谱串联质谱法进行待测植物激素的检测。
实施例二:标准曲线、线性范围、检出限和定量限的测定
一、标准储配液的配制:
1. 准确称取20种目标植物激素标准品各1.5mg于2ml离心管中,用1ml甲醇溶解,于-20℃保存;
2. 准确移取20种单标储配液10ul至不同的5ml离心管,用50%甲醇(含0.1%甲酸)稀释成4000ppb单标储配液,移取浓度为4000ppb的单标100ul到同一个5ml离心管,配制成浓度为200ppb的混合标液a;
3. 准确移取混合标样a 60ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成120ppb的混合标液b;
4. 准确移取混合标样a 500ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成100ppb的混合标液c;
5. 准确移取混合标样c 120ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成60ppb的混合标液d;
6. 准确移取混合标样a 125ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成40ppb的混合标液e;
7. 准确移取混合标样a 20ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成20ppb的混合标液f;
8. 准确移取混合标样a 20ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成10ppb的混合标液g;
9. 准确移取混合标样a 10ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成5ppb的混合标液h;
10. 准确移取混合标样a 10ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成1ppb的混合标液i;
11. 准确移取混合标样i 100ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成0.5ppb的混合标液j;
12. 准确移取混合标样i 40ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成0.2ppb的混合标液k;
13. 准确移取混合标样i 20ul到2ml离心管,用50%甲醇(含0.1%甲酸)稀释成0.1ppb的混合标液l。
二、实验步骤
利用超高效液相色谱串联质谱法测定各个混合标样中20种植物激素的含量,具体条件如下:
1. 色谱条件
色谱柱:ACQUIT UPLC ®HSS T3 1.8um 2.1 ×150mm;流动相A:0.3mmol/L甲酸铵水溶液(含0.1%甲酸),流动相B:乙腈,含0.3mmol/L甲酸铵水溶液(含0.1%甲酸);进样体积为5ul;柱温为30℃;梯度洗脱程序为:0~2min,90%A;2~4min,90%~80%A;4~6min,80%~60%A;6~8min,60%~50%A;8~10min,50%~40%A;10~11min,40%~30%A;11~12min,30%~20%A;12~14min,20%~15%A;14~18min,15%~90%A;18~20min,90%A。
2. 质谱条件
离子源:电喷雾离子源;扫描方式:正/负离子扫描;检测方式:多反应监测(MRM);干燥气温度:35℃,流速:300ul/min;雾化气压为:0.5torr;毛细管电压:4500eV;碰撞电压和MRM参数如表1所示。
表1 20种目标植物激素UPLC-MS/MS分析参数
*表示负离子模式扫描,其余为正离子模式扫描。
3. 具体的仪器操作参照安捷伦1290液相色谱仪和AB5500质谱仪的操作手册。
三、实验结果
按照上述方法对混合标准液进行测定,20种植物激素的标准曲线的线性范围、线性方程、相关系数、检测限和定量限见表2。
表2 20种植物激素的检测限、定量限和标准曲线的线性关系
*表示负离子模式扫描,其余为正离子模式扫描。
由表2可以看出,利用该方法可以检测出20种植物激素,检测限低,线性关系良好(相关系数大于0.99)。
20种植物激素的总离子流图如图1、图2所示,色谱图如图3~图7所示。20种植物激素在分析检测中能得到明显分离,说明这20种植物激素通过正离子和负离子扫描模式能够同时得到有效检测。
实施例二:验证添加回收率检测实验
一、实验步骤
1. 将采集回的土壤,保存于-20℃冰箱保存;
2. 准确称取0.5g土壤样品于50ml离心管,分别设置未加标、加低标、加中标、加高标四种处理,每种处理5个重复;
3. 将植物激素混合标准溶液加入土壤样品中得到低、中、高三种不同浓度的加标土壤样品;
4. 加入5ml异丙醇:水:甲酸(80:19:1,V/V/V)提取剂,涡旋震荡30s;
5. 常温、100W条件下超声30min,加入1ml二氯甲烷,继续在常温、100W条件下超声30min;
6. 在转速为9000rpm、温度为4℃的条件下离心10min,上清液转移至15ml离心管;
7. 常温下真空离心浓缩至干,加入300ul甲醇进行复溶,复溶液经过0.22um针头滤器过滤得到待测液;
8. 将待测液按照实施例二中的色谱条件、质谱条件以及操作步骤用超高效液相色谱串联质谱法对20种植物激素含量进行测定。
二、实验结果
测定结果如表3所示:
表3 20种植物激素在土壤中的回收率
。
结果显示:向土壤样品中添加低中高三种不同浓度的混合标样,ABA的回收率为77%~117%,IP的回收率为95%~108%,2′-SL的回收率为81%~88%,SL的回收率为80%~88%,cZ的回收率为87%~101%,DZR的回收率为83%~93%,IPA的回收率为99%~109%,MeIAA的回收率为70%~105%,SA的回收率为91%~110%,DZ的回收率为73%~75%,GA3的回收率为88%~116%,ICA的回收率为94%~110%,MeJA的回收率为71%~94%,BR的回收率为88%~98%,JA的回收率为78%~114%,IAA的回收率为92%~105%,tZ的回收率为73%~96%,tZR的回收率为92%~113%,IPR的回收率为91%~113%,IBA的回收率为77%~91%。相对标准偏差(RSD)在1%~8%之间,满足土壤样品中药物含量检测的技术要求。
上面结合附图和实施例对本发明作了详细的说明,但是,所属技术领域的技术人员能够理解,在不脱离本发明宗旨的前提下,还可以对上述实施例中的各个具体参数进行变更,形成多个具体的实施例,均为本发明的常见变化范围,在此不再一一详述。
- 还没有人留言评论。精彩留言会获得点赞!