一种重组胱抑素C蛋白及其在检测试剂盒中的应用的制作方法
本发明属于医学免疫体外诊断领域,尤其是一种重组胱抑素c蛋白及其在检测血清中胱抑素c(cysc)含量的检测试剂盒中的应用。
背景技术:
胱抑素c是一种带正电荷的碱性分泌蛋白,分子量为13kd,广泛存在于各种体液中,如精液、唾液、尿液等,无组织特异性。胱抑素c能自由从肾小球滤过,在近曲小管被重新吸收后,被上皮细胞完全代谢分解,不重新回到血液中,因此肾脏是循环中清除cysc的唯一器官,肾小球滤过率(gfr)决定血清中cysc浓度。cysc的生成不受年龄、性别、体重、炎症等因素的影响,是迄今反映gfr变化的理想内源性标志物。目前研究显示干扰cysc测定的物质比较少,使得其测定结果具有很高的可靠性和真实性。因为gfr是反映肾功能的最重要指标,所以近些年cysc凭借敏感性好、特异性高的优势,发展成为评估肾功能的一个重要指标。现在许多文献资料相继报道,胱抑素c(cysc)还广泛应用于心血管系统、内分泌系统、泌尿外科、神经系统等的检测中,具有重要的临床意义。
当前有多种途径可以获取cysc蛋白,其中利用基因工程途径主要有原核和真核表达方法。但是真核表达存在成本比较高,制备工序比较复杂的劣势,导致其不适合用于cysc的大批量制备。而原核表达相对而言,却比较简单。考虑到cysc蛋白是非糖基化蛋白,对翻译后修饰的要求不高,且作为免疫原,对生物活性要求也不高。所以采用原核表达策略是完全可行的。大肠杆菌的遗传背景清楚,培养方法简单,生长周期短,成本低,使得其是表达蛋白质的理想工具,但也存在天然编码序列不易克隆的操作困难。本发明根据大肠杆菌同义密码子偏好性,对天然编码序列进行优化,在不影响重组cysc蛋白正确性的前提下,成功提高表达产量,也为本发明的抗体制备及产业化应用打下了基础。
目前临床对cysc的检测方法主要有酶联免疫吸附测定法、化学发光法、免疫比浊法,这些方法都是基于免疫学,利用抗原抗体的特异性结合,定量检测血清中cysc含量。前两种方法由于费用高或操作繁琐、周期长等劣势,阻碍了其在临床上广泛使用,而随着全自动生化分析仪的普及,生化比浊法具备反应时间短,精密度好,易于自动化等优点,成为临床上主流检测方法。免疫比浊法由于缺乏级联放大效应,使得灵敏度较低,但是本发明采用胶乳增强免疫比浊法,借助包被了兔多抗的“胶乳”介质,显著增大抗原抗体反应物的粒径,提高了检测灵敏度和精密度。
技术实现要素:
本发明提供了一种重组胱抑素c蛋白(以下简称rhcysc),其氨基酸序列如seqidno:1所示。
本发明提供了编码上述所述rhcysc的基因,其碱基序列如seqidno:2所示。该序列是专为大肠杆菌表达系统进行密码子优化得到的序列,能够显著提高异源基因在宿主菌中的表达效率。
本发明还提供了包含了上述所述编码rhcysc的基因的载体,所述的载体优选为原核表达载体pet21b、pet28a、ptwin1,特别优选为ptwin1作为rhcysc高效可溶表达的载体。
本发明还提供了包含有上述所述载体的大肠杆菌宿主菌株,优选地,所述宿主菌株选自大肠杆菌bl21(de3)或bl21(ai)菌株,特别优选为bl21(de3)作为rhcysc高效可溶表达的宿主菌株。
本发明还提供了rhcysc在大肠杆菌中高效可溶表达方法,包括如下步骤:
1.挑取一个含有上述所述的重组大肠杆菌单菌落,接入lb培养液,于37℃培养过夜;
2.取10ml过夜培养物接入lb培养液中,于37℃震荡培养至对数中期(od600=0.8~1.0);
3.在培养物中加入iptg至0.5mmol/l,于15℃诱导表达20h,7000rpm,4℃,15min离心收集含有rhcysc酶的大肠杆菌菌体沉淀。
所述lb培养液中均含氨苄青霉素50-100μg/ml。
本发明还提供了rhcysc的纯化方法,包括如下步骤:
1.将收集得到的含有诱导rhcysc大肠杆菌菌体沉淀,用预冷的结合缓冲液buffera重悬,并于4℃高速离心处理。
2.吸去上清,每克菌体加入结合缓冲液buffera3-10ml,搅动,使菌体悬起。
3.将收集到的rhcysc菌体沉淀使用150ml结合缓冲液buffera彻底重悬均匀。冰水混合物中预冷10min后,进行超声波裂解破碎,破碎条件为:50%功率(200w)、工作3s间隔4s共30min。超声破碎结束后,12000rpm,4℃,15min,收集超声上清,使用0.22μm滤膜过滤后备用。
5.几丁质珠亲和层析,将上述超声上清进行上样,待样品上完以后,使用结合缓冲液buffera冲洗柱子,然后使用洗脱缓冲液bufferb冲洗。此时将层析柱从纯化仪上取出放入37℃培养箱孵育20h进行裂解融合蛋白,然后重新使用洗脱缓冲液进行洗脱目的蛋白,收集洗脱峰。合并各收集峰中样品并以0.22μm滤膜过滤备用。
6.进一步使用截留分子量为3kda的超滤浓缩管浓缩换液,最终得到纯rhcysc样品。
优选的,所述几丁质珠亲和层析,结合缓冲液buffera:20mmtris,500mmnacl,1mmedta,ph8.5;洗脱缓冲液bufferb:20mmtris,500mmnacl,1mmedta,ph6.5,0.22μm滤膜过滤备用。
本发明还提供了由上述rhcysc作为免疫原制备的兔抗人cysc多克隆抗体。
本发明还提供了由上述兔抗人cysc多克隆抗体制备的胶乳增强免疫比浊检测试剂盒。
本发明的一种胱抑素c免疫胶乳增强比浊检测试剂盒,包含r1试剂、r2试剂和标准品,所述r1试剂包括:缓冲液1、稳定剂、增凝剂、保护剂、防腐剂、螯合剂;所述r2试剂包括:缓冲液2、防腐剂、稳定剂、保护剂;所述标准品包括:缓冲液3、保护剂、稳定剂。
优选的,所述r1试剂中:缓冲液为0.02m-0.05m、ph7.0-7.4的磷酸盐缓冲液;稳定剂为40g/l-100g/l的nacl或kcl;增凝剂为10-20g/l的peg,保护剂为20g/l-40g/l的bsa,防腐剂为0.1-0.3g/l的proclin300,螯合剂为0.1g/l-0.8g/l的edta。
优选的,所述r2试剂中:缓冲液为0.02m-0.05m、ph7.0-7.4的磷酸盐缓冲液;防腐剂为0.1-0.3g/l的proclin300;稳定剂为10g/l-20g/l的nacl或kcl,和50-100g/l的蔗糖或葡萄糖,保护剂为20g/l-40g/l的bsa;另外有标记有胱抑素c抗体的胶乳微球(质量浓度为0.2%)。
优选的,所述标准品包括6支不同浓度的胱抑素c重组蛋白的溶液,其中:缓冲液为0.02m-0.05m、ph7.0-7.4的磷酸盐缓冲液;保护剂为1g/l-10g/l的bsa,稳定剂9-13g/l的nacl。
优选的,标记有胱抑素c抗体的胶乳微球制备方法包括如下步骤:
将兔抗人胱抑素c多克隆抗体用mes缓冲液将抗体稀释至2mg/ml,制备成抗体稀释液;用mes缓冲液将胶乳微球(聚苯乙烯胶乳,购自日本jsr公司,粒径100-400nm)稀释至1%(质量浓度),再加入0.5%-2%(质量浓度)的edc,在30℃下搅拌反应30min,反应结束后通过离心去除未反应的edc,然后加入兔抗人胱抑素c多克隆抗体稀释液,在30℃下搅拌反应60min,反应结束后通过离心去除未反应的抗体,再加入终止反应液终止反应即得。
本发明采用大肠杆菌作为表达系统制备重组胱抑素c蛋白,该方法具有周期短、表达量大、成本低的特点,且通过该方法制备出的胱抑素c蛋白可以作为一种有效的免疫原,用于兔多抗的制备,将该种多抗用于胶乳增强免疫比浊检测试剂盒的制备中,能够准确检测出血清中cysc含量,与市售产品相比,具有更好的重复性和更高的准确度,显现出较好的临床应用前景。
附图说明
图1为rhcysc基因pcr产物的琼脂糖凝胶电泳图。
其中,泳道1为500bpdnaladder;泳道2为两端含有ncoi和bamhi酶切位点的rhcysc基因pcr产物。
图2为rhcysc构建到表达质粒ptwin1过程图;
图3为rhcysc诱导前后sds-page凝胶电泳鉴定图。
其中,泳道1为克隆1未加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;泳道2为克隆2未加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;泳道3为克隆3未加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;泳道4为克隆4未加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;泳道5为(10-230kda)宽范围的预染的蛋白上样marker;泳道6为克隆1加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;泳道7为克隆2加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;泳道8为克隆3加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;泳道9为克隆4加入iptg诱导表达的rhcysc重组大肠杆菌bl21(de3)裂解液;图中箭头所指即为cbd-rhcysc融合蛋白。
图4为几丁质珠亲和纯化重组rhcysc细菌裂解液的sds-page凝胶电泳图。泳道1为(10-230kda)宽范围的预染的蛋白上样marker;泳道2-3为37℃培养箱孵育20h进行后,洗脱缓冲液bufferb洗脱收集不同收集管中rhcysc蛋白,图中箭头所指即为纯化后rhcysc蛋白。
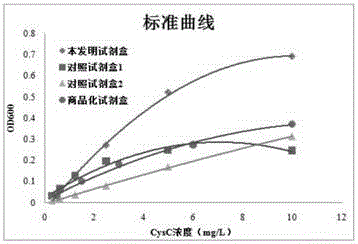
图5为兔抗人cysc多克隆抗体鉴定的sds-page凝胶电泳图。泳道m为蛋白marker,泳道1为兔多抗cysc多克隆抗体。图6试剂盒的标准曲线绘制图
图7比对试验性能评价结果
具体实施方式
下面通过实施例进一步详细描述本发明,但本发明不局限于这些实施例。
实施例1rhcysc蛋白的制备
1、rhcysc基因的表达载体构建
发明人根据ncbi已公开的hcysc的cdna序列(genbank登录号:nm_000099.3),对该基因进行密码子优化后得到本发明的rhcysc基因,如seqidno:2所示。
将优化后的rhcysc全基因在5’端引入ncoi酶切位点序列,在3’端引入bamhi酶切位点序列,并进行全基因合成,将合成的基因片段,构建到puc57质粒(由南京金斯瑞科技有限公司提供)中,得到一种长期保存质粒,记为puc57-rhcysc质粒。以puc57-rhcysc质粒为模板,进行pcr扩增,所用引物序列如下:
上游引物:
m13f:cgccagggttttcccagtcacgac
下游引物:
m13r:agcggataacaatttcacacagga
反应总体积50μl,其中浓度为10μmol/l引物各加2.5μl,浓度为10mmol/l的dntp加1μl,所用dna聚合酶为q5(#m0491l,购自newenglandbiolabs公司),2u/μl,加0.5μl。反应条件为98℃30秒预变性,热循环30次(98℃10秒、55℃15秒、72℃30秒),72℃延伸2分钟,4℃保存,产物经1.0%琼脂糖凝胶电泳分析,结果显示产物大小与预期大小(380bp)一致(结果如图1所示)。
将得到的基因产物用通用型dna纯化回收试剂盒(dp214-02,购自北京天根生化科技有限公司)纯化。纯化后,用ncoi(#r0193s,购自newenglandbiolabs公司)和bamhi(#r0136s,购自newenglandbiolabs公司)双酶切,用t4连接酶(#m0202s,购自newenglandbiolabs公司)连接到ptwin1质粒(n6951s,购自newenglandbiolabs公司)载体中,转化到top10感受态细胞(cb104-02,购自北京天根生化科技有限公司)中,在含有100μg/ml的氨苄青霉素(0339,购自amresco公司)的lb平板中37℃培养过夜。第二天筛选阳性克隆菌测序,比对,与预期序列完全一致,即得到rhcysc一种形式的表达载体,记为ptwin1-rhcysc(质粒构建流程如图2所示)。
2、rhcysc在重组大肠杆菌中的表达和鉴定
具体步骤如下:
1、配制表达和鉴定用lb培养基(0.5%酵母粉,1%蛋白胨,1%氯化钠),将步骤1中测序比对正确的ptwin1-rhcysc质粒转化到大肠杆菌bl21(de3)感受态细胞中(cb105-02,购自北京天根生化科技有限公司)中,37℃氨苄青霉素平板中过夜培养。
2、第二天挑1-4个含有ptwin1-rhcysc质粒的重组单菌落,接入含有100μg/ml的氨苄青霉素的lb培养液,37℃培养过夜。
3、将过夜培养物接入10ml含100μg/ml的氨苄青霉素的lb培养液中,37℃振荡培养。
4、接种后每隔1小时测菌液od600值,待od600≈1.0时,用1mmol/l的iptg(0487,购自amresco公司)进行诱导表达。同时以未加入iptg的大肠杆菌培养液做阴性对照。
5、37℃诱导表达4h后收集菌液,取1ml菌液,12000rpm高速离心3min,用预冷的pbs清洗沉淀,加入5×sds凝胶上样缓冲液,100℃加热5min,12000rpm高速离心1min,取上清。未加入iptg的大肠杆菌培养液也按此步骤处理。
6、各取5μl未加入iptg和加入iptg诱导的培养物悬液,10%sds-page凝胶电泳分析。
7、8-15v/cm电泳,至溴酚蓝迁移到分离胶底部。
8、考马斯亮蓝染色,观察表达产物条带,见图3。
3、rhcysc扩大培养
具体步骤如下:
1、配制扩大培养用lb培养基(0.5%酵母粉,1%蛋白胨,1%氯化钠),称取2l量的上述三种成分倒入2l烧杯中,随后加入1.5l量的去离子水,搅拌至成分充分溶解,并将上述培养基定溶至2l。
2、将步骤1中的2l培养基分装至2l的无挡板锥形瓶中,每瓶1l,121℃,灭菌处理20min,冷却后备用。
3、rhcysc一级种子液制备:从-80℃冰箱中取出一管ptwin1-rhcysc甘油管,溶化后使用接种针沾取少量的菌液在lb固体培养基(lb液体培养基+2%琼脂粉,121℃,灭菌处理20min,冷却至50-60℃加入终浓度为100μg/ml的氨苄青霉素,混匀后倒入无菌培养皿中,凝固后备用)上使用三区划线法进行活化,接种完毕后于37℃培养箱培养12-16h。
4、从上述步骤3中的培养皿中挑取一个大小适中的rhcysc单菌落接种于100接种于挑取的氨苄青霉素10ml无菌lb培养基,37℃220rpm培养12-15h,即可得到一级种子液。
5、rhcysc重组菌株扩大培养:将上述步骤4中的rhcysc一级种子液分别转接到已灭菌备用的100μg/ml的氨苄青霉素lb培养基中,接种量为1%,37℃220rpm培养。
6、rhcysc重组菌株诱导表达:将上述步骤5中rhcysc的培养物,培养3h后,在超净工作台中取出3ml测定od600吸收值,当od600=0.8-1.0之间时将摇床降低温度至15℃,同时取出菌体使用冰水混合物降温10min,然后加入0.5mmiptg,15℃,220rpm培养20h。
7、rhcysc重组菌体的收集和洗涤:使用高速冷冻离心机将上述步骤6中rhcysc培养物7000rpm,4℃,15min进行离心。离心结束后丢弃上清,获得菌体沉淀使用200ml1×pbs缓冲液进行重悬至均匀,然后重复上述离心步骤收集菌体。
4、rhcysc纯化和制备
具体步骤如下:
1、缓冲液配制:
结合缓冲液:20mmtris,500mm氯化钠,1mmedta,ph8.5;
洗脱缓冲液:20mmtris,500mm氯化钠,1mmedta,ph6.5。
2、将扩大培养后收集的rhcysc菌体沉淀使用150ml结合缓冲液彻底重悬均匀。冰水混合物中预冷10min后,进行超声波裂解破碎,破碎条件为:50%功率(200w)、工作3s间隔4s共30min。超声破碎结束后,12000rpm,42,15min,收集超声上清,使用0.22μm滤膜过滤后备用。
3、将几丁质珠(#s6651l,购自newenglandbiolabs公司)装入xk26空柱子中,接入到aktaupc900纯化仪上,结合缓冲液流速为2ml/min,进行平衡柱子,
4、将上述步骤2中的超声上清进行上样,流速为1ml/min,待样品上完以后,使用结合缓冲液冲洗柱子,流速为2ml/min,然后使用洗脱缓冲液冲洗柱床3-5个柱体积,流速为5ml/min。此时将层析柱从aktaupc900纯化仪上取出放入37℃培养箱孵育20h进行裂解融合蛋白,然后重新接入到akta上使用洗脱缓冲液进行洗脱目的蛋白,收集洗脱峰。
5、上述将步骤4中洗脱收集样品使用sds-page凝胶电泳凝胶进行检测,根据imagelab灰度分析软件估算纯度为95%,具体如图4。
6、最后将上述步骤5中检测纯度较好的样品使用截留分子量为3kda的超滤浓缩管进行浓缩,最终得到纯度达到要求的rhcysc样品。
实施例2兔多抗的制备
1、免疫前3天,于耳缘静脉采血留作阴性对照(500ul/只,于37℃静置l小时,10000rpm离心15分钟,吸取血清置于-20℃保存);
2、3天后将rhcysc(1mg/只兔子)与完全弗氏佐剂等体积充分混匀,形成“油包水”形态,于家兔脊柱两旁多点皮下注射;
3、2周后进行第二次免疫:将rhcysc(1mg/只兔子)与不完全弗氏佐剂等体积充分混匀,形成“油包水”形态,注射部位脊柱两旁皮下(注射部位应区别于第一次);该次免疫一周后于耳缘静脉采血(血液处理方式同步骤1);
4、2周后进行第三次免疫:将rhcysc(1mg/只兔子)与不完全弗氏佐剂等体积充分混匀,形成“油包水”形态,注射部位脊柱两旁皮下(注射部位应区别于第二次);该次免疫一周后于耳缘静脉采血(血液处理方式同步骤1);
5、2周后进行第四次免疫,将rhcysc(1mg/只兔子)与不完全弗氏佐剂等体积充分混匀,形成“油包水”形态,注射部位脊柱两旁皮下(注射部位应区别于第三次);该次免疫一周后于耳缘静脉采血(血液处理方式同步骤1);
6、待免疫兔血清的效价符合要求时,采用颈动脉采血方式进行血清的收集,血液处理方式同步骤1。
7、抗体纯化:①将免疫兔血清与饱和硫酸铵等体积混匀,4℃静置1h后,离心(8000g,15min,4℃)弃去上清,用0.2m磷酸氢二钠重悬沉淀,将重悬液用0.22μm的滤器过滤,即为血清预处理物,于4℃备用;②用0.2m磷酸氢二钠平衡proteina纯化柱,再将血清预处理物上柱进行纯化,最后用70%柠檬酸洗脱,收集洗脱液;③将洗脱液于0.02m磷酸盐缓冲液中透析24h;④将纯化的抗体进行纯度和特异性的鉴定。
8、抗体鉴定:①采用sds-page进行抗体纯度的鉴定,具体方法参照《中国药典》,结果显示抗体纯度达到90%以上(图5);②:采用双抗体夹心elisa法进行抗体灵敏度的鉴定(表1),具体操作:以兔多抗人胱抑素c多克隆抗体为捕获抗体(浓度:4μg/ml),hrp标记的兔多抗人胱抑素多克隆c抗体为检测抗体(浓度:1μg/ml),检测灵敏度达到39.1ng/ml。
表1兔抗人胱抑素c抗体的灵敏度评价结果
实施例3检测试剂盒的制备及使用方法
本发明的检测试剂盒是液体双试剂,其中包括试剂r1、试剂r2和校准品,具体见下:
1、试剂r1:在缓冲液1中加入稳定剂(例如:nacl)、增凝剂(例如:peg6000)、保护剂(例如:bsa)、防腐剂(例如:proclin300)、螯合剂(例如:edta),搅拌混匀,即为r1试剂。
2、r2试剂:将兔抗人胱抑素c多克隆抗体用mes缓冲液将抗体稀释至2mg/ml,制备成抗体稀释液;用mes缓冲液将胶乳微球(聚苯乙烯胶乳,购自日本jsr公司,粒径100-400nm)稀释至1%(质量浓度),再加入0.5%-2%(质量浓度)的edc,在30℃下搅拌反应30min,反应结束后通过离心去除未反应的edc,然后加入兔抗人胱抑素c多克隆抗体稀释液,在30℃下搅拌反应60min,反应结束后通过离心去除未反应的抗体,再加入终止反应液终止反应,离心,最后加入由缓冲液2、防腐剂(例如:proclin300)、稳定剂(例如:nacl,蔗糖)、保护剂(例如:bsa)组成的缓冲液搅拌混匀,即为r2试剂(胶乳微球质量浓度为0.2%)。
3、校准品:cysc标准品具体制备见实施例1,将cysc标准品分别加入由缓冲液3、保护剂(例如:bsa)稳定剂(例如:nacl)、防腐剂(例如:proclin300)组成的缓冲液中,制备得到终浓度为10、5、2.5、1.25、0.625、0.3125mg/l的一组校准品。
优选地,为了提高试剂盒的准确度,制备了不同的r1、r2、校准品试剂进行回收率、线性范围的评价和比对,具体评价方法见实施例4,结果见下表2.
表2试剂盒的制备比对结果
本发明的检测试剂盒应用于全自动生化仪,但不局限于此,其中主要参数设置及检测方法如下:
检测波长:主波长600nm,副波长无;检测温度:37℃;
检测方法:取120μl试剂r1与2μl样本混匀,孵育5min后,加入30μl试剂r2,立即读取吸光度a1,孵育5min后读取吸光度a2,计算吸光度变化△a=a2-a1。使用多点非线性校准,绘制校准品的工作曲线,样品中cysc含量可根据△a=变化值在工作曲线上计算获得。
实施例4检测试剂盒的性能测试
对照试剂盒1:试剂r2中所使用的致敏抗体替换为商品化兔抗人cysc多克隆抗体,其他试剂及实验方案均同实施例3(制备例3);
对照试剂盒2:试剂r2中所使用的致敏抗体替换为商品化羊抗人cysc多克隆抗体,其他试剂及实验方案均同实施例3(制备例3);
本发明试剂盒:具体见实施例3(制备例3)制备的cysc检测试剂盒;
商品化试剂盒:购买于某知名公司的临床用cysc胶乳增强比浊试剂盒;
比对上述四种检测试剂的线性范围以及精密度和准确度等性能。
1、线性范围
采用贝克曼au480生化分析仪测定6个不同浓度的cysc标准品在600nm处的吸光度,绘制校准品的工作曲线(见图6)。结果可以看出,本发明试剂的检测范围与商品化试剂盒类似,均宽于对照试剂盒1,更加有利于高浓度的病理样本直接检测,而不需要进行样本的稀释,操作简易化。
2、精密度
重复性:用本发明试剂盒、对照试剂盒、商品化试剂盒分别检测同一份人血清样本10次,根据cysc含量计算检测试剂盒的批内cv。结果表明,本发明的检测试剂盒的重复性性能优于对照试剂盒和商品化试剂盒(见表3)。
批间差:分别用3个不同批号的本发明试剂盒、对照试剂盒测试合适浓度的人血清样本。每个批号测试3次,分别计算相对极差r。结果表明,本发明的检测试剂盒的重复性能优于对照试剂盒(见表3)。
3、准确度
添加回收:在合适浓度的人血清样本(简称:常规样本)中加入一定体积的校准品(cysc理论浓度为c理论)制作成回收样本,在常规样本中加入相同体积的去离子水制作成基础样本,其中加入的校准品量不超过总体积的1/10,每个回收样本和基础样本检测3次,测定平均浓度对应为c1和c0。根据计算公式:回收率=(c1-c0)/c理论*100%计算出各自的回收率。结果表明本发明试剂盒的平均回收率要优于对照试剂盒和商品化试剂盒,显示本发明试剂盒具有很好的特异性和准确度(见表3)。
4、相关性
分别将本发明试剂盒、对照试剂盒、商品化试剂盒对143份人血清,在贝克曼au480生化分析仪同时测定,本发明和对照试剂盒的主要参数设置见实施例3,商品化试剂盒参照说明书进行。将各自测定值与商品化试剂盒测定值进行相关性分析,结果见表3和图7,其中x轴代表商品化试剂盒测定值,y轴代表本发明试剂盒和对照试剂盒测定值。结果显示本发明试剂盒的相关性要优于对照试剂盒,再次表明了本发明试剂盒具有很好的特异性和准确度。
表3试剂盒性能评价比较结果
注:na代表未进行批间r评价
实施例5检测试剂盒的适用性
本发明试剂盒在贝克曼au5800生化分析仪上进行精密度、准确度等性能评价(具体见实施例4),结果见表4。结果显示本发明试剂盒精密度和准确度满足要求,表明本发明试剂盒也可以应用于贝克曼生化分析仪其他机型,具有较广的适用性。
表4试剂盒性能评价结果
序列表
<110>江苏众红生物工程创药研究院有限公司
<120>一种重组人胱抑素c蛋白及其在临床检测试剂盒中的应用
<130>一种重组人胱抑素c蛋白及其在临床检测试剂盒中的应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>120
<212>prt
<213>homosapiens
<400>1
serserproglylysproproargleuvalglyglyprometaspala
151015
servalgluglugluglyvalargargalaleuaspphealavalgly
202530
glutyrasnlysalaserasnaspmettyrhisserargalaleugln
354045
valvalargalaarglysglnilevalalaglyvalasntyrpheleu
505560
aspvalgluleuglyargthrthrcysthrlysthrglnproasnleu
65707580
aspasncysprophehisaspglnprohisleulysarglysalaphe
859095
cysserpheglniletyralavalprotrpglnglythrmetthrleu
100105110
serlysserthrcysglnaspala
115120
<210>2
<211>366
<212>dna
<213>homosapiens
<400>2
agctctccgggtaaaccgccgcgtctggtgggtggtccgatggatgcgagcgttgaagaa60
gaaggcgtccgtcgcgcgctggattttgccgttggtgaatacaacaaagcatcaaacgac120
atgtaccattcgcgcgcactgcaggtggttcgtgctcgcaaacaaattgtcgcgggcgtg180
aactattttctggacgtcgaactgggtcgtaccacgtgcaccaaaacgcagccgaacctg240
gataattgtccgttccatgaccaaccgcacctgaaacgcaaagccttttgcagtttccag300
atctacgcagttccgtggcaaggtaccatgacgctgagtaaatccacctgtcaggatgcc360
taatag366
- 还没有人留言评论。精彩留言会获得点赞!