一种同时检测ALV和REV抗体的试剂盒及方法与流程
本发明涉及一种同时检测alv和rev抗体的试剂盒,本发明还涉及该试剂盒的制备方法与应用,属于生物检测技术领域。
背景技术:
禽白血病(avianleukemia,al)是由禽白血病病毒(avianleukemiavirus,alv)引起的家禽肿瘤性疾病。要是淋巴细胞性白血病,其次是成红细胞性白血病、成髓细胞性白血病。此外还可引起骨髓细胞瘤、结缔组织瘤、上皮肿瘤、内皮肿瘤等。大多数肿瘤侵害造血系统,少数侵害其他组织。alv在各类鸡群都广泛性感染,包括白鸡、蛋鸡和地方黄鸡。对alv的防控措施,只有通过疾病净化,没有其它更好的捷径。alv既可以水平传播,也可以垂直传播。
鸡网状内皮组织增生病是由鸡网状内皮组织增生症病毒(rev)引起的,其急性型表现为死前嗜睡。慢性型表现为矮小综合征,生长发育停滞,羽毛生长不良,冠髯苍白。运动失调,肢体麻痹。
alv与rev属于禽免疫抑制病原,此类病原的感染呈逐年上升趋势。禽的免疫抑制病原会使鸡群对其它病毒或细菌变得更为易感,而且使其感染的症状、病变不典型。在临床上多重病毒混合感染的情况非常普遍,容易造成误诊,其鉴别诊断通常需借助实验室诊断技术,如:病毒的分离和鉴定、血清学试验、酶联免疫吸附试验以及分子生物学诊断等。传统经典的病毒分离方法操作复杂、耗时、费力。部分血清学检测方法敏感性低,特异性差,而且操作方法繁琐,一次只能检测一种病原。不利于疾病的及时诊断治疗,造成重大的经济损失。
技术实现要素:
针对上述问题,本发明的第一个目的是提供一种同时检测alv和rev抗体的试剂盒;本发明的第二个目的是提供上述试剂盒的制备方法。本发明的第三目的是提供同时检测alv和rev抗体的试剂盒的应用。
为此,本发明提供的第一个技术方案是这样的:
一种同时检测alv和rev抗体的试剂盒,包被有revenv蛋白的xmap磁珠、包被有alvp27蛋白的xmap磁珠,alv阳性血清、alv阴性血清、rev阳性血清、rev阴性血清、生物素标记的山羊抗鸡igy多克隆抗体、链霉亲和素藻红蛋白、pbs/tbn缓冲液。
本发明提供的第二个技术方案是这样的:
进一步,上述的一种同时检测alv和rev抗体的试剂盒的制备方法,所述的制备包被有alvp27蛋白的xmap磁珠依次包括下述步骤:
1)提取alv、rev病毒核酸;
2)构建重组抗原表达质粒
对步骤1)提取的病毒核酸分别进行rt-pcr扩增;扩增结束后均回收纯化pcr产物,用限制性内切酶于37℃双酶切3h;酶切产物进行电泳回收,分别与同样经双酶切后的质粒pet28a连接,转化dh5α感受态细菌,转化平板上挑取单个菌落进行pcr及酶切鉴定,阳性菌落进行测序鉴定;测序正确质粒转入感受态bl21进行诱导表达;
3)sds-page检测重组蛋白的表达
收集步骤2)诱导后的重组子,冰上冷却,12000rpm离心2min,细胞沉淀用pbs/tbn洗涤一次,再次离心收集沉淀,在沉淀中加入50μlpbs/tbn进行超声破碎后离心分上清和沉淀,沉淀用尿素溶解,将二者煮沸5min,取20ul直接用于sds-page;
4)重组蛋白亲和层析纯化
5)抗原偶联磁珠。
进一步,上述的一种同时检测alv和rev抗体的试剂盒的制备方法,步骤2)rt-pcr扩增时的反应体系:一步法pcr酶混合液2μl;2×1一步法pcr缓冲液,12.5μl;核苷酸序列seqidno:1所示的上游引物10μm,1μl;核苷酸序列如seqidno:2所示的的下游引物10μm,1μl;rna,2.5μl;或者是核苷酸序列seqidno:3所示的上游引物10μm,1μl;核苷酸序列如seqidno:4所示的的下游引物10μm,1μl;rna,2.5μl;无rna酶dh2o,upto25μl;rt-pcr扩增时的反应程序:反转录50℃,30min,预变性95℃,15min,一个循环;变性94℃,30s,退火55℃,30s,延伸72℃,50s,35个循环;再延伸72℃,10min。
进一步的,述的一种同时检测alv和rev抗体的试剂盒的制备方法,抗原偶联磁珠包括如下步骤:
1)将磁珠放置室温平衡20分钟后,涡旋、超声20s,重悬磁珠;
2)将磁珠转移到usascientificmicrocentrifuge低结合律试管中,12000rpm离心3min,沉淀磁珠,并去除上清;
3)加入100μl双蒸水涡旋、超声,重悬磁珠;12000rpm离心3min,沉淀磁珠,并去除上清;
4)加入80μlactivationbuffer(100mmph6.2磷酸二氢钠)涡旋、超声,重悬磁珠;
5)加入10μl浓度为50mg/ml的硫代琥珀酰亚胺(sulfo-nhs)以及10μl浓度为的50mg/ml的碳酰二亚胺(edc),涡旋、超声混匀;
6)避光,室温轻摇孵育20min后,12000rpm离心3min,沉淀磁珠,并去除上清;
7)加入250μl50mm的mes(ph5.0)缓冲液,涡旋、超声后,12000rpm离心3min,沉淀磁珠,并去除上清;
8)加入检测抗原和50mm的mes(ph5.0)缓冲液,使其总体积为500μl,涡旋、超声混合均匀;
9)避光,室温轻摇孵育2h后,12000rpm离心3min,沉淀磁珠,并去除上清;
10)加入500μl的pbs/tbn/tbn缓冲液(其配方为pbs+0.01%bsa+0.02%.吐温+0.05%叠氮钠),涡旋、超声,重悬磁珠后,12000rpm离心3min,沉淀磁珠,并去除上清;
11)重复步骤10)两次;
12)加入pbs/tbn/tbn缓冲液,涡旋、超声,重悬磁珠,并将偶联好的磁珠于4℃避光保存。
本发明提供的第三个技术方案是这样的:
一种同时检测alv和rev抗体的试剂盒的应用,包括下述步骤:
1)将已偶联检测抗原的磁珠涡旋、超声,悬浮磁珠,并用pbs/tbn/tbn将其稀释到工作浓度100个/μl;
2)将待检样品按比例稀释好后,每个反应孔中加入磁珠和样品各50μl;
3)避光,室温振荡孵育1h;
4)每孔加入100μl的pbs/tbn/tbn洗板3次;
5)加入100μl终浓度为4μg/μlrpe标记的小鼠荧光二抗igg;避光,室温震荡孵育30min;
6)每孔加入100μl的pbs/tbn/tbn洗板3次;
7)每孔加入100μlpbs/tbn/tbn重悬;
8)上机检测。与现有技术相比,本发明提供的技术方案具有如下技术优点:
1、我们申请提供的技术方案通过原核表达系统成功地表达了alv-p27蛋白和rev-env,该蛋白为可溶表达,将样品进行适当洗涤裂解及复性透析后,与磁珠偶联,用于液相芯片系统检测血清中的抗体。通过对临床样本的检测,发现与传统elisa检测方法结果基本一致,用xmap方法可以检测到1:6400稀释度,用elisa方法检测到1:25稀释度,xmap方法灵敏度比elisa高出256倍。检测结果显示特异性优异,与其他禽病原阳性血清无交叉反应且重复性好。在临床样品检测中检出阳性样品比elisa要高出54.54%。
2、本申请提供的技术方案建立的alv和rev-env抗体检测xmap技术,实现了对血清中的alv和rev抗体的同步快速检测,样本用量少,操作简单、快速,可大大降低检测成本。而且检测方法特异性强、敏感性高,整合其它免疫抑制病的xmap检测方法,可以实现多种不同目的病原抗体同时进行检测,适合用于spf鸡的日常监测、临床诊断和流行病学调查。目前全国养禽业在推动禽白血病净化工作,我们所建立的方法比传统elisa方法更具优势,可以应用其中。
3、本发明提供的技术方案可以同时检测alv和rev抗体,节约了检测时间,提高了工作效率。
附图说明
图1是目的基因扩增电泳图;
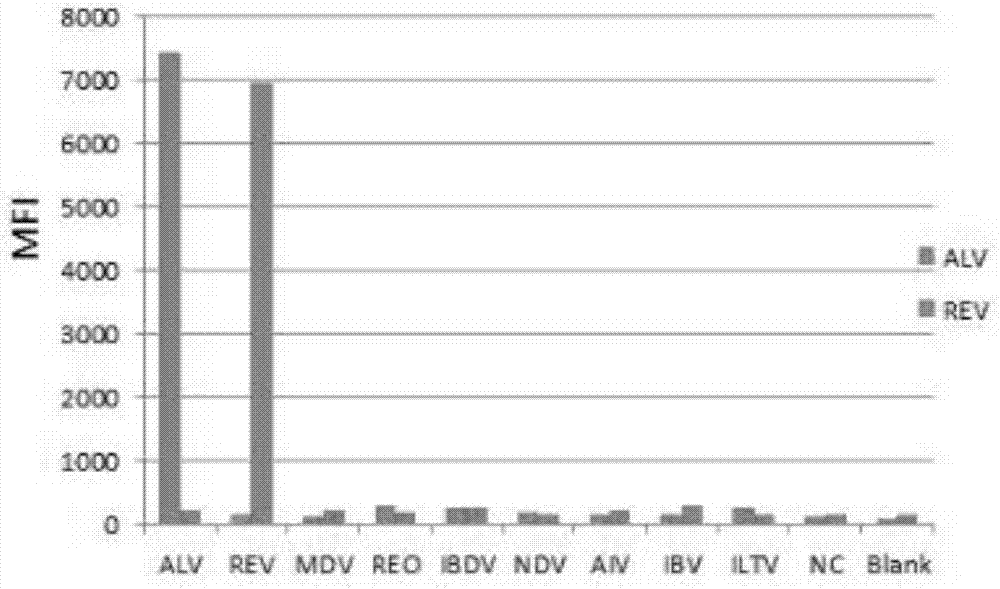
图2是xmap特异性分析图;
图3是xmap敏感性分析图。
具体实施方式
下面结合具体实施方式对本发明的权利要求做进一步的详细说明,对于本申请为详细披露的信息,均按照本领域常规技术手段进行。
实施例1
本申请用于表达alvp27蛋白和revenv蛋白的引物,两端分别添加相应的酶切位点和保护性碱基,并由生工生物工程(上海)股份有限公司广州分公司合成。引物信息见表1。
表1引物序列
实施例2本发明提供检测alv和rev抗体的方法,具体如下:
(1)重组质粒的构建
天根核酸自动抽取仪提取alv病毒核酸,操作按说明书进行。得到的rna样本进行采用takaraprimescripttmonesteprt-pcrkitver.2试剂进行rt-pcr扩增,反应体系:primescript1stepenzymemix,2μl;2×1stepbuffer,12.5μl;上游primer(10μm),1μl;下游primer(10μm),1μl;rna,2.5μl;rnasefreedh2o,upto25μl;反应程序:反转录50℃,30min,预变性95℃,15min,一个循环;变性94℃,30s,退火℃,s,延伸72℃,s,35个循环;再延伸72℃,10min。扩增产物电泳结果见图1。
pcr产物回收纯化后,用限制性内切酶于37℃双酶切30min;酶切产物进行电泳回收,分别与同样经双酶切后的质粒pet28a连接,转化dh5α感受态细菌,转化平板上挑取单个菌落进行pcr及酶切鉴定,阳性菌落进行测序鉴定。测序正确质粒转入感受态bl21进行诱导表达。
(2)重组蛋白的表达
收集诱导后的菌液,12000rpm离心20min,菌体沉淀用pbs/tbn洗涤后,超声破碎,分离上清和沉淀,沉淀用尿素溶解。各取样20μl用于sds-page电泳分析。
(3)重组蛋白的纯化
a)平衡:用5倍体积的平衡缓冲液对空柱进行平衡;
b)样品准备,吸取1mlni-ntaagarose置于样品中,4℃,振摇,结合1h。
c)装柱:小心将溶菌产物-树脂混合物加入到空柱子中,柱子底盖密闭。
d)收集流穿液:开底盖收集流出液。收集流出液用于sds-page电泳分析。
e)洗涤:用10倍体积的平衡缓冲液洗涤一次,收集洗涤液用于sds-page电泳分析。
f)洗涤:washbuffer清洗两次。收集清洗片段用于sds-page电泳分析。
g)洗脱:10倍体积elutionbuffer洗脱重组体蛋白,收集片段用于sds-page电泳分析。
h)各取20ul用于sds-page电泳分析
(4)xmap检测抗原的包被
1)将磁珠放置室温平衡20分钟后,涡旋、超声20s,重悬磁珠;
2)将磁珠转移到usascientificmicrocentrifuge低结合律试管中,12000rpm离心3min,沉淀磁珠,并去除上清;
3)加入100μl双蒸水涡旋、超声,重悬磁珠;12000rpm离心3min,沉淀磁珠,并去除上清;
4)加入80μlactivationbuffer(100mmph6.2磷酸二氢钠)涡旋、超声,重悬磁珠;
5)加入10μl浓度为50mg/ml的硫代琥珀酰亚胺(sulfo-nhs)以及10μl浓度为的50mg/ml的碳酰二亚胺(edc),涡旋、超声混匀;
6)避光,室温轻摇孵育20min后,12000rpm离心3min,沉淀磁珠,并去除上清;
7)加入250μl50mm的mes(ph5.0)缓冲液,涡旋、超声后,12000rpm离心3min,沉淀磁珠,并去除上清;
8)加入检测抗原和50mm的mes(ph5.0)缓冲液,使其总体积为500μl,涡旋、超声混合均匀;
9)避光,室温轻摇孵育2h后,12000rpm离心3min,沉淀磁珠,并去除上清;
10)加入500μl的pbs/tbn/tbn缓冲液,涡旋、超声,重悬磁珠后,12000rpm离心3min,沉淀磁珠,并去除上清;
11)重复步骤10)两次;
12)加入pbs/tbn/tbn缓冲液,涡旋、超声,重悬磁珠,并将偶联好的磁珠于4℃避光保存。
(5)xmap检测方法的建立
将包被检测抗原的磁珠稀释到工作浓度,阳性血清、阴性血清分别稀释100倍使用。rpe标记的二抗按1:500稀释使用。每个样品做2个重复取平均值,检测阈值的计算公式为:cutoff值=阴性平均值+3sd。
依照检测仪器luminex200的说明进行检测后,结果下表所示:
表2revxmap检测结果
表3alvxmap检测结果
根据cutoff值计算公式,alv的检测cutoff值约为600,rev的检测cutoff值约为500。当检测样品的mfi值大于cutoff值时,该实验数据才能进行有效分析。
待测样品的分析判断:
针对rev:1)当待测样本的mfi值>500时,判断为阳性样本;2)待测样本的mfi值≤500时,判断为阴性,需要进行重复实验或采取其他检测方法进一步验证。
针对alv:1)当待测样本的mfi值>600时,判断为阳性样本;2)待测样本的mfi值≤600时,判断为阴性,需要进行重复实验或采取其他检测方法进一步验证。
实施例3特异性分析
采用所建立的xmap检测方法对alv,rev,mdv,reo,ibdv,ndv,aiv,ibv和iltv阳性血清进行检测,设2个重复,并计算mfi平均值,并根据阈值判断检测结果。实验结果如图2所示,只有alv和rev阳性血清的mfi值较高,其他均较低,判断为阴性,说明本检测体系特异性良好。
实施例4敏感性分析
分别用单重xmap对alv和rev进行灵敏度检测,并和elisa做比对。分别将阳性高免血清按1:25;1:50;1:100…倍比稀释,spf阴性血清按1:100稀释后作为阴性对照。rep标记二抗按1:500稀释使用。每个样品设2个重复,并计算平均值。
alv、rev的xmap检测敏感性分析结果如图3所示,结果表明alv和rev的最低检测限度均为1:6400。
实施例5稳定性分析
用所建立的xmap检测方法分别对alv和rev两个不同稀释度的高免血清做重复检测,计算其变异系数,分析批内差异。对上述实验作3次重复,通过三次实验的均值计算变异系数,分析批间差异。
表4alv和rev多重xmap检测的稳定性分析
该结果表明alv和rev多重xmap检测方法的批内差和批间差均低于3%,表明所建立的方法检测性能稳定,结果可靠,具有可重复性的特点。
实施例6临床样品的检测验证
用所建立的xmap检测方法对22份临床样品进行检测,并与elisa检测方法做比对。其检测结果如表5所示。
表5
序列表
<110>广州维佰生物科技有限公司
<120>一种同时检测alv和rev抗体的试剂盒及方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>33
<212>dna
<213>禽白血病病毒(avianleukemiavirus)
<400>1
cgggatcccctgtagtgattaagacagagggac33
<210>2
<211>32
<212>dna
<213>禽白血病病毒(avianleukemiavirus)
<400>2
acgtcgacctagggctggatagcagacgacat32
<210>3
<211>24
<212>dna
<213>内皮组织增生症病毒(reticuloendothelialhyperplasia)
<400>3
caggaattcatggactgtctcacc24
<210>4
<211>24
<212>dna
<213>内皮组织增生症病毒(reticuloendothelialhyperplasia)
<400>4
agagtcgacttgacctagggtatc24
- 还没有人留言评论。精彩留言会获得点赞!