用于检测动脉硬化的血中生物标志物的制作方法
本发明涉及以血中肌球蛋白重链11水平(level)为指标来检测动脉硬化的方法。
背景技术:
由于人口的高龄化和生活习惯的改变,以冠状动脉疾病、外周动脉疾病、主动脉瘤等动脉硬化为主体的疾病正在增加。通过非侵袭(侵入)性的或者比较简便的检查诊断动脉硬化性疾病,并制定适当的检查、治疗计划,这对于预后的改善是必需的。
作为非侵袭性地检测动脉硬化的方法,有根据颈动脉回声测量内中膜复合体厚度、斑块的存在等的方法。然而,该方法成为在颈动脉的有限部位的诊断,未必能够检测在其他部位的动脉硬化。
在动脉硬化的发病中,作为风险因子已知有糖尿病、吸烟、脂质异常症、高血压等(非专利文献1),由于针对高血压或脂质异常症的药物治疗的进步,目前无法只根据这些经典的风险因子来判断动脉硬化的风险。由于动脉硬化本身没有症状,所以患者无法自知该病的进展。因此,寻求可以诊断动脉硬化的生物标志物。
近年来,基于动脉硬化的发病机理的生物标志物的研究日益增多。已知动脉硬化的进展与血管内皮功能紊乱、凝固(凝血)/纤维蛋白溶解系统异常、炎症、脂质代谢异常等有关,且显示了与这些因子有关的蛋白和急性冠状动脉综合征的关联(非专利文献2)。然而,这些蛋白也会因感染或癌症、外伤等而升高,因此血管特异性低,仅凭单一分子无法诊断动脉硬化。在非专利文献2中,研究了与脂质或代谢、凝固(凝血)、新生血管、肾功能炎症、氧化应激等关联的20种以上的因子,但还未发现超出经典的风险因子的生物标志物。
在专利文献1中,作为可以预测心血管事件的生物标志物,列举了包含肿瘤坏死因子α前体等在内的多种蛋白。在心血管事件中,包含主动脉瘤破裂、心肌梗塞(心肌梗死)、脑中风、外周动脉疾病等各种动脉硬化性疾病,但这些生物标志物并不是诊断动脉硬化本身的标志物。
在专利文献2中,作为由动脉粥样硬化引起的心脏疾病的预后生物标志物,公开了血中YKL-40。该生物标志物也不是诊断动脉硬化本身的标志物。而且,YKL-40还会因癌症或炎症而在血中检测出来(非专利文献3、4),因此疾病特异性低。
在专利文献3中公开了以下方法:以随着动脉硬化病变的进展,表达会发生变动的标志物蛋白为指标,来评价动脉硬化病变。然而,这些标志物蛋白是使用动脉硬化模型动物来鉴定的,尚不明确是否能够评价人的动脉硬化病变。另外,这是研究在动脉组织病变部位的蛋白表达量的方法,与颈动脉回声同样,未必能够检测在检查对象部位以外的部位的动脉硬化的存在。
现有技术文献
专利文献
专利文献1:日本特表2010-534852号公报;
专利文献2:日本特表2011-510308号公报;
专利文献3:国际公开第2012/067180号公报;
非专利文献
非专利文献1:Anderson KM.等人, Am Heart J, 1991; 121: 293-8;
非专利文献2:Blankengerg S.等人, Circulation, 2010; 121: 2388-97;
非专利文献3:Kring TS.,等人, Biomark Cancer, 2015; 7: 57-61;
非专利文献4:Ural UM.,等人, Clin Exp Obstet Gynecol, 2015; 42: 495-7。
技术实现要素:
发明所要解决的课题
本发明的目的在于:提供可以通过侵袭少的简便方法检测体内动脉硬化病变的手段。
用于解决课题的手段
本申请发明人深入研究的结果发现:在患有严重的动脉硬化病变的动脉疾病患者中,血中肌球蛋白重链11水平明显高于健康人,从而完成了本申请发明。
即,本发明提供检测动脉硬化的方法,该方法包括:测定由受试者分离的血液样品中的肌球蛋白重链11水平,高于健康人的肌球蛋白重链11水平成为该受试者患有动脉硬化的指标。另外,本发明提供动脉硬化检测试剂盒,该试剂盒包含抗肌球蛋白重链11抗体或其抗原结合性片段。
发明效果
根据本发明,首次明确了:肌球蛋白重链11可用作反映体内存在动脉硬化的血中生物标志物。由于通过血液检查可以检测动脉硬化,因此可以低侵袭且简便地实施检查。另外,该方法并不像颈动脉回声那样仅以特定部位作为检查对象,因此可期待着反映全身血管的状态。通过本发明检测动脉硬化本身,从而可以在动脉硬化性疾病发病之前知晓发病的风险,因此可督促改善自主生活习惯,关系到防止疾病的发病,可有助于消减医疗费。另外,如果为缺乏自觉症状的动脉硬化性疾病的发病初期的患者,则通过本发明的方法知晓存在严重的动脉硬化,从而关系到疾病的早期发现,可以更早期地制定治疗计划,可有助于改善患者的生命预后。根据本发明,可以提供有效数据以检测动脉硬化病变的存在,非常有助于医生对动脉硬化本身的评价、诊断。
附图简述
[图1-1]是在正常组和动脉硬化患者组之间将血中肌球蛋白重链11水平的测定值进行对比的结果。P<0.0001,组间存在显著差异(Welch t检验)。
[图1-2]是通过ROC分析评价基于血中肌球蛋白重链11水平的动脉硬化患者组的检测能力的结果。
[图2-1]是在正常组、接受了PCI的动脉硬化患者组和接受了EVT的动脉硬化患者组这3组将血中肌球蛋白重链11水平的测定值进行对比的结果。***表示相对于正常组p<0.0001,存在显著差异(Welch t检验)。
[图2-2]是通过ROC分析评价基于血中肌球蛋白重链11水平的各动脉硬化患者组的检测能力的结果。
[图3-1]是在日本人正常组、接受了PCI的动脉硬化患者组和接受了EVT的动脉硬化患者组这3组将血中肌球蛋白重链11水平的测定值进行对比的结果。***表示相对于正常组p<0.0001,存在显著差异(Welch t检验)。
[图3-2]是通过ROC分析评价基于血中肌球蛋白重链11水平的各动脉硬化患者组的检测能力的结果。
[图4]是研究46名动脉硬化患者的血中MYH11水平与血中CRP水平之相关的结果。
[图5]是通过ROC分析评价各动脉硬化患者组的基于血中CRP水平的检测能力的结果。
[图6]是研究健康的日本人、PCI患者、EVT患者的血中MYH11水平与布林克曼指数之相关的结果。
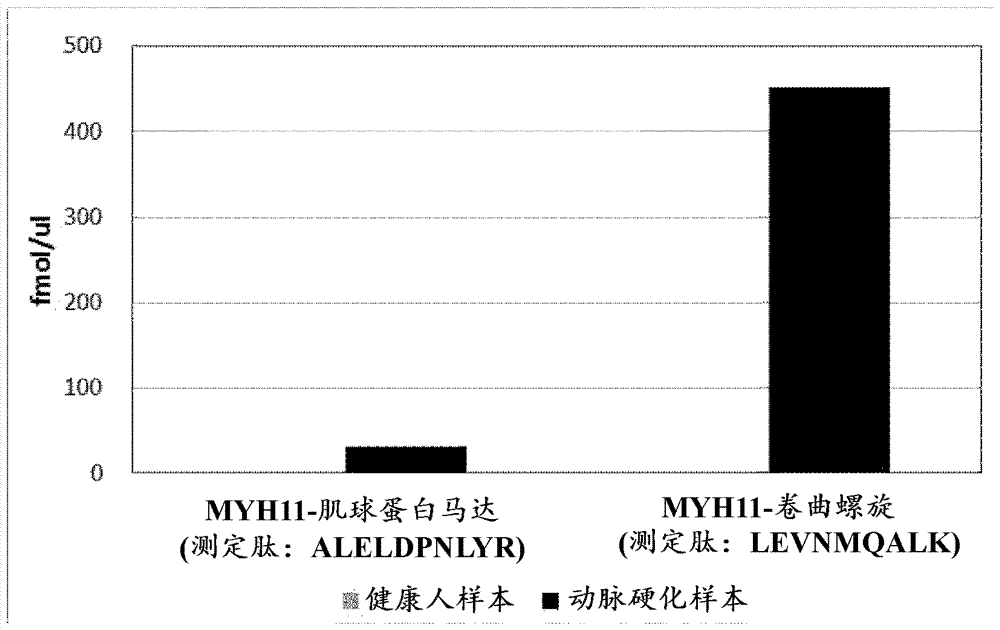
[图7]是以内部标准肽为指标,测定样本(検体)中所具有的MYH11的两个靶肽(ALELDPNLYR、LEVNMQALK)的摩尔浓度的结果。
[图8]是在接受了PCI或EVT的动脉硬化患者的存活组和死亡组(观察期间:1~2.5年)之间将介入前或刚刚介入后~数日以内的血中MYH11水平进行比较的结果。
[图9-1]是肌球蛋白重链11的4种同工型(isoform)的氨基酸序列的排比。
[图9-2]是肌球蛋白重链11的4种同工型的氨基酸序列的排比(图9-1的续图)。
[图9-3]是肌球蛋白重链11的4种同工型的氨基酸序列的排比(图9-2的续图)。
[图9-4]是肌球蛋白重链11的4种同工型的氨基酸序列的排比(图9-3的续图)。
[图9-5]是肌球蛋白重链11的4种同工型的氨基酸序列的排比(图9-4的续图)。
具体实施方式
已知肌球蛋白重链有5、7、10、11等同工型,其中,在本发明中作为对象的是肌球蛋白重链11(Gene ID 4629)。肌球蛋白重链11是在平滑肌中特异性表达的同工型,也被称作平滑肌肌球蛋白重链。平滑肌中表达的肌球蛋白重链11,其中2分子的重链与各2分子的2种肌球蛋白轻链一同形成六聚物的平滑肌肌球蛋白分子。
在肌球蛋白重链11中,已知主要有C末端部分的序列不同的4种同工型SM1A、SM1B、SM2A、SM2B (GenBank检索号: NP_002465.1、NP_001035203.1、NP_074035.1、NP_001035202.1,氨基酸序列分别示于SEQ ID NO: 1~4)。对本发明中测定的肌球蛋白重链11的同工型没有特别限定,可以测定所有的4种同工型,也可以只测定一部分的同工型。
血中肌球蛋白重链11水平可以通过测定血液样品中的肌球蛋白重链11蛋白或其片段来研究。由于肌球蛋白重链11不是分泌蛋白,所以认为其在血中还以片段化的形态存在。所测定的肌球蛋白重链11蛋白或其片段包含:在血中以单体形式存在者、和以与其他蛋白等结合或者缔合的形态存在于血中者(例如,以构成完全的或者部分分解的平滑肌肌球蛋白分子的形态存在于血中者)。因此,作为用于检测动脉硬化病变的血中生物标志物而使用的“肌球蛋白重链11”的用语包含:在血中以单体形式存在的肌球蛋白重链11的全长蛋白及其部分片段、以及处于与其他蛋白或者蛋白片段结合或缔合的形态的肌球蛋白重链11蛋白及其部分片段。
血液样品可以是血清也可以是血浆,但可以优选使用血浆。
本发明中作为对象的动脉硬化包含:初期的动脉硬化~已进展的后期的动脉硬化。另外,动脉硬化在病理学上有粥状硬化、细动脉硬化和中层钙化这3个类型,本发明中作为对象的动脉硬化包含这3个类型。作为对象的动脉硬化的代表性例子可以列举粥状硬化。
作为由动脉硬化引起的疾病(动脉硬化性疾病),可以列举:缺血性心脏病(心绞痛、心肌梗塞)、主动脉瘤(胸部/腹部主动脉瘤、髂动脉瘤等)、闭塞性动脉硬化症、主动脉阀狭窄症、脑血管疾病(脑梗塞、脑中风)等。通过本发明检测动脉硬化本身,从而可以在这样的疾病发病之前知晓发病的风险,因此会督促改善自主生活习惯,还关系到防止动脉硬化性疾病的发病。另外,在被检测到严重的动脉硬化的受试者中,通过实施精密检查和之后的慎重的演变观察(经过观察),能够实现疾病的早期发现、早期治疗。
作为测定血中肌球蛋白重链11水平的手段,只要是能够测定多肽的手段即可,没有特别限定。作为多肽的测定方法,可以列举免疫测定法或质谱(质量分析)等,免疫测定法不需要大型的仪器类,测定操作也简便,因此即使在本发明中也可优选用于肌球蛋白重链11水平的测定。能够检测肌球蛋白重链11的抗体是公知的,还存在市售品。关于市售品的抗肌球蛋白重链11抗体,代表性的是利用小鼠、兔等非人动物调制的非人动物多克隆或单克隆抗体。另外,如上所述,肌球蛋白重链11的氨基酸序列和编码其的核苷酸序列也是公知的,因此利用常规方法的杂交瘤法等可以调制特异性地识别肌球蛋白重链11的抗肌球蛋白重链11抗体并进行使用。
抗肌球蛋白重链11抗体可以是多克隆抗体,也可以是单克隆抗体。作为多克隆抗体,可以使用抗血清。均可利用众所周知的常规方法进行调制。
具体而言,抗肌球蛋白重链11多克隆抗体例如可以如下获得:将通过化学合成或者基因工程学方法调制的肌球蛋白重链11蛋白或其部分片段和适当的佐剂一同对非人动物进行免疫,由从该动物采集的血液获得抗血清,再纯化该抗血清中的多克隆抗体(非人动物抗肌球蛋白重链11多克隆抗体)即得。为了提高被免疫动物中的抗体效价,通常是在几周内进行多次免疫。抗血清中的抗体的纯化例如可以通过硫酸铵沉淀或阴离子色谱法的分馏、亲和柱纯化等来进行。
作为单克隆抗体的周知的制作方法之一例,可以列举杂交瘤法。具体而言,例如由按照上述方式进行了免疫的非人动物采集脾细胞或淋巴细胞这样的抗体产生细胞,使其与骨髓瘤细胞融合来调制杂交瘤,选择产生与肌球蛋白重链11蛋白结合的抗体的杂交瘤,使其增殖,由培养上清可以获得非人动物抗肌球蛋白重链11单克隆抗体。
免疫测定本身在该领域中是众所周知的。若将免疫测定法根据反应形式进行分类,则有夹层法、竞争法、凝集法、蛋白质印迹法等,另外,若根据标记进行分类,则有酶免疫分析、放射免疫分析、荧光免疫分析等。在本发明中,可以采用能够进行定量检测的任一种免疫测定方法。没有特别限定,例如可以优选采用夹层ELISA等的夹层法。
如上所述,平滑肌肌球蛋白分子包含2分子的肌球蛋白重链11,这样的包含2分子的肌球蛋白重链11蛋白或其片段的复合体可以通过使用识别肌球蛋白重链11的相同位点(同一部位)的相同抗体的夹层法进行测定。在想要利用夹层法测定肌球蛋白重链11蛋白的单体或其片段、或者只包含1分子的肌球蛋白重链11的复合体的情况下,只要使用识别肌球蛋白重链11的不同位点的2种抗体即可。如果为多克隆抗体,则标记抗体和固相抗体这两者使用相同的多克隆抗体,可以进行包含单体或片段在内的测定。如上所述,已知肌球蛋白重链11有4种同工型,如果使用识别对4种通用的区域的抗体,则可以包罗所有的4种同工型进行测定。如果使用分别对4种同工型特异性的抗体,则还可以进行区分同工型的测定、或者仅测定特定的同工型。需要说明的是,如图9-1~9-5所示,对SEQ ID NO: 1~4所示的4种同工型通用的区域为SEQ ID NO: 4中的第1位~第211位氨基酸、第219位~第1936位氨基酸的区域,如果使用这些区域或其部分区域作为抗体调制时的免疫原,则可以调制与所有的4种同工型反应的抗体。另外,SEQ ID NO: 4中的第212位~第219位氨基酸的区域是对SM1B和SM2B特异性的区域,SEQ ID NO: 4中的第1937位~第1945位氨基酸的区域是对SM2A和SM2B特异性的区域,SEQ ID NO: 1中的第1930位~第1972位氨基酸的区域是对SM1A和SM1B特异性的区域,因此通过适当组合使用识别这些区域或其部分区域的抗体,可以进行区分同工型的测定或者只测定特定的同工型。
在本发明中,代表性的是可以优选使用识别肌球蛋白重链11蛋白的C末端侧区域的抗体,但也可以使用识别N末端侧区域的抗体,还可以组合使用识别C末端侧区域的抗体和识别N末端侧区域的抗体。需要说明的是,在本发明中,N末端侧区域是指包含由马达结构域和调节结构域构成的头部和采取卷曲螺旋结构的尾部的一部分在内的N末端侧区域,C末端侧区域是指包含采取卷曲螺旋结构的尾部的大部分在内的C末端侧区域。具体而言,例如,SEQ ID NO: 4中的氨基酸序列的第840位氨基酸附近~N末端侧为N末端侧区域,而第840位氨基酸附近~C末端侧为C末端侧区域。识别C末端侧区域的抗体是指,在肌球蛋白重链11蛋白的C末端侧区域内具有表位、且与该C末端侧区域内的任一位点结合的抗体。识别N末端侧区域的抗体的用语也同样。
免疫测定法本身是众所周知的,在本说明书中无需说明,简而言之,例如,在夹层法中,将与肌球蛋白重链11结合的抗体固定于固相上(固相化抗体),使其与样品反应,清洗后使固相化抗体与在相同或不同位点与肌球蛋白重链11结合的抗体上带有标记的标记抗体反应,清洗后,测定与固相结合的标记抗体。固相化抗体和标记抗体均可以是多克隆抗体,也可以是单克隆抗体。需要说明的是,在免疫测定中,代替抗体还可以使用该抗体的抗原结合性片段。
“抗原结合性片段”例如是指免疫球蛋白的Fab片段或F(ab’)2片段这样的维持着对该抗体的对应抗原的结合性(抗原抗体反应性)的抗体片段。众所周知,这样的抗原结合性片段也可用于免疫测定,和原来的抗体同样有效。众所周知,Fab片段或F(ab’)2片段可以通过用木瓜蛋白酶或胃蛋白酶这样的蛋白分解酶处理抗体而获得。需要说明的是,抗原结合性片段并不限于Fab片段或F(ab’)2片段,可以是维持着与对应抗原的结合性的任何片段,也可以是通过基因工程学方法调制的片段。另外,例如还可以使用通过基因工程学方法使单链可变区 (scFv: single chain fragment of variable region)在大肠杆菌内表达的抗体。scFv的制作方法也是众所周知的,提取如上所述制作的杂交瘤的mRNA,调制单链cDNA,使用对免疫球蛋白H链和L链特异性的引物进行PCR,扩增免疫球蛋白H链基因和L链基因,将它们通过接头连接,赋予适当的限制酶位点,再将其导入质粒载体中,通过该质粒载体转化大肠杆菌,由大肠杆菌回收scFv,从而可以制作scFv。这样的scFv也包含在“抗原结合性片段”中。
标记抗体的测定可以通过测定来自标记物质的信号来进行。信号的测定方法根据标记物质的种类而适当选择。例如,在酶标记的情况下,将该酶的底物添加至反应系统内,使用吸光光度计或发光计测定通过酶反应而产生的显色或发光的量即可。对于以各种浓度包含肌球蛋白重链11的浓度已知的标准样品,使用抗肌球蛋白重链11抗体或其抗原结合性片段进行免疫测定,将来自标记的信号量与标准样品中的肌球蛋白重链11浓度的相关关系作图,制作标准曲线,对于肌球蛋白重链11浓度为未知的样本,进行相同的操作,测定来自标记的信号量,将测定值应用于该标准曲线,从而可以定量样本中的肌球蛋白重链11。
在固相化抗体和标记抗体这两者为单克隆抗体的情况下,单克隆抗体的组合是否优选,实际上通过进行免疫测定可以容易地研究。根据需要,可以进行抗体的识别位点的鉴定,研究是否识别不同的表位。抗体的识别位点的鉴定可以通过该领域中周知的常规方法来进行。简而言之,例如,将作为对应抗原的肌球蛋白重链11用胰蛋白酶等这样的蛋白分解酶进行部分消化,使部分消化物溶液通过结合有适合研究识别位点的抗体的亲和柱,使消化物与亲和柱结合,然后洗脱所结合的消化物,进行常规方法的质量分析,从而可以鉴定抗体的识别位点。
高于健康人的血中肌球蛋白重链11水平成为患有动脉硬化的指标。通过测定血中肌球蛋白重链11水平,可以提供有助于检测动脉硬化的数据。动脉硬化检测的用语包含严重的动脉硬化的检测。在受试者的血中肌球蛋白重链11水平测定值高于健康人的情况下,可以判断为该受试者有可能患有动脉硬化病变。另外,血中肌球蛋白重链11水平越高,则可以判断为体内存在动脉硬化病变的可能性越高、或者动脉硬化的严重度有可能更高。“严重度高的动脉硬化”和“严重的动脉硬化”的用语包含:存在于体内的动脉硬化病变部位数多的状态、和存在于体内的动脉硬化病变的进展度高的状态。“进展度高的动脉硬化”和“已进展的动脉硬化”的用语是指通过血管造影确认到50%以上、例如60%以上、70%以上、或者75%以上的狭窄的水平的动脉硬化。需要说明的是,关于血管造影下的狭窄比例,如该领域中所周知,表示与狭窄前后的认为健康的血管直径相比狭窄到了哪个程度,例如狭窄75%是指,以造影前后的血管直径为100%时,所造影的部分直径为25%。
关于血中肌球蛋白重链11水平是否高于健康人,例如,以由测定多名健康人的血中肌球蛋白重链11水平确定的健康基准值作为截断值,通过与该截断值的比较可以进行判断。健康人是未患有动脉硬化的人,具有动脉硬化性疾病症状的人当然除外。在健康人的选择中,只要根据自我评估(自己申告)等选择未患有动脉硬化的人即可,例如可以选择除动脉硬化性疾病以外也未患有作为动脉硬化的危险因子而已知的脂质异常症、高血压、糖尿病、肥胖等生活习惯病的人,或者可以进一步考虑不具有吸烟习惯、还考虑动脉硬化性疾病的家族史等进行选择。健康基准值例如可以是健康人的血中肌球蛋白重链11水平的平均值、或者将标准误差加在该平均值上合起来算得的值。在受试者的血中肌球蛋白重链11水平的测定值高于该截断值的情况下,可以判断为有可能患有动脉硬化病变,其测定值越高,患有动脉硬化病变的可能性就越高、或者动脉硬化的严重度有可能更高。该截断值可以根据每个年代(例如不满30岁、30年代(歳代)、40年代、50年代、60年代、70岁以上等)来设定。
为了检测有可能进展至需要治疗处置水平的特别严重的动脉硬化,也可以实施本发明。这种情况下,可以由对于冠状动脉疾病或外周动脉疾病等严重的动脉硬化性疾病发病的患者组所测定的血中肌球蛋白重链11水平来确定重度动脉硬化基准值。重度动脉硬化基准值可以采用该患者组的血中肌球蛋白重链11水平的测定值的平均值、或者从其平均值中减去标准误差而得到的值等。在受试者的测定值接近于该重度动脉硬化基准值的情况下、或者超过该基准值的情况下,可以判断为该受试者有可能患有特别严重的动脉硬化。对这样的受试者尽快进行精密检查,在确认到异常的情况下,立即慎重地进行治疗处置、或者进行演变观察(经过观察),从而可以实现动脉硬化性疾病的早期发现、早期治疗。
另外,本发明还可以有效地利用于动脉硬化或者动脉硬化性疾病的治疗处置的治疗效果判定、或者临床试验等中的治疗药候选物质的治疗效果的判定。在接受了治疗处置的患者中,在与治疗处置前相比血中肌球蛋白重链11水平下降的情况下,可以判断为通过该治疗处置获得了治疗效果。另外,在接受了治疗药候选物质给药的患者中,在与给药前相比血中肌球蛋白重链11水平下降的情况下,可以判断为该治疗药候选物质具有动脉硬化或者动脉硬化性疾病的治疗效果。
抗肌球蛋白重链11抗体或其抗原结合性片段可以以动脉硬化检测试剂盒的形式提供。如上所述,抗肌球蛋白重链11抗体可以是识别对4种同工型通用的区域、包罗所有的4种同工型进行测定的抗体,也可以是区分识别4种同工型的同工型特异性抗体。在抗肌球蛋白重链11抗体为同工型特异性抗体的情况下,动脉硬化检测试剂盒可以包含所有的对4种同工型特异性的各抗体,也可以只包含任意一部分。另外,作为该试剂盒的优选例子,可以列举包含识别肌球蛋白重链11蛋白的C末端侧区域的抗体的试剂盒,但也可以是包含识别N末端侧区域的抗体的试剂盒,还可以是包含识别C末端侧区域的抗体和识别N末端侧区域的抗体这两者的试剂盒。
动脉硬化检测试剂盒中通常包含使用说明书。在为夹层法的检测试剂盒的情况下,试剂盒中还可以包含作为固相的板或磁性颗粒等颗粒。可以包含抗肌球蛋白重链11抗体或其抗原结合性片段作为标记抗体和固相化抗体。如上所述,标记抗体和固相化抗体可以是相同的抗肌球蛋白重链11抗体或其抗原结合性片段,也可以是不同的抗肌球蛋白重链11抗体或其抗原结合性片段。
实施例
下面,根据实施例来更具体地说明本发明。但本发明并不限于下述实施例。
1. 通过夹层ELISA定量血中肌球蛋白重链11 (其1)
<材料和方法>
以由于动脉硬化的进展而在冠状动脉或主动脉、外周血管处狭窄、梗塞、瘤等动脉疾病发病、且接受了导管治疗或支架治疗的患者作为对象。各患者的动脉硬化病变的存在通过血管造影(狭窄、梗塞的确认)或者CT (钙化的确认)来确认。无法确定动脉硬化性的患者除外。在介入前或者刚刚介入后~数天以内由各患者采集血液,从该血液中分离血浆,测定血浆中的肌球蛋白重链11 (MYH11)水平作为血中MYH11水平。阴性对照的50人份的正常血浆样品(包含高加索人、西班牙裔、黒人)是购入市售品进行使用。
血浆中的MYH11水平的测定通过夹层ELISA来进行,所述夹层ELISA使用了以抗MYH11抗体作为固相抗体和标记抗体的人肌球蛋白重链11 ELISA试剂盒(CUSABIO公司)。使用HRP作为抗MYH11抗体的标记,检测中使用TMB作为底物,利用发光计检测显色。使用以各种浓度包含平滑肌肌球蛋白的标准样品制作标准曲线,应用于该标准曲线,算出各样本中的MYH11浓度。平滑肌肌球蛋白使用上述试剂盒(CUSABIO公司)所附带的重组蛋白。
需要说明的是,关于这里使用的抗MYH11抗体的识别区域,将MYH11的同工型SM2B的全长(SEQ ID NO: 4)分成大约一半,调制N末端侧片段(R1)和C末端侧片段(R2),通过ELISA研究抗体与各片段的反应性时,该抗体只与R2反应、而不与R1反应。由此确认到:该抗体识别MYH11的C末侧一半区域内(SEQ ID NO: 4中的第950位~第1945位氨基酸区域内)的任一部位。另外,确认到上述ELISA试剂盒的固相抗体与MYH11的不同的两个片段反应,推测其为多克隆抗体。
<结果>
图1-1是50名正常人和总计78名患有动脉硬化的患者的血中MYH11水平的测定结果。与正常组相比,在动脉硬化患者组中血中MYH11明显为高值。
图1-2是通过ROC分析评价基于血中MYH11水平的动脉硬化组的检测能力的结果。该结果显示出:作为独立变量的血浆中的MYH11浓度与作为二分变量的动脉硬化存在与否的结果的关系明显强。另外,ROC曲线下面积(AUC: area under the curve)为0.9290。AUC取0.5~1.0的值,AUC 0.5~0.7判断为低准确度,AUC 0.9~0.7判断为中等准确度,AUC 0.9~1.0判断为高准确度。本例中,AUC为0.9以上,显示出:以血中MYH11水平为指标的动脉硬化病变诊断的有效性高。
图2-1是针对患有动脉硬化的患者组中接受了经皮冠状动脉形成术(PCI)的29名患者和接受了外周动脉血管内治疗(EVT)的17名患者,将血中MYH11水平的测定值与正常组进行对比的结果。这些患者组是在下肢动脉等外周动脉或冠状动脉处患有需要治疗处置的程度的明显进展了的动脉硬化的患者,在这样的非常严重的动脉硬化病变中,确认到血中MYH11水平特别高。图2-2是通过ROC分析评价各动脉硬化患者组的基于血中MYH11水平的检测能力的结果,AUC均为超过0.95的高值。
2. 通过夹层ELISA定量血浆中肌球蛋白重链11 (其2)
<材料和方法>
作为动脉硬化样本,使用了上述1.的动脉硬化患者血浆中来自29名PCI适用患者(69.5±1.4岁、BMI: 22.4±0.5、男:女=26:3)和17名EVT适用患者(72.4±1.4岁、BMI: 23.6±1.1、男:女=13:4)的血浆。作为正常样本,使用不具有动脉硬化及其风险因子的40名健康的日本人(70.4±0.6岁、BMI: 23.3±0.2、男:女=33:7)的血浆。夹层ELISA与上述1.相同,使用CUSABIO公司的ELISA试剂盒来进行。
<结果>
图3-1是针对PCI适用动脉硬化患者和EVT适用动脉硬化患者,将血中MYH11水平的测定值与40名正常日本人进行对比的结果。图3-2是通过ROC分析评价各动脉硬化患者组的基于血中MYH11水平的检测能力的结果。即使与健康的日本人相比,动脉硬化患者的血中MYH11水平也明显高,AUC也为超过0.9的高值。
3. 基于血中肌球蛋白重链11水平的动脉硬化诊断性能的研究
(1) 与CRP的诊断性能的比较
已知C-反应蛋白(C-reactive protein,CRP)是心血管事件预测的标志物,血中CRP值也会因动脉硬化而上升(Blankengerg S,等人, Circulation 2010; 121: 2388-97)。为了对基于血中肌球蛋白重链11水平的动脉硬化的诊断性能进行评价,与上述2.相同研究了动脉硬化患者(29名PCI患者、17名EVT患者)和健康的日本人的血浆中CRP水平。
图4是研究46名动脉硬化患者的血中MYH11水平与血中CRP水平之相关的结果。确认到两者之间不相关,是独立的因子。
图5是通过ROC分析评价各动脉硬化患者组的基于血中CRP水平的检测能力的结果。AUC均为低于0.9的低值,确认到:与MYH11相比,基于CRP的动脉硬化诊断能力低。
(2) 与动脉硬化风险因子的相关性
已知吸烟是主要的动脉硬化风险因子之一,吸烟与动脉硬化相关。在研究健康的日本人、PCI患者、EVT患者的血浆中MYH11水平与布林克曼指数(1天的吸烟根数×吸烟年数)的相关时,如图6所示,两者之间具有相关性。即使是健康人,动脉硬化也会伴随年龄增加而缓慢进展,由此认为健康人团体中也包含患有极轻度的动脉硬化的人。PCI患者和EVT患者是需要治疗处置的水平的动脉硬化重症例。图6所示的数据暗示了:即使是轻度的动脉硬化,也能够通过血中MYH11水平进行检测。
4. 肌球蛋白重链11的血中形态分析
<材料和方法>
(1) 抗体固定化微粒的调制
将固定有抗体的磁性微粒(Dynabeads(注册商标) M-280 Tosylactivated; Thermo Fisher Scientific)悬浮在规程(Protocol)所记载的缓冲液中,混合抗人MYH11(HPA015310; Cosmo Bio),在37℃下固定抗体17小时。抗体固定化后,将抗体固定化微粒悬浮在包含10% Blockmaster CE510(JSR)的0.05 mol/L Tris-HCl缓冲液(pH8.0)中,在37℃下培养5小时进行封闭,得到了0.2 mg/mL珠粒的抗MYH11抗体固定化磁性微粒(A)。
(2) 内部标准肽的调整
选择作为MYH11的靶肽的来自肌球蛋白马达结构的肽(作为来自N末端侧结构的肽; ALELDPNLYR; SEQ ID NO: 4的第760位~第769位残基区域)和来自卷曲螺旋结构的肽(作为来自C末端侧结构的肽;LEVNMQALK; SEQ ID NO: 4的第1572位~第1580位残基区域),合成稳定同位素标记(13C和15N)的肽(AQUA肽; Sigma-Aldrich)。
(3) 测定样品的调整
在上述1.所使用的患者样本中,使用将以较高值检测到血浆中MYH11水平的数名患者的血浆混合得到的样本作为患者样本。阴性对照的健康人样本使用了6名健康的日本人的混合血浆样本。
使用了磁性微粒的免疫反应如下:用PBST稀释样本,在所得稀释溶液中悬浮(A),室温下进行搅拌反应3小时。洗脱液使用包含8M尿素的0.1N的盐酸,得到了洗脱液(B)。用1M的Tris中和(B),之后按照常规方法进行还原烷基化。加入胰蛋白酶使其终浓度达到5.0μg/mL,在37℃下培养17小时,得到了蛋白消化产物(C)。在得到的(C)的溶液中添加内部标准肽(10 fmol),通过GL-Tip SDB(GL Sciences)进行脱盐、浓缩,得到了MRM测定用样品(D)。
(4) 通过多重反应监测(Multiple Reaction Monitoring,MRM)法获取肽信息
将所得的MRM测定用样品(D)供给三重四极杆串联质谱仪(三連四重極型質量分析装置)QTRAP 5500 (AB SCIEX),进行两个肽、即MYH11-肌球蛋白马达肽和MYH11-卷曲螺旋肽的测定。用于检测、定量两个肽的MRM方法示于表1。测定结果通过Skyline软件进行分析。通过确认定量用通道(Quantitation)中的MRM信号的洗脱时间与对应的确认用通道(Verification)的信号一致,评价了信号的可靠性。接下来,在各肽的定量用通道中,算出轻肽相对于重肽的峰面积比,从而计算分析样品中所含的两个肽的摩尔浓度。
[表1]
<结果>
以内部标准肽为指标,对于样本中所具有的MYH11,由两个靶肽的定量用通道测定摩尔浓度。结果示于图7。在作为比较对象的健康人样本中,任一个肽均在检测限以下。另一方面,在动脉硬化样本中,以非常高的值检测到来自MYH11的C末端侧结构的肽,判明了其明显高于健康人。虽然与来自C末端侧结构的肽相比,来自N末端侧结构的肽为低值,但仍然同样地判明了与健康人相比,动脉硬化样本一方明显高。
5. 血中MYH11水平与动脉硬化性疾病的预后的相关性
观察接受了PCI或EVT的患者的术后经过时(观察期间为1~2.5年),有3名死亡例。刚刚介入后并没有死亡,由此明确了:不是由介入手术引起的死亡。
1. EVT介入后64天后 因感染症而死亡;
2. EVT介入后294天后 因感染症而死亡;
3. PCI介入后163天后 因弥漫性血管内凝固综合征(DIC,弥漫性血管内凝血)而死亡。
在上述死亡组和存活患者组之间比较介入前或者刚刚介入后~数天以内的血中MYH11水平时,如图8所示,死亡组一方的血中MYH11水平高。在因外周动脉的狭窄或阻塞而发生的外周动脉疾病中,已知严重的感染症的风险增加(https://www.nhlbi.nih.gov/health/health-topics/topics/atherosclerosis)。另外,DIC是能够以各种基础疾病为基础而发生的病态,需要介入的冠状动脉狭窄是DIC的基础疾病之一。该数据暗示了:血中MYH11水平作为动脉硬化性疾病的预后的指标也有效。
<110> 公立大学法人横浜市立大学
东曹株式会社
<120> 用于检测动脉硬化的血中生物标志物
<130> PF588-PCT
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 1972
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Gln Lys Gly Gln Leu Ser Asp Asp Glu Lys Phe Leu Phe Val
1 5 10 15
Asp Lys Asn Phe Ile Asn Ser Pro Val Ala Gln Ala Asp Trp Ala Ala
20 25 30
Lys Arg Leu Val Trp Val Pro Ser Glu Lys Gln Gly Phe Glu Ala Ala
35 40 45
Ser Ile Lys Glu Glu Lys Gly Asp Glu Val Val Val Glu Leu Val Glu
50 55 60
Asn Gly Lys Lys Val Thr Val Gly Lys Asp Asp Ile Gln Lys Met Asn
65 70 75 80
Pro Pro Lys Phe Ser Lys Val Glu Asp Met Ala Glu Leu Thr Cys Leu
85 90 95
Asn Glu Ala Ser Val Leu His Asn Leu Arg Glu Arg Tyr Phe Ser Gly
100 105 110
Leu Ile Tyr Thr Tyr Ser Gly Leu Phe Cys Val Val Val Asn Pro Tyr
115 120 125
Lys His Leu Pro Ile Tyr Ser Glu Lys Ile Val Asp Met Tyr Lys Gly
130 135 140
Lys Lys Arg His Glu Met Pro Pro His Ile Tyr Ala Ile Ala Asp Thr
145 150 155 160
Ala Tyr Arg Ser Met Leu Gln Asp Arg Glu Asp Gln Ser Ile Leu Cys
165 170 175
Thr Gly Glu Ser Gly Ala Gly Lys Thr Glu Asn Thr Lys Lys Val Ile
180 185 190
Gln Tyr Leu Ala Val Val Ala Ser Ser His Lys Gly Lys Lys Asp Thr
195 200 205
Ser Ile Thr Gly Glu Leu Glu Lys Gln Leu Leu Gln Ala Asn Pro Ile
210 215 220
Leu Glu Ala Phe Gly Asn Ala Lys Thr Val Lys Asn Asp Asn Ser Ser
225 230 235 240
Arg Phe Gly Lys Phe Ile Arg Ile Asn Phe Asp Val Thr Gly Tyr Ile
245 250 255
Val Gly Ala Asn Ile Glu Thr Tyr Leu Leu Glu Lys Ser Arg Ala Ile
260 265 270
Arg Gln Ala Arg Asp Glu Arg Thr Phe His Ile Phe Tyr Tyr Met Ile
275 280 285
Ala Gly Ala Lys Glu Lys Met Arg Ser Asp Leu Leu Leu Glu Gly Phe
290 295 300
Asn Asn Tyr Thr Phe Leu Ser Asn Gly Phe Val Pro Ile Pro Ala Ala
305 310 315 320
Gln Asp Asp Glu Met Phe Gln Glu Thr Val Glu Ala Met Ala Ile Met
325 330 335
Gly Phe Ser Glu Glu Glu Gln Leu Ser Ile Leu Lys Val Val Ser Ser
340 345 350
Val Leu Gln Leu Gly Asn Ile Val Phe Lys Lys Glu Arg Asn Thr Asp
355 360 365
Gln Ala Ser Met Pro Asp Asn Thr Ala Ala Gln Lys Val Cys His Leu
370 375 380
Met Gly Ile Asn Val Thr Asp Phe Thr Arg Ser Ile Leu Thr Pro Arg
385 390 395 400
Ile Lys Val Gly Arg Asp Val Val Gln Lys Ala Gln Thr Lys Glu Gln
405 410 415
Ala Asp Phe Ala Val Glu Ala Leu Ala Lys Ala Thr Tyr Glu Arg Leu
420 425 430
Phe Arg Trp Ile Leu Thr Arg Val Asn Lys Ala Leu Asp Lys Thr His
435 440 445
Arg Gln Gly Ala Ser Phe Leu Gly Ile Leu Asp Ile Ala Gly Phe Glu
450 455 460
Ile Phe Glu Val Asn Ser Phe Glu Gln Leu Cys Ile Asn Tyr Thr Asn
465 470 475 480
Glu Lys Leu Gln Gln Leu Phe Asn His Thr Met Phe Ile Leu Glu Gln
485 490 495
Glu Glu Tyr Gln Arg Glu Gly Ile Glu Trp Asn Phe Ile Asp Phe Gly
500 505 510
Leu Asp Leu Gln Pro Cys Ile Glu Leu Ile Glu Arg Pro Asn Asn Pro
515 520 525
Pro Gly Val Leu Ala Leu Leu Asp Glu Glu Cys Trp Phe Pro Lys Ala
530 535 540
Thr Asp Lys Ser Phe Val Glu Lys Leu Cys Thr Glu Gln Gly Ser His
545 550 555 560
Pro Lys Phe Gln Lys Pro Lys Gln Leu Lys Asp Lys Thr Glu Phe Ser
565 570 575
Ile Ile His Tyr Ala Gly Lys Val Asp Tyr Asn Ala Ser Ala Trp Leu
580 585 590
Thr Lys Asn Met Asp Pro Leu Asn Asp Asn Val Thr Ser Leu Leu Asn
595 600 605
Ala Ser Ser Asp Lys Phe Val Ala Asp Leu Trp Lys Asp Val Asp Arg
610 615 620
Ile Val Gly Leu Asp Gln Met Ala Lys Met Thr Glu Ser Ser Leu Pro
625 630 635 640
Ser Ala Ser Lys Thr Lys Lys Gly Met Phe Arg Thr Val Gly Gln Leu
645 650 655
Tyr Lys Glu Gln Leu Gly Lys Leu Met Thr Thr Leu Arg Asn Thr Thr
660 665 670
Pro Asn Phe Val Arg Cys Ile Ile Pro Asn His Glu Lys Arg Ser Gly
675 680 685
Lys Leu Asp Ala Phe Leu Val Leu Glu Gln Leu Arg Cys Asn Gly Val
690 695 700
Leu Glu Gly Ile Arg Ile Cys Arg Gln Gly Phe Pro Asn Arg Ile Val
705 710 715 720
Phe Gln Glu Phe Arg Gln Arg Tyr Glu Ile Leu Ala Ala Asn Ala Ile
725 730 735
Pro Lys Gly Phe Met Asp Gly Lys Gln Ala Cys Ile Leu Met Ile Lys
740 745 750
Ala Leu Glu Leu Asp Pro Asn Leu Tyr Arg Ile Gly Gln Ser Lys Ile
755 760 765
Phe Phe Arg Thr Gly Val Leu Ala His Leu Glu Glu Glu Arg Asp Leu
770 775 780
Lys Ile Thr Asp Val Ile Met Ala Phe Gln Ala Met Cys Arg Gly Tyr
785 790 795 800
Leu Ala Arg Lys Ala Phe Ala Lys Arg Gln Gln Gln Leu Thr Ala Met
805 810 815
Lys Val Ile Gln Arg Asn Cys Ala Ala Tyr Leu Lys Leu Arg Asn Trp
820 825 830
Gln Trp Trp Arg Leu Phe Thr Lys Val Lys Pro Leu Leu Gln Val Thr
835 840 845
Arg Gln Glu Glu Glu Met Gln Ala Lys Glu Asp Glu Leu Gln Lys Thr
850 855 860
Lys Glu Arg Gln Gln Lys Ala Glu Asn Glu Leu Lys Glu Leu Glu Gln
865 870 875 880
Lys His Ser Gln Leu Thr Glu Glu Lys Asn Leu Leu Gln Glu Gln Leu
885 890 895
Gln Ala Glu Thr Glu Leu Tyr Ala Glu Ala Glu Glu Met Arg Val Arg
900 905 910
Leu Ala Ala Lys Lys Gln Glu Leu Glu Glu Ile Leu His Glu Met Glu
915 920 925
Ala Arg Leu Glu Glu Glu Glu Asp Arg Gly Gln Gln Leu Gln Ala Glu
930 935 940
Arg Lys Lys Met Ala Gln Gln Met Leu Asp Leu Glu Glu Gln Leu Glu
945 950 955 960
Glu Glu Glu Ala Ala Arg Gln Lys Leu Gln Leu Glu Lys Val Thr Ala
965 970 975
Glu Ala Lys Ile Lys Lys Leu Glu Asp Glu Ile Leu Val Met Asp Asp
980 985 990
Gln Asn Asn Lys Leu Ser Lys Glu Arg Lys Leu Leu Glu Glu Arg Ile
995 1000 1005
Ser Asp Leu Thr Thr Asn Leu Ala Glu Glu Glu Glu Lys Ala Lys
1010 1015 1020
Asn Leu Thr Lys Leu Lys Asn Lys His Glu Ser Met Ile Ser Glu
1025 1030 1035
Leu Glu Val Arg Leu Lys Lys Glu Glu Lys Ser Arg Gln Glu Leu
1040 1045 1050
Glu Lys Leu Lys Arg Lys Leu Glu Gly Asp Ala Ser Asp Phe His
1055 1060 1065
Glu Gln Ile Ala Asp Leu Gln Ala Gln Ile Ala Glu Leu Lys Met
1070 1075 1080
Gln Leu Ala Lys Lys Glu Glu Glu Leu Gln Ala Ala Leu Ala Arg
1085 1090 1095
Leu Asp Asp Glu Ile Ala Gln Lys Asn Asn Ala Leu Lys Lys Ile
1100 1105 1110
Arg Glu Leu Glu Gly His Ile Ser Asp Leu Gln Glu Asp Leu Asp
1115 1120 1125
Ser Glu Arg Ala Ala Arg Asn Lys Ala Glu Lys Gln Lys Arg Asp
1130 1135 1140
Leu Gly Glu Glu Leu Glu Ala Leu Lys Thr Glu Leu Glu Asp Thr
1145 1150 1155
Leu Asp Ser Thr Ala Thr Gln Gln Glu Leu Arg Ala Lys Arg Glu
1160 1165 1170
Gln Glu Val Thr Val Leu Lys Lys Ala Leu Asp Glu Glu Thr Arg
1175 1180 1185
Ser His Glu Ala Gln Val Gln Glu Met Arg Gln Lys His Ala Gln
1190 1195 1200
Ala Val Glu Glu Leu Thr Glu Gln Leu Glu Gln Phe Lys Arg Ala
1205 1210 1215
Lys Ala Asn Leu Asp Lys Asn Lys Gln Thr Leu Glu Lys Glu Asn
1220 1225 1230
Ala Asp Leu Ala Gly Glu Leu Arg Val Leu Gly Gln Ala Lys Gln
1235 1240 1245
Glu Val Glu His Lys Lys Lys Lys Leu Glu Ala Gln Val Gln Glu
1250 1255 1260
Leu Gln Ser Lys Cys Ser Asp Gly Glu Arg Ala Arg Ala Glu Leu
1265 1270 1275
Asn Asp Lys Val His Lys Leu Gln Asn Glu Val Glu Ser Val Thr
1280 1285 1290
Gly Met Leu Asn Glu Ala Glu Gly Lys Ala Ile Lys Leu Ala Lys
1295 1300 1305
Asp Val Ala Ser Leu Ser Ser Gln Leu Gln Asp Thr Gln Glu Leu
1310 1315 1320
Leu Gln Glu Glu Thr Arg Gln Lys Leu Asn Val Ser Thr Lys Leu
1325 1330 1335
Arg Gln Leu Glu Glu Glu Arg Asn Ser Leu Gln Asp Gln Leu Asp
1340 1345 1350
Glu Glu Met Glu Ala Lys Gln Asn Leu Glu Arg His Ile Ser Thr
1355 1360 1365
Leu Asn Ile Gln Leu Ser Asp Ser Lys Lys Lys Leu Gln Asp Phe
1370 1375 1380
Ala Ser Thr Val Glu Ala Leu Glu Glu Gly Lys Lys Arg Phe Gln
1385 1390 1395
Lys Glu Ile Glu Asn Leu Thr Gln Gln Tyr Glu Glu Lys Ala Ala
1400 1405 1410
Ala Tyr Asp Lys Leu Glu Lys Thr Lys Asn Arg Leu Gln Gln Glu
1415 1420 1425
Leu Asp Asp Leu Val Val Asp Leu Asp Asn Gln Arg Gln Leu Val
1430 1435 1440
Ser Asn Leu Glu Lys Lys Gln Arg Lys Phe Asp Gln Leu Leu Ala
1445 1450 1455
Glu Glu Lys Asn Ile Ser Ser Lys Tyr Ala Asp Glu Arg Asp Arg
1460 1465 1470
Ala Glu Ala Glu Ala Arg Glu Lys Glu Thr Lys Ala Leu Ser Leu
1475 1480 1485
Ala Arg Ala Leu Glu Glu Ala Leu Glu Ala Lys Glu Glu Leu Glu
1490 1495 1500
Arg Thr Asn Lys Met Leu Lys Ala Glu Met Glu Asp Leu Val Ser
1505 1510 1515
Ser Lys Asp Asp Val Gly Lys Asn Val His Glu Leu Glu Lys Ser
1520 1525 1530
Lys Arg Ala Leu Glu Thr Gln Met Glu Glu Met Lys Thr Gln Leu
1535 1540 1545
Glu Glu Leu Glu Asp Glu Leu Gln Ala Thr Glu Asp Ala Lys Leu
1550 1555 1560
Arg Leu Glu Val Asn Met Gln Ala Leu Lys Gly Gln Phe Glu Arg
1565 1570 1575
Asp Leu Gln Ala Arg Asp Glu Gln Asn Glu Glu Lys Arg Arg Gln
1580 1585 1590
Leu Gln Arg Gln Leu His Glu Tyr Glu Thr Glu Leu Glu Asp Glu
1595 1600 1605
Arg Lys Gln Arg Ala Leu Ala Ala Ala Ala Lys Lys Lys Leu Glu
1610 1615 1620
Gly Asp Leu Lys Asp Leu Glu Leu Gln Ala Asp Ser Ala Ile Lys
1625 1630 1635
Gly Arg Glu Glu Ala Ile Lys Gln Leu Arg Lys Leu Gln Ala Gln
1640 1645 1650
Met Lys Asp Phe Gln Arg Glu Leu Glu Asp Ala Arg Ala Ser Arg
1655 1660 1665
Asp Glu Ile Phe Ala Thr Ala Lys Glu Asn Glu Lys Lys Ala Lys
1670 1675 1680
Ser Leu Glu Ala Asp Leu Met Gln Leu Gln Glu Asp Leu Ala Ala
1685 1690 1695
Ala Glu Arg Ala Arg Lys Gln Ala Asp Leu Glu Lys Glu Glu Leu
1700 1705 1710
Ala Glu Glu Leu Ala Ser Ser Leu Ser Gly Arg Asn Ala Leu Gln
1715 1720 1725
Asp Glu Lys Arg Arg Leu Glu Ala Arg Ile Ala Gln Leu Glu Glu
1730 1735 1740
Glu Leu Glu Glu Glu Gln Gly Asn Met Glu Ala Met Ser Asp Arg
1745 1750 1755
Val Arg Lys Ala Thr Gln Gln Ala Glu Gln Leu Ser Asn Glu Leu
1760 1765 1770
Ala Thr Glu Arg Ser Thr Ala Gln Lys Asn Glu Ser Ala Arg Gln
1775 1780 1785
Gln Leu Glu Arg Gln Asn Lys Glu Leu Arg Ser Lys Leu His Glu
1790 1795 1800
Met Glu Gly Ala Val Lys Ser Lys Phe Lys Ser Thr Ile Ala Ala
1805 1810 1815
Leu Glu Ala Lys Ile Ala Gln Leu Glu Glu Gln Val Glu Gln Glu
1820 1825 1830
Ala Arg Glu Lys Gln Ala Ala Thr Lys Ser Leu Lys Gln Lys Asp
1835 1840 1845
Lys Lys Leu Lys Glu Ile Leu Leu Gln Val Glu Asp Glu Arg Lys
1850 1855 1860
Met Ala Glu Gln Tyr Lys Glu Gln Ala Glu Lys Gly Asn Ala Arg
1865 1870 1875
Val Lys Gln Leu Lys Arg Gln Leu Glu Glu Ala Glu Glu Glu Ser
1880 1885 1890
Gln Arg Ile Asn Ala Asn Arg Arg Lys Leu Gln Arg Glu Leu Asp
1895 1900 1905
Glu Ala Thr Glu Ser Asn Glu Ala Met Gly Arg Glu Val Asn Ala
1910 1915 1920
Leu Lys Ser Lys Leu Arg Arg Gly Asn Glu Thr Ser Phe Val Pro
1925 1930 1935
Ser Arg Arg Ser Gly Gly Arg Arg Val Ile Glu Asn Ala Asp Gly
1940 1945 1950
Ser Glu Glu Glu Thr Asp Thr Arg Asp Ala Asp Phe Asn Gly Thr
1955 1960 1965
Lys Ala Ser Glu
1970
<210> 2
<211> 1979
<212> PRT
<213> Homo sapiens
<400> 2
Met Ala Gln Lys Gly Gln Leu Ser Asp Asp Glu Lys Phe Leu Phe Val
1 5 10 15
Asp Lys Asn Phe Ile Asn Ser Pro Val Ala Gln Ala Asp Trp Ala Ala
20 25 30
Lys Arg Leu Val Trp Val Pro Ser Glu Lys Gln Gly Phe Glu Ala Ala
35 40 45
Ser Ile Lys Glu Glu Lys Gly Asp Glu Val Val Val Glu Leu Val Glu
50 55 60
Asn Gly Lys Lys Val Thr Val Gly Lys Asp Asp Ile Gln Lys Met Asn
65 70 75 80
Pro Pro Lys Phe Ser Lys Val Glu Asp Met Ala Glu Leu Thr Cys Leu
85 90 95
Asn Glu Ala Ser Val Leu His Asn Leu Arg Glu Arg Tyr Phe Ser Gly
100 105 110
Leu Ile Tyr Thr Tyr Ser Gly Leu Phe Cys Val Val Val Asn Pro Tyr
115 120 125
Lys His Leu Pro Ile Tyr Ser Glu Lys Ile Val Asp Met Tyr Lys Gly
130 135 140
Lys Lys Arg His Glu Met Pro Pro His Ile Tyr Ala Ile Ala Asp Thr
145 150 155 160
Ala Tyr Arg Ser Met Leu Gln Asp Arg Glu Asp Gln Ser Ile Leu Cys
165 170 175
Thr Gly Glu Ser Gly Ala Gly Lys Thr Glu Asn Thr Lys Lys Val Ile
180 185 190
Gln Tyr Leu Ala Val Val Ala Ser Ser His Lys Gly Lys Lys Asp Thr
195 200 205
Ser Ile Thr Gln Gly Pro Ser Phe Ala Tyr Gly Glu Leu Glu Lys Gln
210 215 220
Leu Leu Gln Ala Asn Pro Ile Leu Glu Ala Phe Gly Asn Ala Lys Thr
225 230 235 240
Val Lys Asn Asp Asn Ser Ser Arg Phe Gly Lys Phe Ile Arg Ile Asn
245 250 255
Phe Asp Val Thr Gly Tyr Ile Val Gly Ala Asn Ile Glu Thr Tyr Leu
260 265 270
Leu Glu Lys Ser Arg Ala Ile Arg Gln Ala Arg Asp Glu Arg Thr Phe
275 280 285
His Ile Phe Tyr Tyr Met Ile Ala Gly Ala Lys Glu Lys Met Arg Ser
290 295 300
Asp Leu Leu Leu Glu Gly Phe Asn Asn Tyr Thr Phe Leu Ser Asn Gly
305 310 315 320
Phe Val Pro Ile Pro Ala Ala Gln Asp Asp Glu Met Phe Gln Glu Thr
325 330 335
Val Glu Ala Met Ala Ile Met Gly Phe Ser Glu Glu Glu Gln Leu Ser
340 345 350
Ile Leu Lys Val Val Ser Ser Val Leu Gln Leu Gly Asn Ile Val Phe
355 360 365
Lys Lys Glu Arg Asn Thr Asp Gln Ala Ser Met Pro Asp Asn Thr Ala
370 375 380
Ala Gln Lys Val Cys His Leu Met Gly Ile Asn Val Thr Asp Phe Thr
385 390 395 400
Arg Ser Ile Leu Thr Pro Arg Ile Lys Val Gly Arg Asp Val Val Gln
405 410 415
Lys Ala Gln Thr Lys Glu Gln Ala Asp Phe Ala Val Glu Ala Leu Ala
420 425 430
Lys Ala Thr Tyr Glu Arg Leu Phe Arg Trp Ile Leu Thr Arg Val Asn
435 440 445
Lys Ala Leu Asp Lys Thr His Arg Gln Gly Ala Ser Phe Leu Gly Ile
450 455 460
Leu Asp Ile Ala Gly Phe Glu Ile Phe Glu Val Asn Ser Phe Glu Gln
465 470 475 480
Leu Cys Ile Asn Tyr Thr Asn Glu Lys Leu Gln Gln Leu Phe Asn His
485 490 495
Thr Met Phe Ile Leu Glu Gln Glu Glu Tyr Gln Arg Glu Gly Ile Glu
500 505 510
Trp Asn Phe Ile Asp Phe Gly Leu Asp Leu Gln Pro Cys Ile Glu Leu
515 520 525
Ile Glu Arg Pro Asn Asn Pro Pro Gly Val Leu Ala Leu Leu Asp Glu
530 535 540
Glu Cys Trp Phe Pro Lys Ala Thr Asp Lys Ser Phe Val Glu Lys Leu
545 550 555 560
Cys Thr Glu Gln Gly Ser His Pro Lys Phe Gln Lys Pro Lys Gln Leu
565 570 575
Lys Asp Lys Thr Glu Phe Ser Ile Ile His Tyr Ala Gly Lys Val Asp
580 585 590
Tyr Asn Ala Ser Ala Trp Leu Thr Lys Asn Met Asp Pro Leu Asn Asp
595 600 605
Asn Val Thr Ser Leu Leu Asn Ala Ser Ser Asp Lys Phe Val Ala Asp
610 615 620
Leu Trp Lys Asp Val Asp Arg Ile Val Gly Leu Asp Gln Met Ala Lys
625 630 635 640
Met Thr Glu Ser Ser Leu Pro Ser Ala Ser Lys Thr Lys Lys Gly Met
645 650 655
Phe Arg Thr Val Gly Gln Leu Tyr Lys Glu Gln Leu Gly Lys Leu Met
660 665 670
Thr Thr Leu Arg Asn Thr Thr Pro Asn Phe Val Arg Cys Ile Ile Pro
675 680 685
Asn His Glu Lys Arg Ser Gly Lys Leu Asp Ala Phe Leu Val Leu Glu
690 695 700
Gln Leu Arg Cys Asn Gly Val Leu Glu Gly Ile Arg Ile Cys Arg Gln
705 710 715 720
Gly Phe Pro Asn Arg Ile Val Phe Gln Glu Phe Arg Gln Arg Tyr Glu
725 730 735
Ile Leu Ala Ala Asn Ala Ile Pro Lys Gly Phe Met Asp Gly Lys Gln
740 745 750
Ala Cys Ile Leu Met Ile Lys Ala Leu Glu Leu Asp Pro Asn Leu Tyr
755 760 765
Arg Ile Gly Gln Ser Lys Ile Phe Phe Arg Thr Gly Val Leu Ala His
770 775 780
Leu Glu Glu Glu Arg Asp Leu Lys Ile Thr Asp Val Ile Met Ala Phe
785 790 795 800
Gln Ala Met Cys Arg Gly Tyr Leu Ala Arg Lys Ala Phe Ala Lys Arg
805 810 815
Gln Gln Gln Leu Thr Ala Met Lys Val Ile Gln Arg Asn Cys Ala Ala
820 825 830
Tyr Leu Lys Leu Arg Asn Trp Gln Trp Trp Arg Leu Phe Thr Lys Val
835 840 845
Lys Pro Leu Leu Gln Val Thr Arg Gln Glu Glu Glu Met Gln Ala Lys
850 855 860
Glu Asp Glu Leu Gln Lys Thr Lys Glu Arg Gln Gln Lys Ala Glu Asn
865 870 875 880
Glu Leu Lys Glu Leu Glu Gln Lys His Ser Gln Leu Thr Glu Glu Lys
885 890 895
Asn Leu Leu Gln Glu Gln Leu Gln Ala Glu Thr Glu Leu Tyr Ala Glu
900 905 910
Ala Glu Glu Met Arg Val Arg Leu Ala Ala Lys Lys Gln Glu Leu Glu
915 920 925
Glu Ile Leu His Glu Met Glu Ala Arg Leu Glu Glu Glu Glu Asp Arg
930 935 940
Gly Gln Gln Leu Gln Ala Glu Arg Lys Lys Met Ala Gln Gln Met Leu
945 950 955 960
Asp Leu Glu Glu Gln Leu Glu Glu Glu Glu Ala Ala Arg Gln Lys Leu
965 970 975
Gln Leu Glu Lys Val Thr Ala Glu Ala Lys Ile Lys Lys Leu Glu Asp
980 985 990
Glu Ile Leu Val Met Asp Asp Gln Asn Asn Lys Leu Ser Lys Glu Arg
995 1000 1005
Lys Leu Leu Glu Glu Arg Ile Ser Asp Leu Thr Thr Asn Leu Ala
1010 1015 1020
Glu Glu Glu Glu Lys Ala Lys Asn Leu Thr Lys Leu Lys Asn Lys
1025 1030 1035
His Glu Ser Met Ile Ser Glu Leu Glu Val Arg Leu Lys Lys Glu
1040 1045 1050
Glu Lys Ser Arg Gln Glu Leu Glu Lys Leu Lys Arg Lys Leu Glu
1055 1060 1065
Gly Asp Ala Ser Asp Phe His Glu Gln Ile Ala Asp Leu Gln Ala
1070 1075 1080
Gln Ile Ala Glu Leu Lys Met Gln Leu Ala Lys Lys Glu Glu Glu
1085 1090 1095
Leu Gln Ala Ala Leu Ala Arg Leu Asp Asp Glu Ile Ala Gln Lys
1100 1105 1110
Asn Asn Ala Leu Lys Lys Ile Arg Glu Leu Glu Gly His Ile Ser
1115 1120 1125
Asp Leu Gln Glu Asp Leu Asp Ser Glu Arg Ala Ala Arg Asn Lys
1130 1135 1140
Ala Glu Lys Gln Lys Arg Asp Leu Gly Glu Glu Leu Glu Ala Leu
1145 1150 1155
Lys Thr Glu Leu Glu Asp Thr Leu Asp Ser Thr Ala Thr Gln Gln
1160 1165 1170
Glu Leu Arg Ala Lys Arg Glu Gln Glu Val Thr Val Leu Lys Lys
1175 1180 1185
Ala Leu Asp Glu Glu Thr Arg Ser His Glu Ala Gln Val Gln Glu
1190 1195 1200
Met Arg Gln Lys His Ala Gln Ala Val Glu Glu Leu Thr Glu Gln
1205 1210 1215
Leu Glu Gln Phe Lys Arg Ala Lys Ala Asn Leu Asp Lys Asn Lys
1220 1225 1230
Gln Thr Leu Glu Lys Glu Asn Ala Asp Leu Ala Gly Glu Leu Arg
1235 1240 1245
Val Leu Gly Gln Ala Lys Gln Glu Val Glu His Lys Lys Lys Lys
1250 1255 1260
Leu Glu Ala Gln Val Gln Glu Leu Gln Ser Lys Cys Ser Asp Gly
1265 1270 1275
Glu Arg Ala Arg Ala Glu Leu Asn Asp Lys Val His Lys Leu Gln
1280 1285 1290
Asn Glu Val Glu Ser Val Thr Gly Met Leu Asn Glu Ala Glu Gly
1295 1300 1305
Lys Ala Ile Lys Leu Ala Lys Asp Val Ala Ser Leu Ser Ser Gln
1310 1315 1320
Leu Gln Asp Thr Gln Glu Leu Leu Gln Glu Glu Thr Arg Gln Lys
1325 1330 1335
Leu Asn Val Ser Thr Lys Leu Arg Gln Leu Glu Glu Glu Arg Asn
1340 1345 1350
Ser Leu Gln Asp Gln Leu Asp Glu Glu Met Glu Ala Lys Gln Asn
1355 1360 1365
Leu Glu Arg His Ile Ser Thr Leu Asn Ile Gln Leu Ser Asp Ser
1370 1375 1380
Lys Lys Lys Leu Gln Asp Phe Ala Ser Thr Val Glu Ala Leu Glu
1385 1390 1395
Glu Gly Lys Lys Arg Phe Gln Lys Glu Ile Glu Asn Leu Thr Gln
1400 1405 1410
Gln Tyr Glu Glu Lys Ala Ala Ala Tyr Asp Lys Leu Glu Lys Thr
1415 1420 1425
Lys Asn Arg Leu Gln Gln Glu Leu Asp Asp Leu Val Val Asp Leu
1430 1435 1440
Asp Asn Gln Arg Gln Leu Val Ser Asn Leu Glu Lys Lys Gln Arg
1445 1450 1455
Lys Phe Asp Gln Leu Leu Ala Glu Glu Lys Asn Ile Ser Ser Lys
1460 1465 1470
Tyr Ala Asp Glu Arg Asp Arg Ala Glu Ala Glu Ala Arg Glu Lys
1475 1480 1485
Glu Thr Lys Ala Leu Ser Leu Ala Arg Ala Leu Glu Glu Ala Leu
1490 1495 1500
Glu Ala Lys Glu Glu Leu Glu Arg Thr Asn Lys Met Leu Lys Ala
1505 1510 1515
Glu Met Glu Asp Leu Val Ser Ser Lys Asp Asp Val Gly Lys Asn
1520 1525 1530
Val His Glu Leu Glu Lys Ser Lys Arg Ala Leu Glu Thr Gln Met
1535 1540 1545
Glu Glu Met Lys Thr Gln Leu Glu Glu Leu Glu Asp Glu Leu Gln
1550 1555 1560
Ala Thr Glu Asp Ala Lys Leu Arg Leu Glu Val Asn Met Gln Ala
1565 1570 1575
Leu Lys Gly Gln Phe Glu Arg Asp Leu Gln Ala Arg Asp Glu Gln
1580 1585 1590
Asn Glu Glu Lys Arg Arg Gln Leu Gln Arg Gln Leu His Glu Tyr
1595 1600 1605
Glu Thr Glu Leu Glu Asp Glu Arg Lys Gln Arg Ala Leu Ala Ala
1610 1615 1620
Ala Ala Lys Lys Lys Leu Glu Gly Asp Leu Lys Asp Leu Glu Leu
1625 1630 1635
Gln Ala Asp Ser Ala Ile Lys Gly Arg Glu Glu Ala Ile Lys Gln
1640 1645 1650
Leu Arg Lys Leu Gln Ala Gln Met Lys Asp Phe Gln Arg Glu Leu
1655 1660 1665
Glu Asp Ala Arg Ala Ser Arg Asp Glu Ile Phe Ala Thr Ala Lys
1670 1675 1680
Glu Asn Glu Lys Lys Ala Lys Ser Leu Glu Ala Asp Leu Met Gln
1685 1690 1695
Leu Gln Glu Asp Leu Ala Ala Ala Glu Arg Ala Arg Lys Gln Ala
1700 1705 1710
Asp Leu Glu Lys Glu Glu Leu Ala Glu Glu Leu Ala Ser Ser Leu
1715 1720 1725
Ser Gly Arg Asn Ala Leu Gln Asp Glu Lys Arg Arg Leu Glu Ala
1730 1735 1740
Arg Ile Ala Gln Leu Glu Glu Glu Leu Glu Glu Glu Gln Gly Asn
1745 1750 1755
Met Glu Ala Met Ser Asp Arg Val Arg Lys Ala Thr Gln Gln Ala
1760 1765 1770
Glu Gln Leu Ser Asn Glu Leu Ala Thr Glu Arg Ser Thr Ala Gln
1775 1780 1785
Lys Asn Glu Ser Ala Arg Gln Gln Leu Glu Arg Gln Asn Lys Glu
1790 1795 1800
Leu Arg Ser Lys Leu His Glu Met Glu Gly Ala Val Lys Ser Lys
1805 1810 1815
Phe Lys Ser Thr Ile Ala Ala Leu Glu Ala Lys Ile Ala Gln Leu
1820 1825 1830
Glu Glu Gln Val Glu Gln Glu Ala Arg Glu Lys Gln Ala Ala Thr
1835 1840 1845
Lys Ser Leu Lys Gln Lys Asp Lys Lys Leu Lys Glu Ile Leu Leu
1850 1855 1860
Gln Val Glu Asp Glu Arg Lys Met Ala Glu Gln Tyr Lys Glu Gln
1865 1870 1875
Ala Glu Lys Gly Asn Ala Arg Val Lys Gln Leu Lys Arg Gln Leu
1880 1885 1890
Glu Glu Ala Glu Glu Glu Ser Gln Arg Ile Asn Ala Asn Arg Arg
1895 1900 1905
Lys Leu Gln Arg Glu Leu Asp Glu Ala Thr Glu Ser Asn Glu Ala
1910 1915 1920
Met Gly Arg Glu Val Asn Ala Leu Lys Ser Lys Leu Arg Arg Gly
1925 1930 1935
Asn Glu Thr Ser Phe Val Pro Ser Arg Arg Ser Gly Gly Arg Arg
1940 1945 1950
Val Ile Glu Asn Ala Asp Gly Ser Glu Glu Glu Thr Asp Thr Arg
1955 1960 1965
Asp Ala Asp Phe Asn Gly Thr Lys Ala Ser Glu
1970 1975
<210> 3
<211> 1938
<212> PRT
<213> Homo sapiens
<400> 3
Met Ala Gln Lys Gly Gln Leu Ser Asp Asp Glu Lys Phe Leu Phe Val
1 5 10 15
Asp Lys Asn Phe Ile Asn Ser Pro Val Ala Gln Ala Asp Trp Ala Ala
20 25 30
Lys Arg Leu Val Trp Val Pro Ser Glu Lys Gln Gly Phe Glu Ala Ala
35 40 45
Ser Ile Lys Glu Glu Lys Gly Asp Glu Val Val Val Glu Leu Val Glu
50 55 60
Asn Gly Lys Lys Val Thr Val Gly Lys Asp Asp Ile Gln Lys Met Asn
65 70 75 80
Pro Pro Lys Phe Ser Lys Val Glu Asp Met Ala Glu Leu Thr Cys Leu
85 90 95
Asn Glu Ala Ser Val Leu His Asn Leu Arg Glu Arg Tyr Phe Ser Gly
100 105 110
Leu Ile Tyr Thr Tyr Ser Gly Leu Phe Cys Val Val Val Asn Pro Tyr
115 120 125
Lys His Leu Pro Ile Tyr Ser Glu Lys Ile Val Asp Met Tyr Lys Gly
130 135 140
Lys Lys Arg His Glu Met Pro Pro His Ile Tyr Ala Ile Ala Asp Thr
145 150 155 160
Ala Tyr Arg Ser Met Leu Gln Asp Arg Glu Asp Gln Ser Ile Leu Cys
165 170 175
Thr Gly Glu Ser Gly Ala Gly Lys Thr Glu Asn Thr Lys Lys Val Ile
180 185 190
Gln Tyr Leu Ala Val Val Ala Ser Ser His Lys Gly Lys Lys Asp Thr
195 200 205
Ser Ile Thr Gly Glu Leu Glu Lys Gln Leu Leu Gln Ala Asn Pro Ile
210 215 220
Leu Glu Ala Phe Gly Asn Ala Lys Thr Val Lys Asn Asp Asn Ser Ser
225 230 235 240
Arg Phe Gly Lys Phe Ile Arg Ile Asn Phe Asp Val Thr Gly Tyr Ile
245 250 255
Val Gly Ala Asn Ile Glu Thr Tyr Leu Leu Glu Lys Ser Arg Ala Ile
260 265 270
Arg Gln Ala Arg Asp Glu Arg Thr Phe His Ile Phe Tyr Tyr Met Ile
275 280 285
Ala Gly Ala Lys Glu Lys Met Arg Ser Asp Leu Leu Leu Glu Gly Phe
290 295 300
Asn Asn Tyr Thr Phe Leu Ser Asn Gly Phe Val Pro Ile Pro Ala Ala
305 310 315 320
Gln Asp Asp Glu Met Phe Gln Glu Thr Val Glu Ala Met Ala Ile Met
325 330 335
Gly Phe Ser Glu Glu Glu Gln Leu Ser Ile Leu Lys Val Val Ser Ser
340 345 350
Val Leu Gln Leu Gly Asn Ile Val Phe Lys Lys Glu Arg Asn Thr Asp
355 360 365
Gln Ala Ser Met Pro Asp Asn Thr Ala Ala Gln Lys Val Cys His Leu
370 375 380
Met Gly Ile Asn Val Thr Asp Phe Thr Arg Ser Ile Leu Thr Pro Arg
385 390 395 400
Ile Lys Val Gly Arg Asp Val Val Gln Lys Ala Gln Thr Lys Glu Gln
405 410 415
Ala Asp Phe Ala Val Glu Ala Leu Ala Lys Ala Thr Tyr Glu Arg Leu
420 425 430
Phe Arg Trp Ile Leu Thr Arg Val Asn Lys Ala Leu Asp Lys Thr His
435 440 445
Arg Gln Gly Ala Ser Phe Leu Gly Ile Leu Asp Ile Ala Gly Phe Glu
450 455 460
Ile Phe Glu Val Asn Ser Phe Glu Gln Leu Cys Ile Asn Tyr Thr Asn
465 470 475 480
Glu Lys Leu Gln Gln Leu Phe Asn His Thr Met Phe Ile Leu Glu Gln
485 490 495
Glu Glu Tyr Gln Arg Glu Gly Ile Glu Trp Asn Phe Ile Asp Phe Gly
500 505 510
Leu Asp Leu Gln Pro Cys Ile Glu Leu Ile Glu Arg Pro Asn Asn Pro
515 520 525
Pro Gly Val Leu Ala Leu Leu Asp Glu Glu Cys Trp Phe Pro Lys Ala
530 535 540
Thr Asp Lys Ser Phe Val Glu Lys Leu Cys Thr Glu Gln Gly Ser His
545 550 555 560
Pro Lys Phe Gln Lys Pro Lys Gln Leu Lys Asp Lys Thr Glu Phe Ser
565 570 575
Ile Ile His Tyr Ala Gly Lys Val Asp Tyr Asn Ala Ser Ala Trp Leu
580 585 590
Thr Lys Asn Met Asp Pro Leu Asn Asp Asn Val Thr Ser Leu Leu Asn
595 600 605
Ala Ser Ser Asp Lys Phe Val Ala Asp Leu Trp Lys Asp Val Asp Arg
610 615 620
Ile Val Gly Leu Asp Gln Met Ala Lys Met Thr Glu Ser Ser Leu Pro
625 630 635 640
Ser Ala Ser Lys Thr Lys Lys Gly Met Phe Arg Thr Val Gly Gln Leu
645 650 655
Tyr Lys Glu Gln Leu Gly Lys Leu Met Thr Thr Leu Arg Asn Thr Thr
660 665 670
Pro Asn Phe Val Arg Cys Ile Ile Pro Asn His Glu Lys Arg Ser Gly
675 680 685
Lys Leu Asp Ala Phe Leu Val Leu Glu Gln Leu Arg Cys Asn Gly Val
690 695 700
Leu Glu Gly Ile Arg Ile Cys Arg Gln Gly Phe Pro Asn Arg Ile Val
705 710 715 720
Phe Gln Glu Phe Arg Gln Arg Tyr Glu Ile Leu Ala Ala Asn Ala Ile
725 730 735
Pro Lys Gly Phe Met Asp Gly Lys Gln Ala Cys Ile Leu Met Ile Lys
740 745 750
Ala Leu Glu Leu Asp Pro Asn Leu Tyr Arg Ile Gly Gln Ser Lys Ile
755 760 765
Phe Phe Arg Thr Gly Val Leu Ala His Leu Glu Glu Glu Arg Asp Leu
770 775 780
Lys Ile Thr Asp Val Ile Met Ala Phe Gln Ala Met Cys Arg Gly Tyr
785 790 795 800
Leu Ala Arg Lys Ala Phe Ala Lys Arg Gln Gln Gln Leu Thr Ala Met
805 810 815
Lys Val Ile Gln Arg Asn Cys Ala Ala Tyr Leu Lys Leu Arg Asn Trp
820 825 830
Gln Trp Trp Arg Leu Phe Thr Lys Val Lys Pro Leu Leu Gln Val Thr
835 840 845
Arg Gln Glu Glu Glu Met Gln Ala Lys Glu Asp Glu Leu Gln Lys Thr
850 855 860
Lys Glu Arg Gln Gln Lys Ala Glu Asn Glu Leu Lys Glu Leu Glu Gln
865 870 875 880
Lys His Ser Gln Leu Thr Glu Glu Lys Asn Leu Leu Gln Glu Gln Leu
885 890 895
Gln Ala Glu Thr Glu Leu Tyr Ala Glu Ala Glu Glu Met Arg Val Arg
900 905 910
Leu Ala Ala Lys Lys Gln Glu Leu Glu Glu Ile Leu His Glu Met Glu
915 920 925
Ala Arg Leu Glu Glu Glu Glu Asp Arg Gly Gln Gln Leu Gln Ala Glu
930 935 940
Arg Lys Lys Met Ala Gln Gln Met Leu Asp Leu Glu Glu Gln Leu Glu
945 950 955 960
Glu Glu Glu Ala Ala Arg Gln Lys Leu Gln Leu Glu Lys Val Thr Ala
965 970 975
Glu Ala Lys Ile Lys Lys Leu Glu Asp Glu Ile Leu Val Met Asp Asp
980 985 990
Gln Asn Asn Lys Leu Ser Lys Glu Arg Lys Leu Leu Glu Glu Arg Ile
995 1000 1005
Ser Asp Leu Thr Thr Asn Leu Ala Glu Glu Glu Glu Lys Ala Lys
1010 1015 1020
Asn Leu Thr Lys Leu Lys Asn Lys His Glu Ser Met Ile Ser Glu
1025 1030 1035
Leu Glu Val Arg Leu Lys Lys Glu Glu Lys Ser Arg Gln Glu Leu
1040 1045 1050
Glu Lys Leu Lys Arg Lys Leu Glu Gly Asp Ala Ser Asp Phe His
1055 1060 1065
Glu Gln Ile Ala Asp Leu Gln Ala Gln Ile Ala Glu Leu Lys Met
1070 1075 1080
Gln Leu Ala Lys Lys Glu Glu Glu Leu Gln Ala Ala Leu Ala Arg
1085 1090 1095
Leu Asp Asp Glu Ile Ala Gln Lys Asn Asn Ala Leu Lys Lys Ile
1100 1105 1110
Arg Glu Leu Glu Gly His Ile Ser Asp Leu Gln Glu Asp Leu Asp
1115 1120 1125
Ser Glu Arg Ala Ala Arg Asn Lys Ala Glu Lys Gln Lys Arg Asp
1130 1135 1140
Leu Gly Glu Glu Leu Glu Ala Leu Lys Thr Glu Leu Glu Asp Thr
1145 1150 1155
Leu Asp Ser Thr Ala Thr Gln Gln Glu Leu Arg Ala Lys Arg Glu
1160 1165 1170
Gln Glu Val Thr Val Leu Lys Lys Ala Leu Asp Glu Glu Thr Arg
1175 1180 1185
Ser His Glu Ala Gln Val Gln Glu Met Arg Gln Lys His Ala Gln
1190 1195 1200
Ala Val Glu Glu Leu Thr Glu Gln Leu Glu Gln Phe Lys Arg Ala
1205 1210 1215
Lys Ala Asn Leu Asp Lys Asn Lys Gln Thr Leu Glu Lys Glu Asn
1220 1225 1230
Ala Asp Leu Ala Gly Glu Leu Arg Val Leu Gly Gln Ala Lys Gln
1235 1240 1245
Glu Val Glu His Lys Lys Lys Lys Leu Glu Ala Gln Val Gln Glu
1250 1255 1260
Leu Gln Ser Lys Cys Ser Asp Gly Glu Arg Ala Arg Ala Glu Leu
1265 1270 1275
Asn Asp Lys Val His Lys Leu Gln Asn Glu Val Glu Ser Val Thr
1280 1285 1290
Gly Met Leu Asn Glu Ala Glu Gly Lys Ala Ile Lys Leu Ala Lys
1295 1300 1305
Asp Val Ala Ser Leu Ser Ser Gln Leu Gln Asp Thr Gln Glu Leu
1310 1315 1320
Leu Gln Glu Glu Thr Arg Gln Lys Leu Asn Val Ser Thr Lys Leu
1325 1330 1335
Arg Gln Leu Glu Glu Glu Arg Asn Ser Leu Gln Asp Gln Leu Asp
1340 1345 1350
Glu Glu Met Glu Ala Lys Gln Asn Leu Glu Arg His Ile Ser Thr
1355 1360 1365
Leu Asn Ile Gln Leu Ser Asp Ser Lys Lys Lys Leu Gln Asp Phe
1370 1375 1380
Ala Ser Thr Val Glu Ala Leu Glu Glu Gly Lys Lys Arg Phe Gln
1385 1390 1395
Lys Glu Ile Glu Asn Leu Thr Gln Gln Tyr Glu Glu Lys Ala Ala
1400 1405 1410
Ala Tyr Asp Lys Leu Glu Lys Thr Lys Asn Arg Leu Gln Gln Glu
1415 1420 1425
Leu Asp Asp Leu Val Val Asp Leu Asp Asn Gln Arg Gln Leu Val
1430 1435 1440
Ser Asn Leu Glu Lys Lys Gln Arg Lys Phe Asp Gln Leu Leu Ala
1445 1450 1455
Glu Glu Lys Asn Ile Ser Ser Lys Tyr Ala Asp Glu Arg Asp Arg
1460 1465 1470
Ala Glu Ala Glu Ala Arg Glu Lys Glu Thr Lys Ala Leu Ser Leu
1475 1480 1485
Ala Arg Ala Leu Glu Glu Ala Leu Glu Ala Lys Glu Glu Leu Glu
1490 1495 1500
Arg Thr Asn Lys Met Leu Lys Ala Glu Met Glu Asp Leu Val Ser
1505 1510 1515
Ser Lys Asp Asp Val Gly Lys Asn Val His Glu Leu Glu Lys Ser
1520 1525 1530
Lys Arg Ala Leu Glu Thr Gln Met Glu Glu Met Lys Thr Gln Leu
1535 1540 1545
Glu Glu Leu Glu Asp Glu Leu Gln Ala Thr Glu Asp Ala Lys Leu
1550 1555 1560
Arg Leu Glu Val Asn Met Gln Ala Leu Lys Gly Gln Phe Glu Arg
1565 1570 1575
Asp Leu Gln Ala Arg Asp Glu Gln Asn Glu Glu Lys Arg Arg Gln
1580 1585 1590
Leu Gln Arg Gln Leu His Glu Tyr Glu Thr Glu Leu Glu Asp Glu
1595 1600 1605
Arg Lys Gln Arg Ala Leu Ala Ala Ala Ala Lys Lys Lys Leu Glu
1610 1615 1620
Gly Asp Leu Lys Asp Leu Glu Leu Gln Ala Asp Ser Ala Ile Lys
1625 1630 1635
Gly Arg Glu Glu Ala Ile Lys Gln Leu Arg Lys Leu Gln Ala Gln
1640 1645 1650
Met Lys Asp Phe Gln Arg Glu Leu Glu Asp Ala Arg Ala Ser Arg
1655 1660 1665
Asp Glu Ile Phe Ala Thr Ala Lys Glu Asn Glu Lys Lys Ala Lys
1670 1675 1680
Ser Leu Glu Ala Asp Leu Met Gln Leu Gln Glu Asp Leu Ala Ala
1685 1690 1695
Ala Glu Arg Ala Arg Lys Gln Ala Asp Leu Glu Lys Glu Glu Leu
1700 1705 1710
Ala Glu Glu Leu Ala Ser Ser Leu Ser Gly Arg Asn Ala Leu Gln
1715 1720 1725
Asp Glu Lys Arg Arg Leu Glu Ala Arg Ile Ala Gln Leu Glu Glu
1730 1735 1740
Glu Leu Glu Glu Glu Gln Gly Asn Met Glu Ala Met Ser Asp Arg
1745 1750 1755
Val Arg Lys Ala Thr Gln Gln Ala Glu Gln Leu Ser Asn Glu Leu
1760 1765 1770
Ala Thr Glu Arg Ser Thr Ala Gln Lys Asn Glu Ser Ala Arg Gln
1775 1780 1785
Gln Leu Glu Arg Gln Asn Lys Glu Leu Arg Ser Lys Leu His Glu
1790 1795 1800
Met Glu Gly Ala Val Lys Ser Lys Phe Lys Ser Thr Ile Ala Ala
1805 1810 1815
Leu Glu Ala Lys Ile Ala Gln Leu Glu Glu Gln Val Glu Gln Glu
1820 1825 1830
Ala Arg Glu Lys Gln Ala Ala Thr Lys Ser Leu Lys Gln Lys Asp
1835 1840 1845
Lys Lys Leu Lys Glu Ile Leu Leu Gln Val Glu Asp Glu Arg Lys
1850 1855 1860
Met Ala Glu Gln Tyr Lys Glu Gln Ala Glu Lys Gly Asn Ala Arg
1865 1870 1875
Val Lys Gln Leu Lys Arg Gln Leu Glu Glu Ala Glu Glu Glu Ser
1880 1885 1890
Gln Arg Ile Asn Ala Asn Arg Arg Lys Leu Gln Arg Glu Leu Asp
1895 1900 1905
Glu Ala Thr Glu Ser Asn Glu Ala Met Gly Arg Glu Val Asn Ala
1910 1915 1920
Leu Lys Ser Lys Leu Arg Gly Pro Pro Pro Gln Glu Thr Ser Gln
1925 1930 1935
<210> 4
<211> 1945
<212> PRT
<213> Homo sapiens
<400> 4
Met Ala Gln Lys Gly Gln Leu Ser Asp Asp Glu Lys Phe Leu Phe Val
1 5 10 15
Asp Lys Asn Phe Ile Asn Ser Pro Val Ala Gln Ala Asp Trp Ala Ala
20 25 30
Lys Arg Leu Val Trp Val Pro Ser Glu Lys Gln Gly Phe Glu Ala Ala
35 40 45
Ser Ile Lys Glu Glu Lys Gly Asp Glu Val Val Val Glu Leu Val Glu
50 55 60
Asn Gly Lys Lys Val Thr Val Gly Lys Asp Asp Ile Gln Lys Met Asn
65 70 75 80
Pro Pro Lys Phe Ser Lys Val Glu Asp Met Ala Glu Leu Thr Cys Leu
85 90 95
Asn Glu Ala Ser Val Leu His Asn Leu Arg Glu Arg Tyr Phe Ser Gly
100 105 110
Leu Ile Tyr Thr Tyr Ser Gly Leu Phe Cys Val Val Val Asn Pro Tyr
115 120 125
Lys His Leu Pro Ile Tyr Ser Glu Lys Ile Val Asp Met Tyr Lys Gly
130 135 140
Lys Lys Arg His Glu Met Pro Pro His Ile Tyr Ala Ile Ala Asp Thr
145 150 155 160
Ala Tyr Arg Ser Met Leu Gln Asp Arg Glu Asp Gln Ser Ile Leu Cys
165 170 175
Thr Gly Glu Ser Gly Ala Gly Lys Thr Glu Asn Thr Lys Lys Val Ile
180 185 190
Gln Tyr Leu Ala Val Val Ala Ser Ser His Lys Gly Lys Lys Asp Thr
195 200 205
Ser Ile Thr Gln Gly Pro Ser Phe Ala Tyr Gly Glu Leu Glu Lys Gln
210 215 220
Leu Leu Gln Ala Asn Pro Ile Leu Glu Ala Phe Gly Asn Ala Lys Thr
225 230 235 240
Val Lys Asn Asp Asn Ser Ser Arg Phe Gly Lys Phe Ile Arg Ile Asn
245 250 255
Phe Asp Val Thr Gly Tyr Ile Val Gly Ala Asn Ile Glu Thr Tyr Leu
260 265 270
Leu Glu Lys Ser Arg Ala Ile Arg Gln Ala Arg Asp Glu Arg Thr Phe
275 280 285
His Ile Phe Tyr Tyr Met Ile Ala Gly Ala Lys Glu Lys Met Arg Ser
290 295 300
Asp Leu Leu Leu Glu Gly Phe Asn Asn Tyr Thr Phe Leu Ser Asn Gly
305 310 315 320
Phe Val Pro Ile Pro Ala Ala Gln Asp Asp Glu Met Phe Gln Glu Thr
325 330 335
Val Glu Ala Met Ala Ile Met Gly Phe Ser Glu Glu Glu Gln Leu Ser
340 345 350
Ile Leu Lys Val Val Ser Ser Val Leu Gln Leu Gly Asn Ile Val Phe
355 360 365
Lys Lys Glu Arg Asn Thr Asp Gln Ala Ser Met Pro Asp Asn Thr Ala
370 375 380
Ala Gln Lys Val Cys His Leu Met Gly Ile Asn Val Thr Asp Phe Thr
385 390 395 400
Arg Ser Ile Leu Thr Pro Arg Ile Lys Val Gly Arg Asp Val Val Gln
405 410 415
Lys Ala Gln Thr Lys Glu Gln Ala Asp Phe Ala Val Glu Ala Leu Ala
420 425 430
Lys Ala Thr Tyr Glu Arg Leu Phe Arg Trp Ile Leu Thr Arg Val Asn
435 440 445
Lys Ala Leu Asp Lys Thr His Arg Gln Gly Ala Ser Phe Leu Gly Ile
450 455 460
Leu Asp Ile Ala Gly Phe Glu Ile Phe Glu Val Asn Ser Phe Glu Gln
465 470 475 480
Leu Cys Ile Asn Tyr Thr Asn Glu Lys Leu Gln Gln Leu Phe Asn His
485 490 495
Thr Met Phe Ile Leu Glu Gln Glu Glu Tyr Gln Arg Glu Gly Ile Glu
500 505 510
Trp Asn Phe Ile Asp Phe Gly Leu Asp Leu Gln Pro Cys Ile Glu Leu
515 520 525
Ile Glu Arg Pro Asn Asn Pro Pro Gly Val Leu Ala Leu Leu Asp Glu
530 535 540
Glu Cys Trp Phe Pro Lys Ala Thr Asp Lys Ser Phe Val Glu Lys Leu
545 550 555 560
Cys Thr Glu Gln Gly Ser His Pro Lys Phe Gln Lys Pro Lys Gln Leu
565 570 575
Lys Asp Lys Thr Glu Phe Ser Ile Ile His Tyr Ala Gly Lys Val Asp
580 585 590
Tyr Asn Ala Ser Ala Trp Leu Thr Lys Asn Met Asp Pro Leu Asn Asp
595 600 605
Asn Val Thr Ser Leu Leu Asn Ala Ser Ser Asp Lys Phe Val Ala Asp
610 615 620
Leu Trp Lys Asp Val Asp Arg Ile Val Gly Leu Asp Gln Met Ala Lys
625 630 635 640
Met Thr Glu Ser Ser Leu Pro Ser Ala Ser Lys Thr Lys Lys Gly Met
645 650 655
Phe Arg Thr Val Gly Gln Leu Tyr Lys Glu Gln Leu Gly Lys Leu Met
660 665 670
Thr Thr Leu Arg Asn Thr Thr Pro Asn Phe Val Arg Cys Ile Ile Pro
675 680 685
Asn His Glu Lys Arg Ser Gly Lys Leu Asp Ala Phe Leu Val Leu Glu
690 695 700
Gln Leu Arg Cys Asn Gly Val Leu Glu Gly Ile Arg Ile Cys Arg Gln
705 710 715 720
Gly Phe Pro Asn Arg Ile Val Phe Gln Glu Phe Arg Gln Arg Tyr Glu
725 730 735
Ile Leu Ala Ala Asn Ala Ile Pro Lys Gly Phe Met Asp Gly Lys Gln
740 745 750
Ala Cys Ile Leu Met Ile Lys Ala Leu Glu Leu Asp Pro Asn Leu Tyr
755 760 765
Arg Ile Gly Gln Ser Lys Ile Phe Phe Arg Thr Gly Val Leu Ala His
770 775 780
Leu Glu Glu Glu Arg Asp Leu Lys Ile Thr Asp Val Ile Met Ala Phe
785 790 795 800
Gln Ala Met Cys Arg Gly Tyr Leu Ala Arg Lys Ala Phe Ala Lys Arg
805 810 815
Gln Gln Gln Leu Thr Ala Met Lys Val Ile Gln Arg Asn Cys Ala Ala
820 825 830
Tyr Leu Lys Leu Arg Asn Trp Gln Trp Trp Arg Leu Phe Thr Lys Val
835 840 845
Lys Pro Leu Leu Gln Val Thr Arg Gln Glu Glu Glu Met Gln Ala Lys
850 855 860
Glu Asp Glu Leu Gln Lys Thr Lys Glu Arg Gln Gln Lys Ala Glu Asn
865 870 875 880
Glu Leu Lys Glu Leu Glu Gln Lys His Ser Gln Leu Thr Glu Glu Lys
885 890 895
Asn Leu Leu Gln Glu Gln Leu Gln Ala Glu Thr Glu Leu Tyr Ala Glu
900 905 910
Ala Glu Glu Met Arg Val Arg Leu Ala Ala Lys Lys Gln Glu Leu Glu
915 920 925
Glu Ile Leu His Glu Met Glu Ala Arg Leu Glu Glu Glu Glu Asp Arg
930 935 940
Gly Gln Gln Leu Gln Ala Glu Arg Lys Lys Met Ala Gln Gln Met Leu
945 950 955 960
Asp Leu Glu Glu Gln Leu Glu Glu Glu Glu Ala Ala Arg Gln Lys Leu
965 970 975
Gln Leu Glu Lys Val Thr Ala Glu Ala Lys Ile Lys Lys Leu Glu Asp
980 985 990
Glu Ile Leu Val Met Asp Asp Gln Asn Asn Lys Leu Ser Lys Glu Arg
995 1000 1005
Lys Leu Leu Glu Glu Arg Ile Ser Asp Leu Thr Thr Asn Leu Ala
1010 1015 1020
Glu Glu Glu Glu Lys Ala Lys Asn Leu Thr Lys Leu Lys Asn Lys
1025 1030 1035
His Glu Ser Met Ile Ser Glu Leu Glu Val Arg Leu Lys Lys Glu
1040 1045 1050
Glu Lys Ser Arg Gln Glu Leu Glu Lys Leu Lys Arg Lys Leu Glu
1055 1060 1065
Gly Asp Ala Ser Asp Phe His Glu Gln Ile Ala Asp Leu Gln Ala
1070 1075 1080
Gln Ile Ala Glu Leu Lys Met Gln Leu Ala Lys Lys Glu Glu Glu
1085 1090 1095
Leu Gln Ala Ala Leu Ala Arg Leu Asp Asp Glu Ile Ala Gln Lys
1100 1105 1110
Asn Asn Ala Leu Lys Lys Ile Arg Glu Leu Glu Gly His Ile Ser
1115 1120 1125
Asp Leu Gln Glu Asp Leu Asp Ser Glu Arg Ala Ala Arg Asn Lys
1130 1135 1140
Ala Glu Lys Gln Lys Arg Asp Leu Gly Glu Glu Leu Glu Ala Leu
1145 1150 1155
Lys Thr Glu Leu Glu Asp Thr Leu Asp Ser Thr Ala Thr Gln Gln
1160 1165 1170
Glu Leu Arg Ala Lys Arg Glu Gln Glu Val Thr Val Leu Lys Lys
1175 1180 1185
Ala Leu Asp Glu Glu Thr Arg Ser His Glu Ala Gln Val Gln Glu
1190 1195 1200
Met Arg Gln Lys His Ala Gln Ala Val Glu Glu Leu Thr Glu Gln
1205 1210 1215
Leu Glu Gln Phe Lys Arg Ala Lys Ala Asn Leu Asp Lys Asn Lys
1220 1225 1230
Gln Thr Leu Glu Lys Glu Asn Ala Asp Leu Ala Gly Glu Leu Arg
1235 1240 1245
Val Leu Gly Gln Ala Lys Gln Glu Val Glu His Lys Lys Lys Lys
1250 1255 1260
Leu Glu Ala Gln Val Gln Glu Leu Gln Ser Lys Cys Ser Asp Gly
1265 1270 1275
Glu Arg Ala Arg Ala Glu Leu Asn Asp Lys Val His Lys Leu Gln
1280 1285 1290
Asn Glu Val Glu Ser Val Thr Gly Met Leu Asn Glu Ala Glu Gly
1295 1300 1305
Lys Ala Ile Lys Leu Ala Lys Asp Val Ala Ser Leu Ser Ser Gln
1310 1315 1320
Leu Gln Asp Thr Gln Glu Leu Leu Gln Glu Glu Thr Arg Gln Lys
1325 1330 1335
Leu Asn Val Ser Thr Lys Leu Arg Gln Leu Glu Glu Glu Arg Asn
1340 1345 1350
Ser Leu Gln Asp Gln Leu Asp Glu Glu Met Glu Ala Lys Gln Asn
1355 1360 1365
Leu Glu Arg His Ile Ser Thr Leu Asn Ile Gln Leu Ser Asp Ser
1370 1375 1380
Lys Lys Lys Leu Gln Asp Phe Ala Ser Thr Val Glu Ala Leu Glu
1385 1390 1395
Glu Gly Lys Lys Arg Phe Gln Lys Glu Ile Glu Asn Leu Thr Gln
1400 1405 1410
Gln Tyr Glu Glu Lys Ala Ala Ala Tyr Asp Lys Leu Glu Lys Thr
1415 1420 1425
Lys Asn Arg Leu Gln Gln Glu Leu Asp Asp Leu Val Val Asp Leu
1430 1435 1440
Asp Asn Gln Arg Gln Leu Val Ser Asn Leu Glu Lys Lys Gln Arg
1445 1450 1455
Lys Phe Asp Gln Leu Leu Ala Glu Glu Lys Asn Ile Ser Ser Lys
1460 1465 1470
Tyr Ala Asp Glu Arg Asp Arg Ala Glu Ala Glu Ala Arg Glu Lys
1475 1480 1485
Glu Thr Lys Ala Leu Ser Leu Ala Arg Ala Leu Glu Glu Ala Leu
1490 1495 1500
Glu Ala Lys Glu Glu Leu Glu Arg Thr Asn Lys Met Leu Lys Ala
1505 1510 1515
Glu Met Glu Asp Leu Val Ser Ser Lys Asp Asp Val Gly Lys Asn
1520 1525 1530
Val His Glu Leu Glu Lys Ser Lys Arg Ala Leu Glu Thr Gln Met
1535 1540 1545
Glu Glu Met Lys Thr Gln Leu Glu Glu Leu Glu Asp Glu Leu Gln
1550 1555 1560
Ala Thr Glu Asp Ala Lys Leu Arg Leu Glu Val Asn Met Gln Ala
1565 1570 1575
Leu Lys Gly Gln Phe Glu Arg Asp Leu Gln Ala Arg Asp Glu Gln
1580 1585 1590
Asn Glu Glu Lys Arg Arg Gln Leu Gln Arg Gln Leu His Glu Tyr
1595 1600 1605
Glu Thr Glu Leu Glu Asp Glu Arg Lys Gln Arg Ala Leu Ala Ala
1610 1615 1620
Ala Ala Lys Lys Lys Leu Glu Gly Asp Leu Lys Asp Leu Glu Leu
1625 1630 1635
Gln Ala Asp Ser Ala Ile Lys Gly Arg Glu Glu Ala Ile Lys Gln
1640 1645 1650
Leu Arg Lys Leu Gln Ala Gln Met Lys Asp Phe Gln Arg Glu Leu
1655 1660 1665
Glu Asp Ala Arg Ala Ser Arg Asp Glu Ile Phe Ala Thr Ala Lys
1670 1675 1680
Glu Asn Glu Lys Lys Ala Lys Ser Leu Glu Ala Asp Leu Met Gln
1685 1690 1695
Leu Gln Glu Asp Leu Ala Ala Ala Glu Arg Ala Arg Lys Gln Ala
1700 1705 1710
Asp Leu Glu Lys Glu Glu Leu Ala Glu Glu Leu Ala Ser Ser Leu
1715 1720 1725
Ser Gly Arg Asn Ala Leu Gln Asp Glu Lys Arg Arg Leu Glu Ala
1730 1735 1740
Arg Ile Ala Gln Leu Glu Glu Glu Leu Glu Glu Glu Gln Gly Asn
1745 1750 1755
Met Glu Ala Met Ser Asp Arg Val Arg Lys Ala Thr Gln Gln Ala
1760 1765 1770
Glu Gln Leu Ser Asn Glu Leu Ala Thr Glu Arg Ser Thr Ala Gln
1775 1780 1785
Lys Asn Glu Ser Ala Arg Gln Gln Leu Glu Arg Gln Asn Lys Glu
1790 1795 1800
Leu Arg Ser Lys Leu His Glu Met Glu Gly Ala Val Lys Ser Lys
1805 1810 1815
Phe Lys Ser Thr Ile Ala Ala Leu Glu Ala Lys Ile Ala Gln Leu
1820 1825 1830
Glu Glu Gln Val Glu Gln Glu Ala Arg Glu Lys Gln Ala Ala Thr
1835 1840 1845
Lys Ser Leu Lys Gln Lys Asp Lys Lys Leu Lys Glu Ile Leu Leu
1850 1855 1860
Gln Val Glu Asp Glu Arg Lys Met Ala Glu Gln Tyr Lys Glu Gln
1865 1870 1875
Ala Glu Lys Gly Asn Ala Arg Val Lys Gln Leu Lys Arg Gln Leu
1880 1885 1890
Glu Glu Ala Glu Glu Glu Ser Gln Arg Ile Asn Ala Asn Arg Arg
1895 1900 1905
Lys Leu Gln Arg Glu Leu Asp Glu Ala Thr Glu Ser Asn Glu Ala
1910 1915 1920
Met Gly Arg Glu Val Asn Ala Leu Lys Ser Lys Leu Arg Gly Pro
1925 1930 1935
Pro Pro Gln Glu Thr Ser Gln
1940 1945
- 还没有人留言评论。精彩留言会获得点赞!