RANTES检测试剂在制备结直肠癌诊断剂方面的应用的制作方法
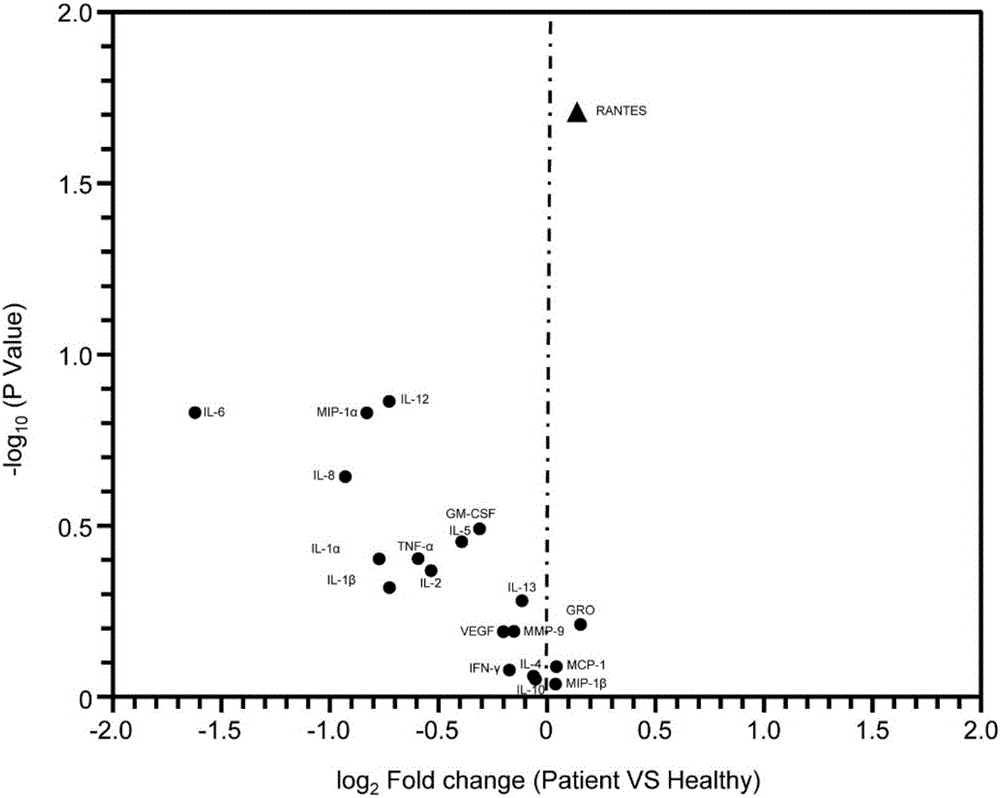
本发明属于生物医药领域,涉及rantes的检测试剂在制备结肠直肠癌诊断试剂/试剂盒中的应用和一种结肠直肠癌诊断的试剂/试剂盒。发明背景结直肠癌(colorectalcancer,crc)是最常见的消化道恶性肿瘤,是世界第二大癌症,其高发病率和致死率分别位于第三位和第四位。近年来随着我国人民生活水平的提高、生活方式的改变以及人口老龄化,结直肠癌在我国的发病率呈现逐渐上升的趋势,居我国恶性肿瘤发病率第三位和死亡率第五位,严重威胁着人们的健康和生命。早发现、早诊断、早治疗是治疗结直肠癌的关键。但是结直肠癌初期多数没有明显症状,随病情进展多以“肠炎”就诊,使得大部分结直肠癌患者确诊时已处于肿瘤进展期,失去了最佳的治疗时机,导致其五年生存率不到20%,预后较差。因此,探索结直肠癌早期、快速、大规模的诊断方法,提高诊疗水平,是目前防治结直肠癌亟待解决的问题。目前临床上广泛使用的结直肠癌诊断方法主要是排泄物隐血试验(fobt)、柔性乙状结肠镜检查、结肠镜检查和ct结肠成像等。但是,这些检测方法都存在一定的局限性。如排泄物检查分离过程繁琐,易受细菌、食物及肠道粘液等的干扰,同时它的特异性也相对较低、假阳性率相对较高,另外由于其具有令人不快的性质,限制了它作为筛选工具的有用性;结肠镜检查是现行的金标准,并且具有较高的特异性,但是由于它的侵入性并具有一定的并发症风险,同时对检测设备和检测人员的技术要求较高,使得了结肠镜检查的依从性不高,误诊率较大。相对于粪便、组织或结肠镜侵入而言,血液更易获取,患者更易接受,其作为早期筛查的媒介具有更大的价值。血清肿瘤标志物检测因其取样快速、方便、安全,已成为用于肿瘤早期诊断、鉴别及分期指导、肿瘤复发转移判断的常用手段。人血清出含有多样的促/抑炎性因子,并且这些促/抑炎性因子伴随机体的疾病进展而波动,在机体稳态调节中发挥着重要的作用。与其他蛋白分子相比,血浆中促/抑炎性也能够代表机体免疫反应的方向和状态,这使得血浆中不同促/抑炎性因子在感染相关疾病及肿瘤诊断及开发应用上具有广阔的前景。技术实现要素:本发明的目的在于提供一种特异性强、灵敏度高的结肠直肠癌的分子标志物,以及该分子标志物的诊断试剂及其应用。本发明的上述目的通过以下技术手段实现:一方面,本发明提供了rantes的检测试剂在制备结肠直肠癌诊断试剂/试剂盒中的应用。趋化性细胞因子对白细胞的趋化作用是炎症反应过程中的重要起始步骤,也是机体防御和清除入侵病原体等异物先天性免疫功能的一个重要方面,参与多种炎症和免疫反应。受激活调节正常t细胞表达和分泌因子(regulateduponactivationnormaltcellexpressesandsecretedfactor,rantes)是趋化性细胞因子cc亚族成员,也称为ccl5。其通过与受体ccr1(chemokinereceptor1)、ccr2(chemokinereceptor2)、ccr4(chemokinereceptor2)、ccr5(chemokinereceptor5)结合,特异性趋化t细胞、单核细胞和嗜酸性细胞,在免疫反应中对t细胞的活化发挥重要作用。虽然已经有报道炎症跟结直肠癌的进展有关,但仍有许多机制尚未探索(刘兆龙,王强.肠道炎症在结肠直肠癌发生中作用的研究进展[j].外科理论与实践,2006,5:025.)。且尚未发现趋化性细胞因子rantes与结肠直肠癌的联系。本发明发明人收集了健康人血液(更优选采用血浆样本)和结直肠癌患者的血浆样本进行检测,通过数据处理分析,得到标准化的不同血浆促/抑炎因子丰度,发现,细胞因子—rantes差异表达,可以作为结直肠癌诊断生物标记物。所述rantes的检测试剂为检测rantes的mrna的表达量;或者检测rantes蛋白的表达量,或者检测rantes蛋白的生物活性中的一种或几种几种。作为本发明中一种优选的实施方式,所述的rantes的检测试剂为检测rantes蛋白的表达量。作为优选的实施方式,rantes蛋白的表达量即表示rantes在检测样品中的浓度;作为更优选的实施方式,表示rantes在血浆中的浓度。作为优选的实施方式,所述的检测试剂为抗体、抗体功能性片段或者偶联抗体。更进一步地,所述的偶联抗体为荧光素偶联抗体或生物酶偶联抗体。其中,所述的抗体可能是单克隆抗体,多克隆抗体,多价抗体,多特异性抗体(例如:双特异性抗体),和/或连接在蛋白酶体上的抗体片段。该抗体可以是嵌合抗体、人源化抗体、cdr移植抗体或人型抗体。抗体片段可以是,例如,fab,fab’,f(ab’)2,fv,fd,单链fv(scfv),具二硫键的fv(sdfv),或vl、vh结构域。抗体可能是一个共轭的形式,例如,结合一个标签、一个可检测标记,或一种细胞毒性剂。抗体可能是同型igg(例如:igg1、igg2、igg3、igg4)、iga、igm、ige或igd。作为优选的实施方式,所述试剂盒为elisa试剂盒,进一步地,是基于抗人rantes偶联抗体的elisa试剂盒,该检测试剂盒用于检测rantes蛋白的表达量。所述的检测试剂的检测方法为elisa法、蛋白芯片法、液相色谱法、免疫比浊法、流式细胞法中的任意一种或几种;作为优选的实施方式,所述的检测试剂的检测方法为蛋白芯片法、elisa法或免疫比浊法中的一种或几种。当检测到rantes蛋白的表达量≥959.7pg/ml,则结直肠癌高风险,当检测到rantes蛋白的表达量≤946.1pg/ml则结直肠癌低风险。当rantes蛋白的表达量介于这两者之间,为不定风险,建议补充其他的现有的或者新开发的诊断方式进行疾病的筛查。作为本发明一种示范性的实施方式,rantes的表达量的计算方法可以采用标准曲线法。作为优选的实施方式,检测试剂所检测样品为血液。作为更优选的实施方式,所述的检测样品为血浆。另一方面,本发明还提供了一种直肠癌诊断的试剂/试剂盒,所述的试剂/试剂盒含有rantes的检测试剂。rantes的检测试剂如上所述。另一方面,本发明还提供了一种结肠直肠癌诊断的芯片,该芯片包括固相载体以及固定于固相载体上的生物标志物rantes的探针。作为优选的实施方式,所述的芯片为蛋白芯片。另一方面,本发明还提供了一种肠直肠癌诊断系统,该检测系统含有:a)检测构件:所述的检测构件用以检测诊断对象的rantes的表达量;b)结果判断构件:所述的结果判断构件用于根据检测构件所检测的rantes的表达量得出结肠直肠癌的患病的可能性或者风险值;作为优选的实施方式,所述的检测构件为酶标仪、激光扫描仪、流式细胞仪、液相色谱仪中的一种或几种;作为优选的实施方式,所述的检测构件为酶标仪、激光扫描仪中的一种或两种;作为优选的实施方式,所述的结果判断构件为软件,其含有输入模块、分析模块和输出模块;输入模块用于输入rantes的表达量;分析模块用于根据rantes的表达量,分析出结肠直肠癌患病可能性或者风险值;输出模块用于输出分析模块的分析结果;其中,所述的系统中,rantes的表达量为rantes的mrna的表达量;或者为rantes蛋白的表达量。作为优选的实施方式,所述的检测构件检测的是rantes蛋白的表达量。作为优选的实施方式,所述的结构判断构件中,当rantes蛋白的表达量≥959.7pg/ml,则结直肠癌高风险,当rantes蛋白的表达量≤946.1pg/ml,则结直肠癌低风险。其中,所述的诊断系统的诊断样品为血液;优选为血浆。本发明的有益效果:(1)本发明首次发现,在众多的免疫球蛋白亚型中,rantes差异表达,其可作为结肠直肠的生物标志物,且具有良好的特异性、灵敏度。(2)本发明检测试剂的检测对象为血液,相比于现有的排泄物隐血试验(fobt),排泄物检查分离过程繁琐,易受细菌、食物及肠道粘液等的干扰,同时它的特异性也相对较低、假阳性率相对较高其具有令人不快的性质,血液更易获取,患者更易接受,其作为早期筛查的媒介具有更大的价值。附图说明图1为差异免疫球蛋白亚型火山图。图2为25例健康人及35例结直肠癌病人血浆中rantes浓度比较。图3为细胞因子标准品梯度稀释图。具体实施方式以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。实施例1差异免疫球蛋白亚型的表达分析实验方法:首先收集中山大学附属第六医院25例健康人及35例结直肠癌患者血浆,通过以下步骤获得筛选出差异细胞因子:1.通过枸橼酸钠抗凝采血管收取3-5cm健康人或结直肠癌患者全血;2.500g转速下离心10分钟,血细胞沉淀后吸取得到血浆上层;3.收集血浆上层清液再通过2000g转速下离心15min的到去除沉淀后血浆样本;4.分装冻存于-80℃冰箱;5.采用瑞博奥蛋白芯片(型号qah-cyt-1)对血浆样本进行检测:(1)玻片芯片的完全干燥玻片芯片从盒子中取出来,在室温平衡20-30min后,将包装袋打开,揭开密封条,然后将芯片放在真空干燥器或者室温干燥1-2小时。(2)标准品的配置细胞因子标准品梯度稀释见图3。添加500μl的样品稀释液(samplediluent)到细胞因子标准混合物的小管中,重新溶解标准品。打开小管前,先快速的离心,轻轻的上下吹打溶解粉末,标记这个小管为std1。分别标记6个干净的离心管为std2、std3到std7,添加200μl的样品稀释液到每个小管中。抽取100μl的std1加入到std2中轻轻混合,然后从std2中抽取100μl加入到std3中,如此梯度稀释至std7。抽取100μl的样品稀释液到另一个新的离心管中,标记为cntrl,作为阴性对照。注:因为每种细胞因子的起始浓度是不同的,所以std1到std7的梯度稀释后,每个细胞因子的系列浓度是不同的。(3)芯片操作流程(a)每个孔中加100μl的样品稀释液,室温摇床上孵育1h,封闭定量抗体芯片。(b)抽去每个孔中的缓冲液,添加100μl的标准液和样品到孔中,4℃过夜孵育。(样品2倍稀释)(c)使用thermoscientificwellwashversa芯片洗板机清洗玻片,分为两步,首先用1×洗液i进行清洗,每孔250μl的1×洗液i,清洗10次,每次震荡10s,震荡强度选择高,用去离子水稀释20×洗液i。然后换用1×洗液ii通道进行清洗,每孔250μl的1×洗液ii,清洗6次,每次震荡10s,震荡强度选择高,用去离子水稀释20×洗液ii。(d)检测抗体混合物的孵育,离心检测抗体混合物小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。添加80μl的检测抗体到每个孔中,rt摇床上孵育2小时。(e)清洗,同步骤(c)(f)cy3-链霉亲和素的孵育,离心cy3-链霉亲和素小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。添加80μl的cy3-链霉亲和素到每个孔中,用铝箔纸包住玻片避光孵育,rt摇床上孵育1个小时。(g)清洗,同步骤(c)(h)荧光检测,采用激光扫描仪例如innoscan300扫描信号,采用cy3或者绿色通道(激发频率=532nm),仪器型号:innoscan300microarrayscanner,厂家:innopsys,扫描参数:wavelengh:532nm;resolution:10μm,采用qah-cyt-1的数据分析软件来进行数据分析。6.对检测数据进行标准化处理,对比分析各种促/抑炎性因子在两组样本中的表达情况。分析数据:1.数据质量控制绘制不同抗体类型的标准曲线后我们得到每个细胞因子的可信检测范围(bestcofidentrange),超过最大值(%abovemax)或者低于检测限(%belowlod)的样品会影响可信度(%inbestcofidence)。下表1代表着2倍稀释下不同细胞因子读值的质量。数据质量控制的结果见表1。表1不同细胞因子浓度检测的质量控制表1说明:血浆检测中,大部分炎性因子表达水平较低,只有il-1a,mcp-1,mip-1b,mmp9,rantes,vegf可信度较高(高于90%)。2.健康人及肠癌患者血浆rantes浓度比较比较25例健康人及35例结直肠癌病人血浆rantes的浓度(见图2)。健康人组均值=903.2pg/ml,sem=28.84,置信区间(846.7—959.7)结直肠癌组均值=995.3pg/ml,sem=25.10,置信区间(946.1-1044.5.4)p采用t检验计算得到。3.差异免疫球蛋白火山图分析为了检测差异表达蛋白,我们对2倍稀释后样品不同细胞因子浓度值进行比较,比较后得到两组间每个细胞因子变化倍数(log2foldchange,log2fc)和t检验后p值(-log10pvalue,pvalue)差异表达蛋白(deps)是指p值小于0.05(-log10pvalue大于1.3),并且变化倍数大于1.2倍或小0.83倍的蛋白。差异免疫球蛋白火山图分析的结果见图1和表2。表2不同细胞因子的浓度值结直肠癌组平均健康人组平均病人vs健康倍数log2值两组p值proteinidmean_emean_clog2fcpvalueil-1a43.3011108274.78087491-0.7744909220.39509il-1b9.96674033817.15295031-0.7270692660.479534il-24.7765707547.37182633-0.5353290890.428048il-41.4986338751.608795126-0.0622441320.869255il-53.3890793644.766052957-0.393665730.352232il-618.6036259659.39437769-1.6232937260.147528il-82.9959558086.615378488-0.9303751130.227171il-1010.2854956810.70923226-0.05317670.887519il-12p700.7592859861.913399209-0.7277133770.136934il-130.5726849750.70323333-0.1150463740.523381gm-csf0.9562406111.426470132-0.3107752730.323078gro138.1805247124.12127870.1536301910.61409ifng23.0740454826.16160769-0.1740902780.835626mcp-186.775821784.221468480.0426066850.815398mip-1a4.3221355848.467450593-0.8309707230.14794mip-1b139.411452135.66828340.0389821320.91754mmp-92545.3880372830.88381-0.153309790.643596rantes497.6380712451.60904130.1397276330.019571tnfa11.3760206617.68371972-0.5942341980.394391vegf45.3490886552.27920875-0.2010316850.644927从分析结果去看:和健康人相比,结直肠癌患者血浆中大部分炎性因子都下调表达,只有少量炎性因子rantes,gro,mcp-1,mip-1β上调表达,并且这些因子浓度都为pg级别。此外,分析结果显示血浆中mmp9下调,而有大量的现有报道认为肿瘤细胞高分泌mmp9(请补充具体的参考文献)。由此可见,肿瘤分泌因子和血浆中上调表达不是同一个概念,要在众多的微量级别的炎性因子中寻找一个可作为标志物具有很大的不确定性。而本发明发现了rantes可以作为存在于血浆的标记物,以血液采样的方式即可实现较好的预诊效果,这对减轻待测人群的取样痛苦,以及实现较为普及性的预诊筛查,具有非常重大的意义。其中,仅有rantes具有显著性的差异,由表2可知:和健康人组(c组)相比均值=451.609,rantes在结直肠癌患者组(e组)中显著高表达均值=497.6381,p值约为0.019。4.灵敏度和特异性根据2中,健康人及肠癌患者血浆rantes浓度的置信区间,可知,当rantes蛋白的表达量≥959.7pg/ml,则结直肠癌高风险,当rantes蛋白的表达量≤946.1pg/ml,则结直肠癌低风险。我们把25例健康人及35例结直肠癌患者的rantes浓度与该范围比较,得到rantes的灵敏度:23/35=65.7%,特异度:14/25=56%。相比于现有技术中单一血清学因子检测来说,和结直肠癌常见的cea、ca50相比,rantes具有更高的灵敏度更高,具有更高的临床实用意义。本发明发现了rantes可以作为存在于血浆的标记物,以血液采样的方式即可实现较好的预诊效果,这对减轻待测人群的取样痛苦,以及实现较为普及性的预诊筛查,具有非常重大的意义。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1