一种微流控芯片及循环外泌体的检测方法与流程
本发明属于微全分析系统的生物学检测技术领域,具体地,本发明涉及一种微流控芯片及循环外泌体的检测方法。
背景技术:
循环外泌体是细胞分泌或从细胞膜上脱落的一种具有双层膜结构的30-150nm之间囊泡状小体,是细胞间传递信息的主要媒介,在生理或病理条件下皆发挥着重要的调节作用。循环外泌体包裹了mrna、microrna和dna等组分,携带了大量重要信息,因此通过对其分析检测对于癌症在内的多种疾病的诊断具有很好的实际意义和应用价值。
微流控技术是一门在微通道内操控流体的科学技术,在微细加工技术与纳米材料科学的推动下,微流控技术在生物、医学及化学等多个领域内扮演着日益重要的角色,其中生物分析是其最主要,也是最为成熟的应用领域。当前常规的外泌体检测技术,如westernblot和elisa(酶联免疫吸附测定),存在灵敏度低、所需样本量多,操作步骤繁琐(需要进行预提取)的缺陷,难以满足实际应用的需求。而微流控技术应是解决上述问题的一种理想手段,同时有望将细胞外囊泡检测及早应用于疾病的即时诊断。
因此,本领域亟需开发一种用于检测循环外泌体的方法,用于预防和诊断疾病。
技术实现要素:
本发明的的目的在于提供一种简单、快速、高效检测环外泌体的微流控芯片及循环外泌体的检测方法。
本发明的第一方面,提供一种微流控芯片,所述微流控芯片包括:一微流控通道,所述微流控通道设有通道入口、通道出口和至少一个用于捕获外泌体的捕获段;
其中,所述捕获段从外至内包括基体层、位于所述基体层上的zn基材料层、位于所述zn基材料层上的表面修饰层和负载于所述表面修饰层上的捕获抗体,所述捕获抗体用于捕获外泌体。
在另一优选例中,所述zn基材料层为zn基纳米结构阵列。
在另一优选例中,所述zn基材料选自下组:zno、zn(oh)f、zno/zn(oh)f,或其组合。
在另一优选例中,所述纳米结构阵列为纳米棒或由纳米棒组成的网络状结构。
在另一优选例中,所述纳米棒直径为10-500nm。
在另一优选例中,所述纳米棒长度为100-30000nm。
在另一优选例中,所述zn基材料层是经修饰或未修饰的。
在另一优选例中,所述表面修饰层的材料选自下组:阴离子聚电解质、硅烷偶联剂,或其组合。
在另一优选例中,所述阴离子聚电解质选自下组:聚苯乙烯磺酸钠、聚乙烯磺酸钾、聚丙烯酰胺,或其组合。
在另一优选例中,所述硅烷偶联剂选自下组:3-缩水甘油基氧基丙基三甲氧基硅烷、3-氨丙基三乙氧基硅烷,3-(三甲氧基甲硅基)甲基丙烯酸丙酯,或其组合。
在另一优选例中,所述微流控通道的基体的内径为100-1000μm,外径尺寸为内径尺寸110-200%。
在另一优选例中,所述微流控通道的基体为毛细管。
在另一优选例中,所述微流控通道的长度为1-10cm,优选地1-5cm。
在另一优选例中,所述微流控通道的基体的材质为硅酸盐,优选石英或玻璃。
在另一优选例中,所述捕获抗体选自下组:anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。
本发明第二方面,提供一种试剂盒,所述试剂盒包括:
(a)如本发明第一方面所述微流控芯片;和
(b)免疫金纳米粒和/或荧光抗体。
在另一优选例中,所述免疫金纳米粒表面负载的抗体选自下组:anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。
在另一优选例中,所述免疫金纳米粒为球状或棒状。
在另一优选例中,所述免疫金纳米粒的尺寸大小为20-150nm。
在另一优选例中,所述荧光抗体选自下组:anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。
在另一优选例中,所述捕获抗体、免疫金纳米粒表面负载的抗体和荧光抗体所分别针不同的循环外泌体表面特异性标志物。
本发明第三方面,提供一种用如本发明第一方面所述微流控芯片检测循环外泌体的方法,所述方法包括步骤:
(1)向微流控通道中注入待测样本,使待测样本中的循环外泌体与负载于所述表面修饰层上的捕获抗体结合后,清洗微流控通道,完成对循环外泌体的捕获;
(2)向微流控通道通入荧光抗体和/或免疫金纳米粒,使荧光抗体和/或免疫金纳米粒与循环外泌体结合后,清洗;
(3)进行荧光测定和/或表面增强拉曼光谱测定。
在另一优选例中,所述方法是非诊断性和非治疗性的。
在另一优选例中,所述免疫金纳米粒表面负载的抗体选自下组:anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。
在另一优选例中,所述免疫金纳米粒为球状或棒状。
在另一优选例中,所述免疫金纳米粒的尺寸大小为20-150nm。
在另一优选例中,,所述荧光抗体选自下组:anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。
在另一优选例中,所述捕获抗体、免疫金纳米粒表面负载的抗体和荧光抗体所分别针不同的循环外泌体表面特异性标志物。
本发明的第四方面提供一种装置,所述装置包括:
如本发明第一方面所述微流控芯片、与所述微流控芯片的通道入口和通道出口连接的管路、和载体;
其中所述的微流控芯片位于载体上。
在另一优选例中,所述管路的材质为聚四氟乙烯管。
在另一优选例中,所述管路的内径大小为100-1000μm。
在另一优选例中,所述管路的外径大小为内径大小的110-200%。
在另一优选例中,所述微流控通道位于一载体上。
在另一优选例中,所述载体为载玻片。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
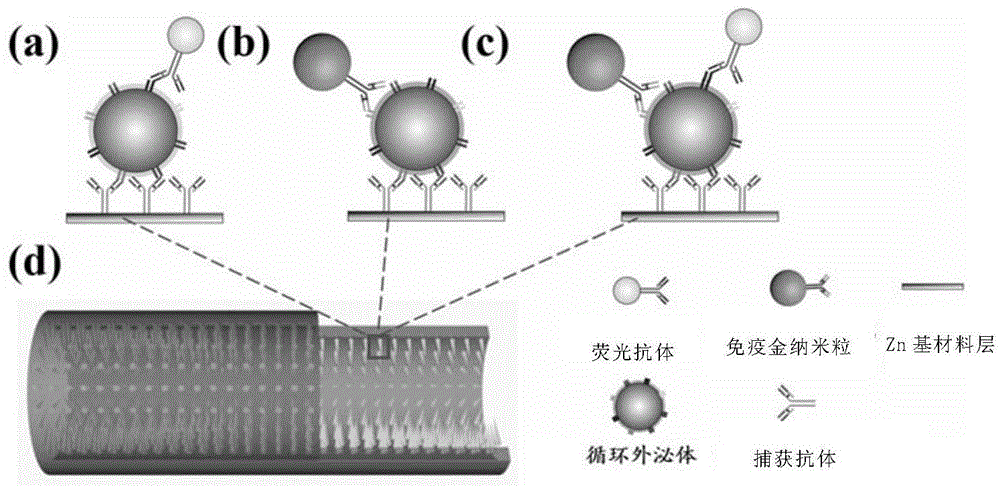
图1为本发明一个优选实施例中微流控通道的捕获段示意图。
图2是本发明一个优选例中基于免疫荧光与表面增强拉曼光谱(sers)联用的循环外泌体检测示意图。
图3是本发明一个优选实施例中装置的结构示意图。
图4是本发明实施例1中毛细管内zno纳米棒阵列的sem图。
图5是本发明实施例1和对比例1中的微流控芯片检测sgc-996胆囊癌细胞系来源的外泌体的荧光显微照片,(a)空白毛细管微通道;(b)zno修饰的毛细管微通道。
图6是本发明实施例2中毛细管内zno/zn(oh)f纳米棒阵列的sem图。
图7是本发明实施例2和对比例2中的微流控芯片对取自胆囊癌病人血样中分泌的外泌体进行sers检测的表面增强拉曼光谱。(a)空白毛细管微通道;(b)zn基化合物修饰的毛细管微通道。
图8是本发明实施例3和对比例3中的微流控芯片对取自胰腺癌病人血样中的循环外泌体进行sers检测的表面增强拉曼光谱,(a)空白毛细管微通道;(b)zn基化合物修饰的毛细管微通道。
具体实施方式
本发明人经过广泛而又深入的研究,首次开发了一种结构新颖的微流控芯片。本发明人意外地发现,在微流控芯片的捕获段的内表面采用特定的zn基材料层时,可以更高效地负载多种捕获抗体,并显著提高对循环外泌体检测效率和检测灵敏度,并可以进行荧光与拉曼光谱双重分析,且简化操作步骤,所需检测样本量少,是一种简单、快速、高效、适用于即时检测的方法。基于以上发现,发明人完成了本发明。
术语
如本发明所用,术语“包括”和“包含”可互换使用,不仅包括开放式定义,还包括封闭式、和半封闭式定义。换言之,所述术语包括了“由……构成”、“基本上由……构成”。
微流控芯片
本发明提供一种微流控芯片,所述微流控芯片包括:一微流控通道,所述微流控通道设有通道入口、通道出口和至少一个用于捕获外泌体的捕获段;
其中,所述捕获段从外至内包括基体层、位于所述基体层上的zn基材料层、位于所述zn基材料层上的表面修饰层和负载于所述表面修饰层上的捕获抗体,所述捕获抗体用于捕获外泌体。在本发明的一个优选例中,所述zn基材料层为zn基纳米结构阵列。优选地,所述纳米结构阵列为纳米棒或由纳米棒组成的网络状结构。在另一优选例中,所述纳米棒直径为10-500nm。在另一优选例中,所述纳米棒长度为100-30000nm。在另一优选例中,所述zn基材料层是经修饰或未修饰的。
在另一优选例中,所述zn基材料包括(但不限于):zno、zn(oh)f、zno/zn(oh)f,或其组合。
本发明所述微流控通道的捕获段示意图如图1所示。
所述zn基材料层能够明显增强荧光检测强度,由于外泌体是一种尺寸在30-150nm之间的细胞外囊泡,所述zn基材料层从微纳结构入手是提高外泌体检测灵敏度,且所述zn基材料层可有效的增大接触面积,从而可以更易捕获及固定目标外泌体,能够有效负载捕获抗体,提高捕获抗体的负载量。
在本发明的在另一优选例中,所述微流控通道的基体的内径为100-1000μm,外径尺寸为内径尺寸110-200%。
所述微流控通道的基体构成所述微流控通道的基体层,所述微流控通道的基体的内径和外径大小既能够保证所述微流控通道的流通顺畅,也能够保证循环外泌体与所述捕获抗体的充分结合,提高检测效率和灵敏度。
在另一优选例中,所述微流控通道的长度为1-10cm,优选地1-5cm。在另一优选例中,所述微流控通道的基体为毛细管。优选地,所述微流控通道的基体的材质为硅酸盐,优选石英或玻璃。
在另一优选例中,所述表面修饰层的材料选自:阴离子聚电解质、硅烷偶联剂,或其组合。
代表性的,所述阴离子聚电解质包括(但不限于):聚苯乙烯磺酸钠、聚乙烯磺酸钾、聚丙烯酰胺,或其组合。
代表性的,所述硅烷偶联剂包括(但不限于):3-缩水甘油基氧基丙基三甲氧基硅烷、3-氨丙基三乙氧基硅烷,3-(三甲氧基甲硅基)甲基丙烯酸丙酯,或其组合。
在另一优选例中,所述捕获抗体包括(但不限于):anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。应当理解的是,所述捕获抗体能够特异性的与循环外泌体结合,根据不同的循环外泌体的测定需要,选择不同的捕获抗体。
试剂盒
本发明提供了一种试剂盒,所述试剂盒包括:
(a)本发明所述微流控芯片;和
(b)免疫金纳米粒和/或荧光抗体。
在本发明的一个优选例中,所述免疫金纳米粒表面负载的抗体包括(但不限于):anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。在另一优选例中,所述免疫金纳米粒为球状或棒状。在另一优选例中,所述免疫金纳米粒的尺寸大小为20-150nm。
在另一优选例中,所述荧光抗体包括(但不限于):anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。
应当理解的是,所述免疫金纳米粒和/或荧光抗体能够特异性的与循环外泌体结合,根据不同的循环外泌体的测定需要,选择不同的免疫金纳米粒和/或荧光抗体。
在另一优选例中,所述试剂盒中,所述捕获抗体、免疫金纳米粒表面负载的抗体和荧光抗体所分别针不同的循环外泌体表面特异性标志物。在另一优选例中,所述捕获抗体、免疫金纳米粒表面负载的抗体和荧光抗体不同。
检测方法
本发明还提供了一种用本发明所述微流控芯片检测检测循环外泌体的方法,所述方法包括步骤:
(1)向微流控通道中注入待测样本,使待测样本中的循环外泌体与负载于所述表面修饰层上的捕获抗体结合后,清洗微流控通道,完成对循环外泌体的捕获;
(2)向微流控通道通入荧光抗体和/或免疫金纳米粒,使荧光抗体和/或免疫金纳米粒与循环外泌体结合后,清洗;
(3)进行荧光测定和/或表面增强拉曼光谱测定。
所述的基于免疫荧光与表面增强拉曼光谱(sers)联用的循环外泌体检测示意图如图2所示。
在另一优选例中,所述方法是非诊断性和非治疗性的。
所述检测方法将微流控芯片、免疫荧光检测及表面增强拉曼光谱检测相结合,具有微流控芯片的高效、快速和样品用量小,zn基化合物纳米棒的荧光增强特性与微纳结构特性,免疫金纳米粒的拉曼信号增强特性等优点,可有效提高循环外泌体的检测效率与检测灵敏度,简化操作步骤,降低所需检测样本量,是一种简单、快速、高效、适用于即时检测的方法。
在另一个优选例中,所述免疫金纳米粒表面负载的抗体包括(但不限于):anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。在另一优选例中,所述免疫金纳米粒为球状或棒状。在另一优选例中,所述免疫金纳米粒的尺寸大小为20-150nm。
在另一优选例中,所述荧光抗体包括(但不限于):anti-cd63、anti-cd81、anti-cd9、anti-epcam,或其组合。
应当理解的是,所述免疫金纳米粒和/或荧光抗体能够特异性的与循环外泌体结合,根据不同的循环外泌体的测定需要,选择不同的免疫金纳米粒和/或荧光抗体。
在另一优选例中,所述试剂盒中,所述捕获抗体、免疫金纳米粒表面负载的抗体和荧光抗体所分别针不同的循环外泌体表面特异性标志物。在另一优选例中,所述捕获抗体、免疫金纳米粒表面负载的抗体和荧光抗体不同。
装置
本发明还提供一种装置,所述装置包括:
本发明所述微流控芯片、与所述微流控芯片的通道入口和通道出口连接的管路、和载体;
其中所述的微流控芯片位于载体上。
在另一优选例中,与所述微流控芯片的通道入口连接的管路和与与所述微流控芯片的通道出口连接的管路是相同的,包括材质、内径和外径大小等等。
在另一优选例中,所述管路的材质为聚四氟乙烯管。
在另一优选例中,所述管路的内径大小为100-1000μm。
在另一优选例中,所述管路的外径大小为内径大小的110-200%。
在另一优选例中,所述微流控通道位于一载体上。
在另一优选例中,所述载体为载玻片。
一种优选的所述装置的制备方法,包括步骤:
选用普通玻璃载玻片(尺寸7.5×2.5cm)作为所述载体,选用石英毛细管(内径为100μm,外径为200μm,长度为3cm)作为本发明所述微流控通道的基体,采用紫外光固化剂将所述石英毛细管与所述普通载玻片粘合,选用所述聚四氟乙烯管与所述微流控芯片的通道入口和通道出口连接的管路,使用环氧树脂将所述聚四氟乙烯管与所述石英毛细管进行粘合,由此完成所述装置的制备,结构如图3所示。
此外,石英毛细管的尺寸大小还可以是内径为530μm、外径为700μm,长度为3cm或内径为300μm,外径为400μm,长度为3cm。
本发明的主要优点包括:
(1)本发明所述的微流控芯片的集成化分析能力和抗原-抗体反应的特异性相结合,可在单一微流控芯片上完成对循环外泌体的免疫荧光检测与表面增强拉曼光谱检测,从而能够对循环外泌体进行准确的分析。
(2)本发明所述微流控芯片具有高效、快速和样品用量小,zn基材料层能够明显增强荧光检测强度,由于外泌体是一种尺寸在30-150nm之间的细胞外囊泡,所述zn基材料层从微纳结构入手是提高循环外泌体检测效率和检测灵敏度,且所述zn基材料层可有效的增大接触面积,从而可以更易捕获及固定目标外泌体,且化操作步骤,降低所需检测样本量,是一种简单、快速、高效、适用于即时检测的方法。
(3)本发明通过免疫荧光检测及表面增强拉曼光谱检测结合能够准确的对循环外泌体进行分析,能够广泛应用于生命和医学科学等领域。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1
具有zn基材料层的微流控芯片no.1的制备和测试
1.微流控通道的制备
1.1zn基化合物纳米棒结合在基体上
配置zno的反应液,将一定量的硝酸锌、乙醇胺与氨水进行混合,采用恒流注射泵将反应液注入微流控通道的石英毛细管(管内径为100μm,外径为200μm)基体上,在75摄氏度下反应1小时,后用去离子水以25μl/min清洗以去除残留的反应物质;后向微通道内注入聚苯乙烯磺酸钠溶液,待孵育1小时后,通入去离子水清洗,完成zn基化合物纳米棒结合在微流控通道的基体上,其中毛细管内zno纳米棒阵列的sem如图4所示。
1.2捕获抗体负载在zn基化合物纳米棒上
所述zn基化合物纳米棒结合在所述基体上后,以25μl/min注入速度通入含有anti-cd63抗体的edc/nhs溶液,待注满后停留2小时,后通入pbs缓冲液清洗,完成捕获抗体结合在zn基化合物纳米棒表面上。
2循环外泌体的捕获
收集sgc-996胆囊癌细胞系的细胞培养上清液,先经低速离心,后采用孔径为0.22μm的滤膜过滤后,收集处理后的细胞上清液,加入dio染料对循环外泌体进行标记;以25μlmin-1的注入速度将处理后的细胞上清液注入微流控通道中,待测样品注满微流控通道后停止注入,停留10分钟后,最后用pbs缓冲液以2mlh-1的流速清洗10分钟以除去剩余样本液,完成微流控通道对循环外泌体的捕获。
3荧光抗体和免疫金纳米粒的固定
向上述微流控通道内以25μl/min的流速通入anti-cd9的荧光抗体,待微流控通道注满后停止注入,常温孵育1小时,在用pbs缓冲液清洗后,以5μl/min的流速通入表面修饰有anti-cd81的免疫金纳米粒(1×1012particleml-1,连续通入5分钟后停止注入,后用pbs缓冲液清洗微流控通道,完成荧光抗体和免疫金纳米粒的固定。
对比例1
不具有zn基材料层的微流控芯片no.c1的制备和测试
重复实施例1的步骤1.1和1.2,不同点仅在于,省略形成zn基化合物纳米棒的步骤,而采用未经处理的石英毛细管作为基体,用聚苯乙烯磺酸钠溶液对基体进行修饰,再进行anti-cd63捕获抗体的修饰,获得通道内固定有捕获抗体的毛细管通道c1。
重复实施例1的步骤2和3,不同点在于采用如上制备的毛细管通道c1,进行循环外泌体的捕获和荧光抗体和免疫金纳米粒的固定。
测试例1
在本测试例中,对实施例1和对比例1的微流控芯片的循环外泌体性能,通过荧光测定和表面增强拉曼光谱测定进行检测。
1.荧光检测
采用荧光显微镜对实施例1和对比例1的微通道区域进行观察,并进行图像采集。
结果如图5所示,其中绿色荧光为dio染料标记的循环外泌体。结果表明,相较于未结合zn基材料层的毛细管微通道c1,zno修饰微流控通道可以对外泌体进行更为高效的捕获。
实施例2
具有zn基材料层的微流控芯片no.2的制备和测试
1微流控通道的制备
1.1zn基化合物纳米棒结合在基体上
配置zno/zn(oh)f复合物的反应液,将一定量的硝酸锌、六亚甲基四胺与氟化铵进行混合,采用恒流注射泵将反应液注入微流控通道石英毛细管(管内径为200μm)基体上在90摄氏度下反应1小时,后用去离子水以25μl/min注入速度清洗以去除残留的反应物质;后向微通道内注入聚乙烯磺酸钾溶液,待孵育1小时后,通入去离子水清洗微流控通道,完成zn基化合物纳米棒结合在微流控通道的基体上,其中毛细管内zno/zn(oh)f纳米棒阵列的sem如图6所示。
1.2捕获抗体负载在zn基化合物纳米棒上
所述zn基化合物纳米棒结合在所述基体上后,以25μl/min注入速度通入含有anti-cd81抗体的edc/nhs溶液,待注满后停留2小时,后通入pbs缓冲液清洗,完成捕获抗体结合在zn基化合物纳米棒表面上。
2.循环外泌体的捕获
抽取得到胆囊癌患者的血液样本,先经低速离心,后采用孔径为0.22μm的滤膜过滤后,收集处理后的血浆样本,加入dio染料对循环外泌体进行标记;以25μl/min的注入速度将处理后的血浆样本注入微流控芯片中,待样本注满微流控通道后停止注入,停留10分钟,最后用pbs缓冲液以2ml/h的流速清洗芯片10分钟以除去剩余样本液,完成微流控通道对循环外泌体的捕获。
3荧光抗体和免疫金纳米粒的固定
向上述微流控芯片以25μl/min的流速通入anti-cd81的荧光抗体,待微流控通道注满后停止注入,常温孵育1小时,在用pbs缓冲液清洗后,以5μl/min的流速通入表面修饰有anti-cd63的金纳米粒(1×1012particle/ml),连续通入5分钟后停止注入,后用pbs缓冲液清洗微流控通道,完成荧光抗体和免疫金纳米粒的捕获。
对比例2
不具有zn基材料层的微流控芯片no.c2的制备和测试
重复实施例2的步骤1.1和1.2,不同点仅在于,省略形成zn基化合物纳米棒的步骤,而采用未经处理的石英毛细管作为基体,用聚乙烯磺酸钾溶液对基体进行修饰,再进行anti-cd81捕获抗体的修饰,获得通道内固定有捕获抗体的毛细管通道c2。
重复实施例2的步骤2和3,不同点在于采用如上制备的毛细管通道c2,进行循环外泌体的捕获和荧光抗体和免疫金纳米粒的固定。
测试例2
在本测试例中,对实施例2和对比例2的微流控芯片的循环外泌体性能,通过荧光测定和表面增强拉曼光谱测定进行检测。
1表面增强拉曼光谱测定
结果如图7所示,相较于未结合zn基材料层的毛细管微通道c2,zno/zn(oh)f修饰微流控通道获得信噪更高的拉曼光谱信号,并且得到更明显的外泌体拉曼光谱特征峰,其中1328cm-1处是ch3ch2的峰,1288cm-1处的峰归属于胞核嘧啶,914cm-1处的峰归属于葡萄糖,1350-1400cm-1处的峰为毛细管微通道的表面增强拉曼光谱信号。
实施例3
1微流控通道的制备
具有zn基材料层的微流控芯片no.3的制备和测试
1.1zn基化合物纳米棒结合在基体上
配置zno的反应液,将一定量的硝酸锌,乙醇胺与氨水进行混合,采用恒流注射泵将反应液注入石英毛细管(管内径为500μm)基体上,在90摄氏度下反应1小时,后用去离子水以25μl/min清洗以去除残留的反应物质;先向微通道内注入3-氨丙基三乙氧基硅烷的乙醇溶液,置于室温1小时后,清洗微通道并注入聚丙烯酰胺溶液,待孵育1小时后,通入去离子水清洗,完成zn基化合物纳米棒结合在微流控通道的基体上。
1.2捕获抗体负载在zn基化合物纳米棒表面
所述zn基化合物纳米棒结合在所述基体上后,以25μl/min注入速度通入含有anti-epcam抗体的edc/nhs溶液,待注满后停留2小时,后通入pbs缓冲液清洗,完成捕获抗体结合在zn基化合物纳米棒表面上。
2循环外泌体的捕获
抽取得到胰腺癌患者的血液样本,先经低速离心,后采用孔径为0.22μm的滤膜过滤后,收集处理后的血浆样本,加入dio染料对循环外泌体进行标记;以25μl/min的注入速度将处理后的血浆样本注入微流控芯片中,待样本注满微流控通道后停止注入,停留10分钟,最后用pbs缓冲液以2ml/h的流速清洗芯片10分钟以除去剩余样本液,完成微流控通道对循环外泌体的捕获。
3荧光抗体和免疫金纳米粒的固定
向上述微流控芯片以25μl/min的流速通入anti-cd63的荧光抗体(1:100比例稀释),待微流控通道注满后停止注入,常温孵育1小时,在用pbs缓冲液清洗后,以5μl/min的流速通入表面修饰有anti-cd9的金纳米粒(1×1012particle/ml),连续通入5分钟后停止注入,后用pbs缓冲液清洗微流控通道,完成荧光抗体和免疫金纳米粒的捕获。
对比例3
不具有zn基材料层的微流控芯片no.c3的制备和测试
重复实施例3的步骤1.1和1.2,不同点仅在于,省略形成zn基化合物纳米棒的步骤,而采用未经处理的石英毛细管作为基体,用3-氨丙基三乙氧基硅烷和聚丙烯酰胺溶液对基体进行修饰,再进行anti-epcam捕获抗体的修饰,,获得通道内固定有捕获抗体的毛细管通道c3。
重复实施例3的步骤2和3,不同点在于采用如上制备的毛细管通道c3,进行循环外泌体的捕获和荧光抗体和免疫金纳米粒的固定。
测试例3
在本测试例中,对实施例3和对比例3的微流控芯片的循环外泌体性能,通过荧光测定和表面增强拉曼光谱测定进行检测。
1.表面增强拉曼光谱测定
结果如图8所示,相较于未结合zn基材料层的毛细管微通道c3,zno修饰微流控通道获得信噪更高的拉曼光谱信号,并且得到更为明显的外泌体拉曼光谱特征峰,其中1490cm-1处是c-h键的峰,1293cm-1处的峰归属于胞核嘧啶,1091cm-1处的峰归属于甘露糖,903cm-1处的峰归属于葡萄糖,1350-1400cm-1处的峰为毛细管微通道的表面增强拉曼光谱信号。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!