基于“线粒体药理学”与“线粒体药物化学”的中药药效物质研究方法与流程
本发明属于中药领域。具体而言,本发明涉及一种基于“线粒体药理学”与“线粒体药物化学”的中药药效物质研究方法。
背景技术
线粒体是细胞的“发动机”,它不仅是细胞内能量生成的关键细胞器,还在细胞凋亡、内钙平衡、氧化应激、脂肪酸代谢等多项重要的生理、生化过程的调节中起着决定性作用,线粒体功能障碍将导致多种疾病发生,而阻止线粒体损伤或调节线粒体功能已成为当前疾病治疗的有效途径之一(advdrugdelivrev,2009,61(14):1250–1275)。因此,线粒体已成为重要的细胞内药物作用靶点。研究表明,许多中药(包括复方、单味药、单体化合物)可通过调节线粒体而发挥各种治疗效果,包括抗肿瘤、抗非酒精性脂肪肝、抗糖尿病、减肥、肝保护、心脏保护及神经保护等(生命科学仪器,2017,15(4):15-19)。遗憾的是,这些中药(包括复方、单味药)调节线粒体而发挥药理作用的活性物质基础仍基本不清楚,已成为制约中医药现代化发展的瓶颈问题。寻找适合中药复杂体系的研究方法,阐明中药药效物质基础,一直是中药研究的关键科学问题。
寻找中药中影响线粒体的活性物质的经典方法是先从中药中制备得单体化合物,然后再用药理实验筛选化合物活性,该方法存在劳动强度高、筛选周期长、命中率低等缺点。为提高筛选效率,科学家开发了高通量筛选技术(analchem,2014,86(11):5232–5237)和高内涵筛选技术(plosone,2012,7(10):e45226),但这两种技术均需预先分离制备大量化合物,也存在筛选周期长、命中率低等缺点。更重要的是以上方法和技术均很难直观反映出中药针对某一病症具有多成分作用的特点,当然也就很难找到中药针对某一病症治疗的有效成分群(物质基础)。
为实现不经分离纯化而直接快速筛选中药结合线粒体的活性物质,我们已将亲和超滤与lc/ms联用,构建了以离体线粒体为靶点的集“识别-分离-鉴定”于一体的中药活性成分筛选方法,并用此法快速筛选出了多味中药中可与线粒体结合的主要活性物质。研究表明,一味中药中存在多种可与线粒体结合的活性成分用(jchromatogra,2015,1413(15):33–46)。
尽管我们所建方法可实现快速筛选,但仍存如下主要问题:1)用离体线粒体为靶点进行体外筛选,筛选到的活性成分进入活体动物后还能否到达(进入)线粒体,并与之发生作用?2)线粒体相关疾病有多种,用正常细胞线粒体(肿瘤线粒体除外)筛选的活性成分究竟与哪种(些)疾病相关?即是针对哪种(些)疾病的物质基础?可见,用此方法仍难以阐明中药调节线粒体而发挥某一病症治疗效果的物质基础,需提出新的分析策略。
众所周知,药物吸收进入体内,分布到靶器官(组织)后方可发挥效应。同样,药物要影响线粒体发挥疗效,也需分布到病变靶器官线粒体(少部分药物可能通过其它靶点而间接影响线粒体),如紫草素可进入细胞线粒体损伤线粒体而抗肿瘤(evidbasedcomplementalternatmed,2012,2012:726025);能发挥多种药效的千层纸素a苷(中药黄芩中的主要成分)亦可进入细胞线粒体发挥作用(jpharmbiomedanal,2018,154:364–372)。另外,我们的研究结果也发现,一味中药中有多种可作用于线粒体的活性成分;可影响线粒体而干预nafld的滇黄精与何首乌中的成分(见本实施例)及单体成分白藜芦醇均可分布于nafld大鼠肝线粒体,为此推测分布于病变器官线粒体的成分群可能是该药物影响线粒体而治疗某一病症的主要物质基础,即通过检测分布于病变器官线粒体的药源性成分(包括原型成分及代谢产物)可探究中药调节线粒体而发挥药理作用的物质基础。
日本学者田代真一于20世纪80年代提出了一种基于含药血清的中药药效物质研究策略,该策略包括血清药理学(serumpharmacology)和血清药物化学(serumpharmacochemistry)研究。含药血清是指给动物或人服用药物后一定时间采血、分离的血清,该血清中含有原形药物成分及其代谢产物。血清药理学是指将含药血清作用于体外细胞模型进行药效评价;血清药物化学是指采用现代分析方法对含药血清中药源性成分进行定性、定量分析。血清药理学与血清药物化学已成为当前中药药效物质基础研究的重要手段(中草药,2015,46(17):2662-2666)。
技术实现要素:
本发明人借鉴含药血清的中药药效物质研究思路,提出一种基于“线粒体药理学”和“线粒体药物化学”的中药药效物质研究策略,该策略包括“线粒体药理学”(mitochondrialpharmacology)与“线粒体药物化学”(mitochondrialpharmacochemistry)研究。含药线粒体是指给动物或人服用药物后一定时间采集靶器官、组织,并分离线粒体,该线粒体中含有原形药物成分及其代谢产物。“线粒体药理学”是指将含药线粒体作用于体外细胞模型进行药效评价,确认线粒体中含有生物活性的药源性成分;“线粒体药物化学”是指采用现代分析方法对含药线粒体中药源性成分进行定性(鉴定药源性成分的化学结构)、定量分析。
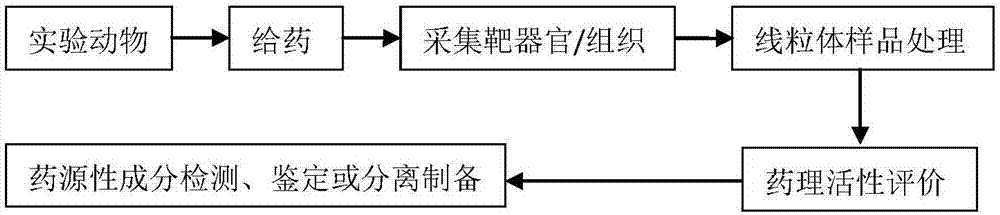
本发明的基于“线粒体药理学”与“线粒体药物化学”探究中药药效物质的方案设计如图1所示,包括:
(1)“线粒体药理学”研究
1)含药线粒体供体动物选择:为了提高实验结果可靠性,缩小或避免动物血清以及动物血清和人类血清之间的理化、生物等特性上的差异,应选用与人类生物学特性近似的动物制备含药线粒体,最大限度模拟体内环境,可选用大鼠和家兔等。选择健康动物还是病理模型动物需依据药效实验结果确定。
2)给药方案设计:一般情况下,给药剂量为原方药剂量的3~20倍,针对目标成分连续给药5~7个半衰期;或以主要成分在线粒体中的“平均稳态浓度”为指导确定;也可依据“给药剂量=临床常用量×动物等效剂量系数×培养基内的稀释度”的方法计算等。
3)靶器官/组织采集:由于中药成分复杂,不同药物成分在线粒体中的达峰时间不同,故对于样本采集时间很难有统一标准,需进行预实验确定。理想的采集时间应落在线粒体中药物浓度的高峰期,这样可避免由于有效物质尚未吸收或代谢殆尽而造成的假阴性结果。
4)线粒体样品处理:采用差速离心分离线粒体,由于线粒体样品中内源性杂质多,药源性成分浓度低,样本量有限,一般须经分离、纯化和富集后再检测。可采用有机溶剂萃取法、沉淀蛋白法、固相萃取法及超滤法等方法富集、纯化目标成分,尽量排除干扰成分。实验中可通过比较不同处理方法确定最佳处理方法。
5)体外细胞实验评价样品生物活性:将处理后的样品给药体外细胞模型,通过检测药效评价及线粒体相关指标,确认样品中含有可影响线粒体功能且能发挥药效的药源性成分。
(2)“线粒体药物化学”研究
线粒体样品检测分析常用的方法有高效液相色谱法(hplc)、高效液相色谱法-质谱联用法(hplc/ms)、气相色谱法(gc)、气相色谱-质谱联用法(gc/ms)、超临界流体色谱法(sfc)、超临界流体色谱-质谱联用法(sfc/ms)、毛细管电泳(ce)、毛细管电泳-质谱联用法(ce/ms)、高效液相色谱法-核磁共振联用法(hplc/nmr)等。如,可在相同条件下,采用hplc/ms法测定中药、空白线粒体、含药线粒体的指纹图谱,分析比较3组指纹图谱,对含药线粒体中出现的目标成分进行归属和结构解析等研究,对部分成分进行结构鉴定,不能鉴定结构的化合物可选择性分离制备后再结合nmr确定结构。
在一个实施方案中,本发明涉及一种基于“线粒体药理学”与“线粒体药物化学”的中药药效物质研究方法,其特征在于:所述研究方法包括“线粒体药理学”与“线粒体药物化学”。
在一个实施方案中,所述中药药效物质研究方法基于含药线粒体进行,所述含药线粒体是给动物或人服用药物后一定时间采集靶器官、组织,并分离线粒体,该线粒体中含有原形药物成分及其代谢产物。
在一个实施方案中,所述“线粒体药理学”是将含药线粒体作用于体外细胞模型进行药效评价,确认线粒体中含有生物活性的药源性成分。
在一个实施方案中,所述“线粒体药理学”包括含药线粒体供体动物选择、给药方案设计、靶器官/组织采集、线粒体样品处理、体外细胞实验评价样品生物活性中的一个或多个步骤。
在一个实施方案中,所述“线粒体药物化学”是采用现代分析方法对含药线粒体中药源性成分进行定性分析(鉴定药源性成分的化学结构)、定量分析。
在一个实施方案中,所述“线粒体药物化学”中线粒体样品检测分析的方法包括高效液相色谱法(hplc)、高效液相色谱法-质谱联用法(hplc/ms)、气相色谱法(gc)、气相色谱-质谱联用法(gc/ms)、超临界流体色谱法(sfc)、超临界流体色谱-质谱联用法(sfc/ms)、毛细管电泳(ce)、毛细管电泳-质谱联用法(ce/ms)或高效液相色谱法-核磁共振联用法(hplc/nmr)。
在一个实施方案中,所述“线粒体药物化学”包括以下步骤:在相同条件下,采用hplc/ms法测定中药、空白线粒体、含药线粒体的指纹图谱,分析比较3组指纹图谱,对含药线粒体中出现的目标成分进行归属和结构解析等研究,对部分成分进行结构鉴定,不能鉴定结构的化合物可选择性分离制备后再结合nmr确定结构。
在一个实施方案中,所述中药是单味中药、复方中药或它们的提取物。本发明方法对于中药种类没有特别限制。
在一个实施方案中,本发明涉及一种基于“线粒体药理学”与“线粒体药物化学”的中药药效物质研究方法获得的中药药效物质。
在一个实施方案中,本发明涉及一种基于“线粒体药理学”与“线粒体药物化学”的中药药效物质研究方法在中药药效物质研究中的应用。
本发明方法中的各步骤可以根据实际情况进行添加和/或删减,各步骤的顺序也可以根据实际情况适当调换,并且添加、删减和/或调换后的技术方案也在本发明的范围内。此外,本发明的各个实施方案可以根据实际情况进行组合,并且组合后的技术方案也在本发明的范围内。
本发明方法通过检测分布于病变器官线粒体的药源性成分(包括原型成分及代谢产物)可以阐明中药调节线粒体而发挥某一病症治疗效果的物质基础,相对于我们之前建立的方法,准确性更强,具有广阔的应用价值。
附图说明
图1显示的是基于“线粒体药理学”与“线粒体药物化学”探究中药药效物质的方案路线图。
图2显示的是含药线粒体样品对脂肪变性肝l-02细胞形态的影响。
图3显示的是灌胃nafld大鼠制首乌水提物后,肝脏线粒体中药源性成分分析的hplc图。(a)0-60min;(b)60-105min;图中黑线为制首乌水提物给药组;红线为模型组;蓝线为正常组;粉红线为制首乌水提物直接进样分析;d1~d6为分布到线粒体的药源成分。
具体实施方式
下面结合具体实施例对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例基于“线粒体药理学”与“线粒体药物化学”探究制何首乌缓解非酒精性脂肪肝的药效物质。实施例中的实验方法,如无特殊说明,均为常规方法。实施例中使用的药材原料、试剂材料等,如无特殊说明,均可自常规生化试剂商店或药品经营企业购买得到。
实施例一:线粒体药理学研究
1动物、材料、试剂及仪器
1.1实验动物
健康雄性sd大鼠,体重180±20g,购自成都达硕生物科技有限公司(合格证号:scxk川2015-030)。该实验经云南中医学院动物实验中心伦理委员会审查合格(编号:r-062014012)。实验前,所有大鼠适应性喂养1周,在适应性饲养期间,动物自由取食,自由饮水。饲养室内保持安静,室内温度维持在23~25℃,湿度55~75%,日光灯照明,每天24h中保持12h照明12h黑暗。
1.2材料与试剂
制何首乌药材购自云南昆明螺狮湾药材批发市场(云南昆明),经云南中医学院俞捷副教授鉴定为蓼科植物何首乌(polygonummultiflorumthunb.)的块根,凭证标本均保存于昆明市代谢性疾病中医药防治重点实验室;rpmi-1640(美国gibcoinvitrogen公司);胎牛血清(fbs;美国hyclone公司);triton-x100(美国sigma公司);胰蛋白酶(1:250;美国amresco公司);医用脂肪乳(四川国瑞药业有限公司;每250ml医用脂肪乳内含50g大豆油、3g卵磷脂和5.5g甘油);甘油三脂(tg)测试盒、总胆固醇(tc)测试盒、总超氧化物歧化酶(t-sod)测试盒、丙二醛测试盒(mda)及谷胱甘肽过氧化物酶(gsh-px)测试盒均购自南京建成生物工程研究所;大鼠线粒体呼吸链复合物i(complexi)elisa测试盒、大鼠线粒体呼吸链复物ii(complexii)elisa测试盒购自上海极威生物科技有限公司;bca蛋白浓度测试盒(碧云天生物技术研究所);其余试剂为分析纯。
1.3主要仪器
co2细胞培养箱(美国thermo公司);超净工作台(sw-cj-ifd型;苏州安泰空气技术有限公司);wt600-1f蠕动泵(保定兰格恒流泵有限公司);bs224电子天平(万分之一,北京赛尔利斯仪器系统有限公司);suno全自动生化分析仪(ab-1020;中国长春赛诺迈德医学技术有限公司);eclipsets100荧光倒置相差显微镜(日本nikon公司);85-2型磁力搅拌器(江苏海门市其林贝尔仪器制造有限公司);ql-861型旋涡混合器(江苏海门市其林贝尔仪器制造有限公司);ph计(fe20;梅特勒-托利多仪器(上海)有限公司);tgl-16bs台式微量离心机(上海安亭科学仪器厂);uv-1800pc型紫外可见分光光度计(上海翱艺仪器有限公司);infinitem200pro多功能酶标仪(瑞士tecan公司);hr/16m高速冷冻离心机(湖南赫西仪器装备有限公司);玻璃匀浆器(宁波新芝生物科技股份有限公司);milli-q超纯水系统(美国millipore公司)。
2细胞培养试剂的配制
1)rpmi-1640培养液配制:取1.69ghepes,150mgl-glutamine,165mgpyrurilacidsodiumsalt,2gnahco3,10.0grpmi-1640粉溶于1l超纯水中,加hcl调节ph至7.20,0.22μm孔径滤器过滤除菌分装,4℃保存,备用。
2)完全培养液的配制(含10%fbs的rpmi-1640培养液):将50ml的fbs与450mlrpmi-1640培养基混匀,4℃冰箱保存备用。
3)g0液的配制(含有0.2%血清的rpmi-1640培养液):将1ml的fbs与500mlrpmi-1640培养基混匀,4℃冰箱保存备用。
4)磷酸缓冲液(pbs):分别称取0.2gkcl,3.49gnahpo4.12h2o,0.2gk2hpo4,8gnacl溶于800ml超纯水,充分搅拌均匀,测ph7.4,定容至1000ml,0.22μm孔径滤器过滤除菌分装,4℃保存,备用。
5)0.25%胰酶溶液:胰蛋白酶0.5g,溶于200mlpbs缓冲液中,0.22μm孔径滤器过滤除菌分装,4℃保存,备用。
6)造模液的配制(医用脂肪乳rpmi-1640造模液):将10ml的fbs与5ml的20%医用脂肪乳混匀,用无血清的rpmi-1640定容到100ml即为医用脂肪乳诱导液。
7)0.01%tritonx-100溶液:100ml双蒸水中加入100μltritonx-100,充分搅拌混匀后,4℃保存。
3方法
3.1含药线粒体样品采集及制备
3.1.1制何首乌水提物制备
将制何首乌药材粉碎,取粉末500g,以水为提取溶剂水浴加热回流3次(每次分别用10、8、6倍量水),每次回流1h;合并3次滤液,减压回收溶剂(50℃);所得浸膏置于-80℃冰箱中结冰后,转移至冻干机中,冷冻干燥得冻干粉。将冻干粉研碎,混匀,置于干燥器中保存备用。
3.1.2非酒精性脂肪肝病理模型复制及给药
30只雄性sd大鼠随机分成3组,每组10只,即正常对照组(生理盐水)、模型组(生理盐水)及制首乌水提物组(8g/kg);各组大鼠均以5ml/kg的剂量灌胃给药,连续14周,每天1次。除正常组喂普通饲料外,其余各组均喂高脂饲料(基础饲料79%、猪油10%、蛋黄10%、胆固醇1%),共喂养14周,诱导产生大鼠非酒精性脂肪肝病理模型。
3.1.3线粒体样品采集及预处理
末次给药1h后,使用水合氯醛麻醉大鼠,剪取肝脏,同组肝脏合并,放置于-80℃冰箱保存待分离线粒体使用。
取各组所有肝脏,加入预冷的线粒体分离液(0.21m甘露醇、0.07m蔗糖、10mmtrisbase、1mmedta、0.5mmegta,ph至7.4),于冰水浴中匀浆;将组织匀浆液转移至离心管中,于4℃,1000×g离心10min,弃去沉淀,上清液转移至另一离心管中,4℃,10000×g离心10min,所得沉淀即为肝细胞线粒体。
取各组分离线粒体沉淀,分别加入2倍量(5ml)甲醇溶剂,涡旋混悬线粒体,超声处理20min后,10000×g离心10min,取上清液用氮气吹干,即得线粒体样品(包括正常组线粒体样品、模型组线粒体样品、含药线粒体样品)。
3.2体外细胞实验评价样品药效及对线粒体功能的调节作用
3.2.1肝l-02细胞的复苏、培养、传代、冻存
1)细胞的复苏:用镊子将冻存有l-02细胞的eppendorf管从液氮罐中取出,迅速放入37℃恒温水浴中,轻轻震摇使其尽快融化,注意防止水浴锅中的水没过冻存管瓶口。
在酒精灯外焰灼烧eppendorf管盖子外壁,打开盖子用吸管吸出细胞悬液,移入25ml培养皿中,并滴加5ml含10%fbs的rpmi-1640培养液,置于培养箱(5%co2、37℃)内培养,次日换液一次,以后隔日换液一次,继续培养。
2)细胞的培养:根据细胞生长情况,待细胞长至80%-90%融合(约2d-3d),用胰蛋白酶消化,按l:3的比例传代,置培养箱中培养。
3)细胞冻存:取对数生长期细胞冻存,冻存细胞前24h换液一次。依照传代的步骤,离心后加入细胞冻存液1.5ml吹散细胞,将细胞悬液转入冻存管中。在将冻存管分别置4℃30min,-20℃4h,-80℃过夜后转入液氮罐冻存。
3.2.2医用脂肪乳诱导的肝细胞脂肪变性模型复制
取对数生长期的l-02细胞用0.25%胰蛋白酶消化,细胞计数后用正常培养液配成单个细胞悬液,以每孔3×105个细胞的密度接种于6孔培养板中,每孔培养液体积2ml。将培养板移入co2培养箱中,在37℃、5%co2及饱和湿度条件下,培养48h使其充分贴壁生长,待细胞长至80%融合时,换成g0液培养24h,使细胞周期同步化。加入造模液(医用脂肪乳rpmi-1640)刺激48h,对照组则给予正常培养液相同的时间,即可得到脂肪变性的肝l-02细胞。
3.2.3实验分组及给药
将肝细胞传板至6孔板,分为正常组、模型组、给药组,模型组、给药组细胞按“3.1.2”项下的方法进行培养,复制好模型后,给予以下处理因素:
(1)正常组:继续给予g0(含0.2%fbs的rpmi-1640培养液)培养;
(2)模型组:继续给予g0(含0.2%fbs的rpmi-1640培养液)培养;
(3)给药组:分别取非诺贝特和含药线粒体样品适量溶于dmso,取dmso溶解的受试样品用g0液稀释到所需要浓度(dmso质量浓度<1‰)。加入含药线粒体样品(分别为50μg/ml、100μg/ml、200μg/ml)和阳性对照非诺贝特(20μg/ml)进行培养;
每个浓度设3个复孔,给药刺激24h后,分别置于倒置显微镜下观察细胞形态,并取细胞裂解液检测其中的总胆固醇tc及总甘油三酯tg含量。
3.2.4肝细胞内tg、tc含量测定
取各组细胞pbs洗涤1-2次,加入1ml胰酶消化细胞,再加入正常培养液停止消化,并吹打细胞(确保将各孔内的所有细胞吹下),将各孔中的细胞悬液置于l.5ml离心管中,2000r/min,离心5min,弃上清,加入triton反复冻融三次。当细胞充分裂解后,4℃,12000r/min,离心10min,取上清液按相应试剂盒说明书操作,测定tg和tc含量。
3.2.5肝细胞线粒体中mda、sod、gsh-px、atp合酶及complexi、ii测定
取各组细胞按“3.1.4”项下方法处理细胞得裂解细胞上清液,按各试剂盒说明书操作,测定各指标水平。
3.3统计学处理
各组数据用均数±标准差
4结果
4.1含药线粒体样品对肝细胞形态的影响
由图2可知,正常肝l-02细胞培养一个实验周期(诱导到给刺激)后,其细胞变圆、变长等形态,边缘清晰,偶见少许脂滴。模型组细胞形态肿大、变圆,脂滴晶莹剔透、较多,且有融合现象。给予非诺贝特刺激脂变肝细胞后,有部分空洞区域,细胞变圆,脂滴减少。同非诺贝特一样,给予含药线粒体样品刺激脂变肝细胞后,培养板底部有部分空洞区域,随刺激液浓度增加,死细胞增多、且细胞变圆,脂滴逐渐减少,中浓度时细胞状态较佳。
4.2含药线粒体样品对肝细胞tg、tc含量的影响
表1结果显示,与正常组比较,模型组肝细胞中tc及tg均显著升高(p<0.01),表明经脂肪乳诱导的肝细胞发生脂代谢紊乱。与模型组比较,非诺贝特及中、高剂量含药线粒体样品组的tc与tg均显著降低(p<0.05,p<0.01),表明二者均可较好改善脂肪乳诱发的肝细胞脂质异常。
表1含药线粒体样品对肝细胞tg、tc含量的影响(
与模型组比较,*p<0.05,**p<0.01
4.3含药线粒体样品对肝细胞mda、sod及gsh-px水平的影响
表2结果显示,与正常组比较,模型组肝细胞中mda含量显著升高(p<0.01),且sod与gsh-px活力显著降低(p<0.01),提示肝线粒体发生氧化应激与脂质过氧化。与模型组比较,含药线粒体样品高剂量可显著降低肝细胞中mda含量(p<0.01),且中、高剂量组能显著升高sod与gsh-px活力(p<0.05),表明测试样品可提高受损肝细胞抗氧化能力。
表2含药线粒体样品对肝细胞mda、sod及gsh-px水平的影响(
与模型组比较,*p<0.05,**p<0.01
4.4含药线粒体样品对肝细胞atp合酶与complexi、ii的影响
表3结果显示,与正常组比较,模型组肝细胞中na+-k+-atpase、ca2+-mg2+-atpase、complexii水平显著降低(p<0.05),提示肝线粒体能量代谢相关酶活性受抑制。与模型组比较,含药线粒体样品高剂量可显著提高na+-k+-atpase、complexi活性(p<0.05),且中剂量组能显著升高ca2+-mg2+-atpase活力(p<0.05),表明测试样品可改善线粒体能量代谢。
表3含药线粒体样品对肝细胞atp合酶与complexi、ii的影响(
与模型组比较,*p<0.05,**p<0.01
实施例二:“线粒体药物化学”研究
1试药与仪器
1.1试药
二苯乙烯苷、虎杖苷、大黄素-8-o-β-d吡喃葡萄糖苷、大黄素甲醚、大黄素、大黄素甲醚-8-o-β-d吡喃葡萄糖苷对照品购自成都普菲德生物科技有限公司;色谱级乙腈、色谱级甲醇(德国merk公司);超纯水由milli-q超纯水系统制备;其余试剂均为分析纯。
1.2仪器
ultimate3000超高效液相色谱串联qexactive四极杆-静电场轨道阱高分辨质谱(赛默飞世尔科技,美国),配有cbm-20a系统控制器,lc-20ad四元泵,sil-20a自动进样器,cto-20a柱温箱及spd-m20apda检测器;超声波清洗机(宁波新芝生物科技股份有限公司);hr/16m高速冷冻离心机(湖南赫西仪器装备有限公司);milli-q超纯水系统(美国millipore公司)。
2方法
2.1供试品溶液配制
取“线粒体药理学研究”中“3.1.3”项下制备的3种线粒体样品(包括正常组线粒体样品、模型组线粒体样品及含药线粒体样品)用100μl80%甲醇复溶,10000×g离心5min,取上清液进行lc/ms分析。
2.2uplc/ms分析条件
uplc-dad条件色谱柱:agilentzorbaxsb-c18(250mm×4.6mm,5μm);流动相:乙腈(a)和水(b)梯度洗脱(0min,5%a;20min,10%a;30min,20%a;40min,30%a;50min,40%a;60min,50%a;70min,60%a;80min,70%a;90min,85%a;100min,95%a;105min,100%a);流速1.0ml/min;柱温30℃;进样体积20μl;dad检测波长设定为200nm。
质谱条件采用全扫描(fullmass)和数据相关二级质谱(dd-ms2)模式检测;离子源为esi;毛细管温度320℃;喷雾气流速1.5l/min;加热模块250℃;全扫描正、负离子同时检测,分辨率70000;接口电压:(+)3.5kv,(-)2.8kv;质量范围m/z:100~1000da;最长注入时间(maximunit):200msec。二级质谱正、负离子同时检测,数据相关二级质谱对最高的5个峰进行二级质谱裂解:分辨率17500,质量范围m/z:50~1000da;最长注入时间(maximunit):50msec;cid能量:30%;使用动态排除,动态排除时间:10s。工作站:xcalibar3.0.63,用于lc/ms数据处理、分子式预测和精确分子量计算。
3结果
采用uplc/ms对制何首乌分布于nafld大鼠肝线粒体的成分进行检测分析,结果如图3所示。从图中可看出,灌胃nafld大鼠制何首乌后,nafld大鼠肝线粒体中检测到4种药源成分,这些成分可能是制首乌影响线粒体而发挥药效的活性物质。表4列出了该4个色谱峰的保留时间、紫外、质谱等信息,通过与文献报道的ms数据以及与对照品进行比对,指认、鉴定出这些色谱峰对应的活性成分的结构(表4)。这些成分均为首次发现可进入线粒体的化合物。
表4制首乌分布于nafld大鼠肝线粒体的药源成分的结构鉴定
实施例三:线粒体药源成分群的抗非酒精脂肪肝药效研究
1动物、材料、试剂及仪器
高密度脂蛋白胆固醇(hdl-c)测试盒、低密度脂蛋白胆固醇(ldl-c)测试盒购自南京建成生物工程研究所;其余同上述“线粒体药理学”研究与“线粒体药物化学”研究。
2方法
2.1线粒体药源成分群供试液配制
6种检测到的线粒体药源成分在制何首乌原药材中的含量比例为:二苯乙烯苷:虎杖苷:大黄素-8-o-β-d吡喃葡萄糖苷:大黄素甲醚:大黄素:大黄素甲醚-8-o-β-d吡喃葡萄糖苷=39:2.6:1.1:0.8:0.7:0.4。取各化合物对照品,按各成分含量比例制备适量混合对照品,用生理盐水混悬后制得线粒体药源成分群供试液。
2.2分组及非酒精脂肪肝模型制备
56只雄性大鼠随机分成8组,每组7只,即正常对照组(生理盐水)、模型组(生理盐水)、制首乌水提物低、中、高剂量组(1、4、8g/kg)、线粒体药源成分群低、中、高剂量组(20、40、80mg/kg);各组大鼠均以5ml/kg的剂量灌胃给药,连续14周,每天1次。除正常组喂普通饲料外,其余各组均喂高脂饲料(基础饲料79%、猪油10%、蛋黄10%、胆固醇1%),共喂养14周,建立大鼠非酒精脂肪肝(nafld)模型。
2.3指标检测
2.3.1样品采集
实验期间每天记录大鼠进食量,每周记录大鼠体重,分别在0、6、12、14周进行眼内眦空腹采血,立即离心(10000r/min,10min)分离血清,收集血清检测tc与tg。在第14周最后一次给药后,对实验大鼠禁食处理12h,使用水合氯醛对其进行麻醉,取血后收集所需脏器放置于-80℃冰箱保存。
2.3.2脏器指数
分别剖取各脏器(肝、脾、肾),称重,按脏器指数=[脏器重量g/体重g]×100%,计算各脏器指数。
2.3.3血清生化指标测定
按试剂盒说明书操作,测定血清中tg和tc含量。
2.3.4肝组织生化指标测定
取肝组织匀浆液上清液,用bca蛋白浓度测定试剂盒测定蛋白浓度;取该上清液100μl,按试剂盒说明书操作,测定肝组织中tc、tg、hdl-c及ldl-c含量。
2.3.5肝细胞线粒体相关指标
(1)肝细胞线粒体分离
取大鼠肝脏0.1g,加入1ml预冷的线粒体分离液(0.21m甘露醇、0.07m蔗糖、10mmtrisbase、1mmedta、0.5mmegta,ph至7.4),于冰水浴中匀浆;将组织匀浆液转移至离心管中,于4℃,1000×g离心10min,弃去沉淀,上清液转移至另一离心管中,4℃,10000×g离心10min,所得沉淀即为肝细胞线粒体。
(2)肝细胞线粒体中mda、sod、gsh-px、atp合酶及complexi、ii测定
取肝细胞线粒体,加生理盐水混匀成混悬液,用bca蛋白浓度测定试剂盒测定线粒体蛋白浓度;分别取100μl线粒体混悬液,按试剂盒说明书操作,测定各指标水平。
2.4统计处理
各组数据采用均数±标准差
3结果
3.1制首乌及线粒体药源成分群对高脂诱导nafld大鼠脏器指数的影响
如表5结果所示,正常组与模型组大鼠的肾指数和脾指数无显著差异,提示本实验对大鼠肾脏和脾脏的脏器指数没有造成明显变化。而与正常组比较,模型组肝指数显著增加(p<0.01),表明高脂饲料喂食造成肝肿大。与模型组比较,制首乌中、高剂量组和线粒体药源成分群中、高剂量组大鼠肝指数均显著下降(p<0.05,p<0.01),表明二者均可改善高脂饲料诱导的肝肿大。
表5制首乌及线粒体药源成分群对nafld大鼠脏器指数影响(
与模型组比较,*p<0.05,**p<0.01
3.2制首乌及线粒体药源成分群对高脂诱导nafld大鼠血清tc与tg的影响
如表6结果所示,高脂饲料造成血清tc显著升高,而对于血清tg影响较小。从第6周开始,模型组tc含量显著增加(与正常组比较,p<0.01),直至第14周实验结束,正常组与模型组tc含量仍表现出显著差异(p<0.01),提示大鼠血脂增加。与模型组比较,第14周实验结束,制首乌组和线粒体药源成分群组大鼠血清中tc含量显著降低(p<0.05,p<0.01),表明其可调节高脂饲料诱发的血脂异常,二者均以高剂量组对tc的调节效果最佳。
表6制首乌及线粒体药源成分群对nafld大鼠血清tc、tg含量的影响(
与模型组比较,*p<0.05,**p<0.01
3.3制首乌及线粒体药源成分群对高脂诱导nafld大鼠肝脏tc、tg、hdl-c、ldl-c的影响
如表7结果所示,与正常组比较,模型组肝组织中ldl-c、tc及tg均显著升高(p<0.01),且hdl-c显著降低(p<0.01),表明高脂饲料喂养大鼠肝脏脂质代谢紊乱。与模型组比较,制首乌组肝组织中ldl-c、tc与tg均显著降低(p<0.05,p<0.01),同时显著升高hdl-c,表明其可有效调节高脂饲料诱发的肝脏脂质异常;给予线粒体药源成分群后,肝组织中ldl-c、tc及tg均显著降低(p<0.05,p<0.01),同时hdl-c有一定程度升高,但无显著变化,表明其可一定程度改善高脂饲料诱发的肝脏脂质异常。
表7制首乌及线粒体药源成分群对nafld大鼠肝脏ldl-c、hdl-c、tc、tg含量的影响(
与模型组比较,*p<0.05,**p<0.01
3.4制首乌及线粒体药源成分群对高脂诱导nafld大鼠肝脏线粒体中mda、sod及gsh-px的影响
如表8结果所示,与正常组比较,模型组大鼠肝脏线粒体中mda含量显著升高(p<0.01),且sod与gsh-px活力显著降低(p<0.01),提示nafld大鼠肝线粒体发生氧化应激与脂质过氧化。与模型组比较,制首乌和线粒体药源成分群显著降低mda含量(p<0.05,p<0.01),且可显著提高sod与gsh-px活力,表明其可有效提高nafld大鼠抗氧化能力。
表8制首乌及线粒体药源成分群对nafld大鼠肝脏线粒体mda、sod及gsh-px的影响(
与模型组比较,*p<0.05,**p<0.01
3.5制首乌及线粒体药源成分群对高脂诱导nafld大鼠肝脏线粒体中atp合酶与complexi、ii的影响
如表9结果所示,与正常组相比,模型组大鼠肝脏线粒体na+-k+-atp酶、ca2+-mg2+-atp酶、complexi及complexii活力均显著降低(p<0.05,p<0.01),表明nafld大鼠能量代谢相关酶活性受抑制。与模型组比较,给予不同剂量制首乌及线粒体药源成分群后,肝线粒体中na+-k+-atp酶、ca2+-mg2+-atp酶活性、complexi及complexii活力均显著升高(p<0.05,p<0.01),表明二者可有效改善nafld大鼠能量代谢障碍。
表9制首乌及线粒体药源成分群对nafld大鼠肝脏线粒体atp合酶与complexi、ii的影响(
与模型组比较,*p<0.05,**p<0.01全文完。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——人线粒体dna聚合酶29.7和编码这种多肽的多核苷酸的制作方法
- 筛选线粒体机能调节剂的方法和所获得的新调节剂的制作方法
- 一种多肽——线粒体载体12和编码这种多肽的多核苷酸的制作方法
- 一种多肽——线粒体载体18和编码这种多肽的多核苷酸的制作方法
- 汉族人群线粒体dna单倍型检测引物阵列及制备方法和应用的制作方法
- 特咖宁在制备线粒体损伤保护剂中的应用的制作方法
- 一种具有保护神经元线粒体动态平衡的融合多肽及其应用的制作方法
- 用于线粒体功能障碍性脑疾病的治疗剂和诊断剂的制作方法
- C<sub>60</sub>的多羟基衍生物在防治线粒体损伤相关疾病中的用途的制作方法
- 对线粒体钠-钙交换体有作用的环状砜类的制作方法