对硒代半胱氨酸进行修饰的方法及其应用与流程
本发明涉及生物化学领域,具体地,本发明涉及对硒代半胱氨酸进行修饰的方法及其应用,更具体地,本申请涉及针对硒代半胱氨酸位点进行硒蛋白富集的方法及其应用。
背景技术:
硒是人体健康中重要的微量元素。硒缺乏与许多人类疾病的发病有关,包括糖尿病,癌症和神经退行性疾病。在生物体内,硒的生物学效应主要由硒蛋白介导,这些蛋白质含有一个或多个硒代半胱氨酸(sec,u)位点。被认为是第21种氨基酸的硒代半胱氨酸是半胱氨酸(cys,c)类似物,其中含硒的硒醇基取代了cys中的含硫巯基。硒蛋白存在于很多生物种类中,其中在人类中发现25种硒蛋白,小鼠中发现24种,大肠杆菌中发现3种。
许多特征性硒蛋白已被证明可以作为抗氧化剂或氧化还原酶来调节细胞的氧化还原循环。硒蛋白是高度有效的细胞内氧化还原状态的调节剂,因为它们可以催化形成二硫键并且以高于它们的硫类似物四个数量级的速度将二硫键还原。硒蛋白的失调与氧化还原相关的人类疾病有关,如心血管疾病,癌症,阿尔茨海默氏病和帕金森氏病等。
开发硒代蛋白质组的高效分析方法面临的主要挑战包括硒醇基团的高反应性及其与半胱氨酸(cys)基团的相似性,这使得难以选择性地针对硒代半胱氨酸进行反应,并对低丰度的硒蛋白进行富集。
因而,开发能选择性地富集硒蛋白的方法迫在眉睫。
技术实现要素:
目前现有技术中还没有能高选择性富集含有硒代半胱氨酸的多肽和蛋白质的方法。发明人首次开发了含sec的多肽和蛋白质的富集方法,该方法通过在较低的ph条件下,在合适的烷化剂的条件下,选择性地富集含sec的肽和蛋白质。
在本发明的第一方面,本发明提出了一种对硒代半胱氨酸进行修饰的方法。根据本发明的实施例,所述方法包括:在ph为3.5~5.5的条件下,使硒代半胱氨酸与烷基化试剂反应,以便获得烷基化硒代半胱氨酸。发明人发现,sec的pka值比cys低,在低ph的条件下sec与cys相比,更不容易质子化,从而在低ph(如3.5~5.5)的条件下sec更容易与烷基化试剂反应,进而发明人发现,在ph为3.5~5.5的条件下,烷基化试剂能特异性地与硒代半胱氨酸发生反应,而不与或者极少与半胱氨酸反应,且收率高、操作简单。
根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述ph为4.0~5.5。由此,在ph为4.0~5.5的条件下,烷基化试剂能更特异性地与硒代半胱氨酸发生反应。
根据本发明的实施例,所述ph为4.0。发明人通过实验发现,在ph为4.0的条件下,硒代半胱氨酸烷基化反应的选择性进一步提高,其选择性比ph在8.0的条件下提高了5倍。由此,在ph为4.0的条件下,烷基化试剂能更特异性地与硒代半胱氨酸发生反应。
根据本发明的实施例,所述烷基化试剂携带标记基团。发明人发现,通过在烷基化试剂上引入标记基团,进而能在硒代半胱氨酸上引入标记基团,从而可以用合适的分离手段通过标记基团将含有硒代半胱氨酸的肽段富集出来。其中,在烷基化试剂上引入标记基团包括但不限于通过click反应或者其他化学反应引入标记基团。
根据本发明的实施例,所述标记基团包括选自生物素(biotin)标记。发明人发现,携带生物素标记的烷基化试剂特异性地烷基化硒代半胱氨酸后,能在硒代半胱氨酸上引入生物素标记,再通过生物素与亲和素(即avidin,抗生物素蛋白)的特异性结合,进而将含有硒代半胱氨酸的肽段富集出来。
根据本发明的实施例,所述烷基化试剂为能特异性与硫原子或硒原子发生烷基化反应的试剂。发明人发现,特异性与硫原子或硒原子发生烷基化反应的试剂在上述ph的条件下能特异性地与硒代半胱氨酸的硒醇基发生烷基化反应。
根据本发明的具体实施例,所述烷基化试剂为碘代乙酰化-聚乙二醇或溴代乙酰化-聚乙二醇。
根据本发明的具体实施例,所述烷基化试剂携带生物素,所述烷基化试剂为ez-linkiodoacetyl-peg2-biotin(即iodoapb)或ez-linkbromoacetyl-peg2-biotin(即bromoapb),其结构式见图2d,x为br即为bromoapb的结构式,x为i即为iodoapb的结构式。发明人发现,上述烷基化试剂能在上述ph的条件下,更加特异性地与硒代半胱氨酸的硒醇基发生烷基化反应。
根据本发明的实施例,所述反应是在25摄氏度下进行的。
根据本发明的实施例,所述反应是在避光条件下进行的。
根据本发明的实施例,所述硒代半胱氨酸是以蛋白质或多肽的形式提供的。根据本发明实施例的方法中的硒代半胱氨酸是以蛋白质的形式提供的,由此,可得到烷基化的含有硒代半胱氨酸的蛋白质或多肽,进而可实现对含有硒代半胱氨酸蛋白质或多肽的富集,例如,可以通过烷基化试剂上携带的生物素与亲和素特异性结合,之后用洗脱液将含硒肽段从亲和素凝胶上洗脱下来,进而实现含有硒代半胱氨酸蛋白质或多肽富集。
在本发明的第二方面,本发明提出了一种富集含有硒代半胱氨酸的蛋白质的方法。根据本发明的实施例,所述方法包括:(1)按照前面任一项所述的方法,对待富集蛋白质中的硒代半胱氨酸进行烷基化修饰;(2)分离经过烷基化的所述待富集蛋白质。发明人发现,sec的pka值比cys低,在低ph的条件下sec与cys相比,更不容易质子化,从而在低ph的条件下sec更容易与烷基化试剂反应,进而发明人发现,在ph为3.5~5.5的条件下,烷基化试剂能特异性地与硒代半胱氨酸发生反应,而不与或者极少与半胱氨酸反应,之后通过合适的分离手段将含有发生特异性烷基化的硒代半胱氨酸的蛋白质或多肽分离出来,即将含有硒代半胱氨酸的蛋白质或肽段富集出来。根据本发明实施例的方法能高选择性地对硒蛋白进行富集,且收率高、操作简单,基本可以对所有已知硒蛋白进行鉴定和定量。
根据本发明的实施例,所述烷基化试剂携带生物素标记。发明人发现,携带生物素标记的烷基化试剂特异性地烷基化硒代半胱氨酸后,能在硒代半胱氨酸上引入生物素标记,再通过生物素与亲和素(即avidin,抗生物素蛋白)的特异性结合,进而将含有硒代半胱氨酸的蛋白质或肽段富集出来。
根据本发明的实施例,在步骤(2)中,采用特异性识别所述生物素标记的试剂进行的。发明人发现,采用特异性识别生物素标记的试剂能特异性地将携带有生物素标记的烷基化硒代半胱氨酸的蛋白质或肽段富集出来。
根据本发明的实施例,所述特异性识别所述生物素标记的试剂为亲和素。亲和素能特异性与生物素结合,进而特异性地将含有硒代半胱氨酸的蛋白质或肽段富集出来。
根据本发明的实施例,所述烷基化试剂为碘代乙酰化-聚乙二醇。根据本发明的具体实施例,所述烷基化试剂携带生物素,所述烷基化试剂为ez-linkiodoacetyl-peg2-biotin(即iodoapb)。发明人发现,上述烷基化试剂能在上述ph的条件下,特异性地与硒代半胱氨酸的硒醇基发生烷基化反应,进而在含有硒代半胱氨酸的蛋白质上带上标记基团(如生物素),之后通过合适的分离手段(如利用亲和素与生物素发生特异性结合)将含有硒代半胱氨酸的蛋白质分离出。
在本发明的另一方面,本发明提出了新的硒蛋白。根据本发明的实施例,所述硒蛋白为mup蛋白、scgb1a1蛋白、fxyd2蛋白、atp5b蛋白以及mt2蛋白。发明人首次发现了在肝脏中的mup蛋白,在肺中的scgb1a1蛋白,在肾脏中的fxyd2蛋白,在肝脏和肾脏中的atp5b蛋白以及在肝脏中的mt2蛋白为未知硒蛋白。上述硒蛋白可以用于制备富硒材料或者富硒药物中,例如,富硒药物可以用于治疗人体缺硒导致的疾病(癌症、心脑血管疾病、糖尿病、肝病、甲状腺激素失衡、内分泌代谢性疾病等)。
在本发明的再一方面,本发明提出了一种发现新的硒蛋白的方法。根据本发明的实施例,1)利用前面所述的富集含有硒代半胱氨酸的蛋白质的方法富集硒蛋白,2)将步骤1)中富集的硒蛋白进行质谱检测,3)将步骤2)中得到的质谱数据与发明人构建出的sis数据库进行匹配,以便确认所富集的硒蛋白是正确的硒蛋白,4)将步骤3)中确认正确的硒蛋白与现有技术中数据库中的蛋白序列进行匹配,以及进行blast比对,如果上述两种途径均没有发现同源序列,则说明所述硒蛋白不是来源于其他蛋白或者是已有硒蛋白的修饰类型,进而说明所述富集的硒蛋白为新的硒蛋白。
附图说明
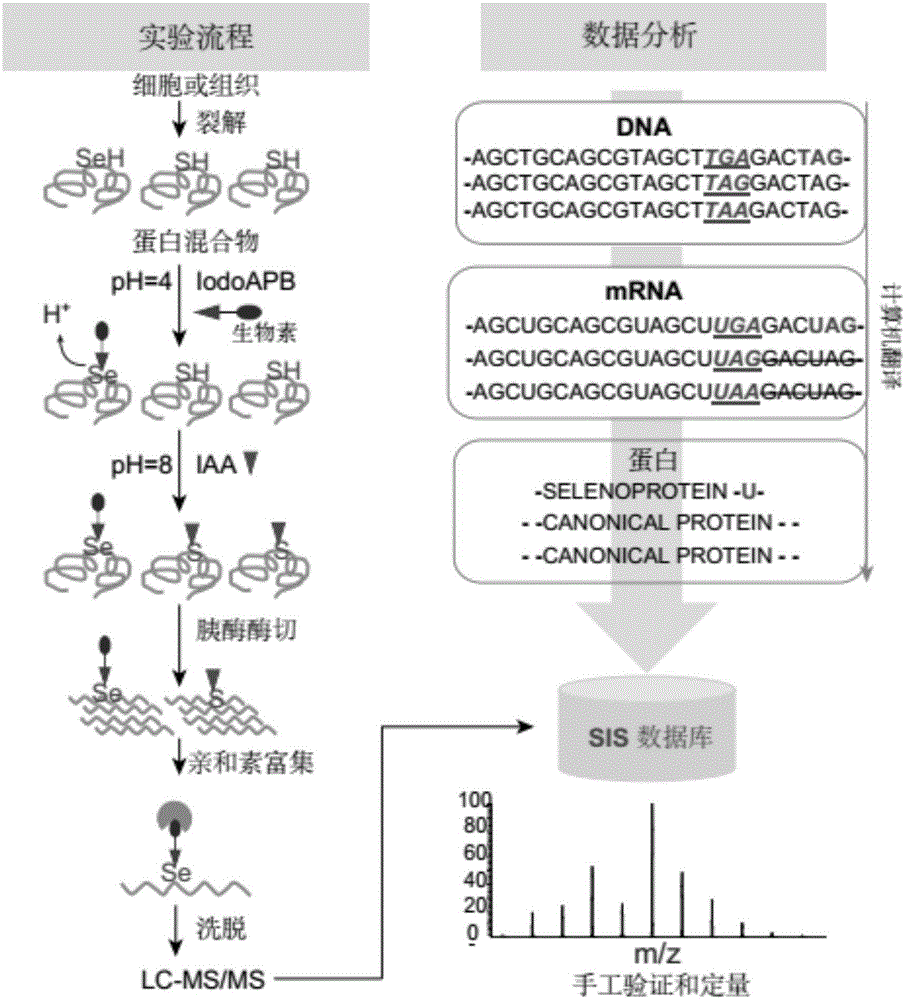
图1是根据本发明实施例的实验流程图;
图2是根据本发明实施例的在不同ph的条件下对含有硒代半胱氨酸的肽段的选择性烷基化;
图3是根据本发明实施例的新发现的5个硒蛋白的蛋白分布、二级谱图;
图4是根据本发明实施例的新发现的5个硒蛋白一级谱图也符合含硒肽段的特征谱图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
实施例1硒蛋白的富集流程
1、细胞和组织样品的处理:
对于细胞样品,将细胞用pbs洗过之后,用8m尿素裂解液直接将细胞裂解。裂解液成分为:8m尿素,100mmtris,ph8.5,1mmedta和蛋白酶抑制剂cocktail。超声破碎dna后14000g离心取上清,并用bca测定蛋白浓度,每个样品取2mg蛋白用于后续处理。组织样品取一定大小的组织,加入一定量的8m尿素裂解液进行匀浆。bca测定浓度后,每个样品各取2mg进行后续硒蛋白的富集。
2、硒蛋白的富集(secms):
如图1所示,将细胞或者组织裂解液先用终浓度为20mm的dtt在37度条件下还原1小时,使得蛋白裂解液中的二硫键、二硒键完全打开。之后,加入二分之一体积的200mm柠檬酸(溶解在8m尿素里,ph约为2.0),调节样品ph至4.0。根据硒代半胱氨酸与半胱氨酸等电点的差异,在ph4.0条件下,将细胞或组织裂解液与连有生物素的碘乙酰胺(即iodoapb)在25度下避光反应一小时,iodoapb终浓度为0.1mm。在酸性条件下,iodoapb可以选择性的与硒代半胱氨酸反应,而几乎不与半胱氨酸反应。这样可以特异性地使硒代半胱氨酸带上生物素标记。之后利用超滤管超滤,将溶液置换成8m尿素溶液,从而将ph调至8.0。在溶液置换的过程中,未反应的多余的iodoapb也被同时过滤掉。之后,在ph8.0条件下,使未反应的半胱氨酸与10mm碘乙酰胺(iaa)反应,将未被iodoapb标记的半胱氨酸保护起来。接下来,将蛋白裂解液用胰酶过夜酶切成肽段。
第二天,取极少量的c8填在200μl的枪头中,分别用乙腈和pbsn(pbs+1%np-40)洗三次。之后将20μl亲和素凝胶放在含有c8堵头的枪头中,用pbsn清洗亲和素凝胶三遍。之后,将细胞或者组织裂解液的酶切产物(肽段混合物)与枪头中的亲和素凝胶进行相互作用。由于生物素和亲和素可以特异性的结合,因此在相互作用的过程中,已经被生物素标记的含硒肽段会被结合到含有亲和素的凝胶上,其他肽段因不能被结合而直接流出,从而实现对含硒肽段的富集。之后用pbsn、pbs和10%的乙腈清洗亲和素凝胶各三次,将非特异性吸附的肽段洗掉。最后,用含有2%三氟乙酸,50%乙腈和48%的水作为洗脱液将含硒肽段从亲和素凝胶上洗脱下来。真空干燥后,用质谱进行检测。
3、数据采集和分析
(1)质谱数据的采集:
含硒肽段用thermoq-exactivehf进行检测,液相采用easy-nlc1000。分析柱长度为15cm,内径为100μm,填料用1.9μm的c18。流动相a为98%水,2%乙腈,0.1%甲酸,流动相b为98%乙腈,2%水,0.1%甲酸。每个样品采集120分钟,流动相梯度为(b相%):0min:4%,3min:8%,89min:22%,113min:35%,116min:90%,120min:90%。液相流速为300nl/min。质谱方法采用dda(datadependentacquisition)模式进行,选择top20的母离子进行子离子的采集。ms1用orbitrap检测,采集范围为350-1500m/z,分辨率为60000。agc设为3e6,最大注入时间为20ms。碎裂方式用hcd,碎裂能量用32,ms2用orbitrap进行检测,起始离子质核比为120m/z,分辨率为30000,agc设为15最大注入时间为100ms。
(2)sis数据的建立:(secis-independentselenoproteindatabse)
从ucsc网站上下载小鼠和人的基因序列数据库。将这些基因用计算机翻译成氨基酸序列,但是将所有原本用做终止密码子的uga密码子翻译成硒代半胱氨酸,无论其3’utr是否含有secis序列。遇到uaa和uag这两种终止密码子则翻译停止。
发明人构建的sis数据库涵盖了最多的潜在硒蛋白。在小鼠的sis数据库中包括了27324个蛋白,其中有13613个蛋白含有硒代半胱氨酸位点,整个数据库包括了24034个硒代半胱氨酸位点。其中,大约有28.3%的蛋白含有1个硒代半胱氨酸位点,有21.6%的蛋白含有两个或两个以上的硒代半胱氨酸位点。在人的sis数据库中包括了35070个蛋白,其中有17613个蛋白含有硒代半胱氨酸位点。其中,大约有26.7%的蛋白含有1个硒代半胱氨酸位点,有23.5%的蛋白含有两个或两个以上的硒代半胱氨酸位点(图3a)。
(3)数据分析:
得到的质谱数据原始文件用proteowizard软件转换为mgf文件后用mascot软件进行搜库。本实施例中针对三种数据库进行了匹对。已知的小鼠蛋白数据库(包含85775种蛋白isoform),小鼠的selenodb数据库(包含目前已知的硒蛋白)和发明人自己构建的sis数据库(secis-independentselenoproteindatabse,包含最多的潜在的硒蛋白)。ms1的质量精度设为10ppm,ms2设为0.1da。可变修饰包括iodoapb(+414.193691da,c/u),carbamidomethyl(+57.021464da,c),dehydroalanine(dha)(-81.932170da,u)和oxidation(+15.994915da,m)。酶设置为胰酶,包括一个漏切位点。13c设为1,以避免单同位素峰选错的情况。mascot软件得到的结果导入skyline软件中进行非标记定量和手工的谱图确认。针对每个硒蛋白分别提峰,计算他们的峰面积从而对对应的硒蛋白进行定量。
4、实验结果
基于质谱的硒蛋白富集方法评价
(1)低ph条件下对化学合成的含硒多肽的特异性标记
实验方法:
人工合成的标准多肽4对,sgasilqagc[c/u]g,vtycgl[c/u]syslr,pnsd[c/u]lgmeek,gpspppmagg[c/u]gr,溶于1%tfa。取20μg多肽混合物(每条多肽各2.5μg),用100mm,ph8.5的tris缓冲液稀释至200μl,加入1mdtt,使之终浓度为20mm,37℃反应30min将二硫键/硒硫键还原。加入100μl200mm的柠檬酸缓冲液(同上,柠檬酸溶解在8m尿素中),调节ph至4.0左右,加入终浓度为0.1mm碘乙酰胺(iaa),避光25℃反应30min,经c18柱除盐后用质谱进行检测。
实验结果:
首先,发明人比较了iodoapb在酸性条件下(ph4.0)时对于sec/cys的标记特异性。研究在酸性条件下,iodoapb能否选择性的仅与sec反应,而不与cys反应。发明人选择了四对标准肽段,其中两对含有一个sec/cys位点,两对含有两个sec/cys位点。这四条肽段均与人的硒蛋白序列对应。因为iaa和iodoapb具有相同的活性反应基团,能够模拟iodoapb与sec/cys的反应,因此用iaa代替iodoapb与sec/cys反应。结果发现,对于含有一个sec/cys位点的肽段,iaa对于sec的标记效率可以高达96.58%,而对于cys仅有2.78%(图2a)。而对于含有两个sec/cys位点的肽段,iaa对于sec的标记效率可以高达97.33%,而对于cys仅有0.79%(图2a)。可见在酸性条件下,iaa及iodoapb均能特异性地与含sec的肽段反应,而几乎不与含有cys的肽段反应。
(2)低ph条件下在细胞裂解液中对含硒多肽的特异性标记
实验方法:
在比较ph4.0和ph8.0条件下,对硒蛋白富集的比较实验中,实验流程如方法介绍中描述,分别在ph4.0和ph8.0条件下进行实验。
在半胱氨酸去除率实验中,分为两个实验组。第一个实验组中,取50μg细胞裂解液在ph4.0的条件下先用0.1mmiodoapb进行标记,剩下的iodoapb通过溶液置换去除掉。接下来在ph8.0条件下,用10mmiaa将剩余的半胱氨酸标记。在第二个实验组中,正好相反,先在ph4.0条件下用0.1mmiaa标记,再在ph8.0条件下用10mmiodoapb进行标记。胰酶酶切后,两组中的iodoapb-cys分别用亲和素凝胶进行富集,之后用质谱进行分析。两组中得到的iodoapb-cys强度比即可以用来计算半胱氨酸的清除率(第二组中iodoapb-cys强度/第一组中iodoapb-cys强度)。
实验结果:
在化学合成的多肽上验证过发明人的方法之后,发明人想验证在复杂样品中本发明的方法是否依然有效。发明人选择了用bv2细胞裂解液这样的复杂样本来进行实验,研究在众多含半胱氨酸的肽段干扰的情况下,iodoapb是否仍然能够选择性地标记硒代半胱氨酸,从而实现对硒蛋白的富集。发明人同时在ph4.0或者ph8.0的条件下进行富集,发现与ph8.0的条件下相比,在ph4.0的条件下,含硒代半胱氨酸的肽段强度升高了5倍,说明在ph4.0的条件下,iodoapb会选择性地与硒代半胱氨酸反应(图2b)。接下来,发明人比较了通过本发明的方法,有多少比例的含半胱氨酸的肽段会被去除,结果显示,有88%的含有半胱氨酸的肽段可以被发明人的方法去除掉,大大减少了对含硒肽段富集的干扰(图2c)。
(3)iodoapb与bromoapb对硒代半胱氨酸的特异性标记
实验方法:
人工合成的标准多肽2对,pnsd[c/u]lgmeek,gpspppmagg[c/u]gr,溶于1%tfa,-80℃保存。取20μg多肽混合物(每条多肽各2.5μg),用100mm,ph8.5的tris,8murea缓冲液稀释至200μl,加入100μl20mmdtt,37℃搅拌30min将交联的二硫键/硒硫键还原。加入200mmcitric缓冲液,调节ph至4.0左右,0.1mm的iodoapb或bromoapb,避光25℃反应60min,之后加入10mmiaa,并调节ph值至8.5,避光反应30min,经c18tip除盐,真空干燥后,用质谱进行检测。
实验结果:
发明人比较了碘代的生物素(iodoapb)与溴代的生物素(bromoapb)的反应效率。研究iodoapb反应效率高还是bromoapb反应效率高,从而选择一个高效特异性的烷基化试剂。结果发现,用iodoapb可以鉴定到12个硒蛋白,而用bromoapb仅能鉴定到7个硒蛋白,且强度仅有iodoapb富集的硒蛋白强度的四分之一左右(图2d)。可见,iodoapb比bromoapb反应性更强,可以鉴定到更多的硒蛋白。
实施例2未知硒蛋白的发现
首先发明人构建了潜在硒蛋白的数据库sis数据库(构建方法如实施例1介绍部分描述),用来预测未被发现的潜在硒蛋白。之后发明人将细胞样品,小鼠的各个组织样品利用发明人发明的secms方法(前面所述的硒蛋白富集方法)进行硒蛋白的富集。采集到的所有质谱数据均与发明人构建的sis数据库进行匹配,用来发现新的硒蛋白。
发明人将所有软件鉴定到的潜在硒蛋白均进行了人工验证,必须同时满足以下两个条件发明人才认为是真的。1.质谱数据必须高度可信,搜索软件打分必须高;2.ms1的谱图必须符合含硒肽段的特征谱图。
发明人发现了五个潜在的硒蛋白,它们分别是在肝脏中发现的mup蛋白,在肺中发现的scgb1a1蛋白,在肾脏中发现的fxyd2蛋白,在肝脏和肾脏中发现的atp5b蛋白以及在肝脏中发现的mt2蛋白。这五个潜在硒蛋白的组织分布与之前发表的人类蛋白质组学研究结果中的蛋白分布相一致(图3b)。除了mup蛋白得到的是终止密码子之后的第二个sec位点,其他硒蛋白鉴定到的肽段均为终止密码子后的第一个sec位点。其中,mup蛋白之前并未有蛋白水平的组织分布数据,且仅在小鼠中有报道,在人类中并无蛋白层面的证据。但mrna水平上的数据表明,其主要分布在肝脏中,与发明人鉴定到的一致。且mup蛋白家族有非常多的蛋白,发明人数据测得的含硒肽段是这个家族中很多的蛋白共有的,并不是某个蛋白独有的,质谱数据并不能区分发明人发现的新的硒蛋白具体属于哪个蛋白。
发明人发现的这五个硒蛋白都具有高度可信的二级谱图(图3c-g),其一级谱图也符合含硒肽段的特征谱图(图4a-e)。这些数据都说明发明人结果是非常可信的。为了进一步验证发明人发现的这几个硒蛋白是真的,发明人首先将新发现的含硒肽段在已有的小鼠数据库中进行了匹配,发现并没有对应的含半胱氨酸同源序列。进一步进行blast也并未发现同源序列。说明发明人发现的新的含硒肽段并不是来源于其他蛋白或者是已有硒蛋白的修饰类型。
发明人进一步化学合成了这几个新发现的含硒肽段,并对它们的ms1,ms2进行了采集,与发明人在生物样本中检测到的ms1,ms2进行对比,发现并没有差别(图3c-g)。需要说明的是mt2的含硒肽段合成上存在技术困难,因此并未拿到合格的合成肽段,其余四个新的硒蛋白均进行了验证。进一步说明了发明人发现的确实是新的硒蛋白。发明人进一步在hek293细胞中对其中两个新的硒蛋白fxyd2和atp5b进行了过表达。fxyd2和atp5b克隆包括其全长序列和5’/3’utr。在过表达蛋白的n端连有flag标签,以便进行富集。发明人先用flag抗体将目标蛋白富集下来,再进行secms的富集,之后用质谱进行检测。发明人发现它们的ms2与合成肽段的ms2是完全一样的(图3c-d),且ms1确实具有含硒肽段的特征。这更加有力地说明了发明人新发现的这几个硒蛋白确实是可信的。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!