人卵巢癌抗原检测方法及其试剂盒与流程
本发明涉及一种基于高量子产率金纳米团簇探针的电致化学发光人卵巢癌抗原检测方法及其检测试剂盒,属于分析化学及纳米技术领域。
背景技术:
二十世纪以来人类的生活环境污染日趋加剧、生活环境不断恶化、人们与致癌因素的接触越来越紧密,恶性肿瘤的发病率也在逐年递增,恶性肿瘤已经超过心脑血管疾病成为人类健康的最大敌人。肿瘤发病机制复杂、治疗效果差,有效筛查技术少,早期诊断技术水平低导致肿瘤发现时普遍偏晚。发展较为先进的早期肿瘤筛查技术显得尤为重要。卵巢癌是女性中常见的恶性肿瘤之一。人卵巢癌抗原存在于上皮卵巢癌组织和病人血清中,是研究最多的卵巢癌标记物,在早期筛查、诊断、治疗及预后的应用研究均有重要意义。人卵巢癌抗原对卵巢上皮癌的敏感性可达约70%。目前用于检测血清中人卵巢癌抗原含量的分析方法已发展出很多种,如酶联免疫分析法、化学发光分析法、电化学分析法、荧光分析法、电致化学发光分析和微流控芯片技术等。其中,电致化学发光(electrochemiluminescence,简称ecl)生物分析是近年来发展起来的一种新型分析方法,是化学发光、电化学、生物分析、微电子技术以及传感技术相结合的最新产物。该分析方法具有操作简单、快速、选择性好、线性范围宽,及易控制等诸多优良的性能特点。对于ecl的研究无论是基础研究还是在临床分析、病毒、免疫检测等领域的应用研究均得到了广泛的发展。
在ecl生物分析中,探寻性能优良的ecl发光体对于改善ecl传感器的性能及拓展其应用范围非常关键。根据不同的发光体,ecl体系主要可以分为三类,即有机化合物体系、无机化合物体系和量子点体系。在众多发光体中,金纳米簇(auncs),作为一种新型的发光底物,是由几个到几十个金原子组成的、尺寸接近电子费米波长的一类新型光学纳米材料。由于具有超小的尺寸,使其表现出不同于大尺寸纳米粒子的特殊性质,如可调的荧光发射、良好的光稳定性、较高的荧光量子产率、较大的斯托克斯位移、低毒性、高导电性、易于制备等优点。因此,金纳米团簇在生物标记、医学成像、生物传感器、催化和光电子学等领域被广泛应用。但是由于其电致化学发光强度小、量子产率低、发光机制不清楚等问题的限制,金纳米团簇在电致化学发光领域的研究还非常少。本课题组通过纳米尺度调控成功制得高量子产率auncs电化学发光探针,在以过硫酸钾为共反应剂的水溶液体系中成功构建了基于高量子产率auncs/过硫酸钾阴极ecl发光体系,实现了生命体中神经递质、抗癌药物、尼古丁等的高效检测。针对临床肿瘤诊断和治疗的迫切需求,设计和制备基于新型功能化金纳米团簇的高量子产率电致化学发光免疫传感器,以期从复杂实际样品中高灵敏、高特异地检测各种生物活性小分子和肿瘤标志物。
本发明提供了一种基于高量子产率金纳米团簇探针的电致化学发光人卵巢癌抗原检测方法,及基于该方法制备的检测试剂盒。
技术实现要素:
本发明的一个目的在于提供一种基于高量子产率金纳米团簇探针的电致化学发光人卵巢癌抗原检测方法。
本发明的另一个目的在于提供一种基于高量子产率金纳米团簇探针的电致化学发光人卵巢癌抗原检测试剂盒。
为了实现上述目的,本发明采用以下技术方案:一种基于高量子产率金纳米团簇探针的电致化学发光人卵巢癌抗原检测方法,其特征在于:首先在电极表面修饰金纳米团簇,通过还原法制备高量子产率金纳米团簇电致化学发光探针,并进一步在电极表面修饰二氧化锰纳米材料,将其作为电致化学发光信号猝灭剂;在空白酶标板固定人卵巢癌抗原抗体,加入人卵巢癌抗原,再加入生物素标记的人卵巢癌抗原抗体,形成夹心免疫复合物;加入链霉亲和素-碱性磷酸酶,再加入2-磷酸-l-抗坏血酸三钠盐,通过碱性磷酸酶选择性水解2-磷酸-l-抗坏血酸三钠盐产生抗坏血酸;取出反应液,将电极浸入反应液中,电极表面的二氧化锰与反应液中的抗坏血酸发生氧化还原反应;采集修饰电极的电致化学发光信号,根据电致化学发光信号的改变实现人卵巢癌抗原的检测。
所述还原法制备高量子产率金纳米团簇电致化学发光探针采用下述的电化学还原法和化学还原法制备:
(1)电化学还原法:采用三电极体系进行还原,以金纳米团簇修饰玻碳电极为工作电极,铂丝电极为对电极,ag/agcl为参比电极,将上述电极插入0.1mol/lph7.4磷酸盐缓冲溶液中,施加-1.4v~-2v范围内负电位电压,进行恒电位还原处理5min~1h,得到电化学发光金纳米团簇探针;
(2)化学还原法:将金纳米团簇修饰玻碳电极浸泡在0.1~1mol/l硼氢化钠溶液反应5min~30min,得到化学还原法制备的金纳米团簇探针修饰电极。
所述电极表面修饰二氧化锰纳米材料采用下述的电化学沉积法或滴涂法制备:
(1)电化学沉积法:采用三电极体系,以还原法处理金纳米团簇修饰电极为工作电极,铂丝电极为对电极,ag/agcl为参比电极,采用i-t法,在1:1v/v的kmno4-h2so4溶液中,电沉积二氧化锰,沉积电位为-0.1v~-0.5v,沉积时间为100s~600s,清洗,氮气吹干;
(2)滴涂法:首先制备二氧化锰纳米片,取500μl10mmol/l的kmno4溶液加入到1.25ml、0.1mol/l、ph6.0的缓冲溶液中,加入去离子水使溶液最后的体积成5ml后超声30min,结束后12000r.p.m离心10min,用水洗3次,重新分散于2.5ml去离子水中,得到二氧化锰纳米片溶液;取5μl滴涂于金纳米团簇修饰电极表面,自然晾干。
所述在空白酶标板固定人卵巢癌抗原抗体的方法为自组装法:取空白酶标板,在空白酶标板样品孔中加入1~5mg/mlph8.5的多巴胺溶液50~100μl,于4℃反应1~5h,反应结束后用水轻轻漂洗,拍干;再滴加0.1~0.5mg/ml人卵巢癌抗原抗体溶液,4℃孵育8~12h,漂洗;加入50~100μl1wt%~5wt%的牛血清白蛋白溶液,于4℃反应0.5~2h,洗涤,拍干。
所述加入人卵巢癌抗原,再加入生物素标记的人卵巢癌抗原抗体,形成夹心免疫复合物的方法为:在固定有人卵巢癌抗原抗体酶标板的样品反应孔中加入样本,盖上封板膜,轻轻振荡混匀,37℃温育30min~60min,洗涤,拍干;加入0.1~10μg/ml生物素标记的人卵巢癌抗原抗体50μl,37℃温育30min~60min,洗涤,拍干。
所述加入链霉亲和素-碱性磷酸酶,再加入2-磷酸-l-抗坏血酸三钠盐的方法为:在形成夹心免疫复合物的酶标板孔中每孔分别加入50μl的0.1~1u/ml链霉亲和素-碱性磷酸酶和5~10mmol/l2-磷酸-l-抗坏血酸三钠盐溶液,轻轻振荡混匀,避光反应,37℃温育30min~60min。
所述采集修饰电极的电致化学发光信号方法如下:采用三电极体系进行测试,以修饰电极为工作电极,铂丝电极为对电极,ag/agcl为参比电极,缓冲溶液为磷酸盐缓冲液或tris-hcl缓冲溶液,所用电解质为kcl或kno3;将上述电极插入含有过硫酸根离子共反应剂的缓冲溶液中,施加一定的扫描电压,工作电极表面产生电致化学发光辐射,光电倍增管高压设置为600~800v,检测电致化学发光辐射信号。
所述根据电致化学发光信号的改变实现人卵巢癌抗原的检测为:电极表面所采集的电致化学发光信号的电致化学发光强度值与人卵巢癌抗原ca125浓度的对数值在0.0625u/ml~2u/ml的范围内呈线性关系,检测限为0.04u/ml。
本发明所述的基于高量子产率金纳米团簇探针的电致化学发光人卵巢癌抗原检测方法的检测试剂盒,其特征在于,包括金纳米团簇溶液、二氧化锰纳米材料、人卵巢癌抗原抗体固定酶标板、人卵巢癌抗原标准品、生物素标记的人卵巢癌抗原抗体、链霉亲和素-碱性磷酸酶、2-磷酸-l-抗坏血酸三钠盐、洗涤液、电致化学发光测试电解质溶液。
所述的人卵巢癌抗原抗体固定酶标板为:取空白酶标板,在空白酶标板样品孔中加入1~5mg/mlph8.5的多巴胺溶液50~100μl,于4℃反应1~5h,反应结束后用水轻轻漂洗,拍干;再滴加0.1~0.5mg/ml人卵巢癌抗原抗体溶液,4℃孵育8~12h,漂洗;加入50~100μl1wt%~5wt%的牛血清白蛋白溶液,于4℃反应0.5~2h,洗涤,拍干;所述洗涤液为磷酸盐缓冲液或tris-hcl缓冲溶液;所述的电致化学发光测试电解质溶液为含有过硫酸钾的缓冲溶液。
具体地说,为了实现上述目的,本发明采用以下具体技术方案:首先制备高量子产率金纳米团簇电致化学发光探针,以二氧化锰为电致化学发光猝灭剂,进而利用酶联免疫反应,在夹心免疫反应的基础上,基于链霉亲和素-碱性磷酸酶溶液和2-磷酸-l-抗坏血酸三钠盐反应产生的抗坏血酸与二氧化锰的氧化学原反应恢复电致化学发光信号,由此发展一种基于高量子产率金纳米团簇探针的电致化学发光免疫分析方法,用于肿瘤标志物人卵巢癌抗原的高效检测。本发明包括以下步骤:
(一)高量子产率金纳米团簇探针制备
高量子产率金纳米团簇探针制备方法如下:
(1)电化学还原法:采用三电极体系进行还原,以金纳米团簇修饰玻碳电极为工作电极,铂丝电极为对电极,ag/agcl为参比电极,将上述电极插入缓冲溶液中,施加负电位电压(-1.4v~-2v范围内),进行恒电位还原处理5min~1h,得到电化学发光金纳米团簇探针。
(2)化学还原法:将金纳米团簇修饰玻碳电极浸泡在0.1~1mol/l硼氢化钠溶液反应5~30min(优选0.1mol/l硼氢化钠溶液反应5min),得到化学还原法制备的金纳米团簇探针修饰电极。
所述的金纳米团簇材料为功能化修饰金纳米团簇,如:n-乙酰化-l-半胱氨酸-金纳米团簇,牛血清白蛋白-金纳米团簇等。
(二)电致化学发光信号采集方法
将电极抛光,再依次放入hno3溶液、无水乙醇和去离子水中超声清洗,n2吹干。采用三电极体系进行测试,以修饰玻碳电极为工作电极,铂丝电极为对电极,ag/agcl为参比电极,将上述电极插入含有共反应剂的缓冲溶液中。采用阶跃脉冲法,初始电位为0v,脉冲时间为10s,终止电位为-2v,脉冲时间为1s。光电倍增管高压设置为600v~800v,检测工作电极表面产生的电致化学发光信号。
所述电极为玻碳电极、丝网印刷电极或ito电极等。上述共反应剂为过硫酸根离子,浓度范围为0.01~1mol/l,优选0.1mol/l。所述缓冲溶液为磷酸盐缓冲液或tris-hcl缓冲溶液,在缓冲溶液中所添加电解质为kcl或kno3,浓度为0.01~1mol/l,优选0.1mol/l。
(三)二氧化锰纳米材料修饰方法
(1)电化学沉积法:采用三电极体系,以还原法处理金纳米团簇修饰电极为工作电极,铂丝电极为对电极,ag/agcl为参比电极,采用i-t法,在kmno4-h2so4(1:1v/v)溶液中,电化学沉积二氧化锰,沉积电位为-0.1v~-0.5v,沉积时间为100s~600s,优选-0.2v,300s,之后用双蒸水冲洗干净,氮气吹干备用。
(2)滴涂法:首先制备二氧化锰纳米片,取500μl10mmol/l的kmno4溶液加入到1.25ml0.1mol/lph6.0的缓冲溶液中,加入去离子水使溶液最后的体积成5ml后超声30min,结束后12000r.p.m离心10min,用水洗3次,重新分散于2.5ml去离子水中,得到二氧化锰纳米片溶液。取5μl滴涂于金纳米团簇修饰电极表面,自然晾干。
(四)夹心免疫反应体系构建
夹心免疫反应体系构建具体步骤如下:(1)将空白酶标板设空白孔(空白对照孔不加样品,其余各步骤操作相同)、标准品孔、待测样品孔。取空白酶标板,在空白酶标板样品孔中加入50μl1~5mg/ml的多巴胺溶液(ph8.5的tris-hcl缓冲溶液溶解),于4℃反应1~5h,反应结束后用水轻轻漂洗,拍干。再滴加0.01~0.5mg/ml人卵巢癌抗原抗体溶液,4℃孵育8~12h,漂洗。加入50~200μl1%~5%的牛血清白蛋白溶液,于4℃反应0.5~2h,反应完成后洗涤(小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复4次,拍干)。然后在标准品孔中加入人卵巢癌抗原标准溶液50μl,在样品反应孔中加入50μl样本,盖上封板膜,轻轻振荡混匀,37℃温育30~60min,洗涤,拍干,再加入0.1~10μg/ml生物素标记的人卵巢癌抗原抗体50μl,37℃温育30~60min,洗涤,拍干。每孔加入0.1~1u/ml链霉亲和素-碱性磷酸酶溶液50μl,轻轻振荡混匀,37℃温育30~60min,用10mmph=7.3tris-hcl缓冲液洗涤,拍干。
(五)人卵巢癌抗原的测定
人卵巢癌抗原检测步骤如下:往上述构建的所述的夹心免疫反应体系的酶标板中加入5~10mmol/l2-磷酸-l-抗坏血酸三钠盐溶液50μl,再加入10mmph=8.0tris-hcl缓冲溶液50μl,轻轻振荡混匀,37℃避光反应25~30min。将上述二氧化锰/金纳米团簇修饰电极浸入上述反应液中浸泡4~10min,取出后用双蒸水冲洗干净,n2吹干。采集工作电极表面产生的电致化学发光信号,以电致化学发光信号对人卵巢癌抗原浓度作图绘制标准曲线。
(六)试剂盒
一种基于高量子产率金纳米团簇探针的电致化学发光人卵巢癌抗原检测试剂盒,其中包括金纳米团簇溶液、二氧化锰纳米材料、人卵巢癌抗原抗体固定酶标板、人卵巢癌抗原标准品、生物素标记的人卵巢癌抗原抗体、链霉亲和素-碱性磷酸酶、2-磷酸-l-抗坏血酸三钠盐、洗涤液、电致化学发光测试电解质溶液。
与现有技术相比,本发明的有益效果为:
本发明以高量子产率金纳米团簇探针为电致化学发光材料,以纳米二氧化锰为电致化学发光猝灭剂,利用酶联免疫反应产生抗坏血酸恢复其电致化学发光信号实现人卵巢癌抗原的检测。本发明对人卵巢癌抗原的检测灵敏度高、操作简单,可有效避免检测过程中实际样品复杂成份的干扰,因而特异性好、准确度高。并且,本发明成本低、制作简单、稳定性好、灵敏度好,线性范围宽(0.0625u/ml~2u/ml),检测限低(0.04u/ml),具有较好的市场价值。
附图说明
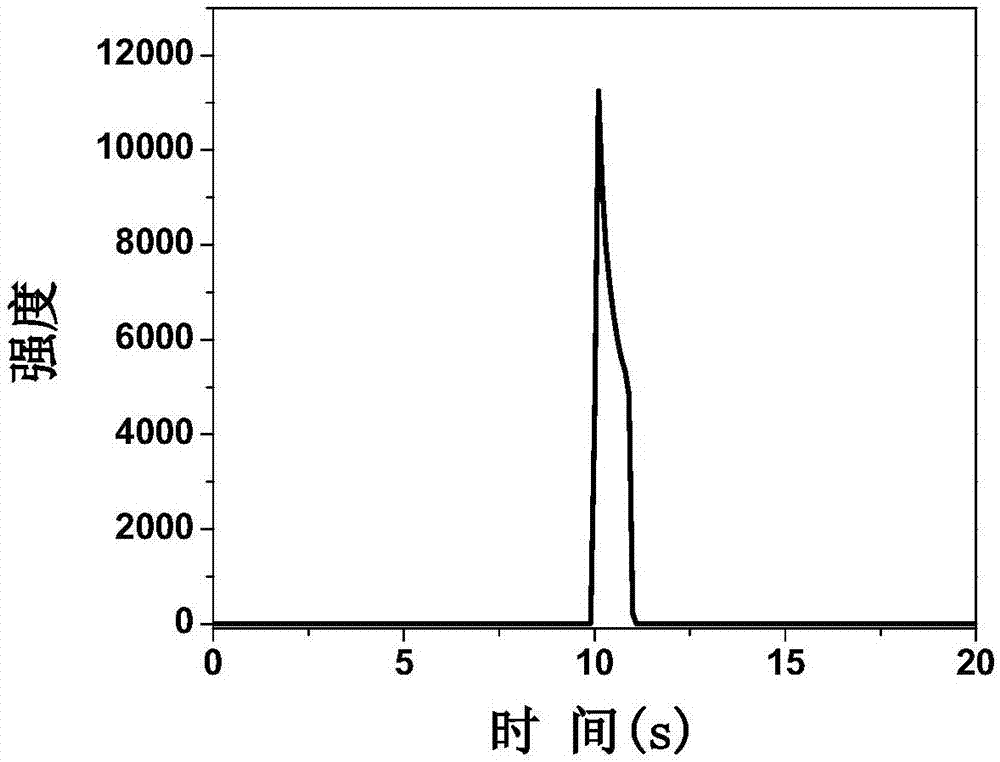
图1为金纳米团簇探针修饰玻碳电极的电致化学发光-时间曲线图。
图2为二氧化锰/金纳米团簇探针修饰玻碳电极的电致化学发光-时间曲线图。
图3为本发明检测人卵巢癌抗原的电致化学发光-时间曲线图(人卵巢癌抗原浓度为2u/ml)。
图4为电致化学发光强度变化与人卵巢癌抗原浓度对数值之间的线性关系图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步阐述,本发明并不限于此。
本发明所用的人卵巢癌抗体(武汉默沙克生物科技有限公司),人卵巢癌抗原(武汉默沙克生物科技有限公司),生物素标记的人卵巢癌抗原抗体(武汉默沙克生物科技有限公司),链霉亲和素-碱性磷酸酶(武汉博士德生物工程有限公司),2-磷酸-l-抗坏血酸三钠盐(sigma-aldrich公司),碱性磷酸酶(sigma-aldrich公司)为现有技术产品。
实施例1
取0.6ml0.5mol/l的naoh与0.4ml20mg/ml氯金酸溶液加入到4ml0.08mol/l的n-乙酰-l-半胱氨酸溶液中,混匀后置于37℃恒温水槽中孵育3小时。待反应结束后,用分子量为3000的透析袋对反应液透析纯化24h,得到纯化后的n-乙酰-l-半胱氨酸保护的金纳米团簇溶液,于4℃冰箱避光保存。
实施例2
将直径3mm的玻碳电极用1.0μm、0.3μm,0.05μm的al2o3粉末依次抛光,打磨,至光滑镜面,再依次放入hno3溶液,无水乙醇,去离子水中超声清洗3分钟,n2吹干。取5μl实施例1制备的n-乙酰-l-半胱氨酸保护的金纳米团簇溶液滴加在处理好的玻碳电极表面,室温干燥,并进一步将该电极浸泡在0.1mol/l硼氢化钠溶液中反应5分钟,得到金纳米团簇探针修饰电极。将上述电极插入含有0.1mol/l过硫酸钾和0.1mol/lkcl的0.1mol/lph7.4磷酸盐缓冲溶液中。采用阶跃脉冲法,初始电位为0v,脉冲时间为10s,终止电位为-2v,脉冲时间为1s。光电倍增管高压设置为750v,检测工作电极表面产生的电致化学发光信号,得到电化学发光信号(见图1)。
实施例3
将直径3mm的玻碳电极用1.0μm、0.3μm,0.05μm的al2o3粉末依次抛光,打磨,至光滑镜面,再依次放入hno3溶液,无水乙醇,去离子水中超声清洗3分钟,n2吹干。取5μl实施例1制备的n-乙酰-l-半胱氨酸保护的金纳米团簇溶液滴加在处理好的玻碳电极表面,室温干燥,并进一步将该电极浸泡在0.1mol/l硼氢化钠溶液中反应5分钟,得到金纳米团簇探针修饰玻碳电极。采用三电极体系,以金纳米团簇探针修饰玻碳电极为工作电极,铂丝电极为对电极,ag/agcl为参比电极,采用计时电流法,在kmno4-h2so4(1:1v/v)溶液中,电沉积二氧化锰,沉积电位为-0.12v,时间为300s,所得到的电极为二氧化锰/金纳米团簇修饰玻碳电极,之后用双蒸水冲洗干净,n2气轻轻吹干备用。将上述电极插入含有0.1mol/l过硫酸钾和0.1mol/lkcl的0.1mol/lph7.4磷酸盐缓冲溶液中。采用阶跃脉冲法,初始电位为0v,脉冲时间为10s,终止电位为-2v,脉冲时间为1s。光电倍增管高压设置为750v,检测工作电极表面产生的电致化学发光信号,得到电化学发光信号(见图2)。
实施例4
取空白酶标板,在空白酶标板样品孔中加入50μl5mg/ml的多巴胺溶液(ph8.5的tris-hcl缓冲溶液溶解),于4℃反应2h,反应结束后用水轻轻漂洗,拍干。再滴加100μg/ml人卵巢癌抗原ca125抗体溶液,4℃孵育12h。孵育结束后用水轻轻漂洗,以便除去电极表面非特异性吸附的抗体。接着加入1%的牛血清白蛋白溶液50μl,于4℃反应1h,反应完成后洗涤(小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复4次,拍干),得到人卵巢癌抗原抗体固定酶标板。人卵巢癌抗原ca125又称糖类抗原ca125。
实施例5
在实施例4制备的人卵巢癌抗原ca125抗体固定酶标板的标准品孔中加入2u/ml的人卵巢癌抗原ca125标准溶液50μl,盖上封板膜,轻轻振荡混匀,37℃温育30min,洗涤,拍干,再加入0.5μg/ml生物素标记的人卵巢癌抗原ca125抗体50μl,37℃温育30min,洗涤,拍干。每孔加入0.2u/ml链霉亲和素-碱性磷酸酶溶液50μl(37℃预热30min),轻轻振荡混匀,37℃温育45min,洗涤,拍干。再往上述酶标板中加入8mmol/l的2-酸磷-l-抗坏血酸三钠盐溶液50μl(37℃预热30min),再加入ph=8.0tri-hcl50μl,轻轻振荡混匀,37℃避光反应25min。将各个孔中的液体取出,加入2ml的ep管当中,将处理好的电极放入各个对应浓度ep管中浸泡10min,取出后用双蒸水冲洗干净,n2吹干。将上述电极插入含有0.1mol/l过硫酸钾和0.1mol/lkcl的0.1mol/lph7.4磷酸盐缓冲溶液中。采用阶跃脉冲法,初始电位为0v,脉冲时间为10s,终止电位为-2v,脉冲时间为1s。光电倍增管高压设置为750v,检测工作电极表面产生的电致化学发光信号,得到的电化学发光信号比未加人卵巢癌抗原的溶液明显增大(图3)。
实施例6
取空白酶标板,将空白酶标板设空白孔(空白对照孔不加样品,其余各步骤操作相同)、标准品孔、待测样品孔。在空白酶标板各孔中加入50μl5mg/ml的多巴胺溶液(ph8.5的tris-hcl缓冲溶液溶解),于4℃反应2h,反应结束后用水轻轻漂洗,拍干。再滴加200μg/ml人卵巢癌抗原ca125抗体溶液,4℃孵育12h。孵育结束后用水轻轻漂洗,以便除去电极表面非特异性吸附的抗体。接着加入1%的牛血清白蛋白溶液50μl,于4℃反应1h,反应完成后洗涤(小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复4次,拍干)。然后在标准品孔中加入不同浓度的人卵巢癌抗原标准溶液50μl,盖上封板膜,轻轻振荡混匀,37℃温育30min,洗涤,拍干,再加入0.5μg/ml生物素标记的人卵巢癌抗原抗体50μl,37℃温育30min,洗涤,拍干。每孔加入0.2u/ml链霉亲和素-碱性磷酸酶溶液50μl(37℃预热30min),轻轻振荡混匀,37℃温育45min,洗涤,拍干。再往上述酶标板中加入8mmol/l的2-酸磷-l-抗坏血酸三钠盐溶液50μl(37℃预热30min),再加入ph=8.0tri-hcl50μl,轻轻振荡混匀,37℃避光反应25min。将各个孔中的液体取出,加入2ml的ep管当中,将处理好的电极放入各个对应浓度ep管中浸泡10min。取出后用双蒸水冲洗干净,n2吹干。将上述电极插入含有0.1mol/l过硫酸钾和0.1mol/lkcl的0.1mol/lph7.4磷酸盐缓冲溶液中。采用阶跃脉冲法,初始电位为0v,脉冲时间为10s,终止电位为-2v,脉冲时间为1s。光电倍增管高压设置为750v,检测工作电极表面产生的电致化学发光信号,在人卵巢癌抗原浓度为0.0625u/ml~2u/ml的范围内人卵巢癌抗原ca125浓度的对数值与电致化学发光强度值呈良好的线性关系,检测限为0.04u/ml(见图4)。
实施例7
取500μl10mmol/l的kmno4溶液加入到1.25ml0.1mol/lph6.0的2-(n-吗啉代)乙磺酸(mes)缓冲溶液中,加入去离子水使溶液最后的体积成5ml后超声30min,结束后12000r.p.m离心10min,用水洗3次,重新分散于2.5ml去离子水中,得到二氧化锰纳米片溶液。
实施例8
试剂盒使用方法:(1)取5μl实施例1制备的n-乙酰-l-半胱氨酸保护的金纳米团簇滴加在处理好的玻碳电极表面,室温干燥。并进一步将该电极浸泡在0.1mol/l硼氢化钠溶液中反应5分钟,得到金纳米团簇探针修饰玻碳电极。取6μl实施例7制备的mno2纳米片溶液滴加在上述金纳米团簇探针修饰玻碳电极表面,室温干燥,得到二氧化锰/金纳米团簇修饰玻碳电极。(2)取实施例4制备的人卵巢癌抗原抗体固定酶标板,将其设为空白孔(空白对照孔不加样品,其余各步骤操作相同)、标准品孔、待测样品孔。在空白酶标板各孔中加入50μl5mg/ml的多巴胺溶液(ph8.5的tris-hcl缓冲溶液溶解),于4℃反应2h,反应结束后用水轻轻漂洗,拍干。再滴加200μg/ml人卵巢癌抗原ca125溶液,4℃孵育12h。孵育结束后用水轻轻漂洗,以便除去电极表面非特异性吸附的抗体。接着加入50μl1%的bsa溶液,于4℃反应1h,反应完成后洗涤(小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复4次,拍干)。然后在标准品孔中加入不同浓度的人卵巢癌抗原标准溶液50μl,盖上封板膜,轻轻振荡混匀,37℃温育30min,洗涤,拍干,再加入0.5μg/ml生物素标记的人卵巢癌抗原ca125抗体50μl,37℃温育30min,洗涤,拍干。每孔加入0.2u/ml的链霉亲和素-碱性磷酸酶溶液50μl(37℃预热30min),轻轻振荡混匀,37℃温育45min,洗涤,拍干。再往上述酶标板中加入8mmol/l的2-酸磷-l-抗坏血酸三钠盐溶液50μl(37℃预热30min),再加入ph=8.0tri-hcl50μl,轻轻振荡混匀,37℃避光反应25min。(3)将各个孔中的液体取出,加入2ml的ep管当中,将处理好的电极放入各个对应浓度ep管中浸泡10min。取出后用双蒸水冲洗干净,n2吹干。将上述电极插入含有0.1mol/l过硫酸钾和0.1mol/lkcl的0.1mol/lph7.4磷酸盐缓冲溶液中。采用阶跃脉冲法,初始电位为0v,脉冲时间为10s,终止电位为-2v,脉冲时间为1s。光电倍增管高压设置为750v,检测工作电极表面产生的电致化学发光信号,在人卵巢癌抗原ca125浓度为0.0625u/ml~2u/ml的范围内人卵巢癌抗原浓度的对数值与电致化学发光强度变化值呈良好的线性关系,检测限为0.04u/ml。
以上所述仅为本发明的典型实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改,等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!