草莓染色体加倍法及所用的倍性快速鉴定方法与流程
本发明涉及利用氨磺乐灵进行二倍体野生草莓加倍并用细胞流式仪快速鉴定染色体倍性的方法。
背景技术:
草莓是多年生常绿草本植物,属于蔷薇科(rosaceae)草莓属(fragaria),染色体基数为x=7,其染色体倍性有二倍体(2x)、四倍体(4x)、五倍体(5x)、六倍体(6x)、八倍体(8x)及少量的十倍体(10x)和十二倍体(12x)。目前世界各地商品化种植的草莓品种均属于八倍体(2n=8x=56)大果凤梨草莓(fragaria×ananassaduch.),全世界草莓属约有20个常见种,除大果栽培种凤梨草莓外,其余种均为野生状态。野生草莓具有许多优良性状,尤其在抗寒、抗病、固形物含量、芳香性、抗氧化物质含量高等方面更具独特之处,是改良现代栽培草莓的重要基因资源。我国自然分布有11个种,是世界上野生草莓种类最丰富的国家,而且很多是珍稀类型。比如野生的森林草莓(f.vescal.)抗病性良好,与栽培草莓相比,几乎没有发生炭疽病。
在草莓染色体加倍的研究中,有报道的均以秋水仙素作为加倍剂,但秋水仙素是一种剧毒物质,使用剂量过低无法获得加倍材料,剂量过高对处理材料具有毒副作用,同时对操作规程有严格要求,对人、畜及环境存在较大安全隐患。氨磺乐灵能与微管、微丝蛋白特异性结合,能阻止正在分裂的植物细胞内的纺锤丝的形成,在药效消失后细胞又能恢复常态,重新进行分裂并形成多倍,与秋水仙素相比用量少毒性低。beatrizpintos(2006)等分别采用氨磺乐灵和秋水仙素处理欧洲栓皮栎(corkoak)单倍体胚囊来获得二倍体植株,氨磺乐灵浓度为0.01mmol﹒l-1,浸泡48h加倍效果最佳,约50%的单倍体胚囊被加倍,且对胚后期生长毒性最小;秋水仙素8.8mmol﹒l-1,处理72h加倍效果仅为22%,且对胚后期生长抵制最强。储丽红等(2014)用氨磺乐灵、秋水仙素对‘dakota’安组花组培苗进行浸泡处理,15mg﹒l-1氨磺乐灵处理7d,死亡率14.58%,诱导率48.72%;0.5%秋水仙素处理5d,死亡率为31.11%,诱导率达62.96。
目前国内尚未有氨磺乐灵在草莓上应用的报道。
技术实现要素:
本发明要解决的技术问题是提供一种草莓染色体加倍及所采用的倍性快速鉴定方法,本发明利用氨磺乐灵对二倍体野生森林草莓进行染色体加倍,并快速检测染色体倍性的方法,采用该方法能有效地获得加倍后代。
为了解决上述技术问题,本发明提供一种草莓染色体倍性快速鉴定方法:
以野生森林草莓诱导获得的诱变后草莓作为试材,以野生森林草莓(二倍体)为对照;
将试材和对照分别进行以下操作:取叶片制备成草莓细胞核染色悬液;从而分别得试材染色后细胞核悬液和对照染色后细胞核悬液;
将上述试材染色后细胞核悬液和对照染色后细胞核悬液在流式细胞仪上检测,利用dna相对含量的直方图来进行试材的倍性分析,并从中筛选出倍性发生变异的单株(从而筛选出新种质材料)。
作为本发明的草莓染色体倍性快速鉴定方法的改进:
调整流式细胞仪的检测参数,使对照染色后细胞核悬液的dna含量峰值出现在200处,获得对照检测直方图(即,直方图横坐标为200,出现dna含量峰值);
保持流式细胞仪的检测参数不变,对试材染色后细胞核悬液进行检测,从而获得试材检测直方图;当试材检测直方图的dna含量峰值出现在200处时,判定该试材所对应的诱变后单株为二倍体,当试材检测直方图的dna含量峰值出现在400处时,判定该试材所对应的诱变后单株为四倍体。
备注说明:
可选用美国贝克曼公司型号为quanta.sc的流式细胞仪。
dna荧光染料可定量结合在dna双链的碳架结构上,细胞内dna分子数目越多,dna分子链越长,荧光染料嵌入碳架结构中的量就越多,经激光照射,这些dna猝发荧光的强度也就越强。由于dna含量与荧光信号强度成正比关系,细胞发出的荧光信号强度可代表所测细胞内的dna含量,而细胞内dna含量与倍性相互关系,因而可用于植物倍性鉴定。
作为本发明的草莓染色体倍性快速鉴定方法的进一步改进,所述草莓细胞染色核悬液的制备方法为依次进行以下步骤:
①、取50mg草莓叶片加入1ml预冷(4±1℃)ottoi缓冲液,将叶片粉碎均匀搅拌混合,70μm过滤器过滤(可过滤至1.5ml离心管)后进行首次低温离心(弃上清液);
②、在首次低温离心所得的沉淀中再加入1ml预冷(4±1℃)ottoi缓冲液均匀混合后进行二次低温离心(弃上清液);
③、在二次低温离心所得的沉淀中加入混合液600μl、10μlrnase酶(浓度为10mg﹒ml-1)和50μlpi(bdpharmingentm,pi/rnasestainingbuffer)混匀后避光条件下于4±1℃放置15±2min从而实现染色,然后用40μm过滤器过滤,得草莓细胞核染色悬液(用于上机检测);
所述混合液由预冷(4±1℃)的ottoi缓冲液与ottoⅱ缓冲液按照1:2的体积比混合而得。
作为本发明的草莓染色体倍性快速鉴定方法的进一步改进:所述步骤①的首次低温离心和步骤②的二次低温离心均为:1000±200r·min-1、4±1℃离心5±1min。
作为本发明的草莓染色体倍性快速鉴定方法的进一步改进:
ottoⅰ缓冲液的制备方法为:称取1.9214g柠檬酸,加入去离子水溶解,加入500μl吐温20搅拌均匀,加入2~3g聚乙烯吡咯烷酮(pvp)搅拌至溶解,然后用去离子水定容至100ml,0.2μm过滤灭菌;
注:该ottoⅰ缓冲液ph2~3,需4℃冷藏;
ottoⅱ缓冲液的制备方法为:称取5.6784g磷酸氢二钠,加入去离子水溶解,然后用去离子水定容至100ml,0.2μm过滤灭菌;
注:该ottoⅱ缓冲液的ph8~9,常温保存。
本发明还同时提供了利用上述草莓染色体倍性快速鉴定方法进行的草莓染色体加倍法,依次包括以下步骤:
1)、取生长健壮且无病虫害的野生森林草莓(二倍体)的匍匐茎,取茎尖处1~2cm的长度作为茎尖段,流水冲洗(放入纱袋中用自来水冲洗);
2)、将上述流水冲洗后的茎尖段经消毒(常规消毒)后,割取3.0~5.0毫米作为茎尖小段,接种到诱导无菌苗培养基上进行培养;培养条件为:16小时光照,光照强度30~40μmolm-2·s-1,温度为25±1℃;8小时暗培养,温度为21±1℃;上述光照和暗培养交替进行;直至获得1.0~2.0cm高的无菌苗;
3)、将步骤2)所得的无菌苗接种到增殖培养基上进行培养;培养条件为:16小时光照,光照强度30~40μmolm-2·s-1,温度为25±1℃;8小时暗培养,温度为21±1℃;上述光照和暗培养交替进行;每30~35d继代一次;此时,每个无菌苗上长出侧枝小苗(一般,每个无菌苗上能长出3~5个长度约为0.8~1.5cm的侧枝小苗);
4)、以步骤2)所得的长至1.0~2.0cm的无菌苗或者步骤3)继代所得的侧枝小苗为试材,先将试材接种至诱变加倍培养基中培养处理14±1天,得诱变后单株;
每个诱变后单株转接入增殖培养基中进行继代培养,每30~35d继代一次,从而获得侧枝单株(即,此时,每个单株上能长出3~5个侧枝单株);
上述在诱变加倍培养基中的培养处理、以及在增殖培养基中的继代培养,均满足以下培养条件:16小时光照,光照强度30~40μmolm-2·s-1,温度为25±1℃;8小时暗培养,温度为21±1℃;上述光照和暗培养交替进行;
备注:此步骤中,为了便于后期对处理后单株的确认,避免产生混淆,对每个诱变后单株,先进行独立编号然后转接入增殖培养基中进行继代培养;
5)、步骤4)所得的每个诱变后单株所对应的侧枝单株挑取任意一个为试材,按照草莓染色体倍性快速鉴定方法(利用细胞流式仪进行染色体快速检测),来判定该处理后单株是否为变异株:
当试材检测直方图的dna含量峰值出现在200处时,判定该试材所对应的诱变后单株为二倍体,当试材检测直方图的dna含量峰值出现在400处时,判定该试材所对应的诱变后单株为四倍体,若试材检测直方图的dna含量峰值出现在500或800处时可分别判定该试材为五倍体或八倍体。
作为本发明的草莓染色体加倍法的改进:
步骤2)中的诱导无菌苗培养基为:ms基本培养基+6-苄氨基嘌呤0.3~0.5mg﹒l-1+蔗糖30.0g﹒l-1+琼脂7.0g﹒l-1,ph为5.5~6.0;
步骤3)和步骤4)中的增殖培养基为:ms基本培养基+6-苄氨基嘌呤0.3~0.5mg﹒l-1+蔗糖30.0g﹒l-1+琼脂7.0g﹒l-1,ph为5.5~6.0;
步骤4)中的诱变加倍培养基为ms基本培养基+6-苄氨基嘌呤0.3~0.5mg﹒l-1+氨磺乐灵150.0~200.0μmol﹒l-1+蔗糖30.0g﹒l-1+琼脂7.0g﹒l-1,ph为5.5~6.0。
诱导无菌苗培养基的制作方法为:以ms基本培养基为基础,每1l的ms基本培养基中加0.3~0.5mg的6-苄氨基嘌呤、30g蔗糖、7g琼脂粉;利用1mol﹒l-1的koh或1mol﹒l-1的hcl调节ph为5.5~6.0。
增殖培养基的制作方法为:以ms基本培养基为基础,每1l的ms基本培养基中加入0.3~0.5mg的6-苄氨基嘌呤、30.0g蔗糖、7.0g琼脂粉,利用1mol﹒l-1的koh或1mol﹒l-1的hcl调节ph为5.5~6.0。
诱变加倍培养基的制作方法具体如下:以ms基本培养基为基础,每1lms基本培养基中加0.3~0.5mg的6-苄氨基嘌呤、150~200μmol氨磺乐灵、30.0g蔗糖、7.0g琼脂粉;利用1mol﹒l-1的koh或1mol﹒l-1的hcl调节ph为5.5~6.0。
本发明利用氨磺乐灵实现对野生森林草莓染色体的加倍,在本发明的草莓染色体加倍法的步骤4)中,在增殖培养基中添加氨磺乐灵150.0~200.0μmol/l处理14±1天后转接入正常增殖培养基中继代。每个单株(诱变后单株)继代培养1次约可得到3~5个侧枝单株,其中1个侧枝单株依照后续的步骤5)进行草莓染色体倍性快速鉴定,余下的侧枝单株待检测结果确定为四倍体时再进行增殖培养。
本发明的草莓染色体倍性快速鉴定方法,经pi染色后的细胞核悬液可在美国贝克曼公司型号为quanta.sc的流式细胞仪上检测,准确率高,利用主峰粒子团清晰集中的dna相对含量直方图来进行待检植株的倍性分析,从而筛选出新种质材料。具体为,将试材染色后细胞核悬液和对照染色后细胞核悬液在流式细胞仪上检测,利用dna相对含量的直方图来进行试材的倍性分析,即,依据优化的草莓流式检测条件得到处理株与对照株的dna含量直方图,根据检测结果进行比较并判断,并从中筛选出倍性发生变异的新材料。
本发明对细胞核悬液制备方法进行了优化,采用70μm+40μm二级过滤法,且40μm过滤器过滤在加入10μlrnase酶和50μlpi于4±1℃避光染色15±2min后进行,过滤掉大于40μm的细胞粘连体,既提高了细胞核悬液的纯度,又防止了仪器管路堵塞的隐患。
草莓低倍性野生种中蕴藏着丰富优良性状的基因资源,由于染色体倍性差异、杂交亲和力差等原因,将野生低倍性种质优良性状基因向栽培凤梨草莓转移存在一定障碍(因为栽培凤梨草莓为八倍体,而野生森林草莓为二倍体,二者之间通过常规杂交通常杂交成功率低,因此要实现优良性状基因转移存在一定障碍)。本发明的氨磺乐灵对二倍体野生森林草莓进行染色体加倍的方法,氨磺乐灵是一种抗微管物质,能与植物微管蛋白高度亲和形成氨磺乐灵-微管蛋白复合体,并干扰细胞器的ca2+运输,导致更多微管解聚合,抑制细胞有丝分裂,达到低浓度、高效率诱导细胞染色体变异的效果。本发明的结果表明,氨磺乐灵比秋水仙碱具有用量少(可减少用量130mg﹒l-1)、低毒性、低成本、高效率诱导染色体的特点。同时建立了染色体倍性快速鉴定方法,改良了细胞解离液配方,改进了细胞核悬液过滤方式。采用本发明的方法,可获得加倍的草莓试管苗,并经过倍性快速鉴定,最终创制出草莓新种质材料,通过染色体加倍结合有性杂交,开发利用低倍性野生草莓基因资源。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
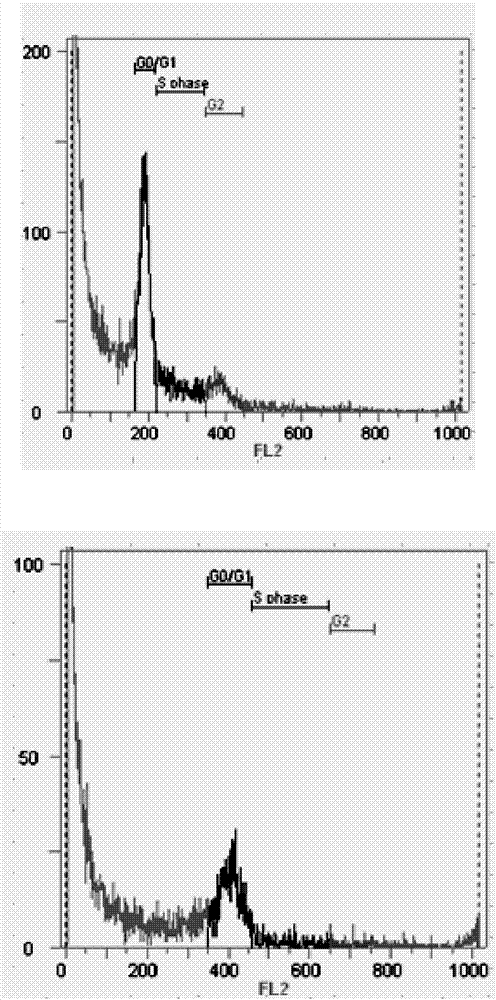
图1为实施例1中二倍体对照(上图)与二个加倍后获得的4倍体材料(中图、下图)流式检测直方图;具体为:中图对应的是实施例1加倍体,下图对应的是对实施例2的加倍体;
直方图中的纵坐标代表细胞核数量,横坐标代表为dna相对含量值;这2个数据均能从流式细胞仪上直接获得。
图2为实施例1中二倍体对照与加倍后获得的多倍体试管苗。
图3为二级过滤法中40μm过滤器不同过滤次序细胞核悬液镜检效果;
左图对比例2所示镜检图;右图为实施例1所示镜检图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:一种草莓染色体加倍及倍性快速鉴定方法,依次进行以下步骤:
1)、取生长健壮且无病虫害的野生森林草莓(二倍体)的匍匐茎,取茎尖处1~2cm的长度作为茎尖段,流水冲洗(放入纱袋中用自来水冲洗);
2)、将上述流水冲洗后的茎尖段经消毒(常规消毒)后,割取3.0~5.0毫米作为茎尖小段,接种到诱导无菌苗培养基上进行培养;培养条件为:16小时光照,光照强度30~40μmolm-2·s-1,温度为25±1℃;8小时暗培养,温度为21±1℃;上述光照和暗培养交替进行;直至获得1.0~2.0cm高的无菌苗;
诱导无菌苗培养基:ms基础培养基+0.5mg﹒l-16-苄氨基嘌呤+7.0g﹒l-1琼脂+30.0g﹒l-1蔗糖,ph为5.5~6.0;
3)、将步骤2)所得的无菌苗接种到增殖培养基上进行培养;培养条件为:16小时光照,光照强度30~40μmolm-2·s-1,温度为25±1℃;8小时暗培养,温度为21±1℃;上述光照和暗培养交替进行;每30~35d继代一次;此时,每个无菌苗上能长出3~5个侧枝小苗(该侧枝小苗的长度约为0.8~1.5cm);
增殖培养基:ms基础培养基+0.4mg﹒l-16-苄氨基嘌呤+7.0g﹒l-1琼脂+30.0g﹒l-1蔗糖,ph为5.5~6.0。
4)、以步骤2)所得的长至1.0~2.0cm的无菌苗或者步骤3)继代所得的侧枝小苗为试材,先将试材接种至诱变加倍培养基中培养处理14天,得诱变后单株;
每个诱变后单株转接入增殖培养基中进行继代培养,每30~35d继代一次;此时,每个单株上能长出3~5个侧枝单株;
可利用该侧枝单株从中筛选出倍性发生变异的单株,依据植株叶片流式细胞仪检测,鉴定出获得四倍体植株(具体如下述步骤5所述);
上述在诱变加倍培养基中的培养处理、以及在增殖培养基中的继代培养,均满足以下培养条件:16小时光照,光照强度30~40μmolm-2·s-1,温度为25±1℃;8小时暗培养,温度为21±1℃;上述光照和暗培养交替进行;
增殖培养基同步骤3)的增殖培养基;
诱变加倍培养基:ms基础培养基+0.4mg﹒l-16-苄氨基嘌呤+200.0μmol﹒l-1氨磺乐灵+7.0g﹒l-1琼脂+30.0g﹒l-1蔗糖,ph为5.5~6.0。
备注:此步骤中,为了便于后期对处理后单株的确认,避免产生混淆,对每个诱变后单株,先进行独立编号然后转接入增殖培养基中进行继代培养;
5)、步骤4)所得的每个诱变后单株所对应的侧枝单株挑取任意一个为试材,按照草莓染色体倍性快速鉴定方法(利用细胞流式仪进行染色体快速检测),来判定该诱变后单株是否为变异株:
具体如下:
一、以野生森林草莓诱导获得的诱变后草莓(步骤4)所得的每个诱变后单株所对应的侧枝单株挑取任意一个)作为试材,以野生森林草莓(二倍体)为对照;
将试材和对照分别进行以下操作:取叶片制备成草莓细胞核染色悬液,草莓细胞核染色悬液的制备方法为依次进行以下步骤:
①、取50mg草莓叶片加入1ml预冷(4±1℃)ottoi缓冲液,将叶片切碎均匀搅拌混合,70μm过滤器过滤(可过滤至1.5ml离心管)后进行首次低温离心(弃上清液);
②、在首次低温离心所得的沉淀中再加入1ml预冷(4±1℃)ottoi缓冲液均匀混合后进行二次低温离心(弃上清液);
③、在二次低温离心所得的沉淀中再加入混合液600μl、10μlrnase酶(浓度为10mg﹒ml-1)和50μlpi(bdpharmingentm,pi/rnasestainingbuffer)混匀后避光条件下于4±1℃)放置15min从而实现染色,然后用40μm过滤器过滤,得草莓细胞核染色悬液(用于上机检测);
所述混合液由预冷(4±1℃)的ottoi缓冲液与ottoⅱ缓冲液按照1:2的体积比混合而得。
ottoⅰ缓冲液的制备方法为:称取1.9214g柠檬酸,加入去离子水溶解,加入500μl吐温20搅拌均匀,加入3g聚乙烯吡咯烷酮(pvp)搅拌至溶解,然后用去离子水定容至100ml,0.2μm过滤灭菌;该ottoⅰ缓冲液ph值约为2~3,需4℃冷藏;
ottoⅱ缓冲液的制备方法为:称取5.6784g磷酸氢二钠,加入去离子水溶解,然后用去离子水定容至100ml,0.2μm过滤灭菌;该ottoⅱ缓冲液的ph值约为8~9,常温保存。
上述首次低温离心和二次低温离心均为:1000±200r·min-1、4±1℃离心5min。
二、将上述试材染色后细胞核悬液和对照染色后细胞核悬液在流式细胞仪上检测,利用dna相对含量的直方图来进行试材的倍性分析,并从中筛选出倍性发生变异的单株(从而筛选出新种质材料);
具体如下:
可选用美国贝克曼公司型号为quanta.sc的流式细胞仪;
调整流式细胞仪的检测参数,使对照染色后细胞核悬液的dna含量峰值出现在200处,获得对照检测直方图(直方图横坐标为200,出现dna含量峰值);
保持流式细胞仪的检测参数不变,对试材染色后细胞核悬液进行检测,从而获得试材检测直方图;当试材检测直方图的dna含量峰值出现在200处时,判定该试材所对应的诱变后单株为二倍体,当试材检测直方图的dna含量峰值出现在400处时,判定该试材所对应的诱变后单株为四倍体。如图1所述。
依照上述方法,可获得经倍性鉴定的加倍试管苗,诱导率为2~3%,并且可以长期得到一定数量的加倍试管苗,从而创制出草莓新材料。流式细胞仪检测结果全峰变异系数为5~6%。
诱导率=诱变后倍性发生变异的单株数/诱变后单株数
流式检测全峰变异系数=标准偏差/平均值。
实施例2、将实施例1的诱变加倍培养基中的氨磺乐灵的浓度由200.0μmol.﹒l-1改成150μmol﹒l-1,其余等同于实施例1。
诱导加倍试管苗获得率为1.5~2%。
对比例1-1、将实施例1的诱变加倍培养基中的氨磺乐灵的浓度由200.0μmo﹒l-1l改成43.3μmol﹒l-1,其余等同于实施例1。
诱变加倍试管苗获得率为0。
对比例1-2、将实施例1的诱变加倍培养基中的氨磺乐灵的浓度由200.0μmol﹒l-1改成10μmol﹒l-1,其余等同于实施例1。
诱变加倍试管苗获得率为0。
对比例2:将实施例1草莓细胞染色核悬液的制备方法中的步骤③改成为:
③、于4℃,在二次低温离心所得的沉淀中再加入混合液600μl均匀混合后用40μm过滤器过滤,再于避光条件下,在滤液中加入10μlrnase酶和50μlpi染色15min。
即,改变二级过滤法中40μm过滤器的过滤次序。
其余等同于实施例1。
如图3所述,该方法所得的细胞核悬液显微镜镜检可见粘连体明显多于实施例1,单细胞核数少于实施例1,实施例1获得了主峰粒子团清晰集中的直方图,从而提高了流式细胞仪上机检测准确性和成峰效果。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!