一种用于均一体系细胞荧光检测钙流方法与流程
本发明涉及细胞荧光检测领域,特别涉及一种用于均一体系细胞荧光检测钙流方法。
背景技术:
高通量筛选是药物发现中很重要的环节。在筛选分析过程中,细胞外部介质的更换经常是耗费时间的一步。同时在这一步骤,细胞的丢失也是容易发生的事故。在细胞介质中添加而不是更换通常更容易操作。
细胞内钙离子的变化是广泛应用的监测细胞表面受体激活的有效指标。用于此技术的荧光标记物fluo-4在和细胞内游离的钙离子结合后,它的荧光发射波长会发生变化。但残留在细胞外面的fluo-4和钙离子结合会干扰细胞内的信号。如果在细胞外有淬灭剂,特异性地屏蔽掉细胞外的信号,就会极大的简化实验过程。
目前,国内外也尝试用各种方法来实现不用置换细胞外介质的方法,我们急迫需要开发一种经济实用的用于均一体系细胞荧光检测钙流方法。
技术实现要素:
本发明主要提供一种可适用于flipr的不需要洗脱细胞外荧光物质的方法。为了实现上述发明目的,本发明采用在细胞装载荧光染料后加入淬灭剂amaranth,提出一种用于均一体系细胞荧光检测钙流方法。
包括如下步骤:
a.称取amaranth粉末,溶解在flipr缓冲液(1xhank’s缓冲液+20mmhepes,ph7.4)中,得到25mg/ml溶液;
b.取10μlfluo-4am(2mm)和10μlpluronicacid(20%indmso)混匀,加入到10.5mlflipr缓冲液中,再加入10.5μl小牛血清,
c.如果细胞像cho一样有阴离子泵(organicaniontransporter,还需要在flipr缓冲液中加入probenecid(终浓度2.5mm)
d.在96孔板的每孔加入100ul荧光染料溶液,放回培养箱温浴0.5h-48h后再加入100μlamaranth溶液,这也是与现有技术的不同之处(以f8nwnowashcalciumassaykit为例),目的是为了减小淬灭剂amaranth对细胞的毒性。
进一步地,还包括前期准备步骤和后续flipr分析步骤。
进一步地,所述前期准备步骤如下:准备细胞板:将cho-m5以每孔60000个细胞的密度种在96孔板中(孔板类型为四周黑色,底部透明),培育16-24小时。
进一步地,所述前期准备步骤如下:准备细胞板:将hek-m4细胞以80000个/孔的密度种在96孔板中(孔板类型为四周黑色,底部透明),培育16-24小时。
进一步地,所述后续flipr分析步骤如下:细胞为cho细胞,将孔板中的培养基全部吸出,加入100μl的荧光染料溶液,37℃孵育0.5h-48h后,再次吸出孔板里的液体,加入100μl的flipr缓冲液(含amaranth),然后根据实验需求加入药物后进行flipr分析。
优选地,所述后续flipr分析步骤如下:细胞为cho细胞,将孔板中的培养基全部吸出,加入100μl的荧光染料溶液,37℃孵育1h后,再次吸出孔板里的液体,加入100μl的flipr缓冲液(含amaranth),然后根据实验需求加入药物后进行flipr分析。
进一步地,所述后续flipr分析步骤如下:细胞为hek细胞,直接在细胞孔板中加入100μl的荧光染料溶液,37℃孵育0.5h-48h后,根据实验需求加入药物后进行flipr分析。
优选地,所述后续flipr分析步骤如下:细胞为hek细胞,直接在细胞孔板中加入100μl的荧光染料溶液,37℃孵育1h后,根据实验需求加入药物后进行flipr分析。
本发明的优点如下:
(1)实现了细胞在测量前不用置换液体;
(2)本发明非常经济实惠,整个检测过程成本占现有技术成本的10%-20%;
(3)本发明整个操作过程简单,可用于高通量筛选。
附图说明
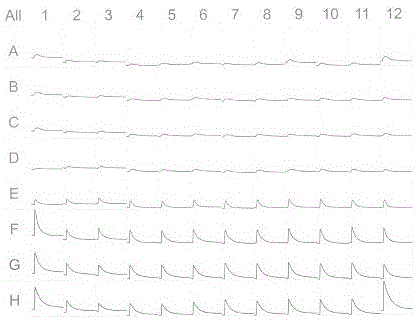
图1为cho-m5flipr分析总图;其中1-3为重复测量复孔(amaranth浓度为0.5mg/ml),4-6为重复测量复孔(amaranth浓度为1mg/ml),7-9为重复测量复孔(amaranth浓度为1.5mg/ml),10-12为重复测量复孔(amaranth浓度为2mg/ml),a至h依次为浓度递增的carbachol,即0.0128nm,0.64nm,3.2nm,16nm,80nm,400nm,2μm,10μm。
图2为hek-m4flipr分析总图;其中1-3为重复测量复孔(amaranth浓度为0.5mg/ml),4-6为重复测量复孔(amaranth浓度为1mg/ml),7-9为重复测量复孔(amaranth浓度为1.5mg/ml),10-12为重复测量复孔(amaranth浓度为2mg/ml),a至h依次为浓度递增的carbachol,即0.0128nm,0.64nm,3.2nm,16nm,80nm,400nm,2μm,10μm。
具体实施方式
通过下列实施例将有助于理解本发明,但不限制本发明的内容。
实施例1
1)准备细胞板:将cho-m5以每孔60000个细胞的密度种在96孔板中(孔板类型为四周黑色,底部透明),培育16小时;
2)准备溶液a:配制flipr缓冲液(1xhbss+20mmhepes),然后加入probenecid(1m溶于1nnaoh)至终浓度为2.5mm,并调节ph至7.4。
3)准备溶液b:取10μlfluo-4am(2mm)和10μlpluronicacid(20%indmso)混匀。
4)准备荧光染料溶液:将20μl溶液b加入到10.5ml溶液a中,再加入10.5μl小牛血清。
5)配制含amaranth缓冲液:在flipr缓冲液中加入不同体积的amaranth,使amaranth最终浓度分别为2.0mg/ml,1.5mg/ml,1.0mg/ml,0.5mg/ml。
6)flipr分析:将孔板中的培养基全部吸出,加入100μl的荧光染料溶液,37℃孵育1h后再次吸出孔板里的液体,加入100μl的flipr缓冲液(含amaranth),然后根据实验需求加入药物后进行flipr分析,结果如图1。
7)结果分析:如图1所示,在cho-m5细胞上flipr信号随carbachol浓度升高而增强,且不同浓度amaranth对flipr信号并无明显影响。
实施例2
1)准备细胞板:将hek-m4细胞以80000个/孔的密度种在96孔板中(孔板类型为四周黑色,底部透明),培育24小时;
2)准备溶液a:配制flipr缓冲液(1xhbss+20mmhepes),并调节ph至7.4。
3)准备溶液b:取10μlfluo-4am(2mm)和10μlpluronicacid(20%indmso)混匀。
4)准备荧光染料溶液溶液:将20μl溶液b加入到10.5ml溶液a中,再加入10.5μl小牛血清。
5)配制含amaranth缓冲液:在flipr缓冲液中加入不同体积的amaranth,使amaranth最终浓度分别为6.0mg/ml,4.5mg/ml,3.0mg/ml,1.5mg/ml。
6)flipr分析:在每个孔中加入100μl的荧光染料溶液,37℃孵育1h后在每孔中加入100μl体积的amaranth溶液使amaranth最终浓度分别为2.0mg/ml,1.5mg/ml,1.0mg/ml,0.5mg/ml,根据实验需求加入药物后进行flipr分析,结果如图2。
7)结果分析:如图2所示,在hek-m4细胞上flipr信号随carbachol浓度升高而增强,且不同浓度amaranth对flipr信号并无明显影响。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于粘接剂活化的使用光的加热装置及其在预成型装置中的集成的制造方法
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种不依赖激发光强的上转换荧光强度比测温方法与制造工艺
- 一种PEP‑1肽介导绿色荧光蛋白转导水牛胚胎的方法与制造工艺
- 一种利用级联放大效应高敏监测水体PAHs的转荧光蛋白基因斑马鱼的研制方法与制造工艺
- 一株表达绿色荧光蛋白(EGFP)基因的人肠道病毒EV71型重组病毒及其应用的制造方法与工艺
- 一种HPV16型E7蛋白的POCT荧光定量检测试剂盒及其应用的制造方法与工艺
- 一种基于双荧光发色团的力和光双重响应型自组装体及其制备方法与制造工艺
- 基于机器视觉的禽类受精蛋检测方法与制造工艺
- 一种荧光蛋白质染色剂及其制备方法和应用与制造工艺