一种15N代谢标记蛋白质结合质谱平行反应监测定量的方法与流程
本发明涉及质谱检测的分析领域,尤其是一种15n代谢标记蛋白质结合质谱平行反应监测定量的方法。
背景技术:
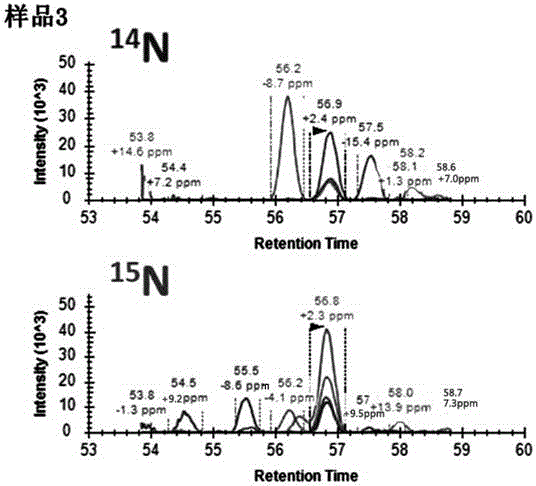
:质谱平行反应监测(parallelreactionmonitoring,prm)技术作为一种质谱检测的分析方法,具有特异性强、灵敏度高、准确度高、重现性好、线性动态范围宽、自动化、高通量的突出优点,这些特质能够满足今天很多研究领域的迫切需要。通过prm技术进行实时的定量监测可以进行药代动力学、临床诊断、违禁药物检查、食品化妆品等工业质量控制、环境检测、农业植物学研究以及代谢组学和蛋白质组学生物标志物的发现等相关研究。在prm靶向追踪定量技术中,内参物的选择对于靶向定量的成功至关重要。目前内参物都采用体外化学合成稳定同位素标记多肽的方式完成,由于氨基酸组成与靶标蛋白质一致,只是稳定同位素的引入导致多肽质量发生变化,因此在一级色谱时具有相似的滞留时间,从而可利用其与样品混合进行目的蛋白质的平行反应监测。在样品检测过程中掺入化学合成的内参多肽进行靶向追踪,由于受到不在同一体系内酶解、不能完全共洗脱、仪器状态等因素影响,使得质谱中产生的离子强度信号并不具有稳定的可重复性。因此,最理想的靶向追踪定量内参物应是与靶标组成和结构相一致的蛋白质,而不是体外化学合成的多肽。基于质谱的平行反应监测定量的方法对临床检测具有很高的应用前景,具备取代抗体检测的潜力。但目前prm技术仍存在许多问题。其广泛接受的做法之一是使用体外合成的重标记多肽(如13c,3h等)来测量内源性蛋白质。这种方法虽简单,但存在一些问题。首先,这种方法需要前期实验以及大量数据分析以确定合成的目标肽段。第二,不同批次样品的蛋白质酶消化过程会产生显著的差异。因此,控制消化步骤是很重要的。结果表明,合成肽段不能准确反映测定的内源蛋白质的绝对量,差异常超过10倍。第三,定量仅限于与合成肽段相同的内源肽段,而不是整个蛋白质序列,相比蛋白靶标,另一个缺点是合成多肽价格昂贵。技术实现要素:有鉴于此,本发明的目的是提供一种15n代谢标记蛋白质结合质谱平行反应监测定量的方法,能够更准确、重现性地测定内源性蛋白质浓度。为了实现上述目的,本发明提供如下技术方案:一种15n代谢标记蛋白质结合质谱平行反应监测定量的方法,包括以下步骤:a)以15n代谢标记内参蛋白,得到15n标记的蛋白;b)向待测样品中加入步骤a)得到的15n标记的蛋白,并进行电泳,得到蛋白凝胶;c)将步骤b)得到的蛋白凝胶进行胶内酶解,得到酶解样品;d)将步骤c)得到的酶解样品进行质谱检测,并将质谱检测结果通过prm进行定量分析。优选地,所述内参蛋白合成方式为15n代谢标记合成优选地,步骤d)中质谱检测采用的是液相色谱串联质谱仪prm监测。优选地,所述待测样品为细胞裂解物。优选地,步骤a)中内参蛋白与所述步骤b)中待测样品中蛋白的序列和结构完全相同。本发明提供了一种15n代谢标记蛋白质结合质谱平行反应监测定量的方法,15n代谢标记的内参蛋白可以准确地反映待检测内源蛋白的结构、状态,与待检测蛋白具有相同的酶解效率,解决了质谱选择追踪定量过程中内参肽离子强度信号受蛋白酶消化、共洗脱基质、样品组成、仪器状态等影响导致的不重现问题,同时提高质谱平行反应监测定量的效率;另外,本发明提供的方法可以产生多种用于平行反应监测的定量多肽,提高了定量准确性并降低合成多肽的成本,且该方法能够用于定量蛋白组学研究、蛋白标志物的检测,医疗诊断、环境卫生,食品安全检测,司法鉴定等有很大的帮助。附图说明图1为实施例样品1的质谱图;图2为实施例样品2的质谱图;图3为实施例样品3的质谱图;图4为实施例样品4的质谱图;图5为prm定量分析图;图6为实施例样品1和样品2的多肽定量图。具体实施方式本发明提供的一种15n代谢标记蛋白质结合质谱平行反应监测定量的方法,包括以下步骤:a)以15n代谢标记内参蛋白质,得到15n标记蛋白质;b)向待测样品中加入步骤a)得到的15n标记的蛋白质,并进行蛋白质电泳,得到蛋白质凝胶;c)将步骤b)得到的蛋白质凝胶进行胶内酶解,得到酶解样品;d)将步骤c)得到的酶解样品进行质谱检测,并将质谱检测结果通过prm进行定量分析。上述技术方案,15n代谢标记的内参蛋白可以准确地反映待检测内源蛋白的结构、状态,与待检测蛋白具有相同的酶解效率,解决了质谱选择追踪定量过程中内参肽离子强度信号受蛋白酶消化、共洗脱基质、样品组成、仪器状态等影响导致的不重现问题,同时提高质谱平行反应监测定量的效率;另外,本发明提供的方法可以产生多种用于平行反应监测的定量多肽,提高了定量准确性并降低合成多肽的成本,且该方法能够用于定量蛋白组学研究、蛋白标志物的检测,医疗诊断、环境卫生,食品安全检测,司法鉴定等有很大的帮助。本发明中,以15n代谢标记内参蛋白,得到15n标记蛋白。需要说明的是,内参蛋白是通过原核表达系统代谢标记合成,因此内参蛋白与待测样品中蛋白的序列和结构完全相同;选用上述内参蛋白可以准确地反映待测样品内源蛋白的结构、状态和丰度。向待测样品中加入15n标记蛋白,并进行电泳,得到蛋白凝胶;在本发明的实施例中,电泳为sds-page电泳;待测样品为细胞裂解物。上述中,将待测样品中加入15n标记蛋白再进行电泳,避免化学标记等后期混合造成的实验平行性误差。需要说明的是,sds-page电泳为①取15n标记蛋白进行sds-page电泳,电泳条件:80v电泳10min后,120v电泳直到溴酚蓝距离上样孔大约1cm即可结束电泳;②用考马斯亮蓝染色方法对步骤①获得的凝胶进行染色:将凝胶置于质量分数为0.1%r-250染色液中,25-40℃摇床上振荡染色2h,脱色液脱色1h,超纯水水洗约4h,每30min换水一次,至凝胶背景脱净、条带清晰为止;染色液为体积比为25:10:65的乙醇、乙酸和水组成,含质量分数为0.1%的r-250,脱色液为体积比为45:10:45的乙醇、乙酸和水组成。将得到的蛋白凝胶进行胶内酶解,得到酶解样品;在本发明的实施例中,蛋白凝胶胶内酶解步骤为①将蛋白质凝胶的染色部分切成约1mm3大小的胶块;②步骤①中的凝胶块用1000μl脱色液脱色两次,每次15min,可重复脱色,直到考马斯亮蓝颜色脱尽为止,弃上清,于labconco中真空干燥凝胶;脱色液为体积比为30:70的乙腈和50mmnh4hco3溶液组成;③加入1000μl10mmdtt溶液,55℃恒温箱中孵育45min,弃废液;④加入100μ200mm碘乙酰胺溶液,室温暗反应30min,弃废液;⑤加入1000μl脱色液清洗两次,每次10min,于labconco中真空干燥凝胶;⑥加入15μl胰酶溶液(20ng/μl,50mmnh4hco3),于4℃放置15min,待凝胶溶胀;⑦加入15μl50mmnh4hco3溶液浸没凝胶,37℃孵育过夜;⑧加入50μl提取液,所述提取液为5%甲酸溶液,37℃孵育1h,取上清转移至干净的离心管中;⑨胶块中再次加入50μl提取液,所述提取液为体积比为50:50的乙腈和5%甲酸溶液;⑩步骤⑧和⑨的两次提取液合并,于labconco中浓缩冻干,得到质谱样品——肽段。将酶解样品进行质谱检测,并将质谱检测结果通过prm进行定量分析。在本发明的实施例中,质谱检测采用的是液相色谱串联质谱仪。质谱检测:选择监测目标内源14n蛋白,根据目标多肽列表,在-2~+2min滞留时间内进行监测,在同一时间内,监测内源蛋白的数量不超过20个,得到质谱数据。prm定量分析方法如下:质谱数据通过x!tandem搜索引擎进行数据库检索,数据库包含15n标准的序列和大肠杆菌数据库(宿主有机体)和常见的污染物,固定修饰为半胱氨酸(cysteine)的脲甲基化(carbamidomethyl+57.02da),可变修饰为蛋白n端乙酰化(n-acetyl+42da),甲硫氨酸、色氨酸氧化(methionine+15.99da),全部氨基酸设置为15n标记。通过skyline分析搜库结果,选取最佳和相关的目标多肽,通过15n内参多肽的离子强度和峰面积计算得出内源目的多肽的含量丰度。为了进一步说明本发明,下面结合实施例对本发明提供的一种115n代谢标记蛋白质结合质谱平行反应监测定量的方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。实施例15n代谢标记蛋白质结合质谱平行反应监测定量的方法,包括以下步骤:a)以15n代谢标记内参蛋白,得到15n标记蛋白;b)向浓度为0.25μg/μl细胞裂解物中加入步骤a)得到的15n标记蛋白,,并进行sds-page电泳,得到蛋白质凝胶;细胞裂解物中15n标记蛋白的浓度从0fmol/μl到100fmol/μl,具体浓度如表1,得到样品1~4,并将样品1~4依次进行sds-page电泳,及其以下胶内酶解、质谱检测、prm定量分析步骤表1样品数据电泳条件:80v电泳10min后,120v电泳直到溴酚蓝距离上样孔大约1cm即可结束电泳;②用考马斯亮蓝染色方法对步骤①获得的凝胶进行染色:将凝胶置于质量分数为0.1%r-250染色液中,25-40℃摇床上振荡染色2h,脱色液脱色1h,超纯水水洗约4h,每30min换水一次,至凝胶背景脱净、条带清晰为止;染色液为体积比为25:10:65的乙醇、乙酸和水组成,含质量分数为0.1%的r-250,脱色液为体积比为45:10:45的乙醇、乙酸和水组成。c)将步骤b)得到的蛋白质凝胶进行胶内酶解,得到酶解样品;胶内酶解具体为①将蛋白质凝胶的染色部分切成约1mm3大小的胶块;②步骤①中的凝胶块用1000μl脱色液脱色两次,每次15min,可重复脱色,直到考马斯亮蓝颜色脱尽为止,弃上清,于labconco中真空干燥凝胶;脱色液为体积比为30:70的乙腈和50mmnh4hco3溶液组成;③加入1000μl10mmdtt溶液,55℃恒温箱中孵育45min,弃废液;④加入1000μ20mm碘乙酰胺溶液,室温暗反应30min,弃废液;⑤加入1000μl脱色液清洗两次,每次10min,于labconco中真空干燥凝胶;⑥加入15μl胰酶溶液(20ng/μl,50mmnh4hco3),于4℃放置15min,待凝胶溶胀;⑦加入15μl50mmnh4hco3溶液浸没凝胶,37℃孵育过夜;⑧加入50μl提取液,所述提取液为5%甲酸溶液,37℃孵育1h,取上清转移至干净的离心管中;⑨胶块中再次加入50μl提取液,所述提取液为体积比为50:50的乙腈和5%甲酸溶液;⑩步骤⑧和⑨的两次提取液合并,于labconco中浓缩冻干,得到质谱样品——肽段。d)将步骤c)得到的酶解样品进行质谱检测,并将质谱检测结果通过prm进行定量分析;质谱检测:选择监测目标内源14n蛋白以及15n内标(按混入15n内参蛋白的量,从低到高进行监测),根据目标多肽列表,在-2~+2min滞留时间内进行监测,在同一时间内,监测内源蛋白的数量不超过20个,得到质谱数据,结果见图1~4。同时,15n内参蛋白和细胞裂解物混合(10fmol15n内标/0.25μg细胞裂解物)作为qc样品,用于定期检测系统状态。prm定量分析:(定量分析结果见图5和图6)质谱数据通过x!tandem搜索引擎进行数据库检索,数据库包含15n标准的序列和大肠杆菌数据库(宿主有机体)和常见的污染物,固定修饰为半胱氨酸(cysteine)的脲甲基化(carbamidomethyl+57.02da),可变修饰为蛋白n端乙酰化(n-acetyl+42da),甲硫氨酸、色氨酸氧化(methionine+15.99da),全部氨基酸设置为15n标记。通过skyline分析搜库结果,选取最佳和相关的目标多肽,通过15n内参多肽的离子强度和峰面积计算得出内源目的多肽的含量丰度,结果参见表2。表2表2内源dvl3_human目的多肽定量结果(amol/0.25μg组织裂解液)startsequenceend样品1样品2样品3样品426amaspesglevr379682644374kyasnllk8160017020实验结果表明15n标记蛋白酶解产生的内参多肽可以很好的平行反应监测内源多肽的含量变化,在不同稀释比例的情况下选择追踪的重现性良好(核质比56.9)。上述说明,使本领域专业技术人员能够实现或使用本对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖性特点相一致的最宽的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1