一种检测头孢克肟相关杂质的方法与流程
本发明涉及检测方法领域,特别是涉及药物中检测杂质的方法。
背景技术:
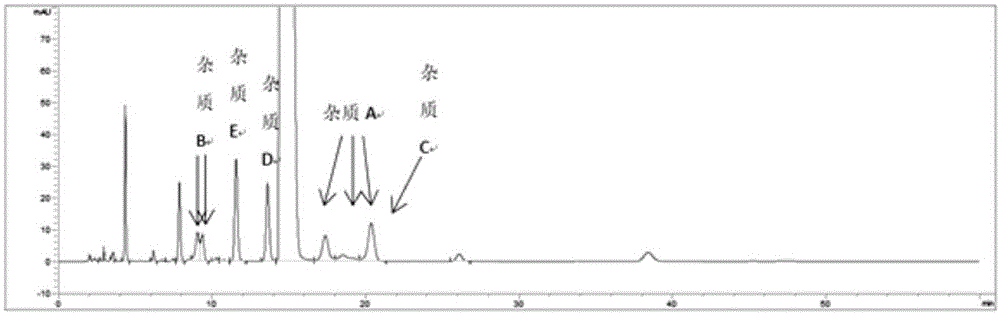
:头孢克肟是第三代口服头孢菌素,关于其原料及其制剂杂质的检测,各国药典收载的标准方法以及杂质控制限度,各国药典色谱条件相似:流动相均为四丁基氢氧化铵溶液和乙腈按一定比例配制的溶液,均采用hplc-uv检测,波长均为254nm;均采用c18色谱柱。除欧洲药典采用流动相作稀释液外,其余药典采用ph7.0的磷酸或磷酸盐缓冲液作稀释液。日本药典和美国药典标准采用面积归一化法计算,其余均采用自身对照法计算。通过药典收载情况及文献调研得知,头孢克肟有5个已知杂质,分别为杂质a、杂质b、杂质c、杂质d和杂质e。其中杂质a、b、d既为工艺杂质,又为降解杂质,在原料合成、制剂工艺以及贮藏过程中均可产生;杂质c为工艺副产物,仅在原料合成过程中产生,在储存过程中不会增长;杂质e为降解杂质,在贮藏过程中可能产生。因此,头孢克肟降解杂质a、b、d、e的含量应为关注的重点。由于各国药典对头孢克肟原料及制剂的杂质分析方法相似,因此,我公司最初在中国药典的色谱条件的基础上建立了适用于本品有关物质检测的方法,见表1。在实际检测时发现,在该色谱条件下,杂质a峰形较差(见图1),杂质a呈三个峰,保留时间为17.208min、18.258min、19.989min,不能准确统计峰面积。通过对杂质进一步研究发现,杂质a和杂质b均为混合物,且校正因子并不在0.9~1.1范围内,但各国药典收载的标准方法中无一采用加入校正因子的计算方法。采用中国药典色谱方法对自制制剂中试样品进行放行。由于自制产品中,降解杂质a和b的含量均远小于限度1.0%,不加校正因子的计算方式对其影响较小。但在稳定性考察期间,杂质a和杂质b均呈现逐渐增长的趋势。可见,对于头孢克肟类药物中相关杂质的检测方法还需进一步探索优化。表1本公司检测有关物质原方法技术实现要素:本发明提供了一种检测头孢克肟相关杂质的方法,能够准确测定头孢克肟杂质a的含量,同时还能够成功将主峰、头孢克肟杂质a、头孢克肟杂质b、头孢克肟杂质d和头孢克肟杂质e有效分离,分离度符合规定,杂质a为单峰。具体的,本发明提供一种检测头孢克肟相关杂质的方法,其特征在于,采用高效液相色谱同时进行定性或/和定量检测头孢克肟相关杂质,液相色谱的检测条件包括:色谱柱:烷基键合硅胶柱,进一步选自c18色谱柱;流动相:水相、有机相;其中,水相为四丁基氢氧化铵溶液;有机相选自乙腈或/和甲醇,不单独为甲醇;流动相采用如表2所示下梯度洗脱程序:表2时间(min)水相(vol.%)有机相(vol.%)085~9010~15580~9010~202570~8515~305070~8515~307080~9010~208580~9010~208685~9010~1510085~9010~15所述杂质为合成等工艺过程中引入的杂质,包括反应物、中间体、副产物、试剂、催化剂等。所述有机相选自乙腈或/和甲醇,不单独为甲醇,是指有机相可以单独为乙腈,也可以为乙腈和甲醇的混合溶剂,但是不单独选用甲醇。进一步地,所述杂质选自头孢克肟杂质a、头孢克肟杂质b、头孢克肟杂质d、头孢克肟杂质e中的一种或几种。进一步地,所述水相的四丁基氢氧化铵溶液ph值范围为4.9~7.0,质量浓度为0.4%~0.5%。进一步地,采用梯度洗脱时,所述有机相为乙腈,流动相采用如表3所示梯度洗脱程序:表3进一步地,所述液相色谱检测条件还包括以下的i~iii中的一项或多项:i色谱柱规格:4.6×250mm,5μm;ii柱温:45~55℃;iii流速:1.2~0.8ml/min。本发明还提供一种检测头孢克肟相关杂质的方法,其特征在于,采用高效液相色谱同时进行定性或/和定量检测头孢克肟杂质a,液相色谱的检测条件包括:色谱柱:烷基键合硅胶柱,进一步选自c18色谱柱;流动相:水相、有机相;其中,水相为四丁基氢氧化铵溶液;有机相选自乙腈或/和甲醇,不单独为甲醇;流动相采用如表4所示梯度洗脱程序:表4时间(min)水相(vol.%)有机相(vol.%)085~9010~15580~9010~202570~8515~305070~8515~307080~9010~208580~9010~208685~9010~1510085~9010~15进一步地,所述水相的四丁基氢氧化铵溶液ph值范围为4.9~7.0,质量浓度为0.25%~10%。在本发明的具体实施方式中,所述液相色谱检测条件还包括以下的i~iii中的一项或多项:i色谱柱规格:4.6×250mm,5μm;ii柱温:40~55℃;iii流速:1.2~0.8ml/min。本发明具体实施方式中使用的色谱柱商品名为agilentzorbaxeclipseplusc18,但是,只要满足上述描述的色谱柱均可运用于本发明的检测方法,不限于上述商品。进一步地,上述检测方法包括以下内容:(1)制备供试品溶液;(2)制备对照溶液;(3)将对照溶液进样检测;(4)将供试品溶液进样检测。所述检测方法可使用面积归一化法、自身对照法、内标法、外标法等方法分析、计算检测结果。进一步地,制备供试品溶液或/和对照溶液使用的溶剂选自四丁基氢氧化铵溶液、ph7.0磷酸盐缓冲液、甲醇、乙腈中的一种或两种以上的混合溶剂。制备供试品溶液或/和对照品溶液使用的溶剂包括溶解溶剂和稀释剂。其中:溶解溶剂进一步选自ph7.0磷酸盐缓冲液、甲醇、乙腈中的一种或几种,更进一步选自甲醇和/或乙腈,优选甲醇;稀释剂进一步选自四丁基氢氧化铵溶液和/或乙腈,优选ph为5.00的0.4%四丁基氢氧化铵溶液与乙腈体积比为90∶10的溶液。制备供试品溶液的较优操作步骤为:向样品中加入4%~60%体积溶解溶剂,超声0.5~5min,再用稀释剂定容至待测浓度,离心过滤后弃去初滤液0~4ml。其中:溶解溶剂的用量优选供试品溶液总体积的4%~40%,进一步优选供试品溶液总体积的10%;超声时间优选0.5~2min,进一步优选0.5min;初滤液弃去体积优选2ml。本发明的有益效果是:(1)本发明能够有效检测头孢克肟杂质a,使之与主峰和其他杂质分离度大,峰形好,解决了现有技术中对头孢克肟杂质a检测中峰形差、不好计算峰面积等缺点。(2)本发明的检测方法能够在一次检测中同时有效检测药物中的头孢克肟杂质a、头孢克肟杂质b、头孢克肟杂质d和头孢克肟杂质e,分离度满足测定要求,效率高,杂质检出能力优异,含量准确,能很好地满足工艺过程中的杂质监控及成品中的杂质控制要求。(3)本发明能够用于头孢克肟各类剂型药物中相关杂质的检测,包括头孢克肟胶囊、头孢克肟颗粒、头孢克肟分散片等,适用范围广。附图说明图1是本公司原检测方法的相关谱图;图2是本发明流动相ph筛选-ph4.0的谱图;图3是本发明流动相ph筛选-ph5.0的谱图;图4是本发明流动相ph筛选-ph6.0的谱图;图5是本发明流动相ph筛选-ph8.0的谱图;图6是本发明实施例3(1)的谱图;图7是本发明实施例3(2)的谱图;图8是本发明实施例3(3)的谱图;图9是本发明实施例4(1)的谱图;图10是本发明实施例4(2)的谱图;图11是本发明实施例4(3)的谱图;图12是本发明实施例5(1)的谱图;图13是本发明实施例5(2)的谱图;图14是本发明实施例5(3)的谱图;图15是本发明实施例6(1)的谱图;图16是本发明实施例6(2)的谱图;图17是原方法检测谱图;图18是本发明方法最佳条件检测谱图。具体实施方式仪器和设备:表5试剂表6试剂级别生产厂家批号乙腈色谱纯上海星可高纯溶剂有限公司0114180102等甲醇色谱纯上海星可高纯溶剂有限公司021271201等10%四丁基氢氧化铵分析纯上海科丰化学试剂有限公司20171016等磷酸分析纯成都科龙试剂化工厂2016091901等对照品及样品表7实施例1各杂质储备液的制备杂质a储备液:称取杂质a4mg至20ml量瓶,加磷酸盐缓冲液(ph7.0)4ml溶解后,加流动相定容至刻度,摇匀即得。杂质b储备液:称取杂质b5mg至25ml量瓶,加磷酸盐缓冲液(ph7.0)溶解定容至刻度,摇匀即得。杂质c储备液:称取杂质c2mg至10ml量瓶,加磷酸盐缓冲液(ph7.0)2ml溶解后,用流动相定容至刻度,摇匀即得。杂质d储备液:称取杂质d5mg至25ml量瓶,加磷酸盐缓冲液(ph7.0)溶解定容至刻度,摇匀即得。杂质e储备液:称取杂质e5mg至25ml量瓶,加磷酸盐缓冲液(ph7.0)溶解定容至刻度,摇匀即得。7-avca储备液:称取杂质7-avca4mg至20ml量瓶,加磷酸盐缓冲液(ph7.0)4ml溶解后,加流动相定容至刻度,摇匀即得。mica储备液:称取杂质mica4mg至20ml量瓶,加磷酸盐缓冲液(ph7.0)4ml溶解后,加流动相定容至刻度,摇匀即得。头孢克肟甲酯储备液:称取杂质头孢克肟甲酯4mg至20ml量瓶,加磷酸盐缓冲液(ph7.0)4ml溶解后,加流动相定容至刻度,摇匀即得。实施例2流动相ph值的筛选流动相:0.25%四丁基氢氧化铵(ph分别为4.0、5.0、6.0、8.0)-乙腈(72∶28);色谱柱:agilentzorbaxeclipseplusc18250*4.6mm,5μm,int-col-038;加标供试品溶液:取头孢克肟胶囊(041702批)高温60℃-30天内容物12mg,至10ml量瓶,分别取各杂质储备液0.5ml至同一10ml量瓶,加磷酸盐缓冲液(ph7.0)2ml,超声溶解后,加流动相定容至刻度,摇匀即得。流速:1.0ml/min;检测波长:254nm;柱温:40℃;筛选结果如下:(1)ph=4.0时,检测谱图见图2。由检测结果可知,在该条件下杂质b(第一个峰rt12.004min)与杂质未达基线分离;杂质a包裹在主峰(rt26.152min)里,未分开;杂质d呈分叉峰(22.054min、22.524min),未达基线分离。(2)ph=5.0时,检测谱图见图3。由检测结果可知,在该条件下主峰与相邻杂质达基线分离;杂质a呈两个峰,两个峰与中间未知杂质(rt33.066min)分离度分别为1.22,1.35;杂质a第二个峰与杂质c重合(rt36.057min);杂质b第一个峰(rt11.716min)里有包裹。(3)ph=6.0时,检测谱图见图4。由检测结果可知,在该条件下主峰与相邻杂质达基线分离;杂质a呈两个峰,两个峰与中间未知杂质(rt20.842min)分离度分别为1.11,1.38;杂质a第二个峰与杂质c重合(rt22.377min);杂质b第一个峰(rt8.871min)里有包裹。未知杂质(rt7.584min)与未知杂质(rt7.319min)未达基线分离。(4)ph=8.0时,检测谱图见图5。由检测结果可知,在该条件下未知杂质(rt6.505)与相邻两个杂质未达基线分离;杂质b(rt7.824min)呈1个峰,有包裹;杂质a两个峰与杂质c连呈“山”型,未达基线分离。由上述结果可知,在ph=5.0的条件下,主峰与相邻杂质达基线分离;杂质a呈两个峰,两个峰之间有一个未知杂质(rt33.066min),分离度分别为1.22,1.35;杂质a第二个峰与杂质c重合(rt36.057min);杂质b第一个峰(rt11.716min)里有包裹。杂质c为原料工艺杂质,在多批原料均未检出,因此杂质c与杂质a重合不影响杂质a的定量检出。其他已知杂质与降解杂质均呈良好分离。因此将本发明检测方法流动相的ph值选定为5.0。实施例3初步梯度筛选柱温:50℃;色谱柱:agilentzorbaxeclipseplusc18250*4.6mm,5μm,int-col-038;加标供试品溶液及除流动相以外的其它色谱条件同实施例2。(1)流动相a:0.25%四丁基氢氧化铵溶液(ph=5.0);流动相b:乙腈;采用如表8所示梯度洗脱:表8由检测结果(图6)可知,在该条件下杂质d与主峰分离度为0.77,杂质a呈两个峰,两个峰之间有一未知杂质(rt37.713min),未知杂质与杂质a两个峰的分离度分别为0.97、1.14,其他各峰分离度良好。(2)流动相a:0.25%四丁基氢氧化铵溶液(ph=5.0)-乙腈(90∶10);流动相b:0.25%四丁基氢氧化铵溶液(ph=5.0)-乙腈(20∶80);采用如表9所示梯度洗脱:表9由检测结果(图7)可知,在该条件下杂质b与相邻杂质无分离度,主峰与杂质d分离度为0.84,杂质a呈两个峰,两个峰之间的未知峰与杂质a无分离度,其他各峰分离度良好。(3)流动相a:0.25%四丁基氢氧化铵溶液(ph=5.0);流动相b:乙腈;流动相c:甲醇;采用如表10所示梯度洗脱:表10由检测结果(图8)可知,在流动相中增加甲醇,杂质a呈两个峰,两个峰之间包裹未知杂质与杂质a分离度分别为0.94、1.06,同时基线干扰大。从上述结果可知,盐浓度为0.25%时,各梯度条件下杂质a均呈两个峰,两个峰之间有一未知杂质,该未知杂质与杂质a分离度均未达基线分离,导致杂质a难以定量统计。增加甲醇后,杂质a两个峰之间的未知杂质与杂质a分离度虽然略有提高,但是基线干扰大。实施例4进一步梯度筛选通过分析实施例3得到的试验数据,发明人提高四丁基氢氧化铵溶液浓度至0.5%,继续优化梯度。将流动相中盐浓度提高至0.5%,分别采用不同梯度系统,对加标供试品溶液中各杂质之间的分离度以及杂质与主峰间的分离度进行考察,并对各成分的分离及杂质a的峰形对比分析。(1)柱温50℃;流动相a:0.5%四丁基氢氧化铵溶液(ph=5.0);流动相b:乙腈;流动相c:甲醇;采用如表11所示梯度洗脱:表11加标供试品溶液及其它色谱条件同实施例2。由检测结果(图9)可知,提高了盐溶液的浓度,在该条件下杂质a与杂质c达基线分离,其他各峰分离度均良好,但是基线干扰大。(2)柱温50℃;流动相a:0.5%四丁基氢氧化铵溶液(ph5.0);流动相b:乙腈;流动相c:甲醇;采用如表12所示梯度洗脱:表12加标供试品溶液及其它色谱条件同实施例2。由检测结果(图10)可知,在该条件下各峰分离度良好,但是基线干扰大。(3)柱温50℃;流动相a:0.5%四丁基氢氧化铵溶液(ph5.0);流动相b:乙腈;采用如表13所示梯度洗脱:表13加标供试品溶液及其它色谱条件同实施例2。由检测结果(图11)可知,在该条件下各已知杂质、主峰与相邻杂质及主要降解杂质均有效分离。从上述结果可知,提高四丁基氢氧化铵浓度至0.5%后,各梯度条件下均能有效分离各成分,流动相系统中有甲醇时,基线干扰较大,影响杂质检出。因此确定本发明流动相体系为四丁基氢氧化铵溶液-乙腈。实施例5柱温筛选在实施例4(3)条件的基础上,调整流动相a、b使不为纯盐和纯有机相,优化柱温及梯度。分别采用不同的色谱条件进行梯度洗脱,对加标供试品溶液中各杂质之间的分离度以及杂质与主峰间的分离度进行考察,并对杂质a的峰形对比分析。流动相a:0.5%四丁基氢氧化铵溶液(ph5.0)-乙腈(90∶10);流动相b:0.5%四丁基氢氧化铵溶液(ph5.0)-乙腈(50∶50);(1)加标供试品溶液及其他色谱条件同实施例2。柱温55℃;采用如表14所示梯度洗脱:表14由检测结果(图12)可知,在该条件下杂质a呈两个峰,杂质a两个峰之间有一未知杂质,与杂质a两个峰分离度良好;各已知杂质与降解杂质及主峰与相邻杂质均达基线分离。(2)加标供试品溶液及其他色谱条件同实施例2。柱温45℃;采用如表15所示梯度洗脱:表15由检测结果(图13)可知,在该条件下杂质a呈两个峰,杂质a两个峰之间有一未知杂质,与杂质a两个峰分离度良好;各已知杂质与降解杂质及主峰与相邻杂质均达基线分离。(3)加标供试品溶液及其他色谱条件同实施例2。柱温40℃;采用如表16所示梯度洗脱:表16由检测结果(图14)可知,在该条件下杂质a呈两个峰,杂质a两个峰之间有一未知杂质,与杂质a两个峰分离度良好;杂质b第二个峰(rt26.823min)与未知杂质(rt27.380min)分离度为0.80,其他各杂质及主峰与相邻杂质分离度均符合要求。上述四个试验中,0~50min梯度一致,从结果可知,各条件下杂质a均呈两个峰,杂质a两个峰之间有一未知杂质,与杂质a两个峰分离度良好;柱温45℃、55℃条件下,杂质b与相邻杂质分离更好,兼顾色谱柱使用寿命及峰分离,选择45℃作为本发明检测方法的色谱条件。对于头孢克肟颗粒品种,有关物质检测中其高温样品在较长保留时间处有非极性的杂质产生,为同时兼顾2个品种,拟定在色谱条件(2)梯度设计中在50min后提高流动相b的比例。实施例6流动相盐浓度优化在实施例5(2)条件的基础上,优化调整流动相盐浓度,同时梯度设计在50min后提高流动相b比例,加快非极性成分洗出,设计不同盐浓度色谱条件对头孢克肟颗粒高温样品加标供试品溶液中各杂质之间的分离度以及杂质与主峰间的分离度进行考察。柱温:45℃;供试品溶液:头孢克肟颗粒高温60℃-30天样品与各已知杂质溶液配制而成。(1)流动相a:0.5%四丁基氢氧化铵溶液(ph5.0)-乙腈(90∶10);流动相b:0.5%四丁基氢氧化铵溶液(ph5.0)-乙腈(50∶50);采用如表17所示梯度洗脱:表17由检测结果(图15)可知,在该条件下各已知杂质与降解杂质、主峰与相邻杂质均达基线分离,70min后mpb达100%,但是基线干扰较大。(2)流动相a:0.4%四丁基氢氧化铵溶液(ph5.0)-乙腈(90∶10);流动相b:0.4%四丁基氢氧化铵溶液(ph5.0)-乙腈(50∶50);采用如表18所示梯度洗脱:表18由检测结果(图16)可知,在该条件下各已知杂质与降解杂质、主峰与相邻杂质均达基线分离,70min后mpb达100%,基线较平稳。从上述测定结果可知,当流动相盐浓度分别为0.4%和0.5%时,各已知杂质与降解杂质、主峰与相邻杂质分离度良好,而70min流动相b达100%后,流动相盐浓度为0.4%基线更平稳,因此选择流动相盐浓度为0.4%作为本发明的色谱条件。最后暂定采用实施例7(2)色谱条件作为有关物质测定方法。实施例7系统适用性试验从本发明检测方法开发过程可知,主峰与杂质d(即(e)异构体)较难分离,为了确保各杂质与主峰在该色谱条件下能达到有效分离,参考有关物质原方法(表1)中“系统适用性试验”拟定系统适用性,确定质量标准系统适用性溶液及其要求为:系统适用性试验溶液:取头孢克肟对照品适量,用水溶解并稀释制成每1ml中约含1mg的溶液,于沸水浴上加热45分钟,冷却,作为系统适应性溶液。系统适用性要求:(e)异构体峰与头孢克肟峰间的分离度应≥1.5。实施例8色谱条件确定表19确定的有关物质色谱条件实施例9有关物质检测的本发明方法和原方法对比有关物质原方法和新方法的对比见表20。表20有关物质检测的本发明方法和原方法对比表分别按照有关物质测定方法原方法和本发明方法对中试样品稳定性6月、各批参比制剂以及参比制剂稳定性3月样品进行测定。两种方法测定加标供试品溶液的图谱见图17~18。由上述测定结果可知,原有关物质检测方法(图17)色谱条件下,杂质a峰形较差,呈多个色谱峰,杂质a的多个色谱峰中还包裹未知降解杂质,不能达到基线分离;本发明检测方法(图18)采用流动相梯度洗脱的方式来优化色谱条件,通过改变稀释剂种类,杂质a呈单峰,与未知各杂质达到基线分离,说明本发明检测方法更能反映本品有关物质的真实情况。综上所述,本发明检测方法采用hplc法对头孢克肟胶囊进行有关物质检测,采用不加校正因子的自身对照法对杂质d、e、单个未知杂质进行控制,采用加校正因子的自身对照法对已知杂质a、b和总杂质进行控制。在初步筛选检测波长、流动相、色谱柱、供试品溶剂和提取方式以及滤膜吸附性考察等基础上建立了优异的色谱条件。与原方法比较,本发明方法杂质分离、检出能力更优,能够一次同时检测杂质a、b、d、e,检测效率高。同时本发明方法能够用于头孢克肟各类剂型药物中相关杂质的检测,包括头孢克肟胶囊、头孢克肟颗粒、头孢克肟分散片等,适用范围广。以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的
技术领域:
,均同理包括在本发明的专利保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1