一种门冬氨酸洛美沙星葡萄糖注射液有关物质的分离测定方法与流程
本发明涉及药物分析领域,具体涉及一种门冬氨酸洛美沙星葡萄糖注射液有关物质的分离测定方法。
背景技术:
目前,门冬氨酸洛美沙星葡萄糖注射液的检测标准经国家食品药品监督管理局标准的有ybh30102005(a厂)、ybh15122004(b厂)和国家药品标准新药转正标准第64册ws1-(x-097)-2005z。上述检测方法中有关物质的测定方法均采用液相色谱法测定,其中ybh30102005(a厂)、ybh15122004(b厂)中有关物质的测定方法规定一致,现有的检测标准皆采用等度洗脱方法测定有关物质,保留时间一般是记录至主峰3倍保留时间,其流动相采用乙腈-磷酸盐缓冲液(称取磷酸二氢钾6.7g,加磷酸2.8ml,加水稀释至1000ml)-0.05mol/l四丁基溴化铵溶液按照体积比15:85:4混合而成,检测波长:288nm,进样量:20μl,供试品浓度0.2mg/ml,对照浓度:2μg/ml。
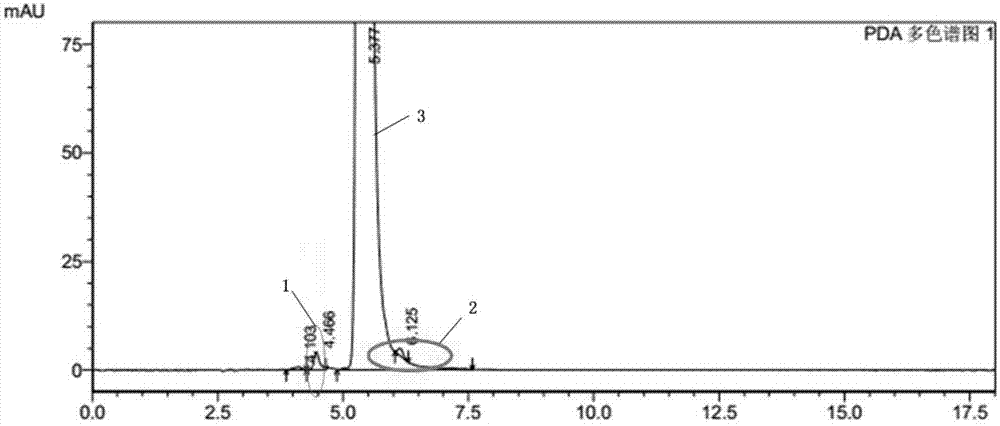
上述标准中有关物质检测方法存在以下缺陷:杂质峰之间分离度不好,5-羟甲基糠醛(5-hmf)、洛美沙星主峰与相邻杂质峰分离不好,有干扰;杂质峰不能很好归属来源(如氧化、光降解产生);洛美沙星主峰峰型较差,有拖尾;流动相中有离子对试剂(四丁基溴化铵),长时间使用对色谱柱损害较大。典型的高效液相色谱图如图1(按照ybh30102005中有关物质的检测方法测定)所示,其中,峰1为5-羟甲基糠醛杂质峰;峰2为其他杂质峰;峰3为洛美沙星峰。
技术实现要素:
本发明的目的在于提供一种门冬氨酸洛美沙星葡萄糖注射液有关物质的分离测定方法,该方法用于门冬氨酸洛美沙星葡萄糖注射液有关物质的检测,洛美沙星与杂质,以及各杂质之间能够很好的分离,具有专属性强、准确度高、重复性好等特点,且能比法定标准测定出更多的杂质峰,检测的总杂质量更大。
本发明的上述目的是采用以下技术方案来实现:
本发明提供的一种门冬氨酸洛美沙星葡萄糖注射液有关物质的分离测定方法,包括以门冬氨酸洛美沙星葡萄糖注射液作为供试品溶液采用高效液相色谱法进行检测,所述高效液相色谱法采用十八烷基硅烷键合硅胶为填料的色谱柱,以流动相a和流动性b进行线性梯度洗脱;所述流动相a为磷酸盐溶液-甲醇;所述流动相b为乙腈。
在本发明的技术方案中,优选地,所述流动相a的配制方法为:将质量百分含量为0.6%~0.7%的磷酸二氢钾溶液和甲醇按照体积比为70:30~80:20混合,采用磷酸调节其ph值至2.5~3.0。
在本发明的技术方案中,优选地,所述磷酸二氢钾溶液的质量百分含量为0.67%,所述磷酸二氢钾溶液和所述甲醇的体积比为76:24,所述ph值为2.7。
在本发明的技术方案中,优选地,所述梯度洗脱的程序为:
在本发明的技术方案中,优选地,所述色谱柱的型号为welchultimatexb-c18,4.6×250mm,5μm。
在本发明的技术方案中,优选地,所述高效液相色谱法的检测波长为280~290nm;更优选为287nm。
在本发明的技术方案中,优选地,所述高效液相色谱法的流速为0.5~1.5ml/min;更优选为1.0ml/min。
在本发明的技术方案中,优选地,所述高效液相色谱法的进样量为5~20μl;更优选为10μl。
在本发明的技术方案中,优选地,所述高效液相色谱法的色谱柱柱温为35~45℃;更优选为40℃。
本发明提供的一种门冬氨酸洛美沙星葡萄糖注射液有关物质的分离测定方法的有益效果:
(1)本发明提供的分离测定方法以welchultimatexb-c18(4.6×250mm,5μm)为色谱柱,采用流动相a(磷酸盐溶液(称取磷酸二氢钾6.7g,加水1000ml使溶解)-甲醇(76:24)(用磷酸调节ph值至2.7))和流动相b(乙腈)为流动相进行线性梯度洗脱,能够大大提高现有标准中有关物质之间的分离度,其中,5-羟甲基糠醛、洛美沙星主峰与相邻杂质峰分离度大于1.5,其余杂质峰间分离度也较好,洛美沙星主峰峰型对称,没有原方法的拖尾现象。该方法具有专属性强、准确度高、重复性好等特点,且能比法定标准测定出更多的杂质峰,检测的总杂质量更大,因此,能够更好地用于门冬氨酸洛美沙星注射液的质量监测。
(2)按照本方法对酸、碱、光、氧化和高温破坏产生的杂质能更好的检测,主峰与前后相邻杂质峰能实现较好的分离,各杂质峰之间分离效果也较好。通过酸、碱、光、氧化破坏,对门冬氨酸洛美沙星葡萄糖注射液样品中的有关物质杂质进行了归属,对企业提高药品质量提供参考。
(3)流动相中只有磷酸二氢钾、甲醇、乙腈和水,不含离子对试剂,对色谱柱损伤较原方法低。
附图说明
图1为按照现有色谱方法所得的高效液相色谱图;
图2为实施例1所得供试品溶液的高效液相色谱图;
图3为实施例1所得对照溶液的高效液相色谱图;
图4为实施例2所得系统适用性溶液的高效液相色谱图;
图5为实施例3所得洛美沙星线性关系图;
图6为实施例7所得专属性试验的高效液相色谱图;
图7为实施例8所得光破坏试验的高效液相色谱图一;
图8为实施例8所得光破坏试验的高效液相色谱图二;
图9为实施例8所得高温和强酸破坏试验的高效液相色谱图一;
图10为实施例8所得高温和强酸破坏试验的高效液相色谱图二;
图11为实施例8所得氧化破坏试验的高效液相色谱图;
图12为实施例8所得强碱破坏试验的高效液相色谱图;
图13为实施例8所得提供的有关杂质的来源归属图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
如无特殊说明,在下面的实施例中使用的对照品洛美沙星来源于中国食品药品检定研究院(批号:130452-200902,含量:90.3%);本发明实施例涉及的供试品门冬氨酸洛美沙星葡萄糖注射液,规格均为100ml,其中含有的门冬氨酸洛美沙星以洛美沙星(c17h19f2n3o3)计0.2g,葡萄糖5g;本发明实施例中涉及的门冬氨酸洛美沙星原料是指门冬氨酸洛美沙星的固体原料药;本发明实施例使用的高效液相色谱仪型号为lc-20at(带pda检测器),购自岛津公司;电子天平型号为ms205du,购自mettler公司。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1:色谱条件的建立
色谱柱:welchultimatexb-c18(4.6×250mm,5μm)
流动相a:磷酸盐溶液(称取磷酸二氢钾6.7g,加水1000ml使溶解)-甲醇(76:24)(用磷酸调节ph值至2.7)
流动相b:乙腈
检测波长:287nm
流速:1ml/min
柱温:40℃
进样量:10μl。
按下表1中的洗脱程序进行线性梯度洗脱:
表1洗脱程序
溶液配制:取门冬氨酸洛美沙星葡萄糖注射液为供试品溶液(含洛美沙星2.0mg/ml),精密量取供试品溶液1ml,加流动相a稀释至500ml,作为对照溶液(含洛美沙星40μg/ml)。
测定方法:取供试品溶液和对照溶液各10μl注入液相色谱仪,按照上述色谱条件分别进行测定,记录色谱图,供试品溶液的高效液相色谱图见图2,对照溶液的高效液相色谱图见图3。
从图2~3可知,采用上述流动相进行梯度洗脱能够大大提高现有标准中有关物质之间的分离度,其中5-羟甲基糠醛(保留时间为4.915min)、洛美沙星主峰与相邻杂质峰分离度大于1.5,其余杂质峰间分离度也较好,洛美沙星主峰峰型对称,没有原方法的拖尾现象。
实施例2:系统适用性试验
取洛美沙星对照品约22mg,加水1ml溶解后再加30%过氧化氢溶液1ml,水浴加热2小时(氧化破坏),冷却,加流动相a稀释至10ml,摇匀,精密量取此溶液10μl注入液相色谱仪,按照实施例1中的色谱条件进行测定,记录色谱图,结果如图4所示。
从图4可以看出,洛美沙星峰保留时间约为22.0min,洛美沙星峰与相邻杂质峰分离度均大于1.5(5.7和2.1)。
实施例3:线性关系
精密称取洛美沙星对照品21.84mg,置100ml量瓶中,加实施例1提供的流动相a溶解并稀释至刻度,摇匀,制成含洛美沙星浓度约为0.2mg/ml的对照品溶液。再精密量取上述对照品溶液适量,用流动相a稀释制成浓度分别约为40μg/ml、20μg/ml和2μg/ml的溶液。分别精密量取0.2mg/ml的对照品溶液20μl、10μl和5μl,40μg/ml的对照品溶液10μl,20μg/ml的对照品溶液10μl和5μl,2μg/ml的对照品溶液10μl注入液相色谱仪,按实施例1中的色谱条件测定峰面积,以峰面积积分值为纵坐标,对照品质量为横坐标,绘制标准曲线,回归方程为y=5791.4x+69480,r2=0.9999,所得标准曲线见图5。
由图5可以看出,洛美沙星在质量为19.72~3944ng之间呈良好线性。
实施例4:检出限、定量限
精密量取浓度约为2μg/ml的洛美沙星对照品溶液660μl和220μl,置10ml量瓶中,加流动相a稀释至刻度,摇匀,分别精密量取10μl,注入液相色谱仪中,作为检出限和定量限,色谱图显示其信噪比分别为5.09和17.72,该方法洛美沙星的检出限和定量限分别为0.43ng和1.30ng。
实施例5:精密度试验
精密量取浓度为40μg/ml的洛美沙星对照品溶液10μl,注入液相色谱仪中,连续进样6次,记录色谱图,峰面积分别为2366997、2365606、2366583、2365493、2365539、2366008,rsd为0.03%,表明本方法精密度良好。
实施例6:重复性试验
取门冬氨酸洛美沙星葡萄糖注射液6份(b厂,批号161103,规格为:100ml,洛美沙星0.2g与葡萄糖5g),按照实施例1提供的色谱条件进行测定,结果详见表2:
表2重复性试验数据
由表2可知,总杂质(平均0.3%)rsd小于2%,单个杂质rsd均小于6%,表明该方法重复性好。
实施例7:专属性试验
空白试验:取5%葡萄糖溶液作为空白辅料溶液。精密量取空白辅料溶液和流动相a溶液各10μl,分别按照实施例1中的色谱条件进行测定,记录色谱图,结果见图6,其中,曲线4为5%葡萄糖溶液的测试结果;曲线5为流动相a的测试结果。
由图6可以看出,流动相a对本法无干扰,空白辅料中5-hmf峰在约5min左右出峰,而样品在这个位置未检测到其他杂质峰,可见,流动相a和葡萄糖对有关物质的检测基本不存在干扰,本发明提供的测试方式用于门冬氨酸洛美沙星葡萄糖注射液的测定具有很好的专属性。此外,通过图6还能看出,5-hmf与样品中杂质能实现完全分离,说明本方法还适用于门冬氨酸洛美沙星葡萄糖注射液中5-hmf的检测。
实施例8:破坏性试验
强制降解试验是在模拟强酸、强碱、氧化、光照以及高温等的强降解条件,加速对门冬氨酸洛美沙星进行破坏,目的是通过考察样品的降解产物和主峰以及已知杂质的分离情况,评估分析方法的有效性和适用性。
为了更好的考察本方法的专属性和稳定性,设计了酸、碱、氧化、光照和高温的强制降解试验。
(1)光破坏试验
日光破坏:取门冬氨酸洛美沙星葡萄糖注射液(b厂,批号161103,规格:100ml:洛美沙星0.2g与葡萄糖5g)在光照强度4000lx,放置24小时后按照实施例1中的色谱条件测定。
紫外破坏1(紫外破坏):取门冬氨酸洛美沙星葡萄糖注射液(b厂,批号161103,规格:100ml:洛美沙星0.2g与葡萄糖5g)液体置玻璃蒸发皿中,紫外线照射2h后按照实施例1中的色谱条件测定。
对照:取门冬氨酸洛美沙星原料(不经过破坏)(d厂提供,批号20151201)加水制成含洛美沙星约2.0mg/ml的溶液,按照对照实施例1中的色谱方法测定。
紫外破坏2(紫外破坏):取门冬氨酸洛美沙星原料(d厂提供,批号20151201),紫外线照射6h后按照实施例1中的色谱条件测定。
上述光破坏试验结果的色谱图见图7~8,在图7中,曲线6为紫外破坏1的测试结果,曲线7为日光破坏的测试结果,曲线8为对照的测试结果;图8为紫外破坏2的测试结果。
(2)高温和强酸破坏试验
高温破坏1:取门冬氨酸洛美沙星原料(d厂提供,批号20151201)约27mg,加水10ml溶解,制成含洛美沙星约2mg/ml的溶液,沸水浴加热4h后按照实施例1中的色谱条件测定。
高温破坏2:取门冬氨酸洛美沙星原料(d厂提供,批号20151201)分别在130℃和160℃条件下加热2h后,取原料约27mg,加水10ml溶解,按照实施例1中的色谱条件测定。
强酸破坏:取门冬氨酸洛美沙星原料(d厂提供,批号20151201)约27mg,加水1ml溶解,制成含洛美沙星约20mg/ml的溶液,加入10mol/l盐酸溶液1ml,沸水浴加热2小时候后,用10mol/l氢氧化钠溶液1ml中和,再加流动相a稀释至10ml,按照实施例1中的色谱条件测定。
高温破坏1和强酸破坏试验结果见图9,其中,曲线9为高温破坏1的测试结果,曲线10为强酸破坏的测试结果;高温破坏2的试验结果见图10,其中,曲线11为160℃下的测试结果,曲线12为130℃下的测试结果。
(3)氧化破坏试验
氧化破坏:取门冬氨酸洛美沙星原料(d厂提供,批号20151201)约27mg,加水1ml溶解,制成含洛美沙星约20mg/ml的溶液,再加入30%过氧化氢溶液1ml,沸水浴2小时后,再加流动相a稀释至10ml,照上述色谱图条件测定。
对照1:取门冬氨酸洛美沙星葡萄糖注射液(b厂,批号161103,规格:100ml:洛美沙星0.2g与葡萄糖5g)不经过破坏,按照实施例1中的色谱方法进行测定。
对照2:取门冬氨酸洛美沙星葡萄糖注射液(a厂,批号21612201-1,规格:100ml:洛美沙星0.2g与葡萄糖5g)不经过破坏,按照实施例1中的色谱方法进行测定。
测试结果见图11,其中曲线13为氧化破坏的测试结果,曲线14为对照1的测定结果,曲线15为对照2的测试结果。
(4)强碱破坏试验
强碱破坏1:取门冬氨酸洛美沙星原料(d厂提供,批号20151201)约27mg,加水1ml溶解,制成含洛美沙星约20mg/ml的溶液,加入10mol/l氢氧化钠溶液1ml(会产生沉淀),沸水浴加热2小时候后,用10mol/l盐酸溶液1ml中和,再加流动相a稀释至10ml,按照实施例1中的色谱条件测定。
强碱破坏2:取门冬氨酸洛美沙星原料(d厂提供,批号20151201)约27mg,加水1ml溶解,制成含洛美沙星约20mg/ml的溶液,加入10mol/l氢氧化钠溶液约0.4ml(不产生沉淀),沸水浴加热2小时候后,用10mol/l盐酸溶液0.4ml中和,再加流动相a稀释至10ml,按照实施例1中的色谱条件测定。
对照:取门冬氨酸洛美沙星原料(不经过破坏)(d厂提供,批号20151201)加水制成含洛美沙星约2.0mg/ml的溶液,按照对照实施例1中的色谱方法测定。
试验结果见图12,其中,曲线16为强碱破坏1的测试结果,曲线17为强碱破坏2的测试结果,同时设置曲线8作为对照。
(5)破坏性试验结论
由图7~12可知,按照本方法对酸、碱、光、氧化和高温破坏产生的杂质能更好的检测,主峰与前后相邻杂质峰能实现较好的分离,各杂质峰之间分离效果也较好。其次,发现门冬氨酸洛美沙星水溶液在沸水浴加热2h稳定,门冬氨酸洛美沙星原料130℃加热2h产生少量杂质,160℃加热2h产生较多杂质且降解杂质量也增加很大;在酸、碱破坏下产生杂质较少;在光照条件下降解加速,产生杂质较多,特别是在紫光灯下2h照射溶液颜色就变成深黄色;采用双氧水氧化破坏产生杂质最多,降解最厉害。对各杂质的来源进行归属,结果见图13,其中,其中曲线18为门冬氨酸洛美沙星原料(a厂提供,批号20151201)有关物质的测试结果(未经过破坏);其余曲线的含义如上所述;通过破坏性试验结果,本发明提供的以下各杂质的来源归属,结果见表3:
表3杂质来源归属
备注:洛美沙星主峰保留时间约为22min
实施例9:样品测试
为了验证本方法测试的准确度,采用本发明实施例1提供的色谱条件对a厂和b厂的门冬氨酸洛美沙星葡萄糖注射液(规格均为100ml:洛美沙星0.2g与葡萄糖5g)分别测定,同时采用法定标准[ybh30102005(a厂)、ybh15122004(b厂)]分别对上述a厂和b厂的样品进行测试,测试结果如表4所示:
其中,有关杂质含量的计算方法:供试品溶液色谱图中如有杂质峰(除5-羟甲基糠醛外),按主成分自身对照法计算供试品溶液中杂质量。
最大单个杂质%=供试品图谱中最大单个杂质峰面积/(对照溶液主峰面积×对照溶液稀释倍数)×100%
总杂质%=供试品图谱中杂质峰面积和/(对照溶液主峰面积×对照溶液稀释倍数)×100%
表4测试结果
从表4可以看出,采用新方法能够更好地区分两家企业的产品质量,从结果看,a厂产品质量优于b厂,本发明建立的有关物质测定方法比法定标准方法能够检测到更多的杂质,平均总杂质量(0.23%)比法定标准结果大0.1%,方法专属性更强。
对a厂和b厂的总杂质数据用spss软件进行“独立样本t检验”,结果发现,采用法定标准方法检验时,两厂总杂质均值无显著差异,p值为0.456(p>0.05),说明采用法定标准方法分析不能区分a厂和b厂的质量差异;采用本发明提供的有关物质方法检验时,两厂总杂质均值存在显著差异,p值为0.001(p<0.01),说明两家企业样品检测结果存在极显著差异,且a厂产品质量显著优于b厂产品。由此可见,与现有的法定标准方法相比,本发明提供的方法更精确,能够更好地用于监测门冬氨酸洛美沙星葡萄糖注射液质量。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!