一种测定花生干种子中反式白藜芦醇含量的方法与流程
本发明涉及食品中活性物质的检测领域,更具体地,涉及一种测定花生干种子中反式白藜芦醇含量的方法。
背景技术:
白藜芦醇(resveratrol),又称芪三酚,是一种非黄酮类多酚化合物,为白色针状晶体,分子式为c14h12o3结构式为:
天然的白藜芦醇有顺式、反式两种结构,这两种结构可各与葡萄糖结合,形成顺式或反式白藜芦醇苷。
白藜芦醇苷在肠道中糖苷酶的作用下可释放出白藜芦醇,其中反式异构体的生理活性强于顺式,单体活性大于糖苷。白藜芦醇广泛存在于虎杖、花生、葡萄等植物中,随着研究的深入,其药理作用逐渐被人们发现,如抗菌、抗炎、抗癌、抗诱变、抗氧化、防治心脏病、降低血脂、抗血小板凝聚和抗血栓等,在心脑血管和癌症的防治上具有良好的应用前景,甚至在食品及保健品行业,白藜芦醇产品备受广大消费者追捧,目前也有将白藜芦醇提取物制成降脂、美容、减肥和抗癌天然保健食品及胶囊。
花生是白藜芦醇含量最高的植物之一,在自然条件下,白藜芦醇作为植物抗毒素在花生受到各种生物及非生物胁迫时大量积累。在植物体内,白藜芦醇由白藜芦醇合成酶在苯丙氨酸代谢途径中合成。目前,国内外对葡萄和虎杖的白藜芦醇研究较多,对花生中白藜芦醇含量的研究报道较少。对于前处理方法,大多采用浸提法、超声提取法等。即将原料粉碎,采用有机溶剂(如甲醇、乙醇、乙酸乙酯等)进行提取,经过滤后将滤液浓缩至干,复溶后进行液相色谱分析。由于花生种子中成分很复杂,杂质较多,目标物出峰不明显,干扰较大。因此,探索新的前处理方法,提高检测效率,为研究花生白藜芦醇合成机理及育种利用奠定基础。
技术实现要素:
本发明的目的在于提供一种测定花生干种子中反式白藜芦醇(trans-resveratrol,t-rvt)含量的方法,该方法包括如下步骤:
将花生干种子粉末置于酶解液中,酶解,再加入乙醇,混匀后,在频率为30~60khz下超声10min~4h,离心取上清液,得花生干种子粗提液;所述酶解液为纤维素酶的水溶液,浓度为1~8g/l;
使用高效液相色谱测定所述花生干种子粗提液中反式白藜芦醇的含量。
本发明利用酶解法联合超声技术提取花生干种子中t-rvt,该前处理方法可以有效地除去高效液相色谱测定时对t-rvt产生干扰的杂质,提高检测效率。在本发明中,优选地是测定反式白藜芦醇(t-rvt)的含量。
在本发明一个优选实施方式中,为了提高t-rvt的提取率,酶解的时间为1~3h,进一步优选为2h。
在本发明一个优选实施方式中,酶解的温度在纤维素酶的最佳酶活条件下进行。
在本发明一个优选实施方式中,酶解液由纤维素酶和超纯水配制而成。其中,酶解液的ph优选为5.0~7.0,进一步优选为5.0~5.5。为了提高t-rvt的提取率,酶解液的浓度优选为1~8g/l,更优选为2~4g/l。
在本发明一个优选实施方式中,为了减少误差,所述花生干种子粉末与所述酶解液的质量体积比为(2~4):5,优选为3:5。
在本发明一个优选实施方式中,为了提高提取率,所述酶解液与所述乙醇的体积比为5:(10~16),优选为5:12。
在本发明一个优选实施方式中,花生干种子粉末的粒径可以为30目到40目。
在本发明一个优选实施方式中,所述超声的频率为40~50khz。在本发明一个优选实施方式中,为了提高t-rvt的提取率,超声的时间优选为10min~4h,进一步优选为10min~1h。
其中,离心取上清液中离心的速度为8000~10000rpm。
在本发明一个优选实施方式中,还包括将花生干种子粗提液使用中性氧化铝进行提纯。中性氧化铝可以实现t-rvt与花生样品中的其他杂质实现有效分离,且对t-rvt不会造成死吸附,样品损失少且提取率高。
在本发明一个优选实施方式中,为了进一步提高检测的准确性,上述方法还包括将所述花生粗提液进行浓缩蒸干,加甲醇复溶,加入氧化铝混匀,离心取上清液,过滤膜得待测品,使用高效液相色谱测定所述待测品中t-rvt的含量。
其中,花生粗提液与甲醇的体积优选为(10~15):1,进一步优选为(14~15):1。
其中,所述花生粗提液与所述氧化铝的体积质量比优选为(20~40):1,进一步优选为(25~30):1。
其中,滤膜可以为0.22um有机滤膜。浓缩蒸干的温度为45~55℃。
在本发明一个优选实施方式中,测定花生干种子中t-rvt含量的方法,包括如下步骤:
将花生干种子粉末置于酶解液中,在纤维素酶最佳温度(40~55℃)下酶解1~3h,再加入乙醇,混匀后,在频率为30~60khz下超声10min~4h,离心取上清液,得花生干种子粗提液;所述酶解液为纤维素酶的水溶液;所述花生干种子粉末与所述酶解液的质量体积比为(2~4):5;所述酶解液与所述乙醇的体积比为5:(10~16);
将所述花生粗提液进行浓缩蒸干,加甲醇复溶,加入中性氧化铝混匀,离心取上清液,过滤膜得待测品,使用高效液相色谱测定所述待测品中t-rvt的含量;其中,所述花生粗提液与所述甲醇的体积为(10~15):1;所述花生粗提液与所述氧化铝的体积质量比为(20~40):1。
在本发明中,体积可以为ml,质量可以为g。
在本发明一个优选实施方式中,“使用高效液相色谱测定所述花生干种子粗提液中t-rvt的含量”具体为:使用外标法建立t-rvt的甲醇溶液的高效液相色谱中的峰面积与浓度的标准曲线,根据所述标准曲线和所述花生干种子粗提液中t-rvt的峰面积,得到所述花生干种子粗提液中白藜芦醇的浓度值。
外标法即:称取适量t-rvt标准品,利用甲醇溶解和定容,配制多种不同已知的t-rvt标准品的浓度,将配好的溶液过0.22um滤膜,装样品瓶中进行测定。所得数据以高效液相色谱谱图中的峰面积为纵坐标,浓度为横坐标,得到峰面积-浓度标准曲线,由此曲线来确定样品中t-rvt含量。
本发明利用酶解法联合超声技术提取花生干种子中t-rvt,该前处理方法可以有效地除去高效液相色谱测定时对t-rvt产生干扰的杂质,提高检测效率。本发明所提供的测定方法具有高选择性、高分离度、能够准确可靠的检测分析花生干种子中t-rvt含量。
附图说明
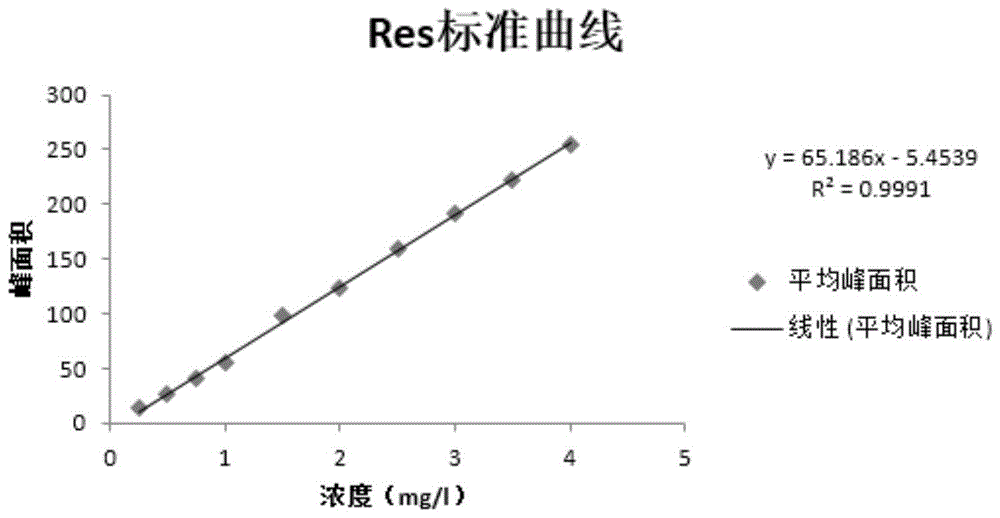
图1为本发明实施例1中hplc外标法得到的白藜芦醇标准曲线;
图2为白藜芦醇的标准品的hplc高效液相色谱图;
图3为实施例4中的供试样品中白藜芦醇的hplc高效液相色谱图;
图4为本发明实施例2中不同酶解液浓度与白藜芦醇得率的曲线图;
图5为本发明实施例2中不同酶解时间与白藜芦醇得率的曲线图;
图6为本发明实施例2中不同超声时间与白藜芦醇得率的曲线图;
图7为使用国标法标样峰图;
图8为使用国标法测得样品色谱图;
图9为使用本发明实施例3中方法标样峰图;
图10为使用本发明实施例3中方法测得样品色谱图。
具体实施方式
下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例,用于说明本发明,但不止用来限制本发明的范围。
本发明采用的仪器装置和试剂;
2ml液相自动进样瓶,50mm*0.22um的有机相过滤膜,50mm*22um的水相过滤膜,0.22um有机相尼龙针式过滤器,购于上海安谱科学仪器有限公司;
hc-c18色谱柱,安捷伦仪器有限公司;
hplc1290infinityⅱ高效液相色谱仪,安捷伦仪器有限公司;
h1-16k型离心机,购于可成仪器公司;
冷冻高速离心机avartij-25,购于美国beckman公司;
漩涡震荡混合仪;
天平:千分之一天平(上海舜宇恒平科学仪器有限公司)
超纯水系统(美国millipore公司)
t-rvt标准品,购于sigma公司
本发明所用试剂与药品包括:甲醇、乙醇和乙酸等均为国产分析纯,hplc用乙腈为色谱纯(德国merck,darmstadt,gemany);水为超纯水(电阻率18.2mω.cm)
实施例1
色谱条件:采用美国agilent1290infinityⅱ高效液相色谱仪,chemstationedition色谱工作站:
色谱柱:agilenthc-c18色谱柱
柱温:30℃;
检测波长:306nm;
流动相:洗脱时间为0-16min,乙腈—水(22:78);洗脱时间为16-18min,乙腈—水(40:60);
流速:0.6ml/min;
进样量:10ul。
t-rvt标准曲线的建立:采用外标法,分别称取适量t-rvt标准品,利用甲醇溶解和定容,配制t-rvt标准品的浓度依次为0.25、0.50、0.75、1.00、1.50、2.00、2.50、3.00、3.50、4.00mg/l,将配好的溶液过0.22um滤膜,装样品瓶中进行测定。所得数据以峰面积为纵坐标,浓度为横坐标,得到峰面积-浓度标准曲线,如图1所示,由此曲线来确定样品中t-rvt含量。
表1t-rvt标准品分析结果
rsd:三个重复间相对标准偏差
如图1所示,根据所得的曲线方程,相关系数为0.9991,有良好的线性范围,将样品所得的峰面积代入其中计算,可得该样品的t-rvt浓度,进而换算到花生干种子中,就能得出花生干种子的t-rvt含量。
实施例2
花生干种子中t-rvt前处理方法的单因素试验。
1、酶解液浓度对花生t-rvt得率的影响。
酶解液浓度分别设为0、2、4、6、8g/l,精确称取花生粉末3.00g,在酶解时间为2h,不进行超声处理的条件下进行前处理。每组设置三个重复。
结果如图4所示,酶解液浓度在0~4g/l的范围内,t-rvt的得率随着酶解液浓度的升高而升高,当酶解液浓度升高至4g/l之后,t-rvt的得率变化不大。因此,选择酶解液浓度为4g/l左右为佳。
2、酶解时间对花生t-rvt得率的影响。
酶解时间分别设为0、1、2、3、4h,精确称取花生粉末3.00g,在酶解液浓度为2g/l,不进行超声处理的条件下进行前处理。每组均设置三个重复。
结果如图5所示,随着酶解时间的延长,t-rvt得率呈上升趋势,在0~2h内t-rvt得率上升较快,超过2h,t-rvt的得率变化不明显,说明超过2h后,酶解可能达到饱和。因此选择酶解时间2h左右为佳。
3、超声时间对花生t-rvt得率的影响。
超声时间分别设为0、1、2、3、4h,精确称取花生粉末3.00g,在酶解液浓度为2g/l,酶解2h的条件下进行前处理。
结果如图6所示,超声时间在0~2h内t-rvt得率小幅度上升,但总体变化不明显。说明在前面酶解等步骤中,白藜芦醇可能很大程度都被提取完全,通过超声处理,将剩余一部分t-rvt释放出来。从结果来看,经超声处理与未经超声处理差异显著,因此,在设计正交试验过程中,同时也为了节省时间,选择超声时间为0~1h左右最佳。
4、正交试验设计
根据单因素试验的结果进行l16(43)正交试验,参数如下表2所示:
表2参数设置
三因素四水平正交试验。结果分析如下表3和表4所示:
表3试验结果
表4正交试验方差分析表
由上表3和表4可知,不同因素水平对花生干种子中t-rvt的得率有不同的影响,从极差r值得知,3个因素对t-rvt得率影响大小顺序为a>c>b,即酶浓度是影响花生干种子t-rvt提取量的最重要因素,超声时间次之,酶解时间影响最小。从方差分析表中也可以看出酶浓度和超声时间对t-rvt提取量有极显著影响,酶解时间对t-rvt提取量有显著影响。其效果最好的提取条件为酶浓度为3g/l,酶解时间为2h,超声时间为20min。
实施例3
本实施例提供了一种使用高效液相色谱分析方法测定花生干种子中白藜芦醇含量的方法,包括如下步骤:
(1)选取大小均一、颜色一致、成熟饱满的花生干种子,用小型粉碎机将所选取的花生干种子粉碎成颗粒细小、均匀一致的粉末(30目到40目之间),用千分之一天平准确称取花生粉末3.00g(误差范围控制在±0.05%)于50ml离心管中。
(2)加入5ml酶解液,盖上盖子后放入温度为50℃的恒温水浴锅内酶解,控制酶解时间为120min。
(3)再加入无水乙醇12ml,混匀后放入频率为40khz的小型超声清洗机超声20min,8000rpm离心后取10ml上清液即得到花生干种子粗提液,备用。
(4)所得的花生干种子粗提液用氮吹仪浓缩至干,其特征在于浓缩蒸干温度为45-55℃,再加1ml甲醇复溶,漩涡混合震荡5min,倒入2ml离心管中,再加0.5g氧化铝粉末,充分混匀,8000rpm离心10min,取全部上清液,经过0.22um有机相针式过滤器过滤后,装入样品瓶中得供试品。
利用《花生中白藜芦醇的测定—高效液相色谱法》(gb/t24903-2010)中的方法测定中花6号、徐花13等20份花生资源t-rvt含量。同样,利用本发明的方法测中花6号、徐花13等20份花生资源,测得的结果如下图7、8、9、10所示。从20个花生资源样品测得的结果来看,在保留时间为6min左右的时候,标准品出峰,而图8中,样品中未检测到t-rvt,说明《花生中白藜芦醇的测定—高效液相色谱法》(gb/t24903-2010)中的方法需要改进,没有本发明的效果好。
实施例4
白藜芦醇的稳定性试验
同一份供试样品实施例3,按照相同的色谱条件分别于0、6、13、25h进样,每个时间点进样3次,图2为白藜芦醇的标准品的hplc高效液相色谱图。图3为供试样品实施例3中白藜芦醇的hplc高效液相色谱图。
实验结果见下表5。
表5t-rvt的稳定性实验结果
从表5中可以看出,t-rvt峰面积rsd为1.07%,表明供试品溶液在24h内基本稳定。
加标回收率实验与精密度实验
以徐花13为材料,精密称定3.00g,分别加入浓度为0.5、1、2mg/l的t-rvt标准品溶液1ml,经前处理得到供试品,在相同的色谱条件下分别进样。
加标回收率=(加标试样测定值-试样测定值)÷加标量×100%。
结果如下表6:
表6
注:以标准曲线方程换算的浓度计。
待测样品的色谱图均出现与标准样品保留时间相同的吸收峰。含有标准样品的样品待测液上hplc仪器分析后,t-rvt的峰面积均增大,说明是样品中含有的t-rvt与标准品出现了叠加峰。如表6所示,加标回收率为98.546%,表明hplc检测方法的加标回收率均相对较高。从hplc检测方法的精密度、加标回收率和标准曲线可以看出,建立的标准曲线具有良好的线性相关系数,且方法的精密度较高,加标回收率也较高,可认为该方法能对花生中t-rvt进行较好的定性、定量分析。
上述结果表明,本发明给出的测定方法,优化了前处理的方法,与现有的方法对比,节省了时间和溶剂,同时,准确性好,重复性好,是一种较快速、准确、灵敏度高的分析方法,为花生干种子中提取t-rvt工艺及测定花生干种子中t-rvt含量提供参考。
最后,本发明的方法仅为较佳的实施方案,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!