利用竞争性免疫反应消除钩状效应的方法及试剂盒与流程
本发明涉及试剂技术领域,尤其是涉及一种利用竞争性免疫反应消除钩状效应的方法。本发明还涉及一种利用竞争性免疫反应消除钩状效应的试剂盒。
背景技术:
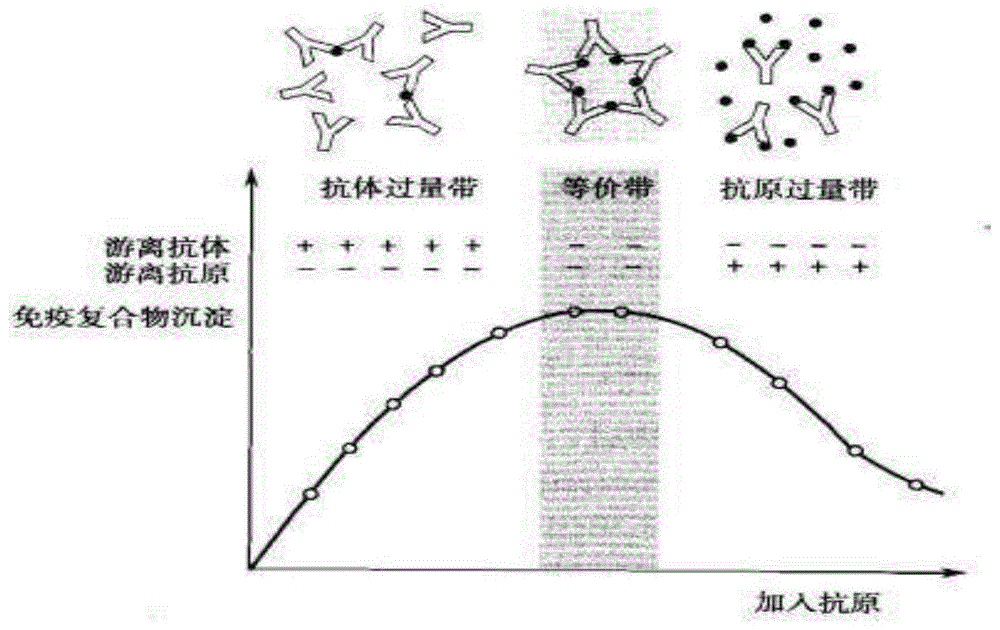
前带和后带早在1929年就由heidelberger提出。他在恒定量抗体中加不同量抗原后形成的免疫复合物(ic)沉淀量的研究中,得到图1所示的关系图形。他把抛物线顶点(拐点)左右两侧,同一反应所显示的不同性状称为双相应答(biphasicresponse),又把该曲线所包括的反应区域以抗原-抗体的相对比例大致分为抗体过剩区,又称前带(prozone),两者浓度大致相等的当量区又称等价带,抗体过剩区又称后带(postzone)。在免疫学检验中,当以定量的抗原测定抗体时,若被测抗体浓度低于抗体当量浓度,形成的ic量正比于抗体浓度;大于该当量浓度后形成的ic量反而减少,抗体过量越多,形成的ic量越少,出现与图1相似的反应曲线。以往把这种现象称为前带现象。反之若以定量的抗体测定抗原时,当被测抗原浓度大于抗体的当量浓度后出现的ic量减少的情况,称为后带现象。这些命名源于经典的heidelberger双相应答曲线,并延用很长时间直至现在。在单克隆抗体问世后,miles等创立了放射免疫测定的双位点二步法,尔后不久又将其发展为双位点一步法。在他们测定血清铁蛋白的研究中发现,在确定的固相抗体浓度和标记抗体浓度,当被测铁蛋白浓度高达一定程度后,反应信号不再与分析物浓度成正比而转向反比关系。这种情况在一步法中尤为严重,即测定的检测范围较之二步法更窄。这种现象以后一再被许多研究者所证实,在elisa反应中更常见。1977年green等根据反应曲线形状提出了钩状效应(hookeffect)的名称。因此严格地说,前带现象系指抗体过剩时反而使反应信号弱化而使信号-剂量(浓度)曲线呈钩状的现象;后带现象是指抗原过剩时使反应信号-剂量曲线呈钩状的现象。因此钩状效应概括了前、后带现象,在命名上较为确切。因习惯使然,前带现象现仍在使用,后带现象一词并不多用,在以前文献中常与前带现象混用。目前钩状效应多指抗原过剩而言,因此又有高剂量钩状效应(highdosehookeffect)一词,以别于竞争法中的低剂量钩状效应。现在前带现象与钩状效应混用的情况仍较多见,命名学上尚未统一。
钩状效应的原因曾有很多种解释。趋于认同的观点是,当抗原-抗体比例适当时,形成较完整的ic网络结构,使蛋白质分子的疏水结构充分暴露而易产生沉淀反应。反之,当两者比例失调时,将不同程度地影响ic的结构完整性,使之具有一定的溶解度或发生可逆溶解作用,即ic越不完整,更易溶解或可逆溶解。因此对于免疫沉淀反应而言,钩状效应是由于不能产生足够大的和溶解度小的ic。对于凝集反应,则因不完整的ic网络结构经摇动而发生可逆解离。对于各种标记免疫测定,则因形成可溶性ic或形成的ic易从固相载体上洗脱。在一步夹心法中过量的被测对象与固相蛋白及标记蛋白争相结合,难以或不能有效地形成夹心结合物。高剂量钩状效应使强阳性标本误测为弱阳性以至假阴性结果。竞争法中的低剂量钩状效应系指分析物浓度较低时反而产生较强的反应信号,对其原因尚在研究中。对于异常值与正常值上限间距不太大的药物分析等,低剂量钩状效应可产生错误结果,一般而言其严重程度不如高剂量钩状效应。
国内目前应用的检测方法主要有干化学检验法、免疫荧光法、酶免疫法、放射免疫法以及免疫比浊法。干化学检验法只能提供半定量或定性的结果,同时干化学试纸条检测结果受较多因素影响,在临床检验中不可避免的会出现假阴性和假阳性结果。免疫荧光法及酶免疫法操作复杂且耗时长,不便广泛临床应用。放射免疫法灵敏度高、特异性强,但具有放射性污染,试剂保存期短等缺点。免疫比浊法具有操作简单、测定周期短、精密度高等优点,在生化分析仪上使用较为广泛。但是,由于免疫比浊法的检测原理是反应生成不溶性抗原-抗体复合物,并产生一定的浊度,浊度的高低反映样品中抗原的含量,导致现有的免疫反应检测试剂盒不可避免的出现灵敏度较低的不足。
技术实现要素:
本发明的目的是提供一种利用竞争性免疫反应消除钩状效应的方法,它具有可直接应用于全自动生化分析仪上,结果检测范围宽,能够解决钩状效应的影响、使用方便,且便于大规模推广的特点。本发明还公开了一种利用竞争性免疫反应消除钩状效应的试剂盒。
本发明所采用的第一个技术方案是:
利用竞争性免疫反应消除钩状效应的方法,所用的试剂包括试剂r1、试剂r2,以及校准品,其特征在于:所述利用竞争性免疫反应消除钩状效应的方法包括:
(1)在试剂r1中加入被测对象相对应的抗原或抗体,在试剂r2中加入被测对象对应的抗体或抗原致敏的胶乳颗粒,校准品采用由被测对象制得的校准品;
(2)被测对象是抗原或抗体;
(3)检测时,样本中的被测对象与其相对应的已知浓度的抗体或抗原结合,再与其对应抗原或抗体致敏胶乳反应,通过测定吸光度的变化量来确定样本中被测对象的浓度。
所述试剂r1包括:缓冲液、表面活性剂、防腐剂,且该试剂r1中还包括有和被测对象相对应的抗原或抗体,且缓冲液的ph值为5.0-9.0;
所述试剂r2包括:缓冲液、防腐剂、助悬剂,且该试剂r2中包括有和被测对象对应的抗体或抗原致敏的胶乳颗粒,且缓冲液的ph值为5.0-9.0。
所述试剂r1的组分为:缓冲液10-300mmol/l、表面活性剂0.1-10.0g/l、防腐剂0.1-10.0g/l,抗体或抗原适量,其中,缓冲液的ph值为5.0-9.0;
试剂r2的组分为:缓冲液10-300mmol/l、防腐剂0.1-10.0g/l,助悬剂0.1-10.0g/l,抗原致敏胶乳或抗体致敏胶乳适量,其中,缓冲液的ph值为5.0-9.0。
所述被测对象的所处的环境是人的体液。
本发明所采用的第二个技术方案是:
利用竞争性免疫反应消除钩状效应的试剂盒,被测对象为抗原或抗体,包括试剂r1、试剂r2,以及校准品,
所述试剂r1包括:缓冲液、表面活性剂、防腐剂,且该试剂r1中还包括有和被测对象相对应的抗原或抗体,且缓冲液的ph值为5.0-9.0;
所述试剂r2包括:缓冲液、防腐剂、助悬剂,且该试剂r2中包括有和被测对象对应的抗体或抗原致敏的胶乳颗粒,且缓冲液的ph值为5.0-9.0;
所述校准品采用由被测对象制得的校准品。
所述抗原为:血清淀粉样蛋白a、胱抑素c、d-二聚体、β2-微球蛋白、轻链kappa、轻链lambda、免疫球蛋白g、转铁蛋白、α2-巨球蛋白、中性粒细胞白明胶酶相关载脂蛋白(nagl)、纤维蛋白原、b因子或可溶性转铁蛋白受体。
所述抗体为:抗链球菌溶血素o、类风湿因子(抗igg)、抗环瓜氨酸肽抗体。
所述缓冲液为tris缓冲液、mes缓冲液、mops缓冲液、tea缓冲液、hepes缓冲液、pipes缓冲液、pbs缓冲液中的一种;所述表面活性剂为聚氧乙烯衍生物、聚氧乙烯烷基醚硫酸盐、聚多卡醇中的一种或多种;所述防腐剂为caa、5-bromo-5-notrp-1,3-dioxane、proclin300、imidazolidinylurea(izu·h2o)、叠氮钠、山梨酸钾、庆大霉素中的一种;所述助悬剂为聚氧乙烯衍生物,聚氧乙烯烷基醚硫酸盐、失水山梨醇酯类、月桂基甜菜碱类中的一种或多种;所述试剂r2中的和被测对象对应的抗体或抗原致敏的胶乳颗粒的粒径为60-300nm。
所述聚氧乙烯衍生物的hlb值为12-18.8,所述失水山梨醇酯类的hlb值为1.8-8.6。
所述聚氧乙烯衍生物的hlb值为13.3-15,失水山梨醇酯类的hlb值为4.3-6.7。
本发明和现有技术相比所具有的优点是:
1、检测准确度高。从原理上来看,结合图1—1和图1—2所示,通过在试剂r1中增加被测对象相对应的抗原或抗体,在试剂r2中增加被测对象对应的抗体或抗原致敏的胶乳颗粒,可有效地避免假阴性,当样本中的抗原超出本发明的检测限时,测定结果不会低于线性值,不会造成误判。比如,对于d-二聚体试剂盒,在试剂r1中增加d-二聚体抗体,在试剂r2中采用d-二聚体致敏的胶乳颗粒,可有效地避免假阴性。当样本中的抗原超出本发明的检测限时,测定结果不会低于线性值,不会造成误判。亦即,相较于目前免疫检测的试剂(以检测抗原为例),校准品基本无差异,试剂r1中不添加抗体,在试剂r2中添加抗体(或包被有抗体的胶乳抗体),且根据浊度的增加来计算检测结果,为吸光度上升的反应,检测结果取决于加入的抗体量。当抗原量超过抗体量时,出现钩状效应,会出现假阴性的结果。例如正常、异常的分界值为5mg/l,假设测定的线性是30mg/l,则55mg/l显示的结果就是5mg/l,100mg/l可能就是负值。本发明中,在试剂r1中添加已知浓度的抗体,在试剂r2中加入抗原包被的胶乳颗粒,根据浊度的减少来计算检测结果。当抗原浓度超过已知抗体的浓度时,过量的抗原与样本中的胶乳颗粒不反应,随抗原过量,浊度不再减少,吸光度趋于稳定,值与抗体的加入量保持一致,添加的抗体量超过异常值即可。例如正常、异常的分界值为5mg/l,假设测定的线性是30mg/l,则55mg/l显示的结果就是30mg/l,100mg/l也是30mg/l,不会发生假阴性。如此,消除了钩状效应,提高了检测精度。另外,通过对表面活性剂和助悬剂hlb值的限定,起到了提高方法中线性拟合度的作用。
2、检测范围宽。提高抗体含量显著提高临床诊断的检测范围。同样,以d-二聚体试剂盒为例,与之前的检测方法相比,同样添加效价为20mg/l的抗体,之前的检测方法在测定30mg/l的样本值为8.5mg/l,而使用本发明的试剂时,测定值为20.5mg/l。使用之前的检测方法,当样本中的d-dimer超过20mg/l后,多余部分d-dimer会与抗体结合,使得浊度下降,导致测定结果偏低,而使用本发明的试剂,在理论上,超过20mg/l的样本,没有剩余的抗体可以与胶乳发生反应,浊度不再降低,故结果始终显示20.5mg/l,由此可见,当添加的抗体超过临床诊断的范围,就不会产生误判。
附图说明
下面结合附图和实施例对本发明进一步说明:
图1是钩状效应示意图;
图1-1是本发明检测抗原的原理示意图;
图1-2是本发明检测抗体的原理示意图;
图2-1是本发明的实施例2-1所制备的消除钩状效应的d-二聚体试剂盒在消除钩状效应后的测定结果图;
图2-2是本发明的实施例2-2所制备的消除钩状效应的d-二聚体试剂盒在消除钩状效应后的测定结果图;
图2-3是本发明的实施例2-3所制备的消除钩状效应的d-二聚体试剂盒在消除钩状效应后的测定结果图;
图2-4是本发明的实施例2-4所制备的消除钩状效应的d-二聚体试剂盒在消除钩状效应后的测定结果图;
图2-5是本发明的实施例2-5所制备的消除钩状效应的d-二聚体试剂盒在消除钩状效应后的测定结果图;
图2-6是本发明的实施例2-6所制备的消除钩状效应的d-二聚体试剂盒在消除钩状效应后的测定结果图;
图2-7是本发明的实施例2-7所制备的消除钩状效应的d-二聚体试剂盒在消除钩状效应后的测定结果图;
图2-8是市售d-dimer试剂盒测定结果图;
图3-1是本发明的实施例3-1所制备的消除钩状效应的β2-微球蛋白试剂盒在消除钩状效应后的测定结果图;
图3-2是本发明的实施例3-2所制备的消除钩状效应的β2-微球蛋白试剂盒在消除钩状效应后的测定结果图;
图3-3是本发明的实施例3-3所制备的消除钩状效应的β2-微球蛋白试剂盒在消除钩状效应后的测定结果图;
图3-4是本发明的实施例3-4所制备的消除钩状效应的β2-微球蛋白试剂盒在消除钩状效应后的测定结果图;
图3-5是本发明的实施例3-5所制备的消除钩状效应的β2-微球蛋白试剂盒在消除钩状效应后的测定结果图;
图3-6是本发明的实施例3-6所制备的消除钩状效应的β2-微球蛋白试剂盒在消除钩状效应后的测定结果图;
图3-7是本发明的实施例3-7所制备的消除钩状效应的β2-微球蛋白试剂盒在消除钩状效应后的测定结果图;
图3-8是市售β2-微球蛋白试剂盒测定结果图。
图4-1是本发明的实施例4-1所制备的消除钩状效应的胱抑素c试剂盒在消除钩状效应后的测定结果图;
图4-2是本发明的实施例4-2所制备的消除钩状效应的胱抑素c试剂盒在消除钩状效应后的测定结果图;
图4-3是本发明的实施例4-3所制备的消除钩状效应的胱抑素c试剂盒在消除钩状效应后的测定结果图;
图4-4是本发明的实施例4-4所制备的消除钩状效应的胱抑素c试剂盒在消除钩状效应后的测定结果图;
图4-5是本发明的实施例4-5所制备的消除钩状效应的胱抑素c试剂盒在消除钩状效应后的测定结果图;
图4-6是本发明的实施例4-6所制备的消除钩状效应的胱抑素c试剂盒在消除钩状效应后的测定结果图;
图4-7是本发明的实施例4-7所制备的消除钩状效应的胱抑素c试剂盒在消除钩状效应后的测定结果图;
图4-8是市售胱抑素c试剂盒测定结果图。
具体实施方式
实施例1
利用竞争性免疫反应消除钩状效应的方法,所用的试剂包括试剂r1、试剂r2,以及校准品。
具体而言,该利用竞争性免疫反应消除钩状效应的方法包括:
(1)在试剂r1中加入被测对象相对应的抗原或抗体,在试剂r2中加入被测对象对应的抗体或抗原致敏的胶乳颗粒,校准品采用由被测对象制得的校准品。
(2)被测对象是抗原或抗体。被测对象的所处的环境是人的体液,包括:尿液、血清、血浆、脑脊液等。
(3)样本中的被测对象与其相对应的已知浓度的抗体或抗原结合,再与其对应抗原或抗体致敏胶乳反应,通过测定吸光度的变化量来确定样本中被测对象的浓度。
其中:
试剂r1包括:缓冲液、表面活性剂、防腐剂,且该试剂r1中还包括有和被测对象相对应的抗原或抗体,且缓冲液的ph值为5.0-9.0,比如,缓冲液的ph值为5.0、6.0、8.0或9.0。
试剂r2包括:缓冲液、防腐剂、助悬剂,且该试剂r2中包括有和被测对象对应的抗体或抗原致敏的胶乳颗粒,且缓冲液的ph值为5.0-9.0,比如,缓冲液的ph值为5.0、6.0、7.0或9.0。
更具体的:
试剂r1的组分为:缓冲液10-300mmol/l、表面活性剂0.1-10.0g/l、防腐剂0.1-10.0g/l,抗体或抗原适量,其中,缓冲液的ph值为5.0-9.0。比如,试剂r1的组分为:缓冲液10mmol/l、表面活性剂0.1g/l、防腐剂0.1g/l,抗体或抗原适量。或者,试剂r1的组分为:缓冲液200mmol/l、表面活性剂5.0g/l、防腐剂5.0g/l,抗体或抗原适量。或者,试剂r1的组分为:缓冲液300mmol/l、表面活性剂10.0g/l、防腐剂10.0g/l,抗体或抗原适量。
试剂r2的组分为:缓冲液10-300mmol/l、防腐剂0.1-10.0g/l,助悬剂0.1-10.0g/l,抗原致敏胶乳或抗体致敏胶乳适量,其中,缓冲液的ph值为5.0-9.0。比如,试剂r2的组分为:缓冲液10mmol/l、防腐剂0.1g/l,助悬剂0.1g/l,抗原致敏胶乳或抗体致敏胶乳适量。或者,试剂r2的组分为:缓冲液200mmol/l、防腐剂5.0g/l,助悬剂5.0g/l,抗原致敏胶乳或抗体致敏胶乳适量。或者,试剂r2的组分为:缓冲液300mmol/l、防腐剂10.0g/l,助悬剂10.0g/l,抗原致敏胶乳或抗体致敏胶乳适量。
据以上说明:
利用竞争性免疫反应消除钩状效应的试剂盒,被测对象为抗原或抗体,包括试剂r1、试剂r2,以及校准品。
试剂r1包括:缓冲液、表面活性剂、防腐剂,且该试剂r1中还包括有和被测对象相对应的抗原或抗体,且缓冲液的ph值为5.0-9.0。
试剂r2包括:缓冲液、防腐剂、助悬剂,且该试剂r2中包括有和被测对象对应的抗体或抗原致敏的胶乳颗粒,且缓冲液的ph值为5.0-9.0。
校准品采用由被测对象制得的校准品。
更具体的:
当被测对象为抗原是,抗原可以为:血清淀粉样蛋白a、胱抑素c、d-二聚体、β2-微球蛋白、轻链kappa、轻链lambda、免疫球蛋白g、转铁蛋白、α2-巨球蛋白、中性粒细胞白明胶酶相关载脂蛋白(nagl)、纤维蛋白原、b因子或可溶性转铁蛋白受体。
当被测对象为抗体时,抗体可以是:抗链球菌溶血素o、类风湿因子(抗igg)、抗环瓜氨酸肽抗体。
缓冲液为tris缓冲液、mes缓冲液、mops缓冲液、tea缓冲液、hepes缓冲液、pipes缓冲液、pbs缓冲液中的一种。表面活性剂为聚氧乙烯衍生物、聚氧乙烯烷基醚硫酸盐、聚多卡醇中的一种或多种。防腐剂为caa、5-bromo-5-notrp-1,3-dioxane、proclin300、imidazolidinylurea(izu·h2o)、叠氮钠、山梨酸钾、庆大霉素中的一种。助悬剂为聚氧乙烯衍生物,聚氧乙烯烷基醚硫酸盐、失水山梨醇酯类、月桂基甜菜碱类中的一种或多种。试剂r2中的和被测对象对应的抗体或抗原致敏的胶乳颗粒的粒径为60-300nm。比如,粒径为60、200或300nm。其中,聚氧乙烯衍生物的hlb值为12-18.8,失水山梨醇酯类的hlb值为1.8-8.6。更好的,聚氧乙烯衍生物的hlb值为13.3-15,失水山梨醇酯类的hlb值为4.3-6.7。比如,聚氧乙烯衍生物的hlb值为12、13.3、15、18.8;失水山梨醇酯类的hlb值为1.8、4.3、6.7、8.6。
该试剂盒在具体检测时,样本中的被测对象与其相对应的已知浓度的抗体或抗原结合,再与其对应抗原或抗体致敏胶乳反应,通过测定吸光度的变化量来确定样本中被测对象的浓度。
下面,分别以抗原为d-二聚体、β2-微球蛋白和胱抑素c作为检测对象为例,进行更详细的说明。以下实施例2—1至2—7以及效果例1是以抗原为d-二聚体进行说明;实施例3—1至3—7以及效果例2是以抗体为β2-微球蛋白进行说明;实施例4—1至4—7以及效果例3是以抗体为胱抑素c进行说明。当抗原为:血清淀粉样蛋白a、胱抑素c、d-二聚体、β2-微球蛋白、轻链kappa、轻链lambda、免疫球蛋白g、转铁蛋白、α2-巨球蛋白、中性粒细胞白明胶酶相关载脂蛋白(nagl)、b因子、可溶性转铁蛋白受体;抗体为:抗链球菌溶血素o、类风湿因子(抗igg)、抗环瓜氨酸肽抗体时,结果类似,不再一一赘述。
实施例2—1
消除钩状效应的d-二聚体试剂盒,包括试剂r1、试剂r2,以及校准品。该校准品可以采用常用市售品。本实施例中,采用市售宁波普瑞柏生物技术股份有限公司的d-二聚体校准品,使用时,校准品中d-二聚体(蛋白基质)浓度分别采用0.00、2.30mg/l、4.10mg/l、7.69mg/l、20.25mg/l、37.65mg/l,校准品中还含有缓冲液10mmol/l。
具体而言:
该试剂r1的组分为:缓冲液200mmol/l、表面活性剂0.5g/l、防腐剂0.1/l、抗d-二聚体抗体20mg/l。其中,缓冲液的ph值为8.2。
该试剂r2的组分为:缓冲液10mmol/l、防腐剂0.1g/l、助悬剂0.1g/l、d-二聚体致敏胶乳50ml/l。其中,缓冲液的ph值为6.0。
其中:缓冲液为tris缓冲液、表面活性剂为ameroxloe-10(聚氧乙烯(10eo)油醇醚,hlb值12)、防腐剂为caa、助悬剂为kao24b(月桂基甜菜碱)、d-二聚体致敏胶乳的粒径为60nm、抗d-二聚体抗体为羊抗人多克隆抗体。
制备得到的试剂为液体试剂,直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。
参数以日立7180自动生化分析仪为例:
测定方法:二点终点法;
检测波长:700nm;
反应方向:向下反应;
v样本:vr1:vr2=4μl:180μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品(a样品-a空白)值在定标曲线上求得样品中d-二聚体的含量。
对d-二聚体样本进行检测,所得结果详见图2—1,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围可达30mg/l。
实施例2—2
消除钩状效应的d-二聚体试剂盒,包括试剂r1、试剂r2,以及校准品。该校准品可以采用常用市售品。本实施例中,采用市售宁波普瑞柏生物技术股份有限公司的d-二聚体校准品,使用时,校准品中d-二聚体(蛋白基质)浓度分别采用0.00、2.30mg/l、4.10mg/l、7.69mg/l、20.25mg/l、37.65mg/l,校准品中还含有缓冲液50mmol/l。
具体而言:
该试剂r1的组分为:缓冲液50mmol/l、表面活性剂5g/l、防腐剂5g/l、抗d-二聚体抗体20mg/l。其中,缓冲液的ph值为7.0。
该试剂r2的组分为:缓冲液150mmol/l、防腐剂5g/l、助悬剂3g/l、d-二聚体致敏胶乳500ml/l。其中,缓冲液的ph值为7.0。
其中:缓冲液为mes缓冲液、表面活性剂为thesit(聚多卡醇)、防腐剂为5-bromo-5-notrp-1,3-dioxane、助悬剂为atlasg-2159(聚氧乙烯单硬脂酸酯,hlb18.8);d-二聚体致敏胶乳的粒径为100nm;抗d-二聚体抗体为兔抗人多克隆抗体。
检测方法和操作步骤相同于实施例1。
对d-二聚体样本进行检测,所得结果详见图2—2,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围至少可达40mg/l。
实施例2—3
消除钩状效应的d-二聚体试剂盒,包括试剂r1、试剂r2,以及校准品。该校准品可以采用常用市售品。本实施例中,采用市售宁波普瑞柏生物技术股份有限公司的d-二聚体校准品,使用时,校准品中d-二聚体(蛋白基质)浓度分别采用0.00、2.30mg/l、4.10mg/l、7.69mg/l、20.25mg/l、37.65mg/l,校准品中还含有缓冲液100mmol/l。
具体而言:
该试剂r1的组分为:缓冲液10mmol/l、表面活性剂10g/l、防腐剂10g/l、抗d-二聚体抗体50mg/l。其中,缓冲液的ph值为9.0。
该试剂r2的组分为:缓冲液300mmol/l、防腐剂10g/l、助悬剂5g/l、d-二聚体致敏胶乳800ml/l。其中,缓冲液的ph值为7.0。
其中:缓冲液为mops缓冲液、表面活性剂为atlasg-1794(聚氧乙烯蓖麻油,hlb13.3)、防腐剂为proclin300、助悬剂为tween80(聚氧乙烯(20eo)失水山梨醇单油酸酯,hlb值15);d-二聚体致敏胶乳的粒径为300nm;抗d-二聚体抗体为鼠抗人单克隆抗体。
检测方法和操作步骤相同于实施例1。
对d-二聚体样本进行检测,所得结果详见图2—3,结果可以看出,当样本终浓度结果超过50mg/l时,其测定结果不再发生明显的变化,检测范围可达80mg/l。
实施例2—4
消除钩状效应的d-二聚体试剂盒,包括试剂r1、试剂r2,以及校准品。该校准品可以采用常用市售品。本实施例中,采用市售宁波普瑞柏生物技术股份有限公司的d-二聚体校准品,使用时,校准品中d-二聚体(蛋白基质)浓度分别采用0.00、2.30mg/l、4.10mg/l、7.69mg/l、20.25mg/l、37.65mg/l,校准品中还含有缓冲液100mmol/l。
具体而言:
该试剂r1的组分为:缓冲液150mmol/l、表面活性剂3g/l、防腐剂0.5g/l、抗d-二聚体抗体25mg/l。其中,缓冲液的ph值为6.0。
该试剂r2的组分为:缓冲液10mmol/l、防腐剂0.3g/l、助悬剂3g/l、d-二聚体致敏胶乳80ml/l。其中,缓冲液的ph值为7.0。
其中:缓冲液为tea缓冲液、表面活性剂为tween80(聚氧乙烯(20eo)失水山梨醇单油酸酯,hlb值15)、防腐剂为imidazolidinylurea(izu·h2o)、助悬剂为span20(失水山梨醇月桂酸酯,hlb值8.6);d-二聚体致敏胶乳的粒径为150nm;抗d-二聚体抗体为鼠抗人单克隆抗体。
检测方法和操作步骤相同于实施例1。
对d-二聚体样本进行检测,所得结果详见图2—4,结果可以看出,当样本终浓度结果超过25mg/l时,其测定结果不再发生明显的变化,检测范围可达42mg/l。
实施例2—5
消除钩状效应的d-二聚体试剂盒,包括试剂r1、试剂r2,以及校准品。该校准品可以采用常用市售品。本实施例中,采用市售宁波普瑞柏生物技术股份有限公司的d-二聚体校准品,使用时,校准品中d-二聚体(蛋白基质)浓度分别采用0.00、2.30mg/l、4.10mg/l、7.69mg/l、20.25mg/l、37.65mg/l,校准品中还含有缓冲液100mmol/l。
具体而言:
该试剂r1的组分为:缓冲液50mmol/l、表面活性剂9g/l、防腐剂0.2g/l、抗d-二聚体抗体30mg/l。其中,缓冲液的ph值为8.0。
该试剂r2的组分为:缓冲液150mmol/l、防腐剂6g/l、助悬剂0.4g/l、d-二聚体致敏胶乳350ml/l。其中,缓冲液的ph值为6.0。
其中:缓冲液为hepes缓冲液、表面活性剂为3:1的表面活性剂为emal227s(聚氧乙烯十二烷基醚硫酸钠)和thesit(聚多卡醇)的混合物、防腐剂为山梨酸钾、助悬剂为span40(失水山梨醇单棕榈酸酯,hlb值6.7);d-二聚体致敏胶乳的粒径为70nm;抗d-二聚体抗体为兔抗人多克隆抗体。
检测方法和操作步骤相同于实施例1。
对d-二聚体样本进行检测,所得结果详见图2—5,结果可以看出,当样本终浓度结果超过30mg/l时,其测定结果不再发生明显的变化,检测范围可达55mg/l。
实施例2—6
和实施例1的区别仅在于:缓冲液为pipes缓冲液、表面活性剂为2:1的tritonx-405(异辛基苯基聚氧乙烯醚)和thesit(聚多卡醇)的混合物、防腐剂为庆大霉素、助悬剂为span80(失水山梨醇单油酸酯,hlb值4.3)。
对d-二聚体样本进行检测,所得结果详见图2—6,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围可达32mg/l。
实施例2—7
和实施例2的区别仅在于:缓冲液为pbs缓冲液、表面活性剂为4:5的kaoa60(聚氧乙烯基联苯乙烯化苯基醚,hlb12.8)和kaob66(聚氧乙烯基衍生物,hlb13.2)的混合物、助悬剂为tritonx-100(异辛基苯基聚氧乙烯醚)。
对d-二聚体样本进行检测,所得结果详见图2—8,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围可达38mg/l。
效果例1
以市售某d-二聚体试剂盒(以下称为市售试剂盒1)和本发明的实施例2—1至2—7所制备的d-二聚体试剂盒(以下称为本发明试剂盒1—1至1—7)进行比对,结合图2—8所示:
市售试剂盒1的检测范围为:20mg/l;
本发明试剂盒1—1的检测范围为:30mg/l;
本发明试剂盒1—2的检测范围为:40mg/l;
本发明试剂盒1—3的检测范围为:80mg/l;
本发明试剂盒1—4的检测范围为:42mg/l;
本发明试剂盒1—5的检测范围为:55mg/l;
本发明试剂盒1—6的检测范围为:32mg/l;
本发明试剂盒1—7的检测范围为:38mg/l;
说明:本发明的试剂盒检测准确度较高、检测范围较宽。同时,可以直接在全自动生化仪进行使用。
同时,通过图2—1至图2—7可以发现,超过添加的抗体浓度,值不会降低,说明本发明的试剂盒没有钩状效应。
实施例3—1
消除钩状效应的β2-微球蛋白试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,校准品采用市售宁波普瑞柏生物技术股份有限公司的β2-微球蛋白校准品,使用时,校准品中β2-微球蛋白浓度分别采用:1、2.25mg/l;2、4.5mg/l;3、9.0mg/l;4、18.0mg/l,校准品中还含有缓冲液100mmo/l。
具体而言:
该试剂r1的组分为:缓冲液200mmol/l、表面活性剂0.5g/l、防腐剂10.0g/l、抗β2-微球蛋白抗体40mg/l,其中,缓冲液的ph值为5.0。
该试剂r2的组分为:缓冲液10mmol/l、防腐剂0.1g/l,助悬剂5.0g/l,β2-微球蛋白致敏的胶乳颗粒100ml/l,其中,缓冲液的ph值为8.0。
更具体的:
缓冲液为pbs缓冲液、表面活性剂为atlasg-2159(聚氧乙烯单硬脂酸酯,hlb18.8)、防腐剂为kathonlx150、抗体为羊抗人多克隆抗体,助悬剂为span20(失水山梨醇月桂酸酯,hlb值8.6),β2-微球蛋白致敏的胶乳颗粒的粒径为60nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:540nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中β2-微球蛋白的含量。
对β2-微球蛋白样本进行检测,所得结果详见图3—1,结果可以看出,当样本终浓度结果超过40mg/l时,其测定结果不再发生明显的变化,检测范围可达60mg/l。
实施例3—2
消除钩状效应的β2-微球蛋白试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,校准品采用市售宁波普瑞柏生物技术股份有限公司的β2-微球蛋白校准品,使用时,校准品中β2-微球蛋白浓度分别采用:1、2.25mg/l;2、4.5mg/l;3、9.0mg/l;4、18.0mg/l,校准品中还含有缓冲液10mmo/l。
具体而言:
该试剂r1的组分为:缓冲液10mmol/l、表面活性剂3g/l、防腐剂0.1g/l、抗β2-微球蛋白抗体20mg/l,其中,缓冲液的ph值为6.0。
该试剂r2的组分为:缓冲液300mmol/l、防腐剂5g/l,助悬剂0.1g/l,β2-微球蛋白致敏的胶乳颗粒50ml/l,其中,缓冲液的ph值为7.0。
更具体的:
缓冲液为tris缓冲液、表面活性剂为thesit(聚多卡醇)、防腐剂为5-bromo-5-notrp-1,3-dioxane、抗体为羊抗人多克隆抗体,助悬剂为atlasg-2159(聚氧乙烯单硬脂酸酯,hlb18.8),防腐剂为5-bromo-5-notrp-1,3-dioxane、β2-微球蛋白致敏的胶乳颗粒的粒径为200nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:540nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中β2-微球蛋白的含量。
对β2-微球蛋白样本进行检测,所得结果详见图3—2,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围可达45mg/l。
实施例3—3
消除钩状效应的β2-微球蛋白试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,校准品采用市售宁波普瑞柏生物技术股份有限公司的β2-微球蛋白校准品,使用时,校准品中β2-微球蛋白浓度分别采用:1、2.25mg/l;2、4.5mg/l;3、9.0mg/l;4、18.0mg/l,校准品中还含有缓冲液30mmo/l。
具体而言:
该试剂r1的组分为:缓冲液150mmol/l、表面活性剂10g/l、防腐剂0.5g/l、抗β2-微球蛋白抗体15mg/l,其中,缓冲液的ph值为8.0。
该试剂r2的组分为:缓冲液10mmol/l、防腐剂8g/l,助悬剂4g/l,β2-微球蛋白致敏的胶乳颗粒500ml/l,其中,缓冲液的ph值为6.0。
更具体的:
r1的缓冲液为mops缓冲液、表面活性剂为atlasg-1794(聚氧乙烯蓖麻油,hlb13.3)、防腐剂为proclin300、抗体为羊抗人多克隆抗体;
r2的缓冲液为hepes缓冲液,助悬剂为span40(失水山梨醇单棕榈酸酯,hlb值6.7),防腐剂为proclin300,β2-微球蛋白致敏的胶乳颗粒的粒径为300nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:540nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中β2-微球蛋白的含量。
对β2-微球蛋白样本进行检测,所得结果详见图3—3,结果可以看出,当样本终浓度结果超过15mg/l时,其测定结果不再发生明显的变化,检测范围可达36mg/l。
实施例3—4
消除钩状效应的β2-微球蛋白试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,校准品采用市售宁波普瑞柏生物技术股份有限公司的β2-微球蛋白校准品,使用时,校准品中β2-微球蛋白浓度分别采用:1、2.25mg/l;2、4.5mg/l;3、9.0mg/l;4、18.0mg/l,校准品中还含有缓冲液70mmo/l。
具体而言:
该试剂r1的组分为:缓冲液300mmol/l、表面活性剂5g/l、防腐剂5g/l、抗β2-微球蛋白抗体30mg/l,其中,缓冲液的ph值为9.0。
该试剂r2的组分为:缓冲液200mmol/l、防腐剂10g/l,助悬剂2g/l,β2-微球蛋白致敏的胶乳颗粒800ml/l,其中,缓冲液的ph值为6.0。
更具体的:
r1缓冲液为tea缓冲液、表面活性剂为kaoa60(聚氧乙烯基联苯乙烯化苯基醚,hlb12.8)、防腐剂为山梨酸钾、抗体为兔抗人多克隆抗体中。
r2缓冲液为hepes缓冲液、防腐剂为山梨酸钾、助悬剂为span80(失水山梨醇单油酸酯,hlb值4.3),β2-微球蛋白致敏的胶乳颗粒的粒径为110nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:540nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中β2-微球蛋白的含量。
对β2-微球蛋白样本进行检测,所得结果详见图3—4,结果可以看出,当样本终浓度结果超过30mg/l时,其测定结果不再发生明显的变化,检测范围可达65mg/l。
实施例3—5
与实施例1的区别仅在于:缓冲液为hepes缓冲液、表面活性剂为tween80(聚氧乙烯(20eo)失水山梨醇单油酸酯,hlb值15)、防腐剂为山梨酸钾、助悬剂为span40(失水山梨醇单棕榈酸酯,hlb值6.7)。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:540nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中β2-微球蛋白的含量。
对β2-微球蛋白样本进行检测,所得结果详见图3—5,结果可以看出,当样本终浓度结果超过40mg/l时,其测定结果不再发生明显的变化,检测范围可达65mg/l。
实施例3—6
与实施例2的区别仅在于:缓冲液为pipes缓冲液、表面活性剂为emal20c(聚氧乙烯十二烷基醚硫酸钠)、腐剂为庆大霉素、助悬剂为3:5的span80(失水山梨醇单油酸酯,hlb值4.3)和tritonx-100(异辛基苯基聚氧乙烯醚)。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:540nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中β2-微球蛋白的含量。
对β2-微球蛋白样本进行检测,所得结果详见图3—6,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围可达40mg/l。
实施例3—7
与实施例3的区别仅在于:缓冲液为pbs缓冲液、表面活性剂为emal227s(聚氧乙烯十二烷基醚硫酸钠)。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:540nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中β2-微球蛋白的含量。
对β2-微球蛋白样本进行检测,所得结果详见图3—7,结果可以看出,当样本终浓度结果超过15mg/l时,其测定结果不再发生明显的变化,检测范围可达32mg/l。
效果例2
以市售某β2-微球蛋白试剂盒(以下称为市售试剂盒2)和本发明的实施例3—1至3—7所制备的β2-微球蛋白试剂盒(以下称为本发明试剂盒2—1至2—7)进行比对,结合图3—8所示:
市售试剂盒2的检测范围为:18mg/l;
本发明试剂盒2—1的检测范围为:60mg/l;
本发明试剂盒2—2的检测范围为:45mg/l;
本发明试剂盒2—3的检测范围为:36mg/l;
本发明试剂盒2—4的检测范围为:65mg/l;
本发明试剂盒2—5的检测范围为:65mg/l;
本发明试剂盒2—6的检测范围为:40mg/l;
本发明试剂盒2—7的检测范围为:32mg/l;
说明:本发明的试剂盒检测准确度较高、检测范围较宽。同时,可以直接在全自动生化仪进行使用。
同时,通过图3—1至3—7可以发现,超过添加的抗体浓度,值不会降低,说明本发明的试剂盒没有钩状效应。
实施例4—1
消除钩状效应的胱抑素c试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,采用市售校准品采用宁波普瑞柏生物技术股份有限公司的胱抑素c校准品,使用时,校准品中胱抑素c浓度分别采用:0.0、0.5mg/l、1.0mg/l、2.0mg/l、4.0mg/l、8.0mg/l,校准品中还含有缓冲液10mmol/l。
具体而言:
该试剂r1的组分为:缓冲液150mmol/l、表面活性剂5g/l、防腐剂10.0g/l、抗胱抑素c抗体10mg/l,其中,缓冲液的ph值为9.0;
该试剂r2的组分为:缓冲液10mmol/l、防腐剂0.1g/l,助悬剂0.1g/l,胱抑素c致敏胶乳50ml/l,其中,缓冲液的ph值为6.0。
其中:
缓冲液为tris缓冲液、表面活性剂为2:1的tritonx-405(异辛基苯基聚氧乙烯醚)和kaob66(聚氧乙烯基衍生物,hlb13.2)、防腐剂为imidazolidinylurea(izu·h2o)、抗体为羊抗人多克隆抗体、防腐剂为imidazolidinylurea(izu·h2o)、助悬剂为kao20ab,胱抑素c致敏胶乳的粒径为60nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:546nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中胱抑素c的含量。
对胱抑素c样本进行检测,所得结果详见图4—1,结果可以看出,当样本终浓度结果超过10mg/l时,其测定结果不再发生明显的变化,检测范围可达15mg/l。
实施例4—2
消除钩状效应的胱抑素c试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,采用市售校准品采用宁波普瑞柏生物技术股份有限公司的胱抑素c校准品,使用时,校准品中胱抑素c浓度分别采用:0.0、0.5mg/l、1.0mg/l、2.0mg/l、4.0mg/l、8.0mg/l,校准品中还含有缓冲液50mmol/l。
具体而言:
该试剂r1的组分为:缓冲液300mmol/l、表面活性剂10g/l、防腐剂0.1g/l、抗胱抑素c抗体15mg/l,其中,缓冲液的ph值为7.0;
该试剂r2的组分为:缓冲液10mmol/l、防腐剂0.3g/l,助悬剂3g/l,胱抑素c致敏胶乳800ml/l,其中,缓冲液的ph值为8.0。
其中:缓冲液为mes缓冲液、表面活性剂为tritonx-405(异辛基苯基聚氧乙烯醚)、防腐剂为山梨酸钾、抗体为兔抗人多克隆抗体、助悬剂为9:4的span40(失水山梨醇单棕榈酸酯,hlb值6.7)和kao24b(月桂基甜菜碱),胱抑素c致敏胶乳的粒径为220nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:546nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中胱抑素c的含量。
对胱抑素c样本进行检测,所得结果详见图4—2,结果可以看出,当样本终浓度结果超过15mg/l时,其测定结果不再发生明显的变化,检测范围可达30mg/l。
实施例4—3
消除钩状效应的胱抑素c试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,采用市售校准品采用宁波普瑞柏生物技术股份有限公司的胱抑素c校准品,使用时,校准品中胱抑素c浓度分别采用:0.0、0.5mg/l、1.0mg/l、2.0mg/l、4.0mg/l、8.0mg/l,校准品中还含有缓冲液30mmol/l。
具体而言:
该试剂r1的组分为:缓冲液10mmol/l、表面活性剂0.8g/l、防腐剂5g/l、抗胱抑素c抗体20mg/l,其中,缓冲液的ph值为5.0;
该试剂r2的组分为:缓冲液300mmol/l、防腐剂9g/l,助悬剂2g/l,胱抑素c致敏胶乳500ml/l,其中,缓冲液的ph值为7.0。
其中:缓冲液为pipes缓冲液、表面活性剂为thesit(聚多卡醇)、防腐剂为caa、抗体为鼠抗人单克隆抗体、助悬剂为tween80(聚氧乙烯(20eo)失水山梨醇单油酸酯,hlb值15),胱抑素c致敏胶乳的粒径为300nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:546nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中胱抑素c的含量。
对胱抑素c样本进行检测,所得结果详见图4—3,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围可达28mg/l。
实施例4—4
消除钩状效应的胱抑素c试剂盒,包括试剂r1、试剂r2,以及校准品。本实施例中,采用市售校准品采用宁波普瑞柏生物技术股份有限公司的胱抑素c校准品,使用时,校准品中胱抑素c浓度分别采用:0.0、0.5mg/l、1.0mg/l、2.0mg/l、4.0mg/l、8.0mg/l,校准品中还含有缓冲液100mmol/l。
具体而言:
该试剂r1的组分为:缓冲液50mmol/l、表面活性剂0.5g/l、防腐剂2g/l、抗胱抑素c抗体30mg/l,其中,缓冲液的ph值为9.0;
该试剂r2的组分为:缓冲液150mmol/l、防腐剂10g/l,助悬剂5g/l,胱抑素c致敏胶乳100ml/l,其中,缓冲液的ph值为7.0。
其中:缓冲液为tea缓冲液、表面活性剂为10:1的thesit(聚多卡醇)和atlasg-1794(聚氧乙烯蓖麻油,hlb13.3)、防腐剂为imidazolidinylurea(izu·h2o)、抗体为兔抗人多克隆抗体、助悬剂为kao20ab、,胱抑素c致敏胶乳的粒径为160nm。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:546nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中胱抑素c的含量。
对胱抑素c样本进行检测,所得结果详见图4—4,结果可以看出,当样本终浓度结果超过30mg/l时,其测定结果不再发生明显的变化,检测范围可达45mg/l。
实施例4—5
和实施例1的区别仅在于:缓冲液为tris缓冲液、防腐剂为proclin300、助悬剂为3:7的span40(失水山梨醇单棕榈酸酯,hlb值6.7)加kao24b(月桂基甜菜碱)。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:546nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中胱抑素c的含量。
对胱抑素c样本进行检测,所得结果详见图4—5,结果可以看出,当样本终浓度结果超过10mg/l时,其测定结果不再发生明显的变化,检测范围可达20mg/l。
实施例4—6
和实施例2的区别仅在于:缓冲液为hepes缓冲液、表面活性剂为3:1的brij35(聚氧乙烯(20eo)失水山梨醇单油酸酯,hlb16.9)和emal20c(聚氧乙烯十二烷基醚硫酸钠)、防腐剂为kathonlx150。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:546nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中胱抑素c的含量。
对胱抑素c样本进行检测,所得结果详见图4—6,结果可以看出,当样本终浓度结果超过15mg/l时,其测定结果不再发生明显的变化,检测范围可达25mg/l。
实施例4—7
和实施例3的区别仅在于:缓冲液为pbs缓冲液、助悬剂为2:7的kao20ab和span20、防腐剂为山梨酸钾。
制备得到的试剂为液体试剂,可直接在全自动生化仪上使用。按照下述比例,在生化仪上进行设定,即可开始测定样本。参数以日立7180自动生化分析仪为例:
测定方法:二点法;
检测波长:546nm;
反应方向:向下反应;
v样本:vr1:vr2=3μl:240μl:60μl;
定标及校准方式:水与校准品定标后采用spline进行曲线拟合。
操作步骤:
样本和试剂r1混匀后于37℃孵育3-5min,读取第1读数点吸光度a1,随即加入试剂r2,混匀后37℃孵育5min,读取第2读数点吸光度a2。
结果计算:
采用校准品与水(零点)进行定标,将吸光度变化值(a校准-a空白)对其相应浓度做图,绘制定标曲线。根据样品的(a样品-a空白)值在定标曲线上求得样品中胱抑素c的含量。
对胱抑素c样本进行检测,所得结果详见图4—7,结果可以看出,当样本终浓度结果超过20mg/l时,其测定结果不再发生明显的变化,检测范围可达30mg/l。
效果例3
以市售某胱抑素c试剂盒(以下称为市售试剂盒3)和本发明的实施例4—1至4—7所制备的胱抑素c试剂盒(以下称为本发明试剂盒3—1至3—7)进行比对,结合图4—8所示:
市售试剂盒3的检测范围为:8mg/l;
本发明试剂盒3—1的检测范围为:15mg/l;
本发明试剂盒3—2的检测范围为:30mg/l;
本发明试剂盒3—3的检测范围为:28mg/l;
本发明试剂盒3—4的检测范围为:45mg/l;
本发明试剂盒3—5的检测范围为:20mg/l;
本发明试剂盒3—6的检测范围为:25mg/l;
本发明试剂盒3—7的检测范围为:30mg/l;
说明:本发明的试剂盒检测准确度较高、检测范围较宽。同时,可以直接在全自动生化仪进行使用。
同时,通过图4—1至图4—7可以发现,超过添加的抗体浓度,值不会降低,说明本发明的试剂盒没有钩状效应。
综上所述,本发明的消除钩状效应的试剂盒通过在试剂r1中增加被测对象相对应的抗原或抗体,在试剂r2中增加被测对象对应的抗体或抗原致敏的胶乳颗粒,可有效地避免假阴性,当样本中的抗原超出本发明的检测限时,测定结果不会低于线性值,不会造成误判,且可提高抗体含量可提高检测范围。
以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!