用于分子表征的纳米孔匹配的蛋白质穿梭物及其数据分析方法与流程
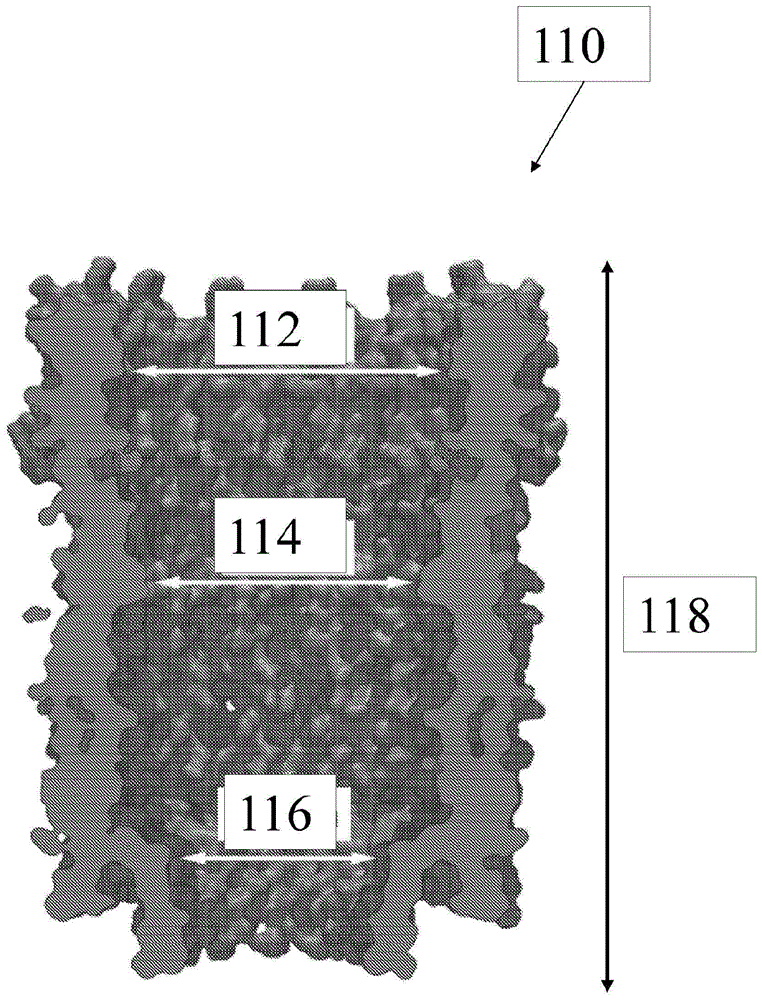
相关申请的交叉引用本申请要求于2017年7月17日提交并且标题为“用于分子表征的纳米孔匹配的蛋白质穿梭物(shuttle)及其数据分析方法”的第62/533,215号美国临时专利申请的优先权和权益,其内容通过引用整体并入本文,如同在本文中完全阐述一样。领域本发明涉及用于表征纳米孔传感器以及用于分析和可视化用所述传感器获得的单分子测量的系统和方法。背景分子可以经由纳米孔捕捉并且进行电监测。特别地,可以诱导通常包括蛋白质分子和与蛋白质分子连接的其他目标分子的蛋白质穿梭物与电压偏置的纳米孔结合。蛋白质穿梭物可以实现对目标分子的监测。然而,由于蛋白质穿梭物中蛋白质分子的复杂的几何结构和电荷结构,分子的基于纳米孔的研究具有挑战性。复杂的结构使得在纳米孔中难以稳定地捕捉蛋白质分子。另外,人工再现的纳米孔和拥有纳米孔的结构通常在纳米孔的尺寸设定,纳米孔与蛋白质分子之间的键的稳定性,噪声特性以及其他化学、机械、电和热约束方面遭遇困难。为了有效地监测纳米孔处的蛋白质分子或其他目标分子,需要系统和方法来诱导和维持分子在纳米孔处的捕捉。还需要有效的分析和可视化技术来分析大量的整体分子事件,以揭示蛋白质穿梭物系统和/或目标分子的动力学。技术实现要素:本公开内容的各种实施例涉及用于表征纳米孔传感器中的穿梭物捕获的方法。所述方法可以包括针对多个不同的偏置电压收集多个时间依赖性电流阻塞特征。然后,所述方法可以包括将所述多个时间依赖性电流阻塞特征分类成永久事件特征和瞬时事件特征。针对所述多个偏置电压中的每一个,可以对于所述瞬时事件特征生成蛋白质动力学景观(pdl)。所述pdl包括阻塞频谱的集合。所述阻塞频谱的集合中的每一个可以包括选择的最大持续时间的瞬时事件的阻塞值的直方图。所述方法可以还包括针对所述多个偏置电压中的每一个,对于所述永久事件特征生成蛋白质动力学景观(pdl)。所述pdl包括阻塞频谱的集合。所述阻塞频谱的集合中的每一个可以包括永久事件的阻塞值的直方图,其中对于每一个永久事件均从事件的开始直到事件开始之后的最大时间获得这些阻塞值。然后,所述方法可以包括基于永久事件特征鉴定永久水平阻塞值。永久阻塞水平是一旦达到,除非例如通过反转施加的电压的极性来使所述穿梭物排出,否则很少会改变的阻塞水平。所述方法还可以包括基于永久事件特征和永久事件的pdl图来鉴定进入水平阻塞值。然后,所述方法可以包括选择与所述瞬时事件特征的pdl对应的所述多个偏置电压中的一个。所述阻塞频谱的集合可以揭示基本上等于所述永久水平阻塞值和/或等于所述进入水平阻塞值的阻塞值处的峰。在一些实例中,所述时间依赖性电流阻塞特征包括在穿梭物捕获事件期间作为时间的函数的纳米孔电流的测量。在一些实例中,所述分类可以包括将显示返回至初始电流水平的所述多个时间依赖性电流阻塞特征中的任意一个鉴定为瞬时事件特征。所述分类可以包括将未显示返回至初始电流水平的所述多个时间依赖性电流阻塞特征中的任意一个鉴定为所述永久事件特征。在一些实例中,所述方法可以还包括针对所述多个偏置电压中的每一个计算永久穿梭物捕获事件的数量与瞬时穿梭物捕获事件的数量的比率。基于计算的比率,所述方法然后可以包括确定阈值偏置电压以实现优选的比率。在一些实例中,所述阻塞频谱可以包括在固定的时间间隔采样以产生直方图数据点的纳米孔电流阻塞数据的平均值。所述固定的时间间隔可以至少与用于对所述纳米孔电流阻塞数据采样的间隔一样长。所述纳米孔电流阻塞数据可以包括从输入电流到所述输入电流的电流变化的比率。在一些实例中,所述鉴定步骤可以包括针对所述多个偏置电压中的至少一个,生成所述永久事件特征的附加pdl。所述鉴定步骤可以还包括选择与低于所述永久阻塞水平的阻塞水平对应的进入水平阻塞值。在一些实例中,所述方法可以还包括将pdl内的所述阻塞频谱的集合中的每一个频谱用高斯分布的总和拟合。可以由所述永久事件的pdl内的所述阻塞频谱的集合中的峰确定所述进入水平阻塞值。在第一实施方案的一些实例中,生成瞬时事件的pdl的特定阻塞频谱中包括的所述事件的所述选择的最大持续时间可以是2毫秒、5毫秒、10毫秒、30毫秒、100毫秒、500毫秒和1000毫秒。在本公开内容的第二实施方案中,可以提供用于表征纳米孔传感器中的穿梭物捕获的方法。首先,所述方法可以包括针对选择的偏置电压收集多个时间依赖性电流阻塞特征。然后,所述方法可以规定基于所述多个时间依赖性电流阻塞特征计算穿梭物捕获事件的持续时间和所述穿梭物捕获事件的阻塞百分比或平均阻塞百分比。然后,所述方法可以规定基于所述多个时间依赖性电流阻塞特征的分布特点来确定阻塞水平。在一些实例中,所述确定步骤可以包括确定所述穿梭物捕获事件的持续时间是否落在预定的最小持续时间至预定的最大持续时间的范围内。所述预定的最小持续时间可以是0毫秒,并且所述预定的最大持续时间可以是2毫秒。在这一类的穿梭物捕获事件的所述阻塞频谱中,这可以提供在40%电流阻塞处的阻塞峰。所述预定的最小持续时间可以是0毫秒,并且所述预定的最大持续时间可以是5毫秒。在所述阻塞频谱中,这可以提供在45%阻塞处和52%阻塞处的附加的阻塞峰。所述预定的最小持续时间可以是0毫秒,并且所述预定的最大持续时间可以是10毫秒。这可以提供在40%阻塞处、45%阻塞处和52%阻塞处的附加的阻塞峰。所述预定的最小持续时间可以是0毫秒,并且所述预定的最大持续时间可以是30毫秒。这可以提供在57%的阻塞水平处的附加的阻塞峰。所述预定的最小持续时间可以是0毫秒,并且所述预定的最大持续时间可以是100毫秒。这可以提供在40%处、45%处、52%处和57%处的阻塞水平。所述预定的最小持续时间可以是0毫秒,并且所述预定的最大持续时间可以是500毫秒。这可以提供在40%处、45%处、52%处和57%处的阻塞水平。所述预定的最小持续时间可以是0毫秒,并且所述预定的最大持续时间可以是1000毫秒。这可以提供在80%处的附加的阻塞水平。在一些实例中,所述方法可以基于所述瞬时事件和永久事件的pdl的比较以及所述瞬时事件和永久事件的pdl内的各个频谱的阻塞峰的存在或不存在中的至少一个来鉴定预期的蛋白质分子取向。在一些实例中,所述确定步骤可以包括如果特定阻塞事件的持续时间大于阈值时间,则将所述特定阻塞事件鉴定为永久的。在一个实现方式中,所述阈值时间可以是大于500毫秒的任意时间值。术语“蛋白质穿梭物”在本文中与术语“分子穿梭物”可互换地使用。在本公开内容中,术语“穿梭物捕获”是指当至少一个分子被捕捉在纳米孔处时。附图简述附图例示出本发明的实施方案,并且连同描述一起用于解释和说明本发明的原理。附图旨在以图解的方式说明示例性实施方案的大多数特征。附图并非旨在描绘实际实施方案的每一个特征以及所描绘的元件的相对尺寸,并且未按比例绘制。图1a示出了示例性clya纳米孔。图1b示出了蛋白质亲和素的第一透视图。图1c示出了蛋白质亲和素的第二透视图。图1d示出了蛋白质亲和素的第三透视图。图1e示出了根据本公开内容的实施方案的被捕捉在clya纳米孔中的示例性亲和素的剖视图。图1f示出了根据本公开内容的实施方案的被捕捉在clya纳米孔中的示例性蛋白质穿梭物的剖视图。图2a示出了根据本公开内容的实施方案的示例性纳米孔传感器系统。图2b示出了根据纳米孔结构的放大的宏观版本,例如用塑料材料中的3d打印的纳米孔来测量对纳米孔电导率的几何贡献的示例性装置。图3a示出了根据本公开内容的实施方案的用于使用纳米孔传感器的示例性方法。图3b示出了根据本公开内容的实施方案的用于捕捉和释放蛋白质穿梭物的示例性方法。图4示出了根据本公开内容的实施方案的示例性靶分子的结构。图5a至图5b示出了根据本公开内容的实施方案的示例性纳米孔和蛋白质分子结构。图6a示出了用于表征纳米孔传感器中的穿梭物捕获的示例性方法。图6b示出了用于确定纳米孔传感器中的至少一个纳米孔的阻塞水平的示例性方法。图7a至图7e示出了根据本公开内容的实施方案的瞬时事件的示例性时间依赖性电流阻塞特征。图8a至图8b示出了根据本公开内容的实施方案的永久事件的示例性时间依赖性电流阻塞特征。图9a至图9d示出了根据本公开内容的实施方案的在瞬时事件与永久事件之间相比的示例性纳米孔电流数据的比较。图10a至图10f示出了根据本公开内容的实施方案的示例性pdl直方图。图11a至图11e显示了根据本公开内容的各种实施方案的各种示例性蛋白质分子取向。图12示出了永久事件与瞬时事件的比例作为电压的函数的x-y图。图13示出了根据本公开内容的示例性实施方案的亲和素与亲和素生物素复合物的电流阻塞的变化的比较。图14a至图14g示出了根据本公开内容的实施方案的pdl直方图的示例性高斯拟合。详述参考附图描述本发明,其中所有附图使用相同的参考数字来表示相似或等同的元件。附图未按比例绘制,并且提供它们仅是为了例示本发明。以下参考用于例示的示例性应用来描述本发明的若干方面。应理解,阐述了许多具体细节、关系和方法以提供对本发明的全面理解。然而,相关领域的普通技术人员将容易地认识到,可以在没有一个或多个具体细节的情况下或在使用其他方法的情况下实施本发明。在其他情况下,未详细示出公知的结构或操作,以避免模糊本发明。本发明不受例示的动作或事件的顺序限制,因为某些动作可以以不同的顺序和/或与其他动作或事件同时发生。此外,并非所有例示的动作或事件都是实施根据本发明的方法必需的。本公开内容涉及用于表征纳米孔传感器中的穿梭物捕获事件的方法。首先,方法针对多个不同的偏置电压收集多个时间依赖性电流阻塞特征。这些时间依赖性电流阻塞特征可以显示出具体的穿梭物捕获事件是永久事件还是瞬时事件。然后,方法可以对于瞬时事件特征生成蛋白质动力学景观(pdl)。pdl包括纳米孔电流数据的直方图,并且在穿梭物捕获事件期间表征通过纳米孔的电流。然后,方法可以包括基于永久事件特征来鉴定进入水平阻塞值。这种进入水平阻塞值可以指示当蛋白质穿梭物进入纳米孔时,为了使纳米孔永久地捕获蛋白质穿梭物,蛋白质穿梭物需要具有的最小必要阻塞。然后,这种信息可以用于选择特定的电压以引起那个特定的进入水平阻塞值。因此,本公开内容提供了表征纳米孔传感器的详细的分析方法,包括蛋白质分子的阻塞水平以及传感器如何与不同电压相互作用。所述分析可以指导与纳米孔传感器的相互作用,以选择特定电压,以便获得相应的永久事件捕获与瞬时事件捕获的比率,并且甚至获得蛋白质穿梭物进入纳米孔的某些构型。本公开内容提供了用于通过监测在通过纳米孔的分子运动期间纳米孔的离子电导率来观察和测量单独的带电生物分子在脂质膜中通过电压偏置的纳米孔易位时的系统和方法。这些测量为这些分子的生物物理学及其与纳米孔的相互作用提供了新的见解。当连接至蛋白质穿梭物的dna链作为靶分子时,本公开内容的实施方案可以用于测序dna的实用的便携式仪器中。因此,本公开内容提供了探测与穿梭物连接的目标分子,以及探测与穿梭物连接的目标分子的动力学。图1a示出了具有入口直径112、内部孔腔直径114、出口直径116和长度118的示例性纳米孔110的蛋白质结构。示例性纳米孔110可以包含clya十二聚体。clya是在大肠杆菌(escherichiacoli)和肠道沙门氏菌(salmonellaenterica)的几种致病菌株中表达的成孔细胞溶解毒素。clya具有12个可溶性单体。在到达靶细胞膜时,可溶性单体经历包括一半单体的氨基酸残基的显著的构型变化,并且随后组装成膜结合的低聚体。所得的横跨膜的clya孔形成膜中的纳米尺寸的圆形洞。图1a示出了在clya被配置成孔之后,clya的示例性横截面视图。横截面视图显示了在clya纳米孔形成圆形洞之后,clya纳米孔的12倍旋转对称轴。一旦clya配置成细胞的脂质膜中的孔,脂质膜作为细胞屏障的功能丧失,并且这最终导致细胞死亡。纳米尺寸的圆形洞在本文中被称为纳米孔。clya纳米孔对于纳米孔的不同内部部分可以具有不同的直径。例如,如图1a中所示,纳米孔110的入口直径112可以具有与内部孔腔直径114不同的宽度,并且两者都可以与出口直径116不同。在一些实例中,内部孔腔直径114可以小于入口直径。此外,出口直径116可以小于入口直径112和内部孔腔直径114。通常,内部孔腔直径114沿着孔腔的长度不是恒定的。例如,clya内部孔腔可以为4.1nm的出口直径116至6.5纳米(nm)的入口直径112。另外,示例性内部孔腔直径114可以是5.4nm。clya纳米孔112当配置在脂质膜或其它支撑结构中时可以具有开孔电导率。尽管clya十二聚体在本申请中被示出并且称为示例性纳米孔,但存在许多不同的clya低聚物。也可以使用clya8’聚体、clya13’聚体、clya14’聚体、四聚体clya和其他低聚体。每种低聚形式可以具有不同的直径112、114和116,并且由于其几何尺寸和特定纳米孔中单体的电荷,可以具有独特的开孔电导率。因此,图1a中以及随后在本公开内容中提及的纳米孔的特征不限于特定的clya低聚体或具体限于clya。只要纳米孔可以捕捉包括蛋白质穿梭物的目标分子,可以使用任何纳米孔。图1b至图1d示出了具有第一尺寸122、第二尺寸124、第三尺寸126和第四尺寸128的蛋白质120的各种透视图。例如,图1b示出了第一取向、图1c示出了第二取向,并且图1d示出了第三取向。蛋白质120可以包括市售的亲和素(avidin)(例如皮尔斯亲和素(pierceavidin),thermofisherscientific),并且可以从鸡蛋清中纯化。图1b至图1d示出了如何亲和素通常是糖蛋白四聚体,其进一步包含带状结构的四个β桶123。选择的取向的亲和素可以具有在亲和素的每一个端部处开放的开放的β桶123。亲和素也可以是单体、二聚体和三聚体,并且所有这些形式均可以如本文所述使用。亲和素可以在每个单体中包含一个天冬酰胺糖基化结合位点121。亲和素具有连接至四个结合位点121中的每一个的多糖。除了核glcnac之外,多糖还具有4个至5个甘露糖和2个glcnac。亲和素在ph为7.5时具有大约7个正电荷的电荷。在其他实现方式中,可以使用去糖基的亲和素。亲和素的正电荷允许亲和素与带负电荷的分子结合。另外,蛋白质分子120的尺寸122、124、126和128可以配对以匹配纳米孔的内径,使得蛋白质分子120可以配合在纳米孔内。例如,第一尺寸122可以是6.8nm,第二尺寸124可以是5.5nm,第三尺寸126可以是6.7nm,并且第四尺寸128可以是7.1nm。尽管为了本申请的目的,亲和素被称为示例性蛋白质分子,但可以使用任何蛋白质分子,只要蛋白质分子可以连接至纳米孔并且阻塞至少一些通过纳米孔的电流。图1e是图1a的纳米孔110的横截面示意图,其中蛋白质120位于纳米孔110中。在各种实施方案中,蛋白质的横截面范围可以大于纳米孔的最小内径;即,蛋白质横截面范围至少与沿着纳米孔长度的最小纳米孔直径一样大。此外,蛋白质的横截面范围也可以大于沿着纳米孔长度除了最小内径的位点的其他位点处的内部纳米孔直径的范围。例如,参考图1c,蛋白质亲和素的横截面范围大于4.1nm的最小clya内径和具有5.4nm的内径的clya纳米孔的中截面直径。即使具有这种较大的径向直径,示例性蛋白质120可以借助于例如蛋白质120的结构中的机械柔性进入纳米孔110。此外,纳米孔110的一个端部或两个端部可以具有大于蛋白质120的范围的内径,从而如果蛋白质120不能以其他方式进入纳米孔110,则能够使蛋白质120至少部分地进入纳米孔110。使用这种布置,蛋白质120可以进入纳米孔110并且在沿着纳米孔110的长度的一个或多个位点处紧密地配合在纳米孔110内。这导致纳米孔110与蛋白质120之间的匹配,例如clya纳米孔与亲和素的情况。在一些实例中,亲和素可以用于构建可以被clya十二聚体纳米孔捕捉的蛋白质穿梭物。对于蛋白质穿梭物,亲和素可以被构造成进入纳米孔110的蛋白质120,如图1e所示。蛋白质穿梭物可以具有连接至蛋白质穿梭物的其他分子,如参考图1f进一步所示。再参考图1e,蛋白质120的横截面范围在尺寸上与纳米孔110的内部孔腔直径基本类似。例如,横截面范围可以是5.5nm,内部孔腔直径可以是5.4nm。亲和素-clya是示例性的蛋白质-纳米孔对,其显示出径向几何结构,其中蛋白质120具有至少约为纳米孔110的直径或略大于纳米孔110的直径的横截面范围,所述纳米孔110的直径是沿着纳米孔长度的一个或多个位点处的纳米孔110的直径。此外,clya纳米孔包括6.5nm的入口直径,其大于至少亲和素蛋白质的横截面范围,由此亲和素蛋白质可以进入clya纳米孔,并且然后沿着纳米孔长度紧密地配合在纳米孔内的位点处。另外,纳米孔110的内部孔腔直径可以阻止蛋白质120以某些构型进入纳米孔110。例如,亲和素可以定向,使得第四尺寸128(7.8nm)进入纳米孔110的入口。亲和素的第四尺寸远大于图1a的clya入口直径114(6.5nm)。如果亲和素以其中第四尺寸128沿入口直径114延伸的取向进入clya纳米孔,则亲和素不会完全进入clya纳米孔。因此,图1e示出了纳米孔直径与蛋白质横截面范围之间的尺寸匹配如何使得能够以特定的取向和/或在纳米孔的位置处或纳米孔中的位置处进行对接。此外,或作为替代,纳米孔孔腔中和/或蛋白质上的电荷使得能够以特定的取向和/或在纳米孔的位置处或纳米孔中的位置处(未示出)进行对接。亲和素在clya12纳米孔中的配合是紧密配合并且可以产生稳定的键。稳定的键使得能够研究与亲和素连接的任何靶分子。图1e示出了蛋白质亲和素和十二聚clya12纳米孔的具有尺寸的分子模型。对于各种明确限定的亲和素取向和沿着clya12纳米孔的长度的不同点,本申请采用亲和素的横截面范围与clya12纳米孔内部孔腔直径之间的这种紧密匹配。因此,这种对是作为用于如本文提供的纳米孔匹配的蛋白质穿梭物的布置的具体可行的实施方案。在一些情况下,deglycolitaed亲和素可以用作蛋白质穿梭物。尽管在本申请中讨论了亲和素与clya纳米孔,但可以使用任何其他的蛋白质穿梭物和纳米孔的组合,其中蛋白质穿梭物的横截面范围为至少约纳米孔的内部孔腔的最小直径的范围。在一个实例中,纳米孔孔腔的最小直径不大于配合在纳米孔孔腔中的蛋白质穿梭物的横截面范围。在另一个实现方式中,也可以使用尺寸小于孔腔直径的蛋白质穿梭物,只要最小的孔腔直径小于蛋白质穿梭物的横截面范围,并且只要蛋白质穿梭物可以稳定地捕捉在特定的位置处并且具有相对于纳米孔的特定的取向即可。图1f是纳米孔110和蛋白质分子120的横截面示意图,所述蛋白质分子120包括通过初级连接物140和次级连接物150附接至纳米孔110中的蛋白质分子120的靶分子160,所述初级连接物140和次级连接物150连接在靶分子160与纳米孔110中的蛋白质分子120之间。这种蛋白质穿梭物能够通过利用蛋白质分子120将靶分子160牵引至纳米孔110和/或至少部分地牵引进入纳米孔110中进行靶分子160的基于纳米孔的研究。如图1f中所示,蛋白质穿梭物可以具有更多或更少的组分,只要蛋白质穿梭物具有蛋白质分子120即可。初级连接物140可以将蛋白质分子120连接至次级连接物150。初级连接物140也可以将次级连接物150连接至靶分子160。在一些实例中,可以存在与初级连接物140、次级连接物种150、初级连接物种140和另一个蛋白质分子120连接的蛋白质分子120的多个链。然而,不需要多于一个的蛋白质分子120。在一些实例中,蛋白质分子120可以带正电荷并且构造成连接至带负电荷的纳米孔110。例如,clya沿内环带负电荷。如以下进一步讨论,通过用控制电压将蛋白质120从纳米孔110中确定性地清除,经判断选择的蛋白质-孔对可以用作蛋白质120的研究平台。返回参考图1f,还可以研究宽范围的靶分子160及其与溶液中分析物的相互作用(未示出)。通过初级连接物140或次级连接物150连接至蛋白质穿梭物上的靶分子160可以借助于它们与蛋白质穿梭物的连接被牵引至纳米孔110并且在纳米孔110处被研究。如上所解释,蛋白质穿梭物可以与特定纳米孔110的大小相匹配。可以利用蛋白质穿梭物的性质(例如电荷)将蛋白质穿梭物吸引至纳米孔110。具有匹配的蛋白质穿梭物的纳米孔能够研究蛋白质穿梭物和靶分子160。其他分子可以连接至蛋白质穿梭物或可以与靶分子反应或在靶分子处反应,并且这些分子也可以经由纳米孔110研究。例如,由于蛋白质分子120与纳米孔110之间的牢固连接,可以研究由靶分子160催化的反应的底物和产物。蛋白质穿梭物可以具有一个或多个特征,这些特征使得蛋白质分子120能够与靶分子160一起被驱动至纳米孔110和/或至少部分地被驱动进入选择的纳米孔110中。例如,蛋白质亲和素在大多数靶分子蛋白质的天然环境的ph下具有大量的正电荷。因此,为了研究靶分子蛋白质,亲和素可以被电泳、电渗或以其他方式被电吸引并且被牵引进入纳米孔110中,其中靶分子160以分子穿梭物构型连接至亲和素用于研究纳米孔110处的靶分子160。在本公开内容的一些实例中,蛋白质分子120可以是亲和素,并且初级连接物140可以是生物素。图1b至图1c显示亲和素的每一个β桶123在一个端部处是开口的。这允许初级连接物140进入并且结合β桶123内的残基。返回参考图1f,生物素可以是被构造成与亲和素的β桶123内的残基结合的示例性连接物。生物素与亲和素的结合表示在自然界中发现的最强的非共价配体键,其中解离常数为10m至15m。可以利用蛋白质亲和素与其配体生物素之间的强键合使得通过与亲和素键合的生物素将连接物连接至亲和素,从而靶分子160可以与次级连接物150一起构造成分子穿梭物布置,用于研究纳米孔110处的靶分子160。生物素对亲和素具有强并且特异性的亲和力。生物素可以结合在亲和素的生物素结合口袋中。亲和素在每个单体具有一个结合口袋。由于亲和素是四聚体,每个亲和素存在四个结合口袋。连接物140可以包括在一个位置处具有生物素的分子。例如,连接物140可以是具有多个聚乙二醇(peg)单元以调节长度的直链分子。生物素可以在一个端部处而马来酰亚胺可以在另一个端部处。例如,生物素可以在一个端部上与亲和素结合。马来酰亚胺可以在另一个端部处与靶分子160上的天然存在的或工程化的半胱氨酸残基结合。可以不需要次级连接物。次级连接物150可以提供为,例如聚合物分子、蛋白质、dna、cas9、赖氨酸、肽或可以附接至靶分子160的其他合适的物质。次级连接物150通过与亲和素和次级连接物键合的生物素来连接至亲和素。次级连接物150的生物素化由此使得亲和素-生物素复合物与次级连接物150之间能够形成强键。次级连接物150与靶分子160的连接提供了用于通过纳米孔110研究靶分子160的亲和素-生物素-连接物-靶分子布置。在一些实例中,靶分子160可以包含dna序列、rna序列、cas9或用于研究的任何其他分子。在一些实例中,可以存在多于一个的靶分子160。在一些实例中,靶分子160可以是穿梭物的任何部分,包括蛋白质分子120或初级连接物140或次级连接物150。例如,根据本公开内容的实施方案,蛋白质穿梭物可以用于使cas9穿梭。cas9可以被引入到初级连接子和/或次级连接子,并且然后引入到亲和素,并且随后被纳米孔捕获。一旦cas9被捕获,它就可以用于进行crispr分析。蛋白质穿梭物可以包括许多初级连接物140和次级连接物150,它们本身是蛋白质,例如中性亲和素、链霉亲和素,或其他合适的物质,它们可以被利用来使附接的靶分子160确定性地取向。在一些实例中,靶分子160可以包含dna序列、rna序列、cas9或用于研究的任何其他分子。在一些实例中,可以存在多于一个的靶分子160。在一些实例中,靶分子160可以是穿梭物的任何部分,包括蛋白质分子120或初级连接物140或次级连接物150。考虑到当穿梭物(例如亲和素)以其稳定的捕捉状态(对接状态)被捕获时穿梭物(例如亲和素)在纳米孔中的确定的取向,如果与靶蛋白质的连接点是已知的(例如当胱氨酸在特定的残基位置被工程化至靶蛋白质中时)并且为了所述靶分子适当地选择连接子的长度,靶分子160的取向也将是确定的。在一些实例中,初级连接物140和/或次级连接物150可以在纳米孔110中具有形状配合布置。因此,初级连接物140和/或次级连接物150可以使蛋白质穿梭物以延伸至靶分子160的确定性布置在纳米孔110中取向。由此,以相对于纳米孔110的确定的方向提供靶分子160。在这样的一个实例中,考虑到例如针对生物素的四个结合位点,对于四聚体亲和素,使用一个至四个的亲和素连接子。在这种蛋白质穿梭物布置中,物质中的仅一种(例如前导亲和素)需要提供能够将穿梭物驱动至纳米孔110的性质。例如,只有前导亲和素需要带电荷以能够现实穿梭物的电泳或电渗驱动。连接的亲和素物质可以是中性亲和素或链霉亲和素。可以使用其他蛋白质和其他连接物。对于以上描述的任何蛋白质穿梭物布置,可以使任何合适的靶分子160穿梭,包括psii分子。psii是催化水分子分裂的酶,每两个水分子分裂成四个质子、四个电子和一个氧分子。可以研究四步催化过程期间的构象动力学和变化。所述过程由阳光(光子)驱动,因此在这种情况下,用于酶促过程的试剂(底物)是两个水分子和4个光子,并且产物是四个质子、四个电子和一个氧分子。穿梭蛋白质可以稳定地与靶分子160连接。连接物140可以对蛋白质分子120和靶分子160上的特定位置是特异性的。连接物140可以具有可变的长度以匹配特定靶分子的需要。例如,对于peg单元,连接物140的长度用生物素与马来酰亚胺之间的peg单元的数量来调整。蛋白质分子120可以连接至广泛种类的重要的靶分子160。蛋白质(包括酶)可以作为靶分子160与适当的连接子(例如生物素-peg单元-马来酰亚胺连接子)连接。任何合适的分子可以作为靶分子进行研究。图2a示出了根据本公开内容的实施方案的示例性纳米孔传感器系统200a。纳米孔传感器系统200a可以包括第一电极210a、第二电极210b、第一流体室212、第二流体室214、蛋白质分子216、纳米孔218、支撑结构220、电流222、电流传感器224、连接物226、靶分子228和生物素230。尽管在图2a中未示出,但系统200a可以包括冲洗系统,由此分子可以根据需要与第一流体室和第二流体室分开冲洗。在一些情况下,这种系统也可以用于将分子注入第一流体室和/或第二流体室中。第一电极210a可以设置在第一流体室212中。第二电极210b可以设置在第二流体室214中。电极210a、电极210b可以被配置成在室212、电极214之间施加电压。流体室212、流体室214可以在其中具有流体。例如,第二流体室214可以具有相对于第一流体室212中的流体带负电压的流体。支撑结构220可以包括脂质双层或被配置成引起室212、室214流体分离的其他材料。施加的偏置电压极性可以产生电流222,所述电流222可以基于选择的蛋白质216的电荷来设置,以使蛋白质从其中一个室被电驱动进入纳米孔218中。例如,为了将亲和素牵引进入纳米孔中,第二流体室214相对于第一流体室212保持在负电压下,并且在第一流体室212中提供亲和素。因此,蛋白质穿梭物216的特性(例如电荷和/或电偶极矩)能够实现蛋白质穿梭物216的电压控制的对接、去对接、捕获和去捕获。在正好将带电蛋白质216(例如,亲和素,更一般地不含靶蛋白质的穿梭物)对接在孔中或孔处之后,可能存在通过孔的非零残余电流,并且残余电流应该具有低噪声背景。例如,1khz带宽的均方根电流噪声可以是残余电流的10%或更少。亲和素二聚体或亲和素单体也可以用作与纳米孔组合的穿梭物,例如,纳米孔可以是clya或耻垢分枝杆菌(mycobacteriumsmegmatis)孔蛋白a(mspa)。转到系统200a的其他细节,可以以任何合适的方式在支撑结构220中提供纳米孔218。例如,可以通过将clya添加至系统200a的第一流体室212中在脂质双层中提供clya纳米孔。如200a中所示,当单一一个clya纳米孔自身插入膜中时,则在200a的电流传感器224中测量的离子电流222由于离子电流流经在两个室的溶液之间的纳米孔而增加。一旦纳米孔218在支撑结构220中就位,蛋白质216或基于蛋白质的分子穿梭物可以被电泳或以其他方式驱动进入纳米孔218中。在这一步骤之前,可以从第一流体室212冲洗保持在溶液中的纳米孔。在本公开内容的一些实例中,纳米孔传感器系统200a可以包括特定的组件。支撑结构220可以是悬浮跨过电解缓冲溶液(150mmnacl、15mmtrisph7.5)中的40微米铁氟龙框架的脂质双层膜。可以将银/氯化银电极210a、210b放置在每一个贮存器中,并且可以跨过膜施加几十mv的电流222。所述膜电隔离两个贮存器,并且最初没有电流222在电极210a与电极210b之间流动。可以将预先形成的clya孔添加至第一流体室212中,并且当单个孔110插入膜中时(在电流阶跃变化至稳定的开孔电流时观察),立即用缓冲电解质溶液冲洗第一流体室212以防止附加的clya孔插入膜中。一旦单个孔在膜中就位,可以将10pmol的亲和素添加至第一流体室212中。当单独的带正电荷的亲和素分子被纳米孔218捕捉并且随后从纳米孔218中逃逸或排出时,电流222被瞬时阻塞。在蛋白质216插入第一流体室212之前,可以测量和分析通过单独的电压偏置的纳米孔218的离子电导率。对于示例性clya纳米孔,发现在30mv偏压下测量的1.66ns的电导率是常见的,并且可以用于亲和素的捕获。具有在该值的一定百分比内的电导率的clya纳米孔是在插入膜中时观察到的最常见的纳米孔,并且随时间是最稳定的。在用于驱动蛋白质进入纳米孔的方法的一个实例中,亲和素被插入在clya纳米孔中。例如,在将10pmol(1微升体积)的亲和素添加至200a的250微升的第一流体室212中(其中1.66nsclya纳米孔位于脂质双层上)后,观察到当单独的亲和素蛋白质分子被纳米孔218捕获并且从纳米孔218中逃逸时,通过-35mv电压-偏置的纳米孔的电流从约58pa的开通(open)-纳米孔值瞬时下降。在一些情况下,可以观察到亲和素在clya中的永久捕捉状态:这可以被称为穿梭蛋白质亲和素在clya中的对接状态。为了测量电流222,可以采用任意合适的电流传感器224,例如,moleculardevicesaxopatch膜片钳放大器。输出信号可以被处理,例如,通过10khz、4极点贝塞尔(bessel)滤波器,以最小化高频电流噪声,并且然后采样和数字化,以及存储用于处理。连接物226可以经由生物素230连接至蛋白质分子216和靶分子228。靶分子228可以是psii靶分子。插入到系统200a中的纳米孔218中的亲和素可以被布置成蛋白质穿梭物,包括一个或多个连接物226和靶分子228。纳米孔系统200a的室212和室214中的蛋白质分子216和靶分子228,亲和素或其他前导蛋白质可以从第一流体室212被牵引至纳米孔218并且被捕捉在纳米孔218中,例如clya纳米孔。也可以在将穿梭物结构单元注入第一流体室或第二流体室中之前预先形成具有蛋白质分子、靶分子和连接子的穿梭物结构。在可替代的配置中,亲和素或穿梭物的其他前导结构被设置在两个流体室中的一个(例如,第一流体室212)中,并且靶分子被设置在两个流体室的另一个(例如,第二流体室214)中。在此的靶分子228可以例如被连接物226和与靶分子228相对的连接物226的端部处的生物素230生物素化。目标分子228可以从第二流体室214到达纳米孔218,并且通过纳米孔至第二流体室214的出口连接至已经被捕捉在纳米孔218中的蛋白质216。在这种连接发生之后,可以调节用于将蛋白质216驱动至纳米孔218的电压或其他刺激,例如,以减轻蛋白质216的捕捉、将蛋白质216牵引回第一流体室212,并且由此经由附接在蛋白质216与靶分子228之间的连接物226将靶分子228从第二流体室214进一步拉至纳米孔218。因此,可以提供系统200a用于电泳驱动和捕获亲和素216,以及相应地将包括亲和素-生物素+连接物+靶分子布置的分子穿梭物捕获进入纳米孔218中。提供系统200a用于确定性控制经由生物素230和连接物226附接至靶分子228的亲和素蛋白质穿梭物,在此是psii光合成酶,用于psii靶分子228朝向以及至少部分进入纳米孔的可控方向和取向。蛋白质分子216可以被捕捉在纳米孔218中,并且靶分子228可以部分地从第一流体室212进入纳米孔218。蛋白质分子216被纳米孔218以对接状态捕获并且靶分子连接至蛋白质分子可以被认为是阻塞事件。在这种情况下的电流信号与当仅对接蛋白质分子216时的电流信号的变化(当在两种情况下在流体室之间施加相同的施加电压时)是目标电流信号,并且含有与用传感器平台感测的靶分子对应的信号。在本公开内容的一些实例中,靶分子228可以设置在第二流体室214中,并且可以被纳米孔218捕获使得靶分子228在阻塞事件期间至少部分地阻塞至少一个纳米孔(未示出)。图2a示出了纳米孔系统200a,其中设置在第一流体室212中的蛋白质216(例如亲和素)可以被电泳、电渗或以其他方式驱动至纳米孔218,至少部分地被带入纳米孔218中,在纳米孔218中保持选定的持续时间,并且然后随后从纳米孔218中释放返回第一流体室212中。然后可以将释放的蛋白质216重新牵引并且重新捕捉在纳米孔218中。可替代地,可以将来自第一流体室212或来自第二流体室214的不同蛋白质驱动至纳米孔218以进行捕捉。当被布置在分子穿梭物中时,亲和素由此可以作为推动穿梭物朝向、进入和离开纳米孔218的发动机进行控制。由此,与蛋白质216连接的靶分子228可以在纳米孔218处被捕获持续一段受控的捕获时间,以使得即使在单分子水平上也能够评估连接的靶分子228。根据靶分子228的大小,可以用亲和素将靶分子228完全拉入纳米孔218中,或者本文所示,可以部分地拉入纳米孔218中。可替代地,靶分子228可以被拉至纳米孔218的入口。对本文提供的亲和素-clya纳米孔平台以及生物素-亲和素-clya系统的无扰的电子性质的理解能够实现此类靶分子捕获和评估。匹配的一对纳米孔和带电荷的蛋白质穿梭物可以导致穿梭蛋白质以特定且可重复的取向对接在纳米孔处或纳米孔中。例如,clya十二聚体可以与亲和素四聚体匹配。这种组合对于宽范围的ph值是理想的。形状配合可以用于确保带电荷的蛋白质穿梭物在孔中特定位置处对接并且具有相对于孔的特定取向。例如,可以使亲和素以导致通过纳米孔的电流阻塞的特定取向对接。施加的电压可以导致蛋白质穿梭物受控地对接和去对接。图2a展示了蛋白质穿梭物的操作,在此,穿梭物包括亲和素-生物素+连接物+靶分子布置,用于可控地将靶分子引导至并且可能地进入纳米孔。系统200a允许在纳米孔中或在纳米孔处捕捉具有低净电荷或无净电荷的目标分子,并且允许捕捉相对于纳米孔具有受控的取向的目标分子。图2b示出了根据本公开内容的实施方案的用于测量纳米孔电导率的示例性宏观纳米孔传感器装置200b。图2b包括许多与图2a相同的组件,并且还包括电压表232和变压器234。因此,纳米孔传感器装置200b可以测量通过第一流体室212与第二流体室214之间的纳米孔218的离子电流。例如,可以将宏观纳米孔218胶合在薄的绝缘塑料片中以模拟脂质膜。所述片可以分隔两个150mmnacl水溶液的贮存器,并且在每一个贮存器中,11.4cm的半径的半球形电极210a和半球形电极210b围绕孔。可以用10至50伏特均方根的60hzac电压对宏观孔系统200b进行电导率测量。电导率可以从i-v图的线性斜率计算。在观察的电流与施加的电压之间不应观察到相移。可以监测电解质的温度,并且可以将测量限制在持续几秒钟以最小化电解质焦耳加热。将测量的电导率值缩放3/107获得2.87ns的纳米孔218的几何电导率。测量的几何孔电导率的倒数是单独的孔的电导率倒数和通路电阻的总和。通路电阻校正至无限电极半径可以使总电阻增加1.57%。通过排除氯离子对孔电导率的贡献的部分,这种测量并且缩放的电导率值将显著减小。为了评估减小因子,1.66nsclya纳米孔可以被捕获在两侧具有150mm缓冲盐溶液的脂质双层膜中。第一流体室212可以用20mm缓冲盐溶液再填充。这可以产生跨过纳米孔218的26mv的可测量的开路电位,这是由于在漂移扩散过程中钠离子与氯离子跨过孔的不相等转移。来自离子通道生物物理学的戈德曼-霍奇金-卡茨(goldman-hodgkin-katz,ghk)通量方程可以分析测量的跨过孔的开路电势。ghk方程可以计算出反映氯离子相对于钠离子被阻塞穿过纳米孔218的程度的渗透因子。靠近出口孔的孔腔中的负电荷可以排斥nacl盐溶液中的负氯离子,并且导致穿过孔的氯离子的迁移率和扩散常数降低。通过施加跨过孔的盐梯度,迁移率和扩散常数的这种差异可以导致跨过孔的电压增加。通过在稳态下(即,当没有电流通过孔时)测量该电压,ghk方程可以推导出氯离子和钠离子的迁移率的比率,并且由此推导出通过孔的氯离子的相对电荷排阻。ghk计算得到0.22的渗透因子,其小于在较高摩尔浓度下获得的0.33。由于在较低离子强度下较大的德拜屏蔽长度,在宏观装置200b中应预期较大的氯离子阻塞效应。获得的渗透因子从几何孔电导率值降低了纳米孔电导率。这种分析可以帮助预测在图2a中显示的系统的条件下clya12孔电导率,其中孔电导率因此应为1.75ns。简单的缩放参数表明,对于其他可能的低聚物候选物(稍大的13’聚体)的电导预期值将是1.97ns,这将其排除。较高的电导率表明纳米孔不适合蛋白质分子。例如,13’聚体孔的较大尺寸(直径)不再使其成为亲和素的形状配合的孔,因此亲和素不会在特定位置和以特定的取向对接在13’聚体孔中。存在少量的具有1.9ns的孔,但这些孔在插入膜220中时有些不稳定。因此,图2b示出了示例性宏观系统200b,其可以鉴定用于适当微观系统(例如,图2a的系统)的约束。图3a示出了根据本公开内容的实施方案的使用纳米孔传感器的示例性方法300a。示例性方法300a可以使用如参考图2a至图2b所述的纳米孔传感器。方法300a可以提供分析在一个或多个纳米孔中和/或处的分子捕捉的方法。所述方法可以通过施加跨过一个或多个纳米孔的电压在步骤310开始。电压可以将至少一个蛋白质穿梭物牵引向一个或多个纳米孔中的至少一个。蛋白质穿梭物可以包含带电荷的蛋白质分子。在一些情况下,蛋白质穿梭物可以还包含一个或多个连接物和靶分子。当施加电压时,方法可以规定在步骤312中测量通过一个或多个纳米孔中的至少一个的离子电流。当测量离子电流时,方法还可以规定基于一个或多个纳米孔中的至少一个的离子电流来检测步骤314中的阻塞事件。阻塞事件指示蛋白质穿梭物被一个或多个纳米孔中的至少一个捕获。可以通过总离子电流的变化或者一个或多个纳米孔中的具体一个的离子电流的变化来检测阻塞事件。离子电流的变化可以包括离子电流的降低。在步骤314的一些实例中,所述方法可以任选地包括在阻塞事件发生之后保持电压。在其他实例中,步骤314可以包括在阻塞事件发生之后降低电压。在其他实例中,步骤314可以包括在阻塞事件发生之后增加电压。在其他实例中,314可以包括在阻塞事件发生之后反转电压。在检测到阻塞事件之后,方法300a可以进行至步骤316,其中测量阻塞事件的持续时间。在测量持续时间之后,所述方法可以还包括318确定在阻塞事件期间的平均离子电流。在一些实例中,方法300a可以包括通过反转电压的极性来诱导捕获的蛋白质穿梭物的排出。例如,方法300a可以包括在某一选择的持续时间之后自动反转电压。例如,所述持续时间可以是测量的电流阻塞的1秒。这种电压极性反转将带正电荷的蛋白质从纳米孔中排出。然后可以将偏置电压返回到负值,之后再次观察到开通-纳米孔电流,随后是新的电流阻塞捕获事件。如果将具有连接的靶分子的蛋白质穿梭物最初提供在第一流体室中,则穿梭物和靶分子被送回至第一流体室。在一些情况下,通过在穿梭物被捕捉之后增加电压,即使穿梭物最初从第一流体室进入孔,也可以将穿梭物排出至第二流体室中。这种方法可以用于一个或多个纳米孔、用于一个或多个蛋白质穿梭物和/或用于一个或多个阻塞事件。因此,例如根据图2c中显示的实例,方法300a提供了确定蛋白质穿梭物是否被纳米孔捕捉的手段。图3b示出了根据本公开内容的实施方案的用于捕捉和释放蛋白质穿梭物的示例性方法300b。示例性方法300b包括在步骤322提供纳米孔传感器。纳米孔传感器可以根据参考图2a至图2c讨论的本公开内容的实施方案。返回参考图3b,方法300b可以然后包括在步骤324引入蛋白质穿梭物。蛋白质穿梭物可以是如参考图1f和图2a讨论的蛋白质穿梭物。蛋白质穿梭物可以被引入到纳米孔传感器的第一流体室中。在本公开内容的一些实例中,蛋白质穿梭物可以被引入到纳米孔传感器的第二流体室中。然后,方法300b可以包括在步骤326中施加电压以使蛋白质穿梭物被纳米孔捕捉。在步骤328中,方法可以规定通过反转电压的极性来诱导蛋白质穿梭物从至少一个纳米孔中排出。因此,图3b提供了根据本公开内容的实施方案的用于捕获和释放蛋白质穿梭物的方法300b。图4示出了根据本公开内容的实施方案的示例性靶分子400的结构。示例性靶分子可以包括脂质或清洁剂分子410;β-分泌酶裂解位点420;γ-分泌酶裂解位点430;以及连接子分子440。在一些实例中,靶蛋白质可以是app,一种膜结合蛋白质。β-分泌酶可以结合app蛋白质并且使app蛋白裂解。连接子分子可以连接蛋白质分子,例如亲和素。裂解酶、β-分泌酶和γ-分泌酶可以顺序地结合app蛋白质并且裂解app蛋白质。通过在clya纳米孔中捕捉具有连接的app蛋白质的穿梭物,可以将β-分泌酶和/或γ-分泌酶添加至纳米孔传感器的流体室中。可以监测得到的时间依赖性电流信号以检查与app蛋白质结合并且裂解app蛋白质的酶的动力学。因此,例如,使用这种示例性靶标的系统可以探测纳米孔传感器系统的动力学是否随着旨在抑制β-分泌酶或γ-分泌酶的裂解活性的靶向药物而改变。被β-分泌酶和γ-分泌酶切割的app被认为对于阿尔茨海默氏病是重要的,因为通过这些酶裂解app导致将形成β-淀粉样斑块的裂解片段aβ的形成。app是β-淀粉样前体蛋白质。aβ是淀粉样β-肽。γ-分泌酶包括催化活性γ-分泌酶(例如含有活性γ-分泌酶复合物的ps1)和可溶性γ-分泌酶(例如用清洁剂酶增溶),包括可溶性活性γ-分泌酶。β-分泌酶包括可溶性β-分泌酶。在图4中,连接子被示意性地显示为在一个位置连接至app蛋白质。取决于连接子位置-例如连接子也可以连接至app的相对端-可以对β-分泌酶和/或γ-分泌酶裂解app的最大敏感性选择平台。任何合适的靶分子可以在纳米孔平台上使用蛋白质穿梭物进行研究,例如,具有脂质或清洁剂分子的淀粉样前体蛋白质(app)。图4示出了待探测的靶蛋白质400结构的实例,即在脂质中或具有清洁剂分子的app蛋白质(其是膜结合蛋白质)。这种蛋白质可以与蛋白质穿梭物布置在一起,用于在纳米孔处研究这种蛋白质。例如,可以借助于纳米孔匹配的蛋白质穿梭物来研究切割酶(例如β分泌酶或γ分泌酶)的运作的动力学以及药物靶标对系统的影响,并且穿梭物可以包括如以上所述的任何数量的连接物。图5a至图5b示出了根据本公开内容的实施方案的示例性宏观纳米孔510和蛋白质分子结构520。图5a至图5b示出了3d打印的宏观模型。图5a示出了亲和素-纳米孔结构,其中刚性亲和素分子520位于刚性clya12孔510的顶部,所述刚性clya12孔510定向成在宏观电导率实验中获得10%的最大电流阻塞。图5b示出了被最大程度地压入刚性clya12孔模型510中的弹性亲和素模型520,在宏观电导率实验中实现了20%的阻塞。对于实际的蛋白质和纳米孔尺寸,比例尺对应于3纳米。对于1.66nsclya纳米孔,如果clya低聚物中的原体(protomer)的数量是已知的,以上描述的亲和素-clya相互作用的性质可以在分子水平上理解。为了解决这个问题,实验方法可以确定预期哪种低聚物具有观察到的1.66ns的电导率。存在决定电导率的两种现象。一种仅仅是纳米孔的几何结构。然后,通过在纳米孔的壁上带电氨基酸的存在来改变这种基于几何结构的电导率。事实上,在clya中,已知沿纳米孔长度的最小直径的极限位点具有高负电荷,其可以阻塞通过纳米孔的氯离子传导。几何和电荷选择性效应可以在不同的实验中确定并且组合以预测给定纳米孔的总电导率。为了确定对纳米孔电导率的几何贡献,可以构建选择的纳米孔(例如clya)的模型(例如3d打印的模型),将其以107/3的系数按比例放大至从蛋白质数据库获得的clya纳米孔的原子坐标。用于制备按比例放大的纳米孔的3d打印机是约50微米的分辨率的formlabsform2模型。将分子的尺寸按比例放大来自pdb数据库的107/3的系数。用于刚性模型的塑料是formlabsclear(部件#flpgcl02、部件#flpgcl03)。为了模拟如本文提供的配合在纳米孔510中的蛋白质520,可以用与clya123d打印的纳米孔510使用的相同的比例制备3d打印的亲和素蛋白质520。用于柔性亲和素模型的3d打印塑料是具有80a的肖氏硬度的formlabsflexible(部件#flflgr02)。不管取向如何,3d打印的蛋白质510稍大而不能完全进入3d打印的clya纳米孔孔腔,大部分被亲和素520的外表面上的几个残基阻止进入。在宏观电导率实验中将分子放置在孔510的边缘上(如图3a中所示)仅使电导率降低10%。通过将亲和素520深深地插入图5b中所示的孔的孔腔中,观察到仅20%的电导率降低。在几何学上,蛋白质和/或纳米孔的弹性可以允许蛋白质更深地进入纳米孔,并且在由施加的偏置电压产生的电场提供的力下更紧密地接触。此外,当蛋白质520接近纳米孔510的底部时,纳米孔孔腔中的静电荷可以在短距离处与蛋白质上的静电荷强烈地相互作用。并且,当蛋白质520在纳米孔510中时,电导率的离子电荷选择性效应可能变得更强,也导致更深的电流阻塞。基于这些考虑,因此优选的是,选择的蛋白质520具有径向直径,所述径向直径至少约与其中配合了蛋白质520的纳米孔510的内部孔腔直径相同。参考如以上关于图2a至图2b所述的纳米孔传感器系统讨论图6a至图6b。值得注意地,纳米孔传感器系统应包括至少一个纳米孔和至少一个蛋白质穿梭物。图6a示出了用于表征纳米孔传感器中的穿梭物捕获的示例性方法600a。方法600a可以通过在纳米孔传感器处针对多个不同偏置电压收集时间依赖性的电流阻塞特征在步骤610开始。每一个单个的蛋白质捕获(无论是瞬时的还是永久的)均产生自身独特的、时间依赖性电流阻塞特征,这些特征可以被独特地识别。时间依赖性电流阻塞特征可以包括在穿梭物捕获事件期间作为时间的函数的纳米孔电流的测量。在图7a至图8b中示出了针对于瞬时事件和永久事件的示例性时间依赖性电流阻塞特征。返回参考图6a,所述方法可以然后进行至步骤612并且将时间依赖性电流阻塞特征分类成永久事件和瞬时事件。对于没有显示返回至初始电流水平的多个时间依赖性电流阻塞特征中的任一个可以被鉴定为永久事件(如图8a至图8b中所示)。对于显示返回至初始电流水平的多个时间依赖性电流阻塞特征中的任一个可以被鉴定为瞬时事件(如图7a至图7e中所示)。然后,所述方法规定在步骤614为瞬时事件特征生成蛋白质动力学景观(pdl)。可以为多个偏置电压中的每一个生成这些pdl。pdl包括阻塞频谱的集合。阻塞频谱的集合中的每一个可以包括选择的持续时间的阻塞值的直方图。在一些实例中,阻塞频谱可以包括以固定间隔采样以产生直方图数据点的纳米孔电流数据的平均值。固定间隔的长度可以至少与纳米孔电流数据的采样周期一样长。例如,固定间隔的长度可以是160微秒。纳米孔电流数据可以包括从输入电流到输入电流的电流变化的比率。在一些实例中,特定阻塞频谱的选择的持续时间可以是0秒至2微秒、0秒至5微秒、0秒至10微秒、0秒至30微秒、0秒至100微秒、0秒至500微秒或0秒至1000微秒。参考图10a至图10f进一步讨论pdl图。返回参考图6a,所述方法可以然后进行至步骤616,以基于永久事件特征来鉴定进入水平阻塞值。在一些实例中,鉴定步骤可以包括针对多个偏置电压中的至少一个生成永久事件特征的附加pdl。鉴定步骤还可以包括选择进入水平阻塞值以与附加pdl中的阻塞频谱的集合的阻塞值的通常的低峰对应。可以选择进入水平阻塞以与单个捕捉事件中通常先前的水平对应,并且低于当穿梭蛋白质永久地捕捉在纳米孔中时观察到的阻塞值。然后,所述方法可以包括在步骤618中基于峰阻塞值选择与瞬时事件特征的pdl对应的多个偏置电压中的一个。阻塞频谱的集合可以提供基本上等于进入水平阻塞值的峰阻塞值。pdl由阻塞频谱的集合生成。永久事件的pdl中的不同阻塞频谱可以用包括在流体室之间施加特定电压而记录的所有永久事件生成。对于pdl内的每一个单独的阻塞频谱,从事件开始至最大时间,仅在每一个事件的初始时间周期内由当前数据生成直方图。对于pdl内的不同的单独的阻塞频谱,不同地选择最大时间,例如2毫秒、5毫秒、10毫秒、30毫秒、100毫秒、500毫秒和1000毫秒。pdl包括阻塞频谱的集合。阻塞频谱的集合中的每一个可以包括永久事件的阻塞值的直方图,其中对于从事件的开始直到事件开始之后的最大时间的每一个永久事件获得这些阻塞值。然后,所述方法可以包括基于永久事件特征鉴定永久水平阻塞值。永久阻塞水平是一旦达到,除非例如通过反转所施加的电压的极性来使穿梭物排出,否则很少会改变的阻塞水平。所述方法还可以包括基于永久事件特征和永久事件的pdl图来鉴定进入水平阻塞值。然后,所述方法可以包括选择与瞬时事件特征的pdl对应的多个偏置电压中的一个。阻塞频谱的集合可以揭示基本上等于永久水平阻塞值和/或等于进入水平阻塞值的阻塞值处的峰。在一些实例中,选择进入阻塞水平还可以包括将第一高斯分布(gaussiandistribution)拟合成阻塞频谱的集合中的每一个,并且将第二高斯分布拟合成特定的阻塞频谱。可以从第一高斯分布中减去第二高斯分布,以产生所得的分布。进入水平阻塞值可以根据所得分布的峰来确定。参考图14a至图14g进一步讨论这种方法。返回参考图6a,所述方法可以任选地包括针对多个偏置电压中的每一个计算永久穿梭物捕获事件的数量与瞬时穿梭物捕获事件的数量的比率的附加步骤。基于计算的比率,所述方法然后可以包括确定阈值偏置电压以实现优选的比率。图6b示出了用于确定纳米孔传感器中的至少一个纳米孔的阻塞水平的示例性方法600b。所述方法可以规定在步骤620中首先针对选择的偏置电压收集多个时间依赖性电流阻塞特征。然后,所述方法可以规定在步骤622中计算穿梭物捕获事件的持续时间和穿梭物捕获事件的阻塞百分比。可以基于收集的多个时间依赖性电流阻塞特征计算穿梭物捕获事件的持续时间和阻塞百分比。例如,当蛋白质分子连接时纳米孔电流相对于当没有蛋白质分子连接时纳米孔电流的变化可以鉴定被穿梭物捕获事件阻塞的原始纳米孔电流的百分比。可以由穿梭物捕获事件的时间的长度鉴定持续时间。然后,所述方法可以包括在步骤624基于多个时间依赖性电流阻塞特征的分布特性来确定阻塞水平。在一些实例中,步骤624可以包括确定穿梭物捕获事件的持续时间是否落在预定的最小持续时间与预定的最大持续时间之间的范围内。例如,0毫秒至2毫秒的范围对应于在40%电流阻塞处的阻塞峰;0毫秒至5毫秒的范围对应于在45%和52%电流阻塞处的阻塞峰;0毫秒至10毫秒的范围对应于在40%、45%和52%电流阻塞处的阻塞峰;0毫秒至30毫秒的范围对应于在57%电流阻塞处的阻塞峰;0毫秒至100毫秒的范围对应于在40%、45%、52%和57%电流阻塞处的阻塞峰;0毫秒至500毫秒的范围对应于在40%、45%、52%和57%电流阻塞处的阻塞峰;以及0毫秒至1000毫秒的范围对应于在80%电流阻塞处的阻塞峰。如pdl中鉴定,当仅蛋白质分子被孔捕捉时与当靶分子连接至蛋白质穿梭物并且与孔相连时的阻塞水平是不同的。阻塞水平的差异可以鉴定靶分子被连接。例如,当亲和素被单独地捕捉在clya中时,pdl峰在40%、45%、52%和57%的阻塞水平处,但当靶分子连接至亲和素时,这些峰将改变。在步骤624的一些实例中,确定步骤可以包括:如果特定阻塞事件的时间的长度小于阈值时间段,则将特定阻塞事件鉴定为瞬时的。阈值时间段可以是小于1秒的任意时间段。因此,图6b示出了根据方法600b的实施方案的能力的变化。例如,永久事件的pdl内的不同的各个频谱可以通过从事件开始的时间长度来鉴定。瞬时事件的pdl以及瞬时事件和永久事件的pdl的比较可以鉴定分子或蛋白质穿梭物的各种捕捉状态。pdl还可以确认分子相对于纳米孔的取向。例如,本申请的方法鉴定,当亲和素处于状态ac80时,亲和素具有相对于clya纳米孔的特定取向。永久事件的pdl对于分析连接至蛋白质穿梭物的靶分子尤其相关。当靶分子连接至蛋白质穿梭物时,永久事件pdl将具有pdl的各个光谱中的相应峰的新的阻塞水平值和新的高度。这些峰的高度在pdl内的频谱间变化以揭示连接的靶分子的整体动力学。频谱间的高度变化是连接的靶分子的结果,因为穿梭物分子以永久状态被稳定地捕获。如稍后参考图14a至图14g讨论,可以通过用高斯分布的总和拟合各个频谱来获得峰高度。在一些实例中,方法600b可以基于阻塞水平来鉴定预期的蛋白质分子取向。这将参考图11a至图11e进一步讨论。图7a至图8b示出了1.66nsclya纳米孔中的单个分子捕获事件的集合。图7a至图8b示出了在每一个捕获事件期间观察到的电流i(t)除以测量的开通(open)-纳米孔电流i0的x-y图。出于本公开内容的目的,i0也被称为输入电流。图7a至图7e中绘制的事件示出了增加持续时间的瞬时事件的时间依赖性阻塞。大多数瞬时事件是简单的,仅具有如图7a中的第一事件中的单个阻塞水平。较长的瞬时事件虽然不是最常见的,但表明有时观察到水平之间的过渡。在分析的第一遍步骤中,这些瞬时捕获中的每一个可以由两个数字来表征,即,事件的持续时间以及事件期间的平均"阻塞"。“阻塞”被定义为(i0–i(t))/i0,其在每一个阻塞事件的持续时间上取平均。图8a至图8b示出了用于两个永久捕获的电流轨迹。这些事件中的每一个均具有一个有趣的时间结构。如同大多数永久捕获事件一样,它们从初始的、波动的阻塞开始,随后是深度的和平静的永久阻塞。永久捕获的特征在于在事件的初始部分期间的持续时间和平均阻塞。在一些情况下,针对特定的蛋白质分子-纳米孔组合可以鉴定蛋白质分子的进入水平。例如,当与clya纳米孔相互作用时,亲和素具有进入水平。因此,亲和素具有必须进入纳米孔以便随后进入永久捕捉状态的特定取向。针对穿梭物平台,存在具有明确取向的永久捕捉状态的事实是重要的。所述状态可以用于将其他分子输送至孔中,其中它们可以被稳定地保持在特定的取向用于分析。然后,pdl方法可以用于揭示由此输送至孔中的分析物/靶分子的动力学。在亲和素被捕捉在孔中(即,穿梭物对接在孔中)的这种情况中,提供了稳定的电流背景(其是亲和素的稳定捕捉状态下的低噪声残余电流)。然后可以将这种电流水平的扰动解释为是由于分析物分子及其动力学,所述分析物分子及其动力学是此处的目标分子及动力学。现在可以基于事件的时间依赖性电流或阻塞信号来生成pdl图,其中所述事件的目标电流或阻塞是相对于孔中仅有亲和素的永久水平的电流或阻塞的差。这将参考图13进一步讨论。图9a至图9d示出了反映这种表征的每一个瞬时捕获事件(光点)的这些参数的散点图。每一个光点属于一个蛋白质捕获。如图9a至图9d中所示,随着瞬时捕获事件持续时间从几百微秒增加至几百毫秒,平均阻塞缓慢地增加。这由散点图中的每一个事件上平均的多个离散阻塞水平的存在引起。永久捕获事件在图9a至图9d的散点图中示出为较暗的点。图9a至图9d表明,平均阻塞显然与持续时间无关,并且接近于最长的瞬时事件的阻塞。这表明在捕获至深度永久阻塞水平之前,蛋白质通常经过可变持续时间的中间状态。图9a、图9c和图9d中的圆圈区域示出了数据集合的噪声性质。这些事件具有20-30%的阻塞水平,这低于如果蛋白质穿梭物结合至纳米孔时预期的阻塞水平。因此,圆圈区域中的数据点最可能反映纳米孔结构中的分子波动。在这些情况中的一些情况下,纳米孔系统可以被复位,使得纳米孔返回到其原始构型,具有适当的输入电流。将这些数据点排除在数据分析之外。图10a至图10f示出了根据本公开内容的实施方案的示例性pdl直方图。在图10a至图10f中的蛋白质动力学景观(pdl)图中显著地并且定量地示出了离散的阻塞水平及其时间依赖性群体的存在。这些图可以根据参考图6a讨论的方法生成。在图10a、图10c和图10e中,仅绘制出持续时间小于指定τ瞬时的瞬时事件。确定所有这些事件在每一个阻塞水平花费的时间量(以160微秒为单位),并且生成在每个水平花费的时间直方图。这一直方图可以被称为阻塞频谱。然后,对于一组增加的τ瞬时值,此类阻塞频谱的集合可以被称为蛋白质动力学景观(pdl)。例如,τ瞬时可以是1秒。对于-30mv的固定的偏置电压,获得图10a至图10b的pdl,图10c至图10d具有-35mv的固定的偏置电压,并且图10e至图10f具有-40mv的固定的偏置电压。pdl图揭示了与clya中的亲和素的离散的阻塞水平对应的几个峰。注意,较深的阻塞水平比较浅的水平持续更长的时间。在图10b、图10d和图10f中提供永久捕获事件数据。在这些图中,将所有的永久捕获事件一起考虑,并且每一个直方图是指出现阻塞值直到捕获事件开始τ永久(这是当亲和素首次进入纳米孔时)的累积的时间(以160微秒为单位)。最深的阻塞水平显示为在最长的时间内被最大程度地填充。图10c示出了对于持续2ms或更少的事件,以40%阻塞(亲和素捕获)ac40处为中心的单个峰。图10a和图10e提供了与此类似的-40mv和-30mv的图。当包括较长的事件时(即,当τ瞬时增加时),出现第二峰。通过仔细的拟合,该第二峰以52%阻塞处为中心,并且表示为水平ac52。在10ms时,两个峰具有相等的强度,并且在30ms时,ac52峰主导。对于更长的时间,在57%阻塞处的更大且单独的(ac57)峰主导。图10a示出了持续比1/2秒更长的瞬时事件的几个非常深的捕获。此处在80%处的阻塞水平主导(ac80)。拟合成频谱的高斯清楚地揭示了在45%阻塞处(ac45)的第五个峰,并且在图13b至图13c中进一步示出了拟合。瞬时事件pdl图的动态行为可以与图10b、图10d和图10f的永久事件pdl图相比。在永久事件的前2ms期间,频谱由一个峰ac57主导。ac40峰几乎看不见,并且ac52缺失。频谱在永久事件的前期通常由ac57主导,但稍后(>=100ms)ac80峰主导。以下表2示出了图10a的每一个阻塞频谱的瞬时事件的数量。-30mv处永久事件的总数量为131。τ瞬时2ms5ms10ms30ms100ms500ms1000ms瞬时事件的数量56694312051552178118541861表2:-30mv处瞬时事件的总数量。以下表3示出了图10e的每一个阻塞频谱的瞬时事件的数量。-40mv处永久事件的总数量为139。τ瞬时2ms5ms10ms30ms100ms500ms1000ms瞬时事件的数量20354873889394表3:-40mv处瞬时事件的总数量。因此,图10a至图10f示出了pdl图如何能揭示蛋白质行为的指示。图11a至图11b示出了对应于ac40状态的预期的亲和素取向。图11c示出了对应于ac52状态的预期的亲和素取向。图11d示出了对应于ac57状态的预期的亲和素取向,并且图11e示出了对应于ac80状态的预期的亲和素取向。因此,图10a至图10f表示,对于永久捕捉事件,亲和素被捕获成图11d所示的状态ac57,其中其停留平均60ms(在-35mv)。接着捕获成深度且永久地捕捉状态ac80,如图11e所示。这种设想由图8a至图8b中所示的永久捕获事件的实验时间轨迹支持。本方法还可以在其他偏置电压的pdl中观察到两个弱的附加峰,其分别对应于很少遇到的、在66%阻塞处(在ac66处)和在90%阻塞处的离散的水平。对于1.66ns孔,图10a至图10f示出了pdl中的水平群体也是强的电压-偏置依赖性。通过绘制永久事件的数量与瞬时事件的数量的比率作为施加的偏置电压的函数来显著地表明这种效应。这显示在图12中。将偏置电压从30mv增加至50mv导致这一比率的显著增加。在高的偏置电压下,孔中蛋白质的能量景观明显地被偏置,将亲和素永久地捕获至孔中的最深水平,最终不可能从孔中逃逸。图12表明,本文提供的pdl分析方法能够揭示对特定性质非常特异性的细节,例如蛋白质在纳米孔中的取向以及通过蛋白质穿梭至纳米孔的靶分子。与本文提供的实验方法一起,分析方法由此提供了用本文提供的基于纳米孔的平台实现单分子表征的强大的技术。对于亲和素-生物素复合物,深度捕捉水平的电流阻塞与单独的亲和素的电流阻塞相比减少了4%。这在图13中的图中示出。由于亲和素的深度阻塞水平与-30mv至-35mv范围内的电压无关,因此深度阻塞水平的差异可能是由于生物素-亲和素复合物的略大的尺寸。图14a至图14g示出了根据本公开内容的实施方案的pdl直方图的示例性高斯拟合。离散的阻塞水平的位置可以拟合成pdl图中的阻塞频谱而获得。对于在-35mv的瞬时事件的pdl图(以上的图10c),低于80%永久水平(ac80)的水平可以通过将四个高斯的总和成低于65%阻塞的每一个频谱而获得。图14a至14g示出了对图10a至图10f的pdl直方图的示例性高斯拟合。为了产生图14a至图14g的拟合例程的有效收敛,可以使用以下程序:首先考虑τ瞬时=1000ms的频谱。一个高斯可以拟合成在主导的57%峰附近的受限的阻塞区域中的频谱,并且然后从数据中减去所得到的高斯。这种减法的结果清楚地显示出52%的峰。另一个高斯可以拟合在围绕该峰的阻塞区域中,并且可以再次减去所得到的高斯。这揭示了45%的峰,其用高斯在受限的阻塞区域中拟合。然后将以57%(ac57)和45%(ac45)处为中心的两个高斯的位置和宽度的所得值用作固定值用于用四个高斯拟合成低于65%的整个阻塞区域上的所有频谱。在图14a至图14g中示出每一个高斯分量的位置、宽度和幅度的拟合和值的结果。在以下表3中示出每一个峰的位置(pos)、宽度(sigma)和幅度(amp)以及每个频谱的拟合程序的结果。表3:pdl图的高斯分布的幅度、位置和宽度可以首先由多个单独的永久事件的电流特征鉴定进入水平。然后在永久事件的pdl中,通过在比80%永久阻塞水平(对于亲和素)低的阻塞水平(即,对于亲和素57%)处的峰的出现来确认进入水平的存在。在对于亲和素的永久事件pdl内的所有频谱中存在这种较低的峰,以及在瞬时事件pdl中发现不存在其他峰(在40%处、在45%处、在52%处的峰)提示了结论,亲和素相对于纳米孔的特定取向对于永久捕捉是必需的。(通过用高斯的总和拟合成pdl内的各个频谱来确定峰位置的位置)。这些水平和结论是针对clya中的亲和素,其仅是使用pdl分析以及蛋白质动力学和/或相互作用的可视化的一个实例。实施例clya单体表达和纯化除非另有说明,否则所有试剂可以从飞世尔科技(fisherscientific)和/或波士顿生物制品(bostonbioproducts)购买。苯基甲烷磺酰氟(pmsf)和氯化镁购自西格玛(sigma)。梯度4%至15%凝胶购自伯乐(bio-rad),并且清洁剂正十二烷基-β-d-吡喃麦芽糖苷(ddm)购自emd密理博(emdmillipore)。在bl21(de3)细胞中表达c-末端his6标记的clyawt蛋白质。具体地,pt7-clyawt-chis6质粒在bl21(de3)化学感受态细胞中转化,并且在lb-amp琼脂板上生长。将一个菌落接种在含有100μg/ml氨苄青霉素抗生素的起子lb培养基中,并且在37℃下生长,以200rpm摇动。起子培养物用于接种含有100μg/ml氨苄青霉素的250mllb培养基。培养物在37℃下生长直至od600为0.5至0.65。然后将培养物在冰上冷却,并且通过添加iptg至最终浓度0.5mm来诱导,并且然后在15℃下在摇动下孵育16小时。16小时后,以3100xg收获培养物,并且将球粒重新悬浮在15ml的50mmtris-hclph8.0、1mmedta缓冲液中,并且在-20℃下冷冻直至准备使用。随后将冷冻的球粒在室温下解冻,并且加入0.5mm的最终浓度的pmsf。将混合物在冰上超声以裂解细胞。将mgcl2以10mm的最终浓度添加至裂解物中,并且然后将混合物在20,000xg下离心20分钟。将上清液通过0.22μm过滤膜过滤,并且负载至用缓冲液a(150mmnacl、50mmtris-hclph8)平衡的重力ninta柱上。随后用缓冲液a洗涤柱以去除未结合的蛋白质。用缓冲液a1(150mmnacl、50mmtris-hcl、50mm咪唑)洗涤弱结合的蛋白质,并且然后洗脱clya蛋白质并且在缓冲液a2(150mmnacl、50mmtris-hcl、150mm咪唑)中收集。将洗脱的clya蛋白质使用6kda至8kda截留膜在透析缓冲液(150mmnacl、50mmtris-hcl、5mmedta)中在4℃持续搅拌下透析两个循环。然后使用10kda截留centricon将蛋白质浓缩至约3ml,并且负载至150mmnacl、20mm磷酸钠ph7.0缓冲液中平衡的凝胶过滤柱上以去除聚集的蛋白质。收集clya单体并且在4℃下保持2周或在-80℃下长期储存。clya低聚物(纳米孔)的制备和纯化然后将纯化的clya单体以0.6mg/ml悬浮在含有50mmnacl、10mm磷酸钠ph7.4的缓冲溶液中(具有缓冲液交换柱)。通过添加正十二烷基β-d-麦芽糖苷(ddm,calbiochem/emd密理博;在水中10%w/v)至1%的最终浓度并且在室温下孵育20分钟,由单体形成低聚体clya。通过使用4%至16%聚丙烯酰胺梯度凝胶(nativepage,invitrogen/novexlifetechnologies)的蓝色天然凝胶电泳进行clya纳米孔纯化。通常,将10μg的clya低聚物与电泳负载的缓冲液组合并且应用于凝胶的1.0mm×5.0mm样品孔。电泳后从凝胶中切下低聚体clya的主要条带,并且通过扩散到含有150mmnacl、0.2%ddm、50mmtris-clph8.0的洗脱缓冲液中从凝胶切片中回收纳米孔。亲和素制备将来自鸡蛋清的冻干纯化的亲和素(皮尔斯/赛默科技(pierce/thermoscientific)产品#21121)称量并且溶解在去离子水中至2mg/ml浓度。为了随后在4℃下储存,将具有20%甘油的等体积的2x磷酸盐缓冲盐水添加至悬浮液中,以使亲和素储备溶液浓度为标称1mg/ml。在clya纳米孔实验中使用之前,将亲和素储备溶液的等分试样应用于用150mmnacl、15mmtris-clph7.5平衡的bio-spin30旋转柱(伯乐实验室(bio-radlaboratories))进行缓冲液交换。d-生物素的制备通过每ml20mmkcl、50mmtris-clph7.5溶解0.2mgd-生物素(西格玛奥德里奇/密理博西格玛(sigma-aldrich/milliporesigma))来制备约1mm生物素溶液。以上描述的纳米孔匹配的蛋白质穿梭物不限于亲和素-clya蛋白质-纳米孔实例。蛋白质和靶分子结构、动力学和酶活性的研究在本文中更一般地通过对于一些蛋白质构型和对于沿着纳米孔长度的至少一个位点,具有基本上等于或小于蛋白质的直径的内部孔腔直径的纳米孔来实现。蛋白质在纳米孔中的永久捕获在本文中是可行的,并且可以用于分子穿梭物中提供的蛋白质和靶分子的研究。在相应的方法中,蛋白质穿梭物和靶分子被捕获在纳米孔中或至少部分地捕获在纳米孔中,进行研究,然后从纳米孔中排出。对于深度捕捉的亲和素和亲和素-生物素复合物观察到的低电流噪声表明,该系统提供了用于研究由靶分子和/或底物与靶分子相互作用和/或由此类相互作用产生的产物诱导的电信号的安静背景。因此,在分子穿梭物中采用的亲和素-生物素复合物能够将靶分子研究控制在迄今无法达到的水平。虽然以上已经描述了本发明的各种实施例,但应理解,它们仅作为实例提出,而不是限制性的。在不背离本发明的主旨或范围的情况下,可以根据本文中的公开内容对公开的实施例进行各种改变。因此,本发明的广度和范围不应受到任何以上描述的实施例限制。相反,本发明的范围应根据以下权利要求及其等同来限定。尽管已经参考一个或多个实现方式说明和描述了本发明,但本领域技术人员在阅读和理解本说明书和附图后将会想到等同的改变和修改。此外,虽然已经参考若干实现方式中的仅一个公开了本发明的具体特征,但在可能期望并且有利于任意给定的或特定的应用中时,此类特征可以与其他实现方式的一个或多个其他特征组合。本文使用的术语仅出于描述具体实施例的目的,而非旨在限制本发明。如本文使用,单数形式“一(a)”、“一(an)”以及“所述/该(the)”旨在还包括复数形式,除非上下文另外明确指出。此外,就术语“包括(including)、”“包括(includes)、”“具有(having)、”“具有(has)、”“具有(with)”或其变体在详细描述和/或权利要求中使用而言,此类术语旨在以类似于术语“包含(comprising)”的方式包括在内。除非另外限定,否则本文使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域的普通技术人员通常理解相同的含义。还应理解,术语(例如通常使用的字典中定义的那些术语)应被解释为具有与相关领域的背景下他们的含义一致的含义,并且不应被解释为理想化的或过于正式的意义,除非本文明确如此定义。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1