用于评价细胞治疗产品的有效性的方法与流程
本发明涉及用于评价细胞治疗剂的有效性的方法和用于制造骨关节炎治疗剂的方法。
背景技术:
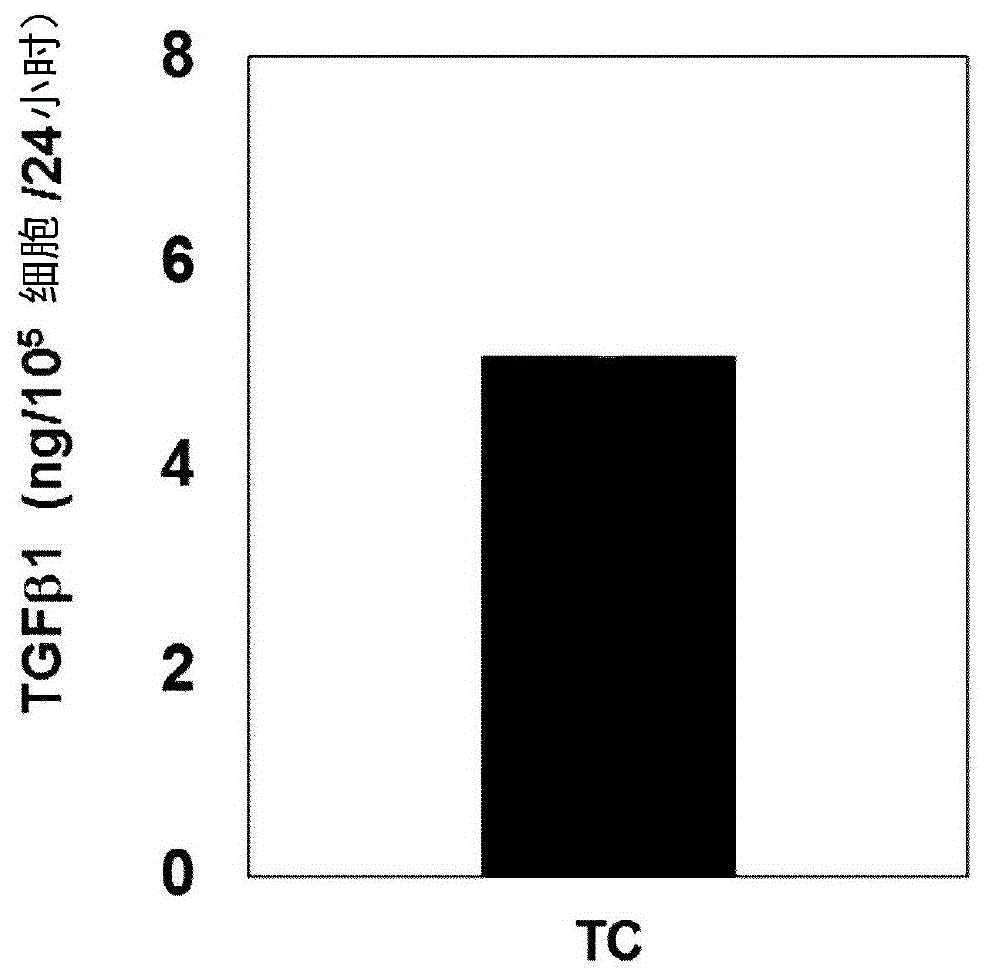
:骨关节炎,也称为退行性关节炎,为引起对关节软骨、底层骨(underlyingbone)和韧带的损伤,以及由于软骨损伤或退行性病变导致的炎症和疼痛的慢性疾病。骨关节炎在身体中的几乎所有关节中发生,包括手指、膝部(膝关节、髌骨)、髋部(hips)(髋关节、髋(coxa))、背部(腰椎关节)和颈部(颈关节)。尚未明确地研究骨关节炎的原因,但是已知由于例如年龄、遗传易感性(geneticpredisposition)、外伤和环境影响等复杂的原因而导致发病。在过去,由于骨关节炎的发生与年龄相关,因此被认为由关节的过度使用或由于老化导致的软骨磨损引起。然而,随着软骨代谢中涉及的各种物质(细胞因子、降解酶等)被公开,理解的是,这些物质引起软骨细胞代谢中的异常和炎性免疫应答等,从而通过各种原因损伤软骨。骨关节炎的主要症状包括反复疼痛、关节僵硬、降低的活动性(mobility)和功能的丧失。通常,症状经数年逐渐发展。随着疾病发展到一定程度,由于关节软骨的丧失和退化导致关节的表面变得不规则,由此引起疼痛程度的增加,并且进行性运动障碍(progressivemovementdisorder)会导致对日常生活的显著的干扰。此外,还可以引起关节变形。目前,针对与软骨生长相关的调节剂和生物化学因子的研究正在进行中。这些因子包括例如作为骨形成的有效刺激物的骨形态发生蛋白(bmp),和刺激细胞生长和细胞外基质(ecm)形成的转化生长因子β(tgf-β)。特别地,已知tgf-β参与蛋白聚糖合成、软骨细胞生长和组织再生。此外,还已知tgf-β具有免疫抑制功能和抗炎功能。实际上,例如表皮生长因子(egf)、胰岛素样生长因子i(igf-i)和碱性成纤维细胞生长因子(bfgf)等其它生长因子也刺激软骨再生,但是这些生长因子对软骨损伤没有影响。如上所述的此类生长因子在给予时难以确定浓度、释放速度或递送方法等。基于在动物实验中证实的结果,研究者继续作出努力以通过脂质体或通过溶解在培养基中来递送这些因子。然而,这些因子对人类的应用尚有待较大的改善。转基因软骨细胞的使用是与细胞介导的基因疗法组合成功地建立软骨再生的新技术(leekh等人,humgenether2001;12:1805-1813,sunu.song等人,tissueengineering2005;11:1516-1526)。该方法使用由具有tgf-β基因的逆转录病毒载体转导的同种异体人软骨细胞与同种异体正常软骨细胞的组合。该方法可以在使外科手术减少到最少的同时诱导软骨再生。同时,在产生并且提供活细胞的细胞治疗剂的情况下,由于例如培养基的改变等生产条件的改变,和例如温度等工作环境的改变导致可能在药物产品中出现差异。因此,有必要在细胞治疗剂的生产中建立质量控制标准以确保有效性(即,疗效)是否达到实际适用于患者的水平。然而,获得一致的过程和技术以验证细胞治疗剂具有可靠的疗效是非常困难的步骤。因此,绝对有必要建立用于适当地验证各细胞治疗剂的有效性的方法和标准。技术实现要素:发明要解决的问题在这些情况下,本发明人作出努力来开发评价用于特定的疾病、特别是骨关节炎的细胞治疗剂的有效性的方法,并且由此建立具有优异的效果的骨关节炎治疗剂的制造方法。结果,本发明人发现,如果经转化以表达tgf-β蛋白的重组细胞的tgf-β的表达水平超过特定的水平,则确认细胞治疗剂在骨关节炎的治疗中具有显著的效果。此外,本发明人还确认当未转化的细胞的血小板反应素1(thrombospondin1)(tsp-1)的表达水平超过特定的水平时,细胞治疗剂也在骨关节炎的治疗中具有显著的效果。基于该发现,完成了本发明。因此,本发明的目的在于提供用于评价细胞治疗剂的有效性的方法。此外,本发明的另一目的在于提供新型骨关节炎治疗剂的制造方法。用于解决问题的方案下文中,将更详细地描述本发明。根据本发明的一个方面,提供用于评价细胞治疗剂的有效性的方法,其包括:(1)分别制备(a)第一群用转化生长因子β(tgf-β)转化的哺乳动物细胞、和(b)第二群未用相同的基因转化的哺乳动物细胞;(2)步骤(1)中的第一群和第二群向小瓶中的填充步骤;(3)步骤(2)中的第一群的失活步骤;(4)步骤(3)中的第一群的培养步骤;(5)来自步骤(4)中的第一群的tgf-β的表达量的测量步骤;和(6)基于在步骤(5)中测量的tgf-β浓度的细胞组合物作为治疗剂的有效性(即,疗效)的评价步骤,其中,如果在步骤(6)中tgf-β的表达水平为0.65ng/105个细胞/24小时以上,则确定细胞组合物作为治疗剂是有效的。在这方面,第一群为用tgf-β转化的细胞并且具有改良的遗传特性。为了在此类具有改良的遗传特性的细胞要作为药物来提供时防止意外情况并且确保安全性,优选进行失活过程(例如,照射)以使细胞变得处于复制缺陷状态(replicationincompetentstate)。然而,此类失活过程影响tgf-β分泌和原位细胞(cellsinsitu),因此,将实质上需要用于确定是否细胞即使在失活之后作为治疗剂也有效的标准。因此,本发明的主要特征在于,在包括第一群用tgf-β转化的哺乳动物细胞、和第二群未用相同的基因转化的哺乳动物细胞的细胞治疗剂(混合细胞)中,通过基于第一群中的tgf-β表达水平鉴定第一群的质量,来确定细胞组合物作为细胞治疗剂的有效性。在本发明中,第一群用tgf-β转化的哺乳动物细胞中包括的细胞或细胞组(cellgroup)优选为表达tgf-β1的细胞或细胞组。在本发明中,作为用于确定本发明的细胞治疗剂的有效性的标准,对第一群中的tgf-β表达水平不特别限定,只要达到期望的效果即可,然而,其优选为至少0.65ng/105个细胞/24小时,更优选至少1.0ng/105个细胞/24小时,并且最优选至少1.7ng/105个细胞/24小时。根据本发明的一个实施方案,发现当tgf-β表达水平为0.63ng/105个细胞/24小时时,显著的疼痛缓解和软骨结构的改善是无效的,因此,要求tgf-β表达水平为至少0.65ng/105个细胞/24小时。用于根据本发明的细胞治疗剂的有效性的指标(index)作为指征(indicator)具有优异的准确性和可靠性,并且因此可以用于确定骨关节炎治疗剂的有效性。在本发明中,术语“表达水平”或“分泌水平”是指tgf-β蛋白的表达水平。在本公开中,术语“有效性的确定”用于指对本发明的细胞治疗剂的治疗效果产生有益的或不利的响应的潜力。在本发明中,上述确定涉及此类响应的程度。例如,有效性确定涉及在使用细胞治疗剂的治疗之后是否获得对骨关节炎的治疗效果和/或其可能性。根据本发明的优选的实施方案,步骤(3)中的失活通过照射来进行,其中照射可以包括γ射线、x射线或电子射线,但是不限于此。此外,可以使用现有技术中已知的各种技术来容易地进行照射。根据本发明的优选的实施方案,步骤(2)中的小瓶可以包含冷冻保护液,其中冷冻保护液包括二甲亚砜(dmso)。优选地,冷冻保护液可以包含5体积%至15体积%的dmso。此外,可以在将小瓶冷冻之前或之后进行步骤(3)中的失活,并且可以在-20至-196℃下进行冷冻。可以在将冷冻的小瓶解冻之后进行步骤(4)中的培养,并且可以将冷冻的小瓶在15至40℃下放置1至90分钟来进行解冻。步骤(4)中的培养可以进行6至96小时。根据本发明的优选的实施方案,哺乳动物细胞可以为软骨细胞或软骨祖细胞(chondroprogenitorcell)。此外,本发明可以进一步包括鉴定第二群中的tsp-1基因的表达。例如,已知正常软骨细胞、软骨祖细胞或干细胞表达tsp-1。在本发明的一个实施方案中,发现tsp-1表达的有无在包括第二群的细胞治疗剂的治疗效果中起到重要的作用。因此,可以通过检测第二群中的tsp-1基因的产物,即,rna或蛋白质来鉴定是否存在tsp-1基因的表达,并且评价第二群的有效性。作为用于确定本发明的细胞治疗剂的有效性的标准,对第二群中的tsp-1表达水平不特别限定,只要达到期望的效果即可,然而,其优选为至少31ng/105个细胞/24小时,更优选至少50ng/105个细胞/24小时,并且最优选至少90ng/105细胞/24小时。在本发明的一个实施方案中,发现当tsp-1表达水平为30.53ng/105个细胞/24小时时,没有显示显著的疼痛缓解和软骨结构的改善,因此,要求tsp-1表达水平为至少31ng/105个细胞/24小时。根据本发明的一个实施方案,如果在包括(a)第一群用tgf-β转化的哺乳动物细胞、和(b)第二群未用相同的基因转化的哺乳动物细胞的细胞治疗剂中检测(鉴定)到其中第一群中的tgf-β表达水平为0.65ng/105个细胞/24小时以上,而第二群中的tsp-1表达水平为31ng/105个细胞/24小时以上,则确定细胞治疗剂对于骨关节炎具有治疗效果。通常可以通过从样品中提取rna或蛋白质,并且检测提取物中的rna或蛋白质的特定的部分来进行检测。此类rna或蛋白质的检测可以通过免疫测定、杂交和扩增来确定,但是不限于此,并且可以使用现有技术中已知的各种技术来容易地进行。本文中所使用的检测剂可以选自由对以上基因具有特异性的反义寡核苷酸、引物对、探针、及其组合组成的组。即,可以通过使用与编码基因的核酸分子或核酸分子的互补分子(complementarymolecule)杂交的一种或多种寡核苷酸引物的扩增来进行核酸的检测。例如,使用引物的核酸的检测可以通过如下来进行:根据例如聚合酶链式反应(pcr)等扩增过程来扩增基因序列,然后通过现有技术中已知的任意方法来确定基因是否被扩增。此外,检测剂可以为特异性地结合至蛋白质中的氨基酸区域的抗体,并且可以包括多克隆抗体、单克隆抗体、重组抗体、或其组合。此类抗体不仅可以包括多克隆抗体、单克隆抗体、重组抗体以及具有2个全长轻链和2个全长重链的完整形式,还可以包括抗体分子的功能性片段,例如,fab、f(ab')、f(ab')2和fv。可以使用现有技术中众所周知的技术来容易地进行抗体的生产,并且还可以使用商购可得的抗体。此外,根据本发明的另一方面,提供用于制造骨关节炎治疗剂的方法,其包括:(1)分别制备(a)第一群用tgf-β转化的哺乳动物细胞、和(b)第二群未用相同的基因转化的哺乳动物细胞;(2)在冷冻保护液中的步骤(1)中的第一群和第二群各自在小瓶中的填充步骤;(3)在将小瓶冷冻之前或之后步骤(2)中的第一群的失活步骤;(4)步骤(3)中的第一群的解冻步骤;(5)步骤(4)中的第一群的培养步骤;(6)步骤(5)中的第一群中的tgf-β的表达水平的测量步骤;和(7)在步骤(6)中测量的tgf-β表达水平为0.65ng/105个细胞/24小时以上的细胞的选择步骤。根据本发明的优选的实施方案,该方法进一步包括测量第二群中的tsp-1的表达水平,并且选择tsp-1表达水平为31ng/105个细胞/24小时以上的细胞的步骤(8)。换言之,本发明的方法可以包括:选择其中第一群中的tgf-β表达水平为0.65ng/105个细胞/24小时以上,并且第二群中的tsp-1表达水平为31ng/105个细胞/24小时以上的细胞;并且确定作为治疗剂有效的细胞,由此制备治疗剂。根据本发明的骨关节炎治疗剂的制造方法具有如下构成:其中分别基于(a)第一群用tgf-β转化的哺乳动物细胞、和(b)第二群未用相同的基因转化的哺乳动物细胞中的tgf-β和/或tsp-1表达水平来确定有效性。在这方面,将不描述关于重复的内容的描述,从而避免本公开过度复杂。发明的效果当分别使用(a)第一群用tgf-β转化的哺乳动物细胞中的tgf-β表达水平、和(b)第二群未用相同的基因转化的哺乳动物细胞中的tsp-1表达水平,作为用于确定根据本发明的细胞治疗剂的有效性的标准时,可以在开始治疗之前明确地确定各细胞治疗剂的疗效。此外,由于避免了没有治疗效果的细胞治疗剂的使用,因此不会引起不期望的过程和副作用。附图说明图1为示出tc细胞中的tgf-β1蛋白的表达水平的图。图2为示出各制造批次中的tgf-β1的表达水平的确认结果的图。图3a为示出当用混合细胞和/或抗tgf-β1中和抗体来处理患有mia诱导的骨关节炎的动物模型时vonfrey纤维丝试验(filamenttest)结果的图;和图3b为通过曲线下面积(auc)来示出以上vonfrey纤维丝试验结果的图。图4为分别示出hc细胞和tc细胞中的tsp-1蛋白的表达水平的图。图5为示出各细胞生产批次中的tsp-1的表达水平的确认结果的图和表。图6a为示出当用混合细胞和/或抗tsp-1中和抗体来处理mia诱导的骨关节炎动物模型时vonfrey纤维丝试验结果的图;和图6b为通过曲线下面积(auc)来示出以上vonfrey纤维丝试验结果的图。图7a为示出当用具有不同的tgf-β1表达水平的混合细胞来处理患有mia骨关节炎的动物模型时vonfrey纤维丝试验结果的图;图7b为通过曲线下面积(auc)来示出以上vonfrey纤维丝试验结果的图;和图7c为示出h&e染色组织分析的结果的照片。图8a为示出120gy混合细胞的1,2vff试验结果以确定tgf-β1的最小有效值的图;和图8b为通过auc来示出计数结果的图。图9a为示出120gy混合细胞的1,2vff试验结果以确定tsp-1的最小有效值的图;图9b为通过auc来示出计数结果的图;和图9c为示出h&e染色组织分析的结果的照片。具体实施方式下文中,提供以下实施方案从而更详细地描述本发明。对本领域技术人员将是显而易见的是,关于本发明的目的,本发明的范围不受这些实施方案限制。实施例1.细胞治疗剂的制备本发明的用于该实施例的细胞治疗剂为表达tgf-β1(ncbi参考序列:nm_000660.6)的转化的细胞群(第一群;下文中称为tc)和未使用以上基因转化的正常细胞群(第二群;下文中称为hc)。可以通过根据已知的方法将tgf-β1的cdna注入细胞中来制备tc。例如,将tgf-β1的cdna插入具有例如氨苄西林或新霉素等抗性基因(resistantgene)的已知载体[例如,来自promegaco.的pci(包含氨苄西林抗性基因)]中以构建包含tgf-β1的cdna的载体,然后根据例如磷酸钙法或脂质体转染法(lipofectinmethod)等已知的方法将载体注入软骨细胞中,由此制备tc。hc和tc为人源软骨细胞,其中hc为正常软骨细胞而tc为分泌tgf-β1的转化的软骨细胞。在已知的文献[cytotherapy,2012feb;14(2):247-256)和美国专利no.7,005,127和7,282,200]中公开了用于hc和tc的构建的方法。hc与tc的基于细胞的数量的混合比为3:1,并且应用于以下实施例。将所制备的tc和hc分别填充至小瓶中,并且冷冻和制备/贮存以用作基于混合细胞的治疗剂。此时,在冷冻之前或之后通过照射使tc失活。实施例2.细胞治疗剂中的tgf-β1分泌的鉴定本发明人确认根据制造方法制备的tc细胞是否表达tgf-β1,从而建立用于确定混合细胞作为如实施例1中那样的细胞治疗剂的有效性的标准。将tc细胞填充至小瓶中并且使其在冷冻状态下失活。在失活之后,将冷冻的小瓶取出并且在37℃的水浴中解冻,并且将细胞从小瓶中取出,并且添加在包含培养基的锥形管中。将细胞以210×g离心5分钟以除去上清液。使细胞悬浮在培养基中,然后在6孔板中接种至3个孔中以达到1.0×105个细胞/孔。将细胞分别在37℃、co2培养箱中培养24小时。在24小时之后,更换培养基并且将细胞在37℃、co2培养箱中培养24小时。在温育之后,将所用的培养基取样1ml。此时,在3个孔中使用2ml培养基作为阴性对照组。通过elisa方法来测量采样培养基中的tgf-β1的量,并且也以相同的方法来测量阴性对照组。tgf-β1分泌水平计算为“样品中的tgf-β1的平均分泌量-阴性对照组中的tgf-β1的平均分泌量”。根据结果,如以下图1和表1中所示,可以确认tgf-β1在tc细胞中以平均5.07ng/1×105个细胞/24小时表达。[表1]tgf-β1(ng/1×105个细胞/24小时)tc平均5.07实施例3.分批确定tgf-β1表达水平在各制造批次中考察tgf-β1的表达水平,从而建立tc细胞中显示作为细胞治疗剂的有效性的tgf-β1表达标准。根据结果,如以下图2和表2中所示,可以确认各批次的tgf-β1蛋白的表达水平存在差异。[表2]tc批次1批次2批次3tgf-β1(ng/1×105个细胞/24小时)9.869.8712.46如上所述,由于tgf-β1蛋白表达水平取决于生产批次而不同,因此当存在例如工艺变化等变化时可能出现较大的差异。因此,可以理解的是,对于能够再现相同的治疗效果的细胞治疗剂,应当建立tgf-β1表达的参比浓度以用于质量控制。实施例4.细胞治疗剂中tgf-β1表达与疗效之间的关系的验证为了验证tc细胞中在tgf-β1表达水平与治疗效果之间是否实质上存在密切的关系,本发明人准备了mia骨关节炎动物模型,然后用混合细胞和/或抗tgf-β1中和抗体来处理该模型,然后观察疼痛的变化。mia注射2周后,分别将作为对照组的cs-10给予组(载体)和通过将hc和tc以3:1的比例混合来制备的混合细胞(1.2×106个)给予至试验动物的左膝的关节腔中。对于中和抗体试验,在混合细胞给予当天和第3天将对照抗体(igg,500ng/30μl)和tgf-β1中和抗体(抗tgf-β1,500ng/30μl)给予至左膝的关节腔中。此后,进行vonfrey纤维丝试验。使用由dixon在1980年建立的50%上下阈值法(50%up&downthresholdmethod)来进行该试验(chaplansr等人,大鼠足部触觉异常性疼痛的定量评估(quantitativeassessmentoftactileallodyniaintheratpaw),journalofneurosciencemethods,1994,53:55-63;和dixonw.j.,实验观察的有效分析(efficientanalysisofexperimentalobservations),annualreviewspharmacologytoxicology,1980,20:441-62)。使用n值分别为0.4、0.6、1、2、4、6、8和15克(g)的总计九(9)种vonfrey纤维丝,考察疼痛反应并且根据预定的模式来计算阈值。根据结果,如图3a和3b中所示,在给予后第7天,测量结果分别为cs-10给予组(载体)中的1.46±0.54和混合细胞给予组中的4.87±0.8。直至给予细胞后第42天,此类镇痛效果显示类似的趋势,并且与cs-10给予组相比,在所有测量值处均观察到统计学上显著的镇痛功效(p<0.05)。此外,为了鉴定在混合细胞给予的情况下由tc分泌的tgf-β1如何影响镇痛效果,当还添加中和并且抑制tgf-β1蛋白的活性从而阻断其治疗效果的抗tgf-β1中和抗体时,观察到在给予后第7天,混合细胞给予组的疼痛治疗效果对应于tgf-β1中和抗体给予组(混合细胞+抗tgf-β1)中的阈值1.43±0.38,其显示与cs-10给予组类似的疼痛。此外,直至第42天也没有检测到疼痛治疗效果的差异。另一方面,使用对照抗体(igg)的组(即,混合细胞+igg)保持与混合细胞给予组类似的疼痛治疗效果。从以上结果,可以理解的是,由tc分泌的tgf-β1对骨关节炎治疗显示显著的效果。实施例5.细胞治疗剂中的tsp-1表达的鉴定为了研究tsp-1(ncbi参考序列:nm_003246.3)蛋白是否分别在hc细胞和tc细胞中表达以及其表达水平,将以与以上实施例2中所述相同的方法贮存的各细胞小瓶解冻,并且通过elisa方法来测量tsp-1量。根据结果,如以下图4和表3中所示,分别地,hc细胞中的tsp-1表达水平为180.37ng/1×105个细胞/24小时,并且在tc细胞中表达水平为0.29ng/1×105个细胞/24小时,由此证明tsp-1表达的抑制。[表3]tsp-1(ng/1×105个细胞/24小时)hctc平均180.370.29实施例6.分批确定tsp-1表达水平如以上实施例2中所述在各制造批次中考察tsp-1的表达水平,从而建立hc细胞中显示作为细胞治疗剂的有效性的tsp-1表达标准。根据结果,如以下图5和表4中所示,可以确认各批次的tsp-1的表达水平存在差异。[表4]hc批次1批次2批次3tsp-1(ng/1×105个细胞/24小时)76.41162.30116.14如上所述,由于tsp-1蛋白表达水平取决于生产批次而不同,因此当存在例如工艺变化等变化时可能会出现较大的差异。因此,可以理解的是,对于能够再现相同的治疗效果的细胞治疗剂,应当建立tsp-1表达的参比浓度以用于质量控制。实施例7.细胞治疗剂中tsp-1表达与疗效之间的关系的验证为了验证混合细胞的治疗效果,本发明人以与以上实施例4中所述相同的方式准备了mia骨关节炎动物模型,然后用混合细胞和/或抗tsp-1中和抗体来处理该模型,然后观察疼痛的变化。根据结果,如图6a和6b中所示,在给予后第7天,测量结果分别为cs-10给予组(载体)中的1.19±0.23和混合细胞给予组中的6.79±1.03。直至混合细胞给予后第42天,此类疼痛治疗效果显示类似的趋势,并且与cs-10给予组相比,在所有测量值处均观察到统计学上显著的镇痛功效(p<0.05)。此外,为了鉴定在混合细胞给予的情况下由hc分泌的tsp-1如何影响混合细胞的镇痛功效,当还添加中和并且抑制tsp-1蛋白的活性从而阻断其治疗效果的抗tsp-1中和抗体时,观察到在给予后第7天,混合细胞给予组的疼痛治疗效果对应于tsp-1中和抗体给予组(混合细胞+抗tsp-1)中的阈值2.28±0.54,其显示与cs-10给予组类似的疼痛。此外,直至42天也没有检测到疼痛治疗效果的差异。另一方面,使用对照抗体(igm)的组(即,混合细胞+igm)显示与混合细胞给予组类似的疼痛治疗效果(p<0.05)。由以上结果,可以理解的是,从hc分泌的tsp-1对骨关节炎治疗显示显著的效果。实施例8.细胞治疗剂中的tgf-β1的最小剂量的验证为了确定作为混合细胞的组成细胞的tc中的tgf-β1的最小值,本发明人对于mia注射2周后诱导的骨关节炎的受试者使用显示不同的tgf-β1值的tc,并且用通过将hc和tc以3:1的细胞比例混合来制备的混合细胞(2.8×105个细胞)来治疗受试者,然后观察疼痛的变化。此时,为了体现在不同条件的影响下具有不同的tgf-β1表达水平的tc的情况,制备具有不同的tgf-β1值的tc。通过tgf-β1的shrna处理和150gyγ照射来制备此类tc,并且确定tgf-β1平均值(ng/1×105个细胞/24小时),如以下表5中所示。[表5]根据结果,如图7a和7b中所示,在给予后第14天,cs-10给予组(载体)和混合细胞给予组的测量结果分别为1.17±0.53和6.06±1.91。直至给予细胞后第42天,此类疼痛治疗效果显示类似的趋势,并且与cs-10给予组相比,在所有测量值处均观察到统计学上显著的镇痛功效(p<0.05)。此外,在给予细胞后第14天,获得测量结果如下:分别地,对于shrna对照(shcon)处理给予组为6.21±1.59;对于使用150gyγ照射的tc的混合细胞给予组为1.39±0.23;和对于连同对tgf-β1的shrna处理的混合细胞给予组为0.86±0.49。直至给予细胞后第42天,这些效果是相似的。当将vonfrey纤维丝测量结果表示为auc值时,与对照组,即,cs-10给予组相比,在混合细胞给予组和shrna对照(shcon)处理给予组中也显示统计学上显著的结果(p<0.05)。根据对从相同的动物模型分离的组织的h&e染色分析的结果,在混合细胞给予组和shcon处理给予组中观察到软骨结构的改善,如图7c中所示。另一方面,分别地,在作为对照组的cs-10给予组(载体)、连同对tgf-β1的shrna处理的混合细胞给予组和使用150gyγ照射的tc的混合细胞给予组中未观察到软骨结构的改善。此外,为了确定由tc分泌的tgf-β1导致的疼痛缓解以及软骨结构改善的最小有效值,考察使用另一批次中生产的tc的混合细胞导致的镇痛效果和软骨结构的改善。所制备的tc的tgf-β1值分别为9ng/1×105个细胞/24小时和1.7ng/1×105个细胞/24小时。这些tc用于混合细胞的制备。所制备的混合细胞分别表示为9ng_混合细胞和1.7ng_混合细胞。根据结果,如图8a和8b中所示,在9ng_混合细胞、1.7ng_混合细胞和作为对照组的cs-10给予组(载体)分别给予后第14天,测量结果如下:对于cs-10给予组为1.48±0.26;对于9ng混合细胞为5.57±1.13;和对于1.7ng_混合细胞为7.41±1.21。直至给予细胞后第42天存在类似的趋势。与cs-10给予组相比,9ng_混合细胞给予组和1.7ng_混合细胞给予组二者均显示统计显著性(p<0.05)。当将vonfrey纤维丝测量结果表示为auc值时,与对照组,即,cs-10给予组相比,在9ng混合细胞和1.7ng_混合细胞给予组中也显示统计学上显著的结果(p<0.05)。因此,在使用由tc分泌的不同的tgf-β1的混合细胞给予之后获得的结果中,测得用于疼痛缓解和软骨结构的改善的tgf-β1的最小有效值高于在150gyγ照射的混合细胞给予组中确定的0.63ng/1×105个细胞/24小时,即,0.65ng/1×105个细胞/24小时以上。实施例9.细胞治疗剂中的tsp-1的最小剂量的验证为了确定作为混合细胞的组成细胞的hc中的tsp-1的最小值,本发明人用通过将hc和tc以3:1的比例混合来制备的混合细胞(2.8×105个)来治疗mia注射2周后诱导的骨关节炎的受试者,其中hc对于受试者显示不同的tsp-1值,然后观察疼痛的变化。此时,为了体现由于不同的条件导致的在tsp-1表达水平方面不同的hc情况,制备显示不同的tsp-1表达水平的hc。使用针对tsp-1的sirna来制备此类具有不同的tsp-1值的hc,并且确定平均tsp-1值(ng/1×105个细胞/24小时),如以下表6中所示。[表6]根据结果,如图9a和9b中所示,测量结果如下:在给予后第14天,分别地,对于cs-10给予组(载体)为0.6±0.19;对于混合细胞给予组为4.7±1.03;和对于混合细胞+sirna对照给予组为4.7±1.67。直至给予细胞后第42天,此类效果显示类似的趋势,并且与cs-10给予组相比,在所有测量值处均观察到统计学上显著的镇痛功效(p<0.05)。此外,在给予后第14天,混合细胞+sirna1给予组和混合细胞+sirna2给予组的测量结果分别为3.95±0.94和1.89±0.9。与cs-10给予组相比,在混合细胞+sirna1给予组中观察到统计学上显著的镇痛功效。直至给予细胞后第42天,这些疼痛治疗效果具有类似的趋势。当将vonfrey纤维丝测量结果表示为auc值时,与对照组,即,cs-10给予组(载体)相比,在混合细胞给予组、sirna对照处理给予组和混合细胞+sirna1给予组中也分别获得统计学上显著的结果(p<0.05)。此外,根据对于从相同的动物模型分离的组织的h&e染色分析的结果,如图9c中所示,在混合细胞给予组、sirna对照处理给予组和混合细胞+sirna1给予组中观察到软骨结构的改善。另一方面,对于作为对照组的cs-10给予组(载体)和混合细胞+sirna2给予组,未观察到软骨结构的改善。因此,确定的是由hc分泌的tsp-1用于疼痛缓解和软骨结构的改善的最小有效值高于在混合细胞+sirna2给予组中确定的30.53ng/1×105个细胞/24小时,具体地,31ng/1×105个细胞/24小时以上。产业上的可利用性总之,当基于(a)作为第一群的用tgf-β转化的哺乳动物细胞中的特定的tgf-β表达水平、和(b)作为第二群的未用相同的基因转化的哺乳动物细胞中的特定的tsp-1表达水平,使用根据本发明建立的用于评价骨关节炎治疗剂的有效性的方法时,可以在开始治疗之前可靠地确定单个细胞治疗剂的有效性(即,疗效),由此实现一致的治疗效果。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1