用于经由局部pH调节的单步骤ELISA的系统和方法与流程
本申请要求于2017年7月12日提交的序列号为no.62/531,836的美国临时申请的优先权权益,所述美国临时申请的公开内容通过引用在其整体上并入本文中。
背景技术:
酶联免疫吸附测定法(“elisa”)是一种蛋白质检测方法,其用于范围从基础生物研究到疾病诊断的各种应用。elisa在学术研究实验室、医学测试参考实验室和医院中被广泛用于检测来自各种类型的生物试样的目标物质。elisa过程基于通过主要/捕获剂来标识目标物质的原理。目标物质的存在通过检测/二次抗体而可视化,在所述检测/二次抗体上结合有酶或荧光染料。来自酶的酶促反应产物或来自荧光染料的信号强度被测量作为试验的输出。
一些定点照护系统(point-of-caresystem)利用elisa进行目标物质检测,并且elisa是用于诊断疾病的普遍使用的测试格式。然而,elisa尚未针对大多数病例而被标准化,并且甚至商业elisa试剂盒也经常不可靠。不同实验室间的测试结果差异是对于elisa在疾病诊断中的实际应用的另一个主要关注点。已知的elisa过程具有多个反应步骤,每个反应步骤具有彻底的洗涤步骤。在elisa协议中具有多个反应步骤和洗涤步骤增加了引入误差的机会,并且避免引入医学诊断测试或多参数筛选类型试验的误差是至关重要的。例如,多个洗涤步骤引起不精确,因为不完全的洗涤诱发假阳性信号和/或噪声,而过度侵蚀性的洗涤通过解离抗体结合的目标物质使信号强度降低。
多个反应步骤也使得开发便携式基于elisa的系统更困难且复杂。便携式基于elisa的系统的共同特征包括一次性微流体盒、用于试剂溶液流量控制的机械部件以及光学检测部件。诸如泵、马达和注射器之类的机械部件通常需要大的物理空间、复杂的软件控制算法和高水平的潜在维护。
因而,已知的elisa过程和基于elisa的系统具有多个反应和洗涤步骤,其增加了技术人员驱动的误差的机会、必要的试剂溶液量以及不同测试之间的可变性。具有试剂溶液处置的多个步骤也是对于仪器自动化和小型化、尤其是对于定点照护系统的主要障碍。因此,期望在elisa过程和基于elisa的系统的领域中的进一步发展。
技术实现要素:
根据本公开的示例性实施例,一种用于使用酶联免疫吸附测定法(elisa)来检测试剂溶液中目标物质的存在和/或浓度的方法包括:将目标物质直接或间接结合到电极,以及将检测剂直接或间接结合到结合的目标物质。所述方法进一步包括使用电极调节仅仅其中结合的目标物质和结合的检测剂所位于的试剂溶液的一部分的ph,所述试剂溶液部分的经调节的ph引起结合的检测剂经历改变。所述方法还包括对结合的检测剂中的改变进行检测。检测到的改变对应于试剂溶液中目标物质的存在和/或试剂溶液中目标物质的浓度。
根据本公开的另一个示例性实施例,一种用于使用酶联免疫吸附测定法(elisa)来检测目标物质的方法包括:将目标物质直接或间接结合到位于包括试剂溶液的测试井中的第一电极,以及将检测剂添加到测试井。检测剂的结合部分直接或间接结合到结合的目标物质,并且检测剂的未结合部分未结合到结合的目标物质。所述方法进一步包括将附加的检测剂添加到对照井,该对照井包括附加的试剂溶液并且不包括目标物质。第二电极位于对照井中。所述方法包括:使用第一电极调节仅仅其中结合的目标物质所位于的测试井中试剂溶液的一部分的ph,以引起位于所述试剂溶液部分中的检测剂的结合部分和位于所述试剂溶液部分中的检测剂的未结合部分经历第一改变;以及使用第二电极调节仅仅位于对照井中的附加试剂溶液的对应部分的ph,以引起位于附加试剂溶液的对应部分中的附加检测剂的对应部分经历第二改变。所述方法进一步包括检测第一改变作为第一检测值,检测第二改变作为第二检测值,以及生成测试值作为第一检测值与第二检测值的比较。生成的测试值对应于测试井中目标物质的存在和/或测试井中目标物质的浓度。
根据本公开的又一个示例性实施例,一种用于使用酶联免疫吸附测定法(elisa)来检测目标物质的存在和/或浓度的系统包括:测试井、位于测试井中并且包括目标物质的试剂溶液以及位于测试井中与试剂溶液直接接触的至少一个电极。目标物质直接或间接结合到所述至少一个电极。所述系统进一步包括检测剂和控制器,所述检测剂包括ph敏感的报告剂(reporter),所述检测剂被配置成直接或间接结合到结合的目标物质,所述控制器电连接到所述至少一个电极。控制器被配置成使用电极调节仅仅其中结合的目标物质和结合的检测剂所位于的试剂溶液的一部分的ph。所述试剂溶液部分的经调节的ph引起结合的检测剂的ph敏感的报告剂经历改变。控制器检测ph敏感的报告剂中的改变,并且检测到的改变对应于试剂溶液中目标物质的存在和/或试剂溶液中目标物质的浓度。
根据另一个实施例,一种用于使用酶联免疫吸附测定法(elisa)来检测目标物质的存在和/或浓度的系统包括:测试井;位于测试井中并且包括目标物质的试剂溶液;位于测试井中与试剂溶液直接接触的至少一个电极;捕获剂,其包括ph敏感的供体分子和受体分子中的一个,捕获剂结合到所述至少一个电极,目标物质直接或间接结合到捕获剂;检测剂,其包括ph敏感的供体分子和受体分子中的另一个,检测剂被配置成直接或间接结合到结合的目标物质;以及控制器,其电连接到所述至少一个电极并且被配置成:使用电极调节仅仅其中结合的检测剂所位于的试剂溶液的一部分的ph,所述试剂溶液部分的经调节的ph引起ph敏感的供体分子经历第一改变,并且第一改变引起受体分子经历第二改变;以及检测受体分子中的第二改变,检测到的第二改变对应于试剂溶液中目标物质的存在和/或试剂溶液中目标物质的浓度。
附图说明
图1是图示包括井、控制器、电源和存储器的单步骤elisa系统的框图,在一个实施例中,elisa系统使用试剂溶液ph的局部改变来检测测试样本中目标物质的存在和/或浓度;
图2是三个染料的光或发射输出相对于ph的曲线图,其中两个染料适合用于与图1的elisa系统一起使用,包括phrodo®绿色和fam;
图3是图示用于操作图1的elisa系统的示例性方法的流程图;
图4是图1的elisa系统的测试井和对照井的框图,其中elisa系统不展现ph的局部改变;
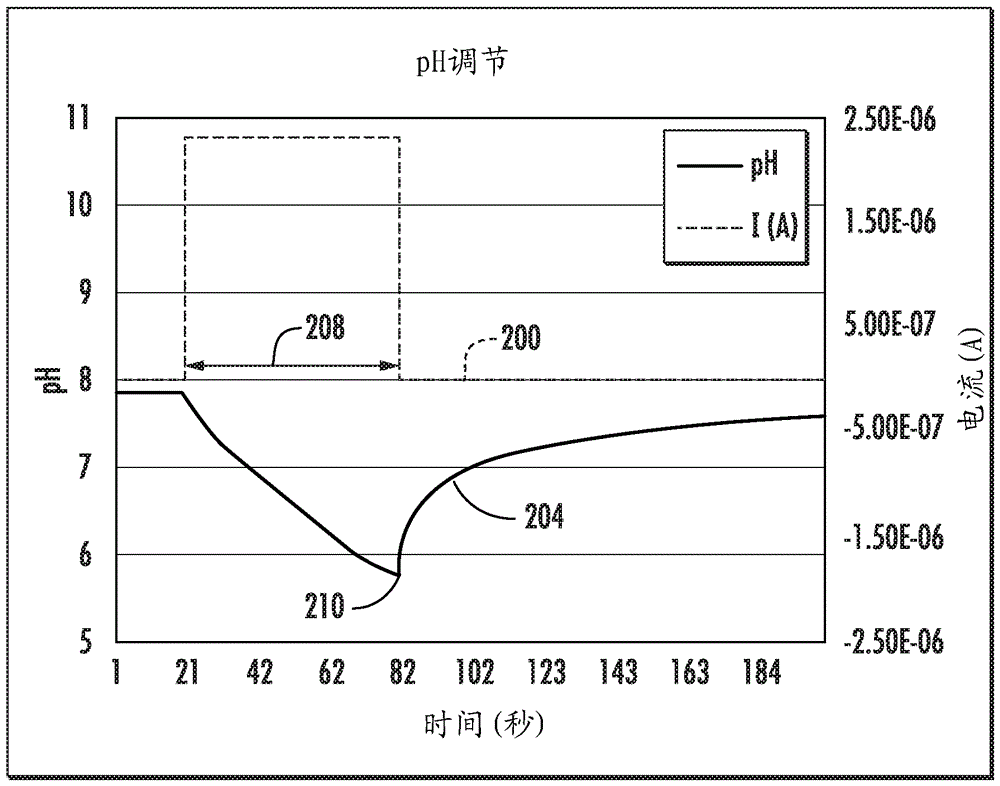
图5是与图1的elisa系统相关联的电流和ph相对于时间的曲线图;
图6是图1的elisa系统的测试井和对照井的框图,其中所述系统展现了测试井和对照井二者中的ph的局部改变;
图7是图示图1的elisa系统的示例性信号读出的框图;
图8是图示单步骤elisa系统的示例性多路复用实施例的框图;
图9是图示单步骤elisa系统的另一个示例性多路复用实施例的框图;
图10是图示适合用于与本文中公开的单步骤elisa系统一起使用的四个类型的elisa的框图;
图11是图示本文中公开的elisa系统的另一个测试井和另一个对照井的框图;
图12是图示本文中公开的elisa系统的洗涤步骤和单个反应步骤的框图;
图13是图示常规的elisa系统的多个洗涤步骤和多个反应步骤的现有技术框图;
图14a是图示在对调节区的ph进行调节之前如本文中所公开的基于fret的单步骤elisa系统的框图;
图14b是在调节区的ph调节期间所示的图14a的基于fret的系统的一部分的框图;
图15是图示如由图14a的系统使用的fret的框图;
图16是图示在图14a的基于fret的系统中使用的示例性供体和受体对的图表;
图17是图示如本文中所公开的单步骤elisa系统的另一个示例性多路复用实施例的框图;以及
图18是图示如本文中所公开的单步骤elisa系统的又一个示例性多路复用实施例的框图。
具体实施方式
出于促进对本公开原理的理解的目的,现在将对在附图中图示的以及在以下书面说明书中描述的实施例进行参考。理解到,因此意图没有对本公开范围的任何限制。进一步理解到,本公开包括对图示实施例的任何变更和修改,并且包括如本公开所属领域中的技术人员将通常想到的本公开原理的另外应用。
出于本公开的目的,短语“a和/或b”意指(a)、(b)或(a和b)。出于本公开的目的,短语“a、b和/或c”意指(a)、(b)、(c);(a和b);(a和c);(b和c);或(a、b和c)。
如关于本公开的实施例使用的术语“包含”、“包括”、“具有”等是同义的。
本公开描述了用于在单个反应步骤中利用试剂溶液的单个混合物执行elisa的系统和方法。如本文中所使用的,“单步骤elisa”是指包括仅仅一个反应步骤以配置用于目标物质检测的系统的系统和/或方法。单步骤elisa可以包括一个或多个洗涤步骤。
本文中公开的系统和方法利用与诸如ph敏感的荧光染料或ph敏感的酶反应之类的ph敏感的报告剂系统相组合的限定区域中的离子浓度梯度或电化学ph调节。在一个实施例中,在不需要用户改变溶液并且在没有电子测试读出装备的情况下,所公开的elisa系统生成测试结果。此外,本文中公开的elisa系统具有仅仅一个洗涤步骤。因而,本文中公开的elisa系统简单且紧凑,并且还具有增强的测试准确性和再现性。
如图1中所示,作为单步骤elisa系统100提供的生物传感器包括样本井108、电源116、存储器124和控制器132。井108通常形成在玻璃载片(或任何其他类型的载片)、半导体或塑料基板上。附加地或可替换地,井108可以是在微量滴定板(未图示)中形成的许多基本上相同的井108中的一个。在图1中示出了潜在许多的井108中的仅一个井108。示例性井108限定了用于容纳液体混合物的开口圆柱形容积,所述液体混合物通常被称为样本134。在一个实施例中,井108容纳近似0.5nl至5ml的样本134。在另一个实施例中,井108是被连接到微流体通道(未示出)的封闭腔室。
井108包括底表面136和从底表面136延伸的侧表面137。第一电极140和第二电极144位于井108中。在本文中也被称为底部电极的电极140位于由井108限定的圆柱形容积内的井108的底表面136上、在该底表面136处或在该底表面136附近。电极140的至少一部分被定位成直接接触井108所包含的样本134。在图示的实施例中,电极140的上表面148(即电极140面朝远离井108的底表面136的表面)被定位成直接接触样本134。在一个实施例中,电极140基本上是平坦的,并且具有基本上对应于井108的底表面136的圆形周边。在其他实施例中,电极140具有任何合适的形状。在一个实施例中,上表面148被图案化、形成或以其他方式被配置,使得样本134对于为电极140通电具有期望的电化学响应。特别地,在一个实施例中,电极140的上表面148被图案化,以引起样本134的试剂溶液150在ph调节期间抵抗缓冲效应。尽管图1图示了如包括电极140中的仅一个的系统100,但是在其他实施例中,系统100包括如适当用于井108的面积和形状的任何合适数目的电极140。例如,在一个实施例中,系统100包括在井108的底表面136上彼此间隔开的多于十个的电极140。
在本文中也被称为侧电极的电极144安装在井108的侧表面137上、在该侧表面137处或在该侧表面137附近。电极144被定位成至少部分地直接接触井108所包含的样本134。电极144与电极140间隔开,并且不直接接触电极140。如图1中所示,在一个实施例中,电极144限定了基本上垂直于电极140的上表面的主表面146。在其他实施例中,电极144具有任何合适的形状,包括圆柱形和平面形。此外,在一些实施例中,电极144具有“网状”或穿孔配置,在所述“网状”或穿孔配置中,电极144包括穿过其中的多个孔。在其他实施例中,电极144不垂直于电极140,并且可以相对于电极140具有任何合适的角度取向。此外,在其他实施例中,电极144被定位在井108中将电极144配置用于与样本134接触的任何地方。例如,电极144和电极140可以位于相同的表面上。附加地或可替换地,电极144可以浸入样本134的中间中,使得电极接触样本134并且与井108的表面间隔开。例如,电极144可以连接到可插入到样本134中的探针(未示出)的端部。
电极140、144由任何合适的(一个或多个)材料形成,所述任何合适的(一个或多个)材料包括但不限于金属,诸如铂、金和银;金属氧化物,诸如氧化铟锡和掺杂氟的氧化锡;以及碳材料,诸如玻璃碳或石墨。电极140、144不需要由相同的(一个或多个)材料形成。例如,底部电极140可以由第一材料形成,并且侧电极144可以由不同于第一材料的第二材料形成。
如图1中所示,井108所包含的样本134包括试剂溶液150、目标物质158和检测剂170。捕获剂166也包括在井108中,但是通常不被认为是样本134的部分。在一个实施例中,试剂溶液150是响应于电刺激而展现ph的局部改变的水溶液。试剂溶液150包括能够电化学氧化和/或电化学还原的电活性分子,所述电活性分子导致质子的生成或消耗,以响应于耦合到电极140、144中的至少一个的电信号来调节试剂溶液150的至少一部分的ph。试剂溶液150可以包括用于导致ph的局部改变的电化学活性剂、缓冲抑制剂、缓冲溶液、酶、酶底物、电解质或其任何组合。电极140、144的至少一部分与试剂溶液150直接接触。在特定实施例中,试剂溶液150包括电解质,诸如硫酸钠、氯化钠或氯化钾、溴化钠或溴化钾、碘化钠或碘化钾、高氯酸钠或高氯酸钾、硝酸钠或硝酸钾、四烷基溴化铵和四烷基碘化铵。试剂溶液150的示例性缓冲抑制剂包括但不限于聚(烯丙胺盐酸盐)、聚(二烯丙基二甲基氯化铵)、聚(乙烯基吡咯烷酮)、聚(乙烯亚胺)、聚(乙烯胺)、聚(4-乙烯基吡啶)和三(2-羧乙基)膦盐酸盐。在一些实施例中,试剂溶液150包括选自乙腈、二甲基亚砜(dmso)、二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dmac)及其混合物的组的水混溶性有机助溶剂。如果包括有机助溶剂,则所述有机助溶剂根据本文中描述的方法300(图3)促进试剂溶液150的ph调节。试剂溶液150在本文中也可以被简单地称为“试剂”。
在另一个实施例中,试剂溶液150被配置用于醌衍生物、肼衍生物或水的可逆电化学氧化/还原,以便在局部区域中诱发ph的迅速改变。可以利用醌衍生物在0到10的范围中调节局部区域中的ph。对碱性端的ph调节极限取决于特定醌衍生物的pka,但是对酸性端没有理论极限。在这样的实施例中,试剂溶液150被提供为任何醌衍生物、肼衍生物或苯酚-钌(2,2’-联吡啶)32+,或者经历质子耦合电子转移的任何其他分子和/或化合物。
目标物质158包括任何生物分子,包括但不限于蛋白质、肽、抗体、核酸、细胞外囊泡、激素和抗原。目标物质158的示例性源包括诸如血液、血清、唾液、尿液、汗液之类的来自人类和动物的体液;生物细胞;或组织样本。因而,系统100适合用于医学应用和兽医应用二者。附加地或可替换地,目标物质158包括消耗品,诸如牛奶、酒、水果、蔬菜、婴儿食品或水。如本文中所述,目标物质158直接或间接结合到电极140。
在继续参考图1的情况下,捕获剂166附接/结合到电极140的上表面148。捕获剂166是固定目标物质158的任何分子和/或化合物,如由图1中固定的目标物质158的四个示例性分子所示。例如,捕获剂166可以是目标物质158吸附到其以便固定目标物质158的物质。示例性地,捕获剂166包括但不限于抗体、肽、核酸、小分子和/或任何其他合适的分子。在一个实施例中,捕获剂166仅仅位于底部电极140的上表面148上,并且不位于井108内的任何其他表面上。在这样的实施例中,上表面148是被占据的区域,并且井108的其他区域和区是已经从其阻挡捕获剂166的未占据的区域。具体地,从包括侧电极144和井108的侧表面137的未占据的区域阻挡捕获剂166。此外,以捕获剂166的分子限定平均上层172(图1)的方式将捕获剂166施加或形成在电极140上,在所述平均上层172以上没有(或基本上没有)捕获剂166对信号有贡献。也就是说,捕获剂166的所有(或基本上所有)分子位于捕获剂166的上层172以下。在其他实施例中,捕获剂166位于井108、电极140和/或电极144的任何其他表面上;然而,仅仅位于调节线184(图1,参见下面阐述的讨论)下方的捕获剂166对检测剂170的输出有贡献。
捕获剂166的分子使用任何期望的过程被附接到电极140。例如,包括基于链接器分子的化学、静电吸附和物理吸附的过程通常用于将捕获剂166附接或链接到电极140。在一些实施例中,对井108的底表面136和/或底部电极140应用表面处理,以使得捕获剂166能够甚至更有效地结合到电极140。
在各图中,捕获剂166以比电极140、144大得多的比例被示出,以帮助理解、描述和图示系统100。由于捕获剂166结合到电极140,因此捕获剂166不像目标物质158和检测剂170那样在试剂溶液150内自由流动。此外,在一个实施例中,在添加样本134之前,将捕获剂166添加到井108。取决于所利用的elisa的类型,目标物质158直接或间接结合到捕获剂166(参见本文中对图10的讨论)。
检测剂170是与目标物质158形成复合物的任何分子和/或化合物。形成“复合物”包括吸附、链接和/或以其他方式结合到目标物质158。例如,检测剂170可以被提供为抗体、肽、核酸、小分子和/或任何其他合适的分子。如图1中所示,当检测剂170存在于目标物质158时,检测剂170结合到目标物质158(或与目标物质158形成复合物)。一些检测剂170结合到已经被捕获剂166固定的目标物质158的实例,从而形成包括被结合到电极140的捕获剂166、目标物质158和检测剂170的分子链(或分子夹层)。分子链限定了如图1中所示的固定高度线178所标识的最大高度或平均高度。在一个实施例中,固定高度线178基于分子158、166、170中的每个的最长尺寸的总和来被确定。被结合到固定目标物质158的所有或基本上所有检测剂170分子位于固定高度线178下方。
如图1中所示,检测剂170包括标签174。标签174是具有依赖于ph的性质或特性的检测酶或其他分子。例如,在一个实施例中,标签174是诸如ph敏感的荧光染料之类的ph敏感的报告剂,其在具有为第一ph的试剂溶液150的溶液中的时候展现光发射,并且在具有为不同于第一ph的第二ph的试剂溶液150的溶液中的时候不展现光发射。例如,当试剂溶液150具有7.0的ph时,标签174基本上不发射光,并且当试剂溶液150具有4.5的ph时,标签174发射人类可感知和机器可检测的光强度。示例性标签174除了其他之外至少包括oregon绿色、fam(例如6-fam(6-羧基荧光素))、lysosensor绿色、phrodo绿色、protonex染料(作为酸性条件下的示例性染料)、hex(六氯荧光素)、joe(nhs酯,6-羧基-4’,5’-二氯-2’,7’-二甲氧基荧光素)、tet(四氯荧光素)和辣根过氧化物酶(hrp)。此外,其他示例性标签174包括诸如gfp(绿色荧光蛋白)、yfp(黄色荧光蛋白)、cfp(青色荧光蛋白)及其衍生物(作为中性-碱性条件下的示例性染料)之类的荧光蛋白。
如本文中提及的,当标签174位于试剂溶液150中时,该试剂溶液150具有引起标签174(即,ph敏感的报告剂)发射等于或超过预定光水平175(图2)的光强度的ph,标签174被“激活”。当标签174位于试剂溶液150中时,该试剂溶液150具有引起标签174发射小于预定光水平175的光强度的ph,标签174被“去激活”。
图2图示了示例性标签174的荧光发射的大小,包括phrodo绿色和fam相对于ph。atto488染料也被绘制为对照,并且不展现基于ph的荧光发射的改变。如图2中所示,当试剂溶液150为酸性时,phrodo绿色具有高于预定光水平175的高荧光发射,并且当试剂溶液150为碱性时,phrodo绿色具有低于预定光水平175的低荧光发射。phrodo绿色在大约4.0至5.0范围中的ph处展现远高于预定光水平175的光强度输出。然而,fam具有与phrodo绿色相反的光强度输出特性。具体地,当试剂溶液150为酸性时,fam展现低于预定光水平175的低荧光发射,并且当试剂溶液150为中性或碱性时,fam展现高于预定光水平175的高荧光发射。fam在大约7.5至9.0范围中的ph处展现远高于预定光水平175的光强度输出。基于以上,当试剂溶液150的ph为大约4.0至6.5时,phrodo绿色表现向观察者明亮地发光,并且当试剂溶液150的ph比大约6.5大时,phrodo绿色表现不太明亮地发光或根本不发光。当试剂溶液150的ph为大约6.5至9.0时,fam表现向观察者明亮地发光,并且当其溶液的ph比大约6.5小时,fam表现不太明亮地发光或根本不发光。
再次参考图1,系统100的电源116是通过控制器132电连接到电极140、144的电源。电源116向电极140、144输出(如由用户选择的)ac或dc功率,并且被提供为任何典型的电源。在一个实施例中,电源116是开关模式的电源供给。在一个实施例中,电源116生成电信号并且向电极140、144供给电信号,所述电信号用于调节仅仅试剂溶液150的选择部分(即例如,位于调节线184下方的试剂溶液150的部分)的ph。
系统100的存储器124是电连接到控制器132的非瞬态计算机可读介质。在一个实施例中,存储器124将数据存储在对应于特定的井108、电极140、144、试剂溶液150、目标物质158、捕获剂166、检测剂170和/或标签174的程序文件或程序180中。例如,第一程序180可以包括引起电源116向电极140供给电信号的数据,所述电信号导致2.5μa电流通过样本134。在一个实施例中,根据常规的电流流动,电流从电极140流过样本134并且流到电极144。电流的大小通常被选择为对应于电极140、144附近(即调节线184下方(图1))的试剂溶液150的期望的预定ph。另一个程序180可以对应于不同的井108、电极140、144、试剂溶液150、目标物质158、捕获剂166、检测剂170和/或标签174,并且可以包括对应于通过样本134的不同期望大小的电流的数据。又一个程序180可以根据恒电流模式或恒电位模式来操作系统100。
控制器132被配置成执行存储在存储器124中的程序/指令180(即软件)。控制器132可操作地连接到电源116、存储器124和电极140、144。控制器132被提供为至少一个微控制器和/或微处理器。
在操作中并且参考图3,控制器132被配置成执行方法300,以用于确定或检测样本134中目标物质158的存在和/或样本134中目标物质158的浓度。如框304中所示并且另外参考图4,方法300包括准备测试井188和对照井190。如上所述,在一个实施例中,测试井188和对照190都是井108中的一个。为了准备井188、190,捕获剂166形成在相应的电极140上,并且从井188、190的其他区域和表面阻挡该捕获剂166。图4图示了每个井188、190具有被结合到或以其他方式附于电极140的捕获剂166。
在捕获剂166结合到相应的电极140之后,井188、190通常被洗涤以移除任何未结合的捕获剂166。洗涤井188、190包括利用试剂溶液150(或另一个合适的物质)冲洗井188、190,以从井188、190移除捕获剂166的任何未结合分子。洗涤井188、190不干扰或置换被结合到电极140的捕获剂166的分子。方法300没有其他洗涤步骤。
接下来,为了进一步准备井188、190,将样本添加到每个井188、190。特别地,将样本134添加到测试井188。样本134包括试剂溶液150、目标物质158和检测剂170。对照样本138被添加到对照井190。对照样本138包括试剂溶液150和检测剂170,但是不包括目标物质158。在一个实施例中,井188、190二者包括相同的试剂溶液150和相同的检测剂170。
在将测试样本134添加到测试井188之后,如图4中所示,捕获剂166的分子吸附、复合和/或以其他方式固定目标物质158的至少一些分子。此外,检测剂170的至少一些分子结合到目标物质158的吸附的分子并且也变得固定,并且检测剂170的其它分子结合到目标物质158的未结合分子并且在样本134中自由浮动。这样的过程是方法300的“单个反应步骤”。使用方法300和系统100,测试井188中目标物质158的固定分子是目标物质158的“可检测分子”。未固定在测试井188中的目标物质158的分子——如果有的话——通常不可被方法300和系统100检测到,即使检测剂170被结合到所述目标物质158的分子。
在将对照样本138添加到对照井190之后,如图4中所示,对照井190的捕获剂166没有固定任何东西或任何重要的东西。在对照井190中,没有目标物质158要结合到捕获剂166。此外,检测剂170仅仅直接结合到目标物质158,并且不能直接结合到捕获剂166。因此,对照样本138包括检测剂170与位于调节线184上方的检测剂170的一些分子以及与位于调节线184下方的检测剂170的其他分子的基本上同质的混合物。
接下来,如图3的框308中所示,方法300包括局部地调节测试井188和对照井190二者中的样本134、138的ph。“局部地”调节ph包括将仅仅位于每个井188、190的相应调节区182(图4)中的试剂溶液150的部分(即试剂溶液150的第一部分)的ph从第一ph值(即未调节的或初始的ph值、第一ph值)改变到不同于第一ph值的第二ph值(即预定的ph值、第二ph值)。在一个实施例中,调节区182从井108的底表面136延伸到调节线184(图4),该调节线184(图4)位于距底表面136的预定距离194(图4)。调节线184将调节区182与非调节区186(图4)(即试剂溶液150的第二部分)分离。当调节区182中的试剂溶液150的ph被局部地调节(即改变)时,非调节区186中的试剂溶液150的ph不改变。也就是说,在ph的局部调节期间,位于调节区182中的调节线184下方的样本134、138的部分被调节,并且位于非调节区186中的调节线184上方的样本134、138的部分的ph不被调节(或被阻止调节)。局部地调节ph在本文中也称为(i)通过电化学反应改变调节区182中试剂溶液150的离子浓度,和(ii)在至少调节线184处和调节线184下方的样本134中引入离子梯度。
根据存储在存储器124(图1)中的程序180(图1)中的至少一个,通过激励电极140、144来局部地调节试剂溶液150的ph。在一个实施例中,受激励的电极140引起位于调节区182中电极140附近的试剂溶液150部分的原位氧化和/或还原。氧化和/或还原或者(i)释放被结合到水试剂溶液150的水分子的氢离子(h+)以形成使试剂溶液150酸化的水合氢离子(h30+)(即局部地增加ph),或者(ii)增加使试剂溶液150碱化的氢氧阴离子(oh-)的浓度(即局部地增加ph)。系统100可被配置成至少基于试剂溶液150的组成、电极140、144的组成、电极140、144的表面结构(即电极140、144被图案化)以及从控制器132施加到电极140、144的电信号的特性来局部地增加或局部地减小调节区182中试剂溶液150的ph。
图5的曲线图图示了适合用于施加到相应电极140、144的电信号200以及表示响应于电信号200在调节区182中的试剂溶液150经局部地调节的ph的ph曲线204。更具体地,图5表明了在具有1mm磷酸盐缓冲剂的试剂溶液150中,通过氧化铟锡电极140上的2,5-二甲基对苯二酚的氧化的按需ph调节。当阳极电流(即电信号200)施加到电极140时,质子产生克服了试剂溶液150的缓冲能力,并且试剂溶液150的ph变得更酸性。电信号200被测量为从时间0到21秒为0微安(0μa)的电流,并且然后作为阶跃函数增加到近似2.4微安(2.4μa)。电信号200在大约60秒的预定时间段208内利用2.4微安的直流电信号为电极140通电。在预定时间段208之后,电信号200步降到0微安。在其他实施例中,预定时间段208是从1.0纳秒到60分钟。表面上图案化的预校准氧化铱感测电极(未图示)确定了图5中的ph曲线204的ph值。
响应于施加到电极140的电信号200,位于调节区182中的试剂溶液150的部分展现ph的暂时改变。如图5的ph曲线204中所示,ph从大约8.0的初始值改变到大约5.7的预定ph值210(图5)。在预定时间段208的过程内,调节区182中的试剂溶液150的部分的ph逐渐降低到预定的ph210。在一个实施例中,如图5中所示,试剂溶液150响应于电信号200展现ph的基本上线性的降低。试剂溶液150的ph的降低至少取决于电信号200的特性、试剂溶液150的组成和缓冲强度。在其他实施例中,试剂溶液150的ph的降低是非线性的。在预定时间段208结束时,当电信号200不再施加到电极140时,调节区182中的试剂溶液150的ph恢复回到初始值。图5示出了恢复到初始值基本上是指数的,非常像电容器的充电。在一个实施例中,调节区182中的试剂溶液150的ph在大约五分钟内恢复回到ph的初始值。试剂溶液150的ph恢复回到ph初始值所需要的时间至少取决于电信号200的特性、试剂溶液150的组成和缓冲强度。因而,试剂溶液的ph可以在从一秒至十分钟的任何地方内恢复回到ph的初始值。
可以在恒电流模式(电流控制)或恒电位模式(电压控制)下实行试剂溶液150的ph的局部调节。此外,在方法300期间,可以将任何类型的电信号施加到电极140、144。例如,在一个实施例中,施加到电极140、144的电信号是具有预定脉冲频率、预定脉冲宽度和预定脉冲形状的退火脉冲。退火脉冲的电压足以改变调节区182中的ph并且从样本134移除非共价结合的分子。非共价结合的分子的移除消除或减少了在目标物质158与捕获剂166之间初始接触之后对基板(即电极140)的洗涤。另一个优点是退火脉冲在从样本134移除非共价结合的材料方面比简单的洗涤更高效。
也可以利用闭环控制来实行试剂溶液150的ph的局部调节。闭环控制利用闭环控制功能提供试剂溶液150的精确的ph控制,所述闭环控制功能基于来自位于井108中的ph传感器(未示出)的输入。施加到电极140、144的电信号200的大小可以使用闭环控制来动态调整,使得调节区182中试剂溶液150的期望的ph水平维持预定时间段208。
方法300使得系统100能够控制经历ph的局部改变的试剂溶液150的量。通过考虑到控制器132控制调节线184在井188、190内的位置,这样的控制被可视化和理解。调节线184的位置通常被测量为调节线184与捕获剂166位于其上的电极140、144之间的距离。至少部分地基于固定高度线178(图4)来选择调节线184的位置。在一个实施例中,调节线184的位置被确定为与固定高度线178相同的位置处,或者离电极140比固定高度线178刚稍微更远(即,比固定高度线178高)。调节线184的位置对于测试井188和对照井190二者是相同的,即使对照井190不包括目标物质158的固定分子。
施加到电极140的电信号引起试剂溶液150的氧化/还原反应在电极140处发生。在预定时间段208期间,形成在电极140表面处的改变ph的离子和/或阴离子从电极140扩散开(在图4中向上)。结果是调节线184可以被认为在电极140的水平处开始,并且在预定时间段208期间远离电极140向上移动。随着预定时间段208的持续时间增加,调节线184的高度增加,并且经历ph的局部改变的试剂溶液150的量增加。在另一个实施例中,调节线184的位置至少部分地由电极140、144的配置确定,具体地由施加到电极140、144的电信号的大小确定。
在一个实施例中,选择预定时间段208的持续时间,使得仅仅位于从固定高度线178到井的底表面136的试剂溶液150的部分经历ph的改变。也就是说,预定时间段208的持续时间至少足够长,以使改变ph的离子和/或阴离子从电极140的表面向上扩散到固定高度线178,使得通过目标物质158被结合到捕获剂166的检测剂170的分子位于经调节的ph的区域中。为此,调节线184被配置成非常接近(即,从1-100000纳米)通过捕获剂166上的固定目标物质158和检测剂170的平均高度而形成的表面(即,非常接近固定高度线178)。
如上所述,检测剂170的标签174是ph敏感的。方法300导致位于调节区182中的标签174经历改变,并且防止位于非调节区186中的标签174经历改变。具体地,控制器132引起仅仅位于调节区182中的标签174发射高于预定光水平175的光,并且防止位于非调节区186中的标签174发射高于预定光水平175的光或发射低于预定光水平175的光。控制器132引起仅仅位于固定高度线178处或其下方的标签174发射光,因为仅这些标签174潜在地指示目标物质158的存在。方法300包括操作控制器132,以在预定时间段208内向至少电极140供给电信号200,该预定时间段208具有足够的持续时间,以引起位于固定高度线178处或其下方的试剂溶液150的ph改变到预定的ph210,并且引起位于调节区182中的标签174经历可检测的改变。因此,方法300包括对调节区182中的试剂溶液150的ph使用动态和按需控制。
图3中的框312示出了方法300包括检测在测试井188中的检测剂170的输出信号。检测剂170可以具有任何合适的输出类型或输出信号,包括发光、荧光、比色方法、电化学方法、阻抗测量、磁感应测量和/或化学发光。在一个实施例中,方法300包括检测从测试井188发射的光的亮度和/或强度作为第一检测值(即标签174的第一改变和第一输出信号),并且检测从对照井190发射的光的亮度和/或强度作为第二检测值(即标签174的第二改变和第二输出信号)。当调节区182中的试剂溶液150的部分展现预定的ph210时,检测值被检测到。
如图6中所示,当试剂溶液150改变到预定的ph时,位于调节线184处或其下方的检测剂170的标签174展现可检测的改变,所述可检测的改变利用诸如电荷耦合设备、相机、红外相机、热相机、分光光度计、荧光计、发光计、显微镜之类的测试仪器和/或人眼可检测。已经历了可检测的改变的标签174在图6中被图示为具有黑色轮廓线的白星,并且曾未经历可检测的改变的标签174在图6中被图示为实心黑色星。在图6中,仅仅位于调节区182中的标签174展现可检测的改变,并且不在调节区182中的标签174(即,在非调节区186中的那些)不展现可检测的改变。可检测的改变发生在位于调节区182中的测试井188的标签174和对照井190的标签174中。
图6进一步图示了位于调节线184下方的检测剂170的一些分子未(直接或间接)结合到捕获剂166。位于调节线184下方的检测剂170的这些未结合分子(即自由浮动分子)对亮度的可检测的改变有贡献,但是不指示目标物质158的存在,并且在下文中被称为假检测分子212。测试井188和对照井190二者通常包括至少一些假检测分子212,因为检测剂170的分子遍及试剂溶液150分散。此外,由于类似的结构、形状和大小,井188、190通常包括相同数目的假检测分子212。因此,第一检测值是位于测试井188的调节区182中的检测剂170的结合部分和检测剂170的未结合部分的总和。第二检测值是位于对照井190的调节区182中的检测剂170的未结合部分。如下所述,控制器132计及假检测分子212。此外,在调节线184上方,检测剂170的所有或基本上所有分子未结合到捕获剂166并且不经历改变,因为它们未暴露于调节区182的经调节的ph。
接下来,如框316中所示,方法300包括使用控制器132将测试井188的检测值与对照井190的检测值进行比较,以生成另一个输出信号。在一个实施例中,电子测试仪器216(图6)用于检测测试井188和对照井190的检测值,并且用于从测试井188的第一检测值中减去对照井190的第二检测值,以得出系统100的测试值。所述减法将位于测试井188的调节区182中的结合检测剂170的光输出与位于测试井188的调节区182中的未结合检测剂170的光输出进行隔离。在一个实施例中,测试仪器216的输出被校准以表示样本134中目标物质的浓度或量。附加地或可替换地,测试仪器216的输出是仅仅样本134中目标物质158的存在或不存在的指示。
在示例中,如图6中所示,测试井188包括目标物质158,并且对照井190不包括目标物质158。测试井188的检测值包括被结合到目标物质158的检测剂170的光输出加上假检测分子212的光输出。对照井190的检测值仅包括假检测分子212的光输出。由于除了向样本134添加目标物质158之外样本134和样本138基本上相同,因此样本134、138二者应当具有相同数目的假检测分子212。因此,从测试井188的光输出中减去对照井190的光输出从测试井188的光输出移除了假检测分子212的影响,并且所述差值仅表示被结合到测试井188中的目标物质158的检测剂170的光输出。
在各图中未示出的另一个示例中,测试井188不包括目标物质158(技术人员初始可能不知道这一事实),并且对照井190不包括目标物质158。在该示例中,测试井188的检测值仅基于假检测分子212的光输出,并且对照井190的检测值仅基于假检测分子212的光输出。因此,当从测试井188的检测值中减去对照井190的检测值时,差值近似为零,从而指示目标物质158不存在于测试井188中。
在另一个实施例中,方法300的框312和框316由技术人员在定点照护解决方案中执行。在该实施例中,检测剂170的标签174被配置成发射在(对于人眼)可见的光谱中的光。在框312期间,技术人员观察测试井188和对照井190的相应亮度水平或特定颜色。然后,技术人员将亮度水平和/或颜色与(例如)印刷的或电子的参考图表进行比较,以确定测试结果(即,以确定样本134中目标物质158的存在和/或浓度)。在该实施例中没有电子测试仪器216被用于确定测试结果。
在单步骤elisa系统100的又一个实施例中,利用检测窗口,所述检测窗口足够小以仅仅覆盖用(基于荧光染料或基于酶的)ph敏感的信号报告系统标记的捕获剂166、目标物质158和检测剂170的一组完全结合的复合物,使得有效地排除来自未结合的检测抗体(即假检测分子212)的噪声信号。出于该目的,ph调节步骤通常是快速的,并且主动ph调节发生的物理空间通常被很好地控制。
图7包括具有捕获剂166、目标物质158和检测剂170的不同布置的测试井188和对照井190的另一个图示。
如图8中所示,单步骤elisa系统400的多路复用实施例包括井404、控制器408、存储器412和电源416。井404具有位于其中的电极420和电极424。电极420、424中的每个位于井404的底表面430上。电极420、424、电源416和存储器412各自电连接到控制器408。存储器412包括被配置成引起控制器408实现类似于图3的方法300的方法的程序434。控制器408基本上与控制器132相同,电源416基本上与电源116相同,并且存储器412基本上与存储器124相同。图8图示了测试样本440位于左侧电极420、424组上,并且对照样本444位于右侧电极420、424组上。物理空间(即间隙)位于样本440、444之间,使得样本440、444通过空气空间与彼此隔离。
系统400与系统100的不同之处在于,测试样本440和对照样本444在多路复用布置中位于相同的井404中(即,在相同的空间中)。如图8中所示,选择测试样本440的容积以在左侧电极420、444组上形成不延伸到右侧电极420、444组的小“气泡”。测试样本440的表面张力维持测试样本440的形状,并且防止测试样本440与对照样本444接触和混合。类似地,选择被施加到右侧电极420、424组的对照样本444的容积,以形成不延伸到左侧电极420、424组的另一个小“气泡”。对照样本444的表面张力维持对照样本444的形状,并且防止对照样本444与测试样本440接触和混合。因此,系统400使用与系统100相比的一半数目的井404。
在操作中,系统400包括在井404中局部地调节测试样本440和对照样本444的ph。在图示的实施例中,调节区182由调节线184限定,并且是位于电极424上方的试剂溶液150的大体上矩形的区域。捕获剂166位于调节区182中。调节线184将调节区182与非调节区186分离。当调节区182中的试剂溶液150的ph被局部地调节时,非调节区186中的试剂溶液150的ph不改变。根据上面阐述的过程,通过激励电极420、424,由控制器408局部地调节试剂溶液150的ph。
在图8中,检测剂170的标签174是ph敏感的,并且位于调节区182中的标签174响应于被局部地调节的ph而经历改变。位于非调节区186中的标签174不经历改变。位于图8的调节区182中的标签174所经历的改变形成两个输出信号。仅仅位于调节区182中的标签174对测试样本440的输出信号有贡献,并且位于调节区182外部的标签174对输出信号没有贡献。具体地,仅仅位于调节区182中的标签174发射高于预定光水平175的光,并且位于非调节区186中的标签174被防止发射高于预定光水平175的光或发射低于预定光水平175的光。位于由测试样本440的调节线184所限定的区182的外部的标签174不能指示目标物质158的存在,因为这些标签174不响应于被局部地调节的ph而生成任何类型的输出信号。位于测试样本440的调节区182中的标签174的光输出被检测为第一检测值,并且位于对照样本444的调节区182中的标签174的光输出被检测为第二检测值。控制器408根据上面阐述的过程将测试样本440的检测值与对照样本444的检测值进行比较,以确定测试样本440中目标物质158的存在和/或浓度。
图9中示出了另一个多路复用的单步骤elisa系统500。系统500被配置成检测单个测试样本526内多个类型/不同类型的目标物质158a、158b、158c的存在和/或浓度。系统500包括测试井504、对照井506、控制器508、存储器512、电源516和具有三个传感器522a、522b、522c的测试仪器518。测试井504包括由电极524a、524b、524c共享的公共电极520,以及位于测试井504中的测试样本526。对照井506包括电极520、524d,并且对照样本528位于对照井506中。电极524a、524b、524c、524d、520、存储器512、电源516和测试仪器518各自电连接到控制器508。存储器512包括被配置成引起控制器508实现与图3的方法300类似/相同的方法的程序534。控制器508基本上与控制器132相同,电源516基本上与电源116相同,并且存储器512基本上与存储器124相同。
图9的系统500与系统100的不同之处在于,测试样本526在试剂溶液150内包括三个不同的捕获剂166a、166b、166c、三个不同的目标物质158a、158b、158c和三个不同的检测剂170a、170b、170c。目标物质158a、158b、158c在图9中各自被不同地图示。捕获剂166a、166b、166c和检测剂170a、170b、170c通过图9中的参考标号和字母是可区分的,但是具有相同的图形描绘。捕获剂166a仅结合到电极524a和524d,捕获剂166b仅结合到电极524b,并且捕获剂166c仅结合到电极524c。如下所述,系统500的不同之处还在于调节区182包括大体上矩形的子调节区530a、530b、530c。
测试井504的示例性配置在测试井504的左侧上形成包括子调节区530a的“a”检测区,在测试井504的中间中形成包括子调节区530b的“b”检测区,以及在测试井504的右侧上形成包括子调节区530c的“c”检测区。线532a标识子调节区530a与子调节区530b之间的边界,并且线532b标识子调节区530b与子调节区520c之间的边界。在一个实施例中,测试仪器518的传感器522a被定位成检测来自“a”检测区(即子调节区530a)的光输出,传感器522b被定位成检测来自“b”检测区(即子调节区530b)的光输出,并且传感器522c被定位成检测来自“c”检测区(即子调节区530c)的光输出。在其他实施例中,测试仪器518包括少于三个的传感器522a、522b、522c。例如,在一个实施例中,测试仪器518包括“宽角度”传感器(未示出),所述“宽角度”传感器(未示出)被配置成检测来自检测区a、b、c中的每个的光输出并且用于区分来自检测区a、b、c中的每个的光输出。测试仪器518的每个实施例还被配置成检测来自对照井506的调节区182的光输出。
对照井506包括示例性对照样本528,示例性对照样本528包括试剂溶液150和至少一个类型的检测剂170a、170b、170c。在图9的示例性实施例中,对照样本528包括所有三个检测剂170a、170b、170c。捕获剂166a、166b、166c中的至少一个被结合到电极524d。在图示的示例中,捕获剂166a被结合到电极524d。
在操作中,系统500包括局部地调节井504中的测试样本526和井506中的对照样本528的ph。在图示的实施例中,调节区182从调节线184向下朝向电极524a、524b、524c、524d延伸。捕获剂166a位于子调节区530a中,捕获剂166b位于子调节区530b中,并且捕获剂166c位于子调节区530c中。调节线184将调节区182与非调节区186分离。当调节区182中的试剂溶液150的ph被局部地调节时,非调节区186中的试剂溶液150的ph不改变。根据上面阐述的过程,通过激励电极524a、524b、524c中的至少一个以及电极520,由控制器508局部地调节试剂溶液150的ph。
检测剂170a、170b、170c的标签174是ph敏感的,并且位于调节区182中的标签174响应于被局部地调节的ph而经历改变。位于非调节区186中的标签174不经历改变。位于图9的调节区182中的标签174所经历的改变形成至少四个输出信号。前三个输出信号相应地在检测区a、b和c处生成。第四输出信号在对照井506的调节区182处生成。仅仅位于调节区182中的标签174对测试样本526的输出信号有贡献,并且位于调节区182外部的标签174对输出信号没有贡献。在一个实施例中,位于测试样本526的检测区a中的标签174的光输出被检测为第一检测值,位于测试样本526的检测区b中的标签174的光输出被检测为第二检测值,位于测试样本526的检测区c中的标签174的光输出被检测为第三检测值,并且位于对照样本528的调节区182中的标签174的光输出被检测为第四检测值。具体地,可以通过同时为每个电极524a、524b、524c通电来同时生成每个检测区a、b、c的光输出(输出信号),以调节包括所有子调节区530a、530b、530c的整个调节区182中的ph。在另一个实施例中,三个电极524a、524b、524c中所选择的一个和/或电极520被调节,以调节仅仅在子调节区530a、530b、530c中所选择的一个中的ph,在这种情况下,仅仅位于所选择的子调节区530a、530b、530c中的标签174经历改变,并且生成由测试仪器518可检测的光输出作为检测值。控制器508根据上面阐述的过程将测试样本526的(一个或多个)检测值与对照样本528的检测值进行比较,以确定测试样本526中目标物质158a、158b、158c的存在和/或浓度。
在另一个实施例中,系统500包括三个不同类型的标签174(未示出),诸如a、b和c类型的标签174。在这样的实施例中,每个类型的标签174被配置成生成唯一的或(由测试仪器518)可单独标识的输出。例如,每个不同类型的标签174当被暴露于预定的ph值210时可以输出不同波长的光。
如图10中所示,单步骤elisa系统100、400、500与各种类型的elisa兼容,所述各种类型的elisa包括其中目标物质158被“夹”在捕获剂166与检测剂170之间的“夹层”elisa技术。在夹层技术中,中间分子460(由虚线椭圆示出)可以结合或可以不结合在目标物质158与检测剂170之间。系统100、400、500也与直接elisa兼容,在所述直接elisa中不包括捕获剂166,并且目标物质158直接结合到电极140、424。也在图11中图示的直接elisa包括被结合到目标物质158的检测剂170,使得目标物质158被直接检测。然而,在间接elisa(图10中所示)中,中间分子460结合在目标物质158与检测剂170之间,并且通过测量已经被结合到中间分子460的检测剂170分子的输出来间接检测目标物质158。此外,系统100、400、500与竞争elisa兼容,所述竞争elisa不包括捕获剂166,但是包括诸如抑制剂抗原之类的抑制剂物质464。在每个类型的elisa中,系统100、400、500根据上述方法300调节试剂溶液150的ph。系统100、400、500与所有类型的elisa兼容。
本文中公开的系统100、400、500提供了优于现有技术elisa系统的众多优点。如通过比较图12和图13所示,在对检测值进行检测之前,本文中公开的系统100、400、500具有仅仅一个洗涤步骤和仅仅一个反应步骤。特别地,如图12中所示,洗涤(即洗涤1)发生在捕获剂166结合到电极140之后并且在将目标物质158添加到井188之前。没有另外的洗涤步骤或反应步骤被利用;因此,系统100、400、500是单步骤elisa。然而,如图13中所示,常规的elisa系统600在对输出进行检测之前具有至少三次洗涤和至少三个反应步骤。常规的elisa系统600包括不包含电极的井604。捕获剂608直接结合到井604的底表面612。常规的elisa在捕获剂608结合到井604和表面612之后具有第一次洗涤(即洗涤1)。接下来,在将目标物质620添加到井604之后,执行第二次洗涤(即洗涤2)以移除曾未结合到捕获剂608的未结合目标物质620a的分子。在将检测剂628添加到井604之后,执行第三次洗涤(即洗涤3)以移除曾未结合到目标物质620的未结合检测剂628a的分子。在第三次洗涤之后,暂时受控的酶促发展反应提供了输出值。
井604通过展现试剂溶液650颜色的改变来提供输出值,所述试剂溶液650颜色的改变利用测试装备(未示出)或通过来自技术人员的视觉观察是可检测的。具体地,检测剂628利用酶654标记,酶654被配置成与试剂溶液650中的底物658反应,以生成改变试剂溶液650颜色的产物或在表面612上形成可见的局部沉淀物。系统600不使用ph的改变来检测目标物质620。
本文中公开的系统100、400、500和方法300比常规的elisa系统600更不容易出现用户误差得多,并且因此提供了更可再现且更可靠的测试结果。在elisa过程中的每个洗涤步骤的情况下,存在技术人员将中断测试过程的可能性。例如,在常规的elisa系统600中,如果将井604洗涤以移除测试物质620的未结合分子620a,则有可能干扰和移除测试物质620的一些结合分子,从而通过减少结合到捕获剂608的测试物质620的量来影响测试结果。因此,通常合期望的是减少洗涤次数。此外,每次洗涤花费一定量的时间;因此,高吞吐量是系统100、400、500的另一个优点。如本文中公开的,与单步骤elisa方法300相比,对每个成分(捕获剂608、目标物质620和检测剂628)进行长达一小时的反应以及每个洗涤步骤至少五分钟的至少三到五个洗涤步骤显著增加了常规的elisa系统600的反应时间。由于系统100、400、500使用较少的洗涤,因此系统100、400、500比图13的常规的elisa系统600更快速且更具可靠性地生成测试结果,从而使得系统100、400、500特别地非常适合用于定点照护系统。如果采用多路复用格式(即,如图8和图9中所示),则与常规的elisa系统600相比,系统400、500的吞吐量增加得甚至更多。
如图14a、图14b、图15和图16中所示,elisa系统700利用了ph调节和基于fret的检测方法。基于fret(基于荧光共振能量转移)的检测方法使用一对荧光团来检测目标物质158。当所述对中的一个荧光团(供体)利用正确激发波长下的光被激发时,能量转移到另一个荧光团的受激能级,并且另一个荧光团(受体)发射对应发射波长下的荧光信号。取决于使用的fret对,能量转移还可以诱发光信号的猝灭,而不是光信号的发射或荧光信号的释放。
如下面阐述的,诸如系统700之类的基于fret的检测系统减少了假检测分子(诸如假检测分子212,图1)的数目。为此,系统700使用利用fret对被标记的捕获剂和检测剂:利用供体分子被标记的捕获剂和利用受体分子被标记的检测剂,或反之亦然。供体或受体中的至少一个生成依赖于ph的输出信号(诸如光输出)。如图15中所示,仅当供体和受体通过结合到相同的目标物质158而位于距彼此的预定距离738内时,才生成输出信号,并且将该ph调节到期望的预定ph。另一个益处是fret系统700可以淬灭以及激发荧光,结果,(一个或多个)目标物质158的存在可以被指示为包括荧光信号(光的发射)的输出信号或者被指示为包括光不存在的输出信号(淬灭信号)。示例性fret对(即供体和受体对)在图16中被描述,并且包括荧光素异硫氰酸酯(fitc)和四甲基罗丹明的异硫氰酸酯衍生物(tritc)、fam和tritc以及oregon绿色488和四甲基罗丹明(tmr)。图16还阐述了每个供体和受体对的激发和发射波长,以及哪一对是ph敏感的。
图14a和图14b中示出了示例性的基于fret的系统700。系统700被配置成在不需要单独的对照井的情况下检测目标物质158的存在和/或浓度。系统700包括井704、控制器708、存储器712、电源716和测试仪器718。井704包括电极720、724和位于井740中的测试样本726。电极720、724、存储器712、电源716和测试仪器718各自电连接到控制器708。存储器712包括被配置成引起控制器708实现与图3的方法300类似/相同的方法的程序734。控制器708基本上与控制器132相同,电源716基本上与电源116相同,并且存储器712基本上与存储器124相同。
系统700包括被结合到电极720的捕获剂166,并且测试样本726包括目标物质158和检测剂170。在该示例中,捕获剂166和检测剂170包括fret对。具体地,捕获剂166利用供体分子730被标记,并且检测剂170利用受体分子734被标记。在其他实施例中,捕获剂166利用受体分子734被标记,并且检测剂170利用供体分子730被标记。在图14a中,试剂溶液150未被ph调节。因而,测试样本726的ph自始至终基本上是均匀的,并且供体分子730和受体分子734都没有活性。
在一个实施例中,受体分子734与标签174的不同之处在于,受体分子734不生成输出信号或直接响应于试剂溶液150的ph的局部改变而经历改变。相反,受体分子734仅当位于距激活的供体分子730的预定距离738(图14b)内时才经历改变。供体分子730响应于试剂溶液150的ph的局部改变而经历改变(即第一改变),但是供体分子730所经历的改变不可被测试仪器718检测到。相反,供体分子730激活位于距其预定距离738内或在预定供体区域742内的受体分子734。当控制器708调节调节区182的ph时,仅仅位于距激活的供体分子730预定距离738内的受体分子734生成由测试仪器718可检测的输出信号(即第二改变)。非调节区186位于调节区182上方。
在操作中,如图14b中所示,系统700可操作来检测测试样本726中目标物质158的存在和/或浓度。首先,系统700局部地调节调节线184下方的调节区182中的ph。经调节的ph激活捕获剂166的供体分子730,并且引起仅仅位于供体区域742内的受体分子734经历改变并生成由测试仪器718可检测的输出信号。如图14b中所示,两个附近的检测剂750具有位于调节区182中的调节线184下方的受体分子754。受体分子754被间隔在供体区域742外部且未被激活,并且对测试仪器718可检测的输出信号没有贡献。
位于供体区域742内部的受体分子734所经历的改变是系统700的输出信号。在一个实施例中,没有控制信号被系统700生成,并且没有控制信号从输出信号中被减去,因为系统700使用fret概念消除了“假阳性”。简而言之,使用fret引起仅仅最有可能结合到目标物质158的那些受体分子734生成输出。fret通过简单地防止未被结合到目标物质158但位于调节线184下方的受体分子734对输出信号做出贡献来改进测试的可靠性。在另一个实施例中,从系统700获得控制信号,以补偿不是由于ph调节所致的受体分子734的任何荧光输出。该荧光输出在本文中被称为荧光输出的背景水平。荧光输出的背景水平——如果有的话——从经ph调节的标签734所生成的输出信号中被减去。
基于以上,在基于fret的系统700中,供体分子730和受体分子734中的至少一个是ph敏感的。具体地,在基于fret的系统700的第一配置中,供体分子730是ph敏感的,并且受体分子734不是ph敏感的。在基于fret的系统700的第二配置中,供体分子730不是ph敏感的,并且受体分子734是ph敏感的。在基于fret的系统700的第三配置中,供体分子730和受体分子734二者是ph敏感的。
在基于fret的系统700的另外配置中,为了检测样本726中目标物质158的存在和/或浓度,不需要ph调节。在这样的实施例中,供体分子730和受体分子734都不是ph敏感的,并且在不调节试剂150的ph的情况下执行单步骤elisa。具体地,当供体分子730和受体分子734位于距彼此小于预定距离738时,供体分子730和受体分子734被选择为具有可检测的输出(光发射或猝灭信号)。因为供体分子730被结合到电极720,所以可检测的输出主要地受被结合到目标物质158的检测剂170的分子中的受体分子734影响。未结合的检测剂170的分子通常位于比距供体分子730的预定距离738更远处,并且因此对可检测的输出没有贡献。与不使用ph调节的基于fret的系统相比,本文中所述的ph调节方案通常提供增加水平的准确度。
图17中示出了另一个多路复用系统800。系统800被配置成在没有单独的对照井的情况下使用单个井804来检测样本826内多个类型/不同类型的目标物质158a、158b、158c的存在和/或浓度。系统800包括井804、控制器808、存储器812和电源816。系统800还可以包括测试仪器(未示出),诸如图9的测试仪器518。井804包括由测试电极824a、824b、824c和对照电极824d共享的公共电极820。电极824a、824b、824c、824d、820、存储器812和电源816各自电连接到控制器808。存储器812包括被配置成引起控制器808实现与图3的方法300类似/相同的方法的程序834。控制器808基本上与控制器132相同,电源816基本上与电源116相同,并且存储器812基本上与存储器124相同。
图17的系统800类似于图9的系统500,但是不同之处在于井804是系统500的测试井504和对照井506的组合。井804包括样本826,样本826在试剂溶液150内具有三个不同的目标物质158a、158b、158c和三个不同的检测剂170a、170b、170c,试剂溶液150包括标签174。此外,存在被结合到对应的电极824a、824b、824c的三个不同的捕获剂166a、166b、166c。在图17中,目标物质158a、158b、158c各自被不同地图示。捕获剂166a、166b、166c和检测剂170a、170b、170c通过图17中的参考标号和字母是可区分的,但是具有相同的图形描绘。捕获剂166a仅结合到电极824a,捕获剂166b仅结合到电极824b,并且捕获剂166c仅结合到电极824c。系统800包括(在横截面中)大体上矩形的子调节区830a、830b、830c。线832a标识子调节区830a与子调节区830b之间的边界,并且线832b标识子调节区830b与子调节区820c之间的边界。调节线184将调节区182与非调节区186分离。
井804包括测试区域850和对照区域854。边界线858标识区域850、854之间的边界,但是在区域850、854之间不存在物理屏障。也就是说,区域850、854被流体地连接,并且样本826在两个区域850、854之间自由移动。对照电极824d不包括被附接到其的捕获剂(包括捕获剂166a、166b、166c)的任何分子。换句话说,对照电极824d没有捕获剂166a、166b、166c。因而,即使对照电极824d暴露于包括目标物质158a、158b、158c的样本826,在对照电极824d与样本826的任何分子之间也没有特异性结合(specificbinding)。也就是说,样本826内没有分子被配置成直接结合到对照电极824d。因此,对照区域854的输出信号(即光输出或其他可检测的输出)仅基于假检测分子212。在操作中,从子调节区830a、830b、830c的输出信号(即光输出或其他可检测的输出)中减去对照区域854的输出信号,以得出试验结果。
系统800使能实现以单个井的形式对于具有单个目标物质的样本或具有多个目标物质158a、158b、158c的多路复用样本826执行试验。系统800在图17中以与多路复用样本826一起使用的格式被图示。
图18中示出了另一个多路复用系统900。系统900被配置成在没有单独的对照井的情况下使用单个井904来检测样本926内多个类型/不同类型的目标物质158a、158b、158c的存在和/或浓度。系统900包括井904、控制器908、存储器912和电源916。系统900还可以包括测试仪器(未示出),诸如图9的测试仪器518。井904包括公共电极920和公共测试电极924。电极920、924、存储器912和电源916各自电连接到控制器908。存储器912包括被配置成引起控制器908实现与图3的方法300类似/相同的方法的程序934。控制器908基本上与控制器132相同,电源916基本上与电源116相同,并且存储器912基本上与存储器124相同。
图18的系统900基本上与图17的系统800相同,但是不同之处在于系统900仅包括一个测试电极920,而不是图17的间隔开的多个测试电极824a、824b、824c。如图18中所示,单个电极920从测试区域950延伸到对照区域954。此外,三个不同类型的捕获剂166a、166b、166c在电极920的三个不同的图案化位置982、984、986处结合到电极920。图案化位置982、984、986可以各自具有相同的图案,或者位置982、984、986可以各自具有对应于捕获剂166a、166b、166c中的特定一个的不同图案。也就是说,例如,图案化位置982可以用引起仅仅捕获剂166a结合到其同时防止捕获剂166b、166c结合到其的方式被图案化。在一个实施例中,电极924可以使用点阵列(spottedarray)方案来被图案化。
样本926包括试剂溶液150内的三个不同的目标物质158a、158b、158c和三个不同的检测剂170a、170b、170c,试剂溶液150包括标签174。此外,三个不同的捕获剂166a、166b、166c结合到电极924。在图18中,目标物质158a、158b、158c各自被不同地图示。捕获剂166a、166b、166c和检测剂170a、170b、170c通过图18中的参考标号和字母是可区分的,但是具有相同的图形描绘。捕获剂166a仅结合到图案化位置982,捕获剂166b仅结合到图案化位置984,并且捕获剂166c仅结合到图案化位置986。没有位于对照区域954中的结合的捕获剂分子166a、166b、166c。系统900包括(在横截面中)大体上矩形的子调节区930a、930b、930c。线932a标识子调节区930a与子调节区930b之间的边界,并且线932b标识子调节区930b与子调节区920c之间的边界。调节线184将调节区182与非调节区186分离。边界线958标识区域950、954之间的边界,但是在区域950、954之间不存在物理屏障。也就是说,区域950、954被流体地连接,并且样本926在两个区域950、954之间自由移动。
在对系统900的输出进行检测中,测试仪器(诸如测试仪器518)被定位成使用传感器522a检测来自子调节区930a的光输出,使用传感器522b检测来自子调节区930b的光输出,以及使用传感器522c检测来自子调节区930c的光输出。由对照区域954的任何部分中的测试仪器518的另一个传感器检测控制信号。
虽然已经在附图和前面的描述中详细地图示和描述了本公开,但是应当认为本公开在特性上是说明性的,而不是限制性的。理解到,已经呈现了仅优选实施例,并且期望保护进入本公开的精神内的所有改变、修改和另外的应用。
- 还没有人留言评论。精彩留言会获得点赞!