一种单细胞液滴/单液滴发生系统及其使用方法与流程
本发明属于原子光谱与质谱检测设备和分析技术领域,特别涉及一种单细胞液滴/单液滴发生系统及其使用方法。
背景技术:
电感耦合等离子体质谱仪(inductivelycoupledplasmamassspectrometry,icpms)是一种公认的最强有力的痕量元素分析技术,目前已经广泛应用于材料、环境、食品、医药等领域的痕量元素分析。它具有对多元素的高选择性、高灵敏度,极低的检出限,极宽的线性动态范围,谱线简单干扰少,分析速度快,以及与结构无关、与其它方法联用可广泛应到生物样品的特性,且能够得到确切的定性定量的结果。单细胞分析是近年来一个重要的研究领域,电感耦合等离子体质谱仪由于其出色的痕量元素分析能力,在单细胞检测方面起到了关键性作用。近些年来金属纳米粒子,特别是功能化的金属纳米粒子广泛应用于生物成像、胞内传感、疾病治疗等方向,但对于其在细胞内的积累、分布与异质性情况鲜有报道。因此设计一种高通量的单细胞分析系统对于阐明纳米粒子对细胞或活生物体的影响非常重要。
目前,基于电感耦合等离子体质谱仪的单细胞检测方法有以下几种方式:1.细胞悬浮液直接进样,包括采用常规雾化器和总消耗雾化器进样;2.液滴式进样,包括喷射打印式和微流控液滴封装式;3.激光剥蚀进样。
细胞悬浮液直接进样是将消化下来的细胞稀释到一定浓度,根据进样效率和概率计算,使得在电感耦合等离子体质谱仪的一个积分时间内,有且只有一个细胞能被检测到,从而实现单细胞的直接检测。但是,细胞悬液中细胞是随机分布的,而且气动雾化系统中雾化产物的产生也是随机的,根据泊松分布公式可以计算出两个细胞被同时检测到的概率比较大,因此很难确定信号峰是代表单细胞还是多细胞,这对单细胞检测是不利的。同样,当使用总消耗雾化器进样时,虽然进样效率得到了极大的提高,但是没有根本上解决随机进样的问题,而且,随着进样效率的提高,多细胞被同时检测的概率也会随之增加。
液滴式进样原则上是将细胞与细胞之间间隔开来,以大大降低多细胞检测概率。目前报道的基于液滴式进样的方式大体有两种,一种是基于喷射打印装置,由于进样管尖端的压电结构,在脉冲电的作用下,使连续的液流分裂成皮升级液滴,在优化的细胞密度等条件下,可以实现单细胞的液滴封装。在经过特殊设计的接口,可以实现基于电感耦合等离子体质谱仪的单细胞检测。虽然这种方式具有高精确度,但是检测效率低,同样,该装置成本以及维护费用较高,不适用于广泛应用。另一种基于微流控芯片的液滴封装系统,增加了检测效率,降低了使用成本,但是由于微流控本身存在的问题,例如重现性差,压力耐受性差,以及表面性质等问题,制约了其进一步的应用。
激光剥蚀进样是利用激光的高能量,在一定的光斑条件下,将单细胞激发成气态样品,被载气带入电感耦合等离子体质谱仪进行检测。但激光器价格高昂,同样不能广泛应用。
技术实现要素:
针对现有单细胞电感耦合等离子体质谱仪检测技术中液滴封装进样存在的问题,本发明提供一种三维易组装的单细胞液滴/单液滴发生系统及其使用方法;是将单细胞液滴/单液滴发生系统与电感耦合等离子体质谱仪联用对单细胞或单液滴进行的检测方法;适用于单细胞液滴/单液滴电感耦合等离子体质谱分析;该系统采用商业化的四通模块以及不同尺寸的毛细管构建流动聚焦液滴发生系统并与电感耦合等离子体质谱仪联用,实现对单细胞液滴/单液滴中纳米粒子的分析检测。该装置具有组装容易,高压稳定,可控性好,无需单独接口设计等优点。细胞悬浮液作为水性分散相由流式聚焦原理的结构喷射并被油性连续相切割包裹,最终通过雾化系统将产生的含有单细胞的液滴引入电感耦合等离子体质谱仪检测。在优化的条件下,保证了单细胞的高效封装和高效检测。基于开发的单细胞液滴/单液滴发生联用电感耦合等离子体质谱仪分析系统,我们实现了稳定的高效的单细胞封装和分析,该方法可用于单细胞水平下检测细胞内纳米粒子的含量及其分布情况。
本发明的目的是通过以下技术方案来实现的:
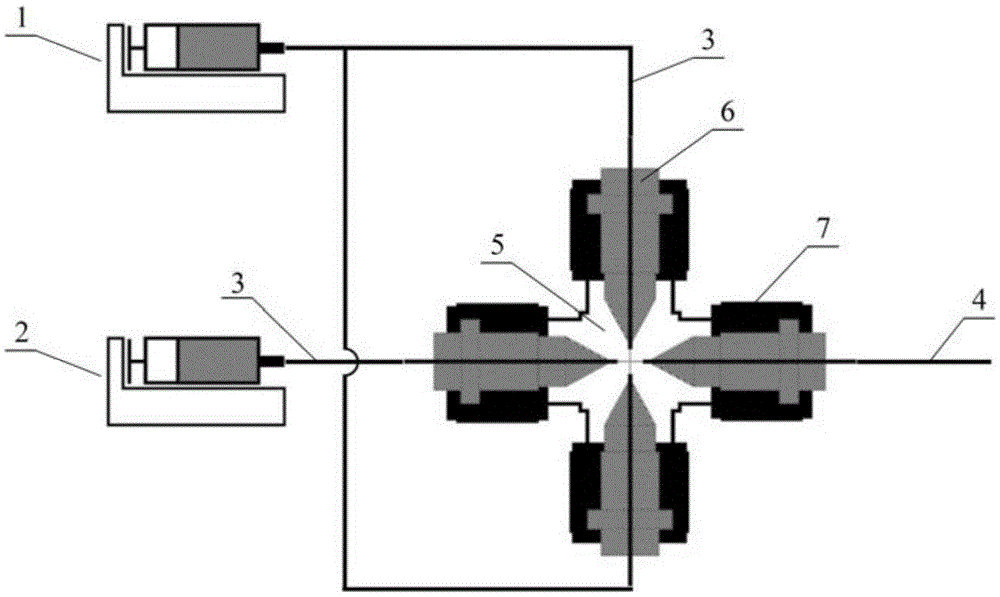
一种单细胞液滴/单液滴发生系统,包括连续相注射泵、分散相注射泵、含十字交叉通道的四通、四件第一毛细管套管、四件内牙螺盖及四根毛细管组成;四件第一毛细管套管分别套在四根毛细管上,将四根毛细管端口与含十字交叉通道的四通通道端口紧密相连,通过四件内牙螺盖将第一毛细管套管和毛细管固定于含十字交叉通道的四通上;连续相注射泵与一组相对的毛细管相连通,相对的毛细管通道为连续相通道,分散相注射泵与第三毛细管相连通,第三毛细管为分散相通道,第四毛细管为出口通道,四根毛细管均穿过四件第一毛细管套管和四件内牙螺盖并紧紧贴于含十字交叉通道的四通的通道端口处;
所述的单细胞液滴/单液滴发生系统中,含十字交叉通道的四通其中的两个相对的连续相通道入口,对应第一件毛细管和第二件毛细管;另外的一个分散相通道,其入口对应第三件毛细管,出口通道对应第四件毛细管,所述根据流动聚焦原理设计;
所述的单细胞液滴/单液滴发生系统中,含十字交叉通道的四通的通道体积为17~106nl,第一件毛细管、第二件毛细管和第三件毛细管的内径均为100~250μm,外径均为300~400μm;第四件毛细管的内径为40~150μm,外径为150~360μm;
所述的单细胞液滴/单液滴发生系统,还包括雾化装置和电感耦合等离子体质谱仪,所述的雾化装置包括雾化器和雾化室;第四毛细管穿过第二毛细管套管与雾化器溶液通道相连,并穿过雾化器溶液通道,使第四毛细管出口端与雾化器终端相差0~4mm;高纯氩气经载气入口进入雾化器气体通道;雾化器终端伸入雾化室1/3~1/2位置,雾化室内腔为圆柱形或圆锥形通道,雾化室容积为10~40ml,雾化室与雾化器同心设置,雾化室内腔的轴向有效长度与径向有效长度比为(5~2):(2~1),雾化室的出口与雾化器同向设置;雾化室出口与电感耦合等离子体质谱仪的进样口直接相连;高纯氧气作为辅助气体经辅助气入口进入雾化室;
所述单细胞液滴/单液滴发生系统所产生的液滴被引入到雾化装置雾化,雾化产物随载气和辅助气进入电感耦合等离子体质谱仪检测。
本发明的单细胞液滴/单液滴发生系统使用方法,采用液滴发生系统,包括如下步骤:
步骤1,由连续相注射泵提供含添加剂的有机溶液,所述的有机溶液为低碳链有机醇,添加剂为碳酸二甲酯和表面活性剂的混合剂,低碳链有机醇与碳酸二甲酯的体积比为100:(10~20),低碳链有机醇与表面活性剂的体积与质量比为100ml:(1~2.5)mg;由分散相注射泵提供细胞悬浮液;
步骤2,根据流动聚焦原理,固定第三毛细管内分散相流速,逐步增加第一毛细管和第二毛细管连续相流速,连续相施加在分散相上的剪切力逐渐增加,最终分散相被剪切成连续的液滴,随着连续相流速的进一步增加,分散相液滴的直径逐渐减小;当液滴直径减小至15~30μm时,实现对单细胞的封装,制得单细胞液滴/单液滴;
所述的单细胞液滴/单液滴发生系统使用方法,其中:
所述步骤1中,细胞内含纳米粒子的细胞悬浮液的制备方法为:(1)在细胞培养瓶中,将第一培养基中培养细胞至对数生长期,去除第一培养基并清洗;(2)在细胞培养瓶中,换入含有纳米粒子溶液的第二培养基培养,孵育细胞;(3)将孵育好的细胞从细胞培养瓶中消化下来,并进行离心清洗,用磷酸缓冲溶液(0.01mol/lpo43-,ph=7.4)重悬离心产物以制成细胞悬浮液;(4)使用血球计数板对细胞悬浮液中的细胞进行计数,并用磷酸缓冲溶液稀释至细胞数密度为104~106cells/ml;
所述步骤1中,连续相内加入一定比例的碳酸二甲酯,可保证仪器稳定运行,并有效减少采样锥孔处的碳沉积;
所述步骤2中,连续相流速为40~100μl/min,分散相流速为5~10μl/min;
本发明的单细胞液滴/单液滴发生系统使用方法,采用包含雾化装置和电感耦合等离子体质谱仪对液滴发生器产生的单细胞液滴/单液滴进行检测,包括如下步骤:
步骤1,由连续相注射泵提供含有添加剂的有机溶液,所述的有机溶液为低碳链有机醇,添加剂为碳酸二甲酯和表面活性剂的混合剂,低碳链有机醇与碳酸二甲酯的体积比为100:(10~20),低碳链有机醇与表面活性剂的体积与质量比为100ml:(1~2.5)mg;由分散相注射泵提供细胞悬浮液;
步骤2,根据流动聚焦原理,固定第三毛细管内分散相流速,逐步增加第一毛细管和第二毛细管连续相流速,连续相施加在分散相上的剪切力逐渐增加,最终分散相被剪切成连续的液滴,随着连续相流速的进一步增加,分散相液滴的直径逐渐减小;当液滴直径减小至15~30μm时,实现对单细胞的封装,制得单细胞液滴/单液滴;
步骤3,单细胞液滴/单液滴由第四毛细管引入雾化器出口,在雾化器出口被载气入口进入的氩气雾化;
步骤4,雾化产物随载气氩气和辅助气氧气进入电感耦合等离子体质谱仪检测;
步骤5,清洗单细胞液滴/单液滴发生系统和雾化器,再次进样检测。
所述的单细胞液滴/单液滴发生系统使用方法,采用包含雾化装置和电感耦合等离子体质谱仪对液滴发生器产生的单细胞液滴/单液滴进行检测,其中:
所述步骤1中,细胞内含纳米粒子的细胞悬浮液的制备方法为:(1)在细胞培养瓶中,将第一培养基中培养细胞至对数生长期,去除第一培养基并清洗;(2)在细胞培养瓶中,换入含有纳米粒子溶液的第二培养基培养,孵育细胞;(3)将孵育好的细胞从细胞培养瓶中消化下来,并进行离心清洗,用磷酸缓冲溶液(0.01mol/lpo43-,ph=7.4)重悬离心产物以制成细胞悬浮液;(4)使用血球计数板对细胞悬浮液中的细胞进行计数,并用磷酸缓冲溶液稀释至细胞数密度为104~106cells/ml;
所述步骤1中,连续相内加入一定比例的碳酸二甲酯,可保证仪器稳定运行,并有效减少采样锥孔处的碳沉积;
所述步骤2中,连续相流速为40~100μl/min,分散相流速为5~10μl/min;
所述步骤3中,载气氩气的流量为0.6~1.2l/min,辅助气氧气的流量为20~50ml/min;
所述步骤3中,单细胞液滴/单液滴发生系统,出口通道对应的第四件毛细管与雾化装置的雾化器入口相连,并穿过雾化器液体管道,使第四毛细管出口端与雾化器终端相差0~4mm,液体样品在雾化器出口处雾化;
所述步骤4中,雾化产物在载气和辅助气带动下进入电感耦合等离子体质谱仪,在时间分辨模式下进行检测;捕捉并记录待测元素的瞬时信号随时间响应,根据迭代算法获取有效信号,根据有效信号获取信号强度-频率分布状况,并对频率分布状况进行高斯拟合;最后,根据有效信号数值和高斯拟合结果获得单细胞液滴/单液滴中待测物的量;
所述步骤4中,载气氩气和辅助气氧气的纯度均为99.999%;电感耦合等离子体质谱仪的功率为1300~1500w,积分时间为1~10ms;
所述的单细胞液滴/单液滴发生系统使用方法,采用包含雾化装置和电感耦合等离子体质谱仪对液滴发生器产生的单细胞液滴/单液滴进行检测,检测采样效率6~8%。
本发明的一种单细胞液滴/单液滴发生系统及其在单细胞检测中的使用方法,与现有技术相比,本发明的优势在于:
1、与传统喷射打印式微液滴发生系统相比,具有结构简单,价格低廉,通量高等特点;
2、与微流控液滴发生系统相比,具有耐高压(有利于实现更高通量),无需单独设计相关接口就可直接与电感耦合等离子体质谱仪联用,大大减小了不稳定液滴产生的概率;
3、本方法在连续相中加入碳酸二甲酯作为添加剂,不仅能弥补由于有机物的引入而导致的电感耦合等离子体温度下降的问题,减少氧气的使用,而且还能有效减少采样锥孔处的碳沉积,保证检测的稳定性,可连续稳定工作6~8小时。
4、采用自行设计的雾化器结构和小体积雾化室,相比于常规雾化器和常规雾化室,有效提高了样品引入效率。
附图说明
图1、单细胞液滴/单液滴发生系统结构示意图;
图2、雾化装置示意图;
图3、雾化器局部结构图;
图4、本发明单细胞液滴/单液滴发生-电感耦合等离子体质谱仪检测系统示意图;
其中,1、连续相微量注射泵,2、分散相微量注射泵,3、石英毛细管a,4、石英毛细管b,5、含十字交叉通道的四通(通道体积17~106nl,通道内径:100~200μm),6、第一毛细管套管(内径:300-400μm),7、内牙螺盖,8、第二毛细管套管(内径:100~380μm),9、雾化器,10、载气入口,11、辅助气入口,12、雾化室,13、雾化器溶液通道,14、雾化器气体通道,15、雾化产物,16、电感耦合等离子体质谱仪。
具体实施方式
下面结合附图和实施例对本发明的具体实施方式做详细说明。
实施例1
一种单细胞液滴/单液滴发生系统,如图1~4所示,包括连续相微量注射泵1、分散相微量注射泵2、石英毛细管3、4、含十字交叉通道的四通5、第一毛细管套管6、内牙螺盖7所组成;第一毛细管套管6分别套在石英毛细管a3、石英毛细管b4上,将石英毛细管a3、石英毛细管b4端口与含十字交叉通道的四通5的端口紧密相连,通过内牙螺盖8将第一毛细管套管7和石英毛细管a3、石英毛细管b4固定于含十字交叉通道的四通5上;连续相微量注射泵1与一组相对的石英毛细管a3相连通,相对的一组石英毛细管a3通道为连续相通道,分散相微量注射泵2与石英毛细管a3相连通,石英毛细管a3为分散相通道,石英毛细管b4为出口通道,石英毛细管a3、石英毛细管b4均穿过第一毛细管套管6和内牙螺盖7,并紧紧贴于含十字交叉通道的四通5的端口处。
其单细胞液滴/单液滴发生系统中,含十字交叉通道的四通5的通道体积为38nl,石英毛细管a3的内径均为150μm,外径均为360μm;石英毛细管b4的内径为100μm,外径为360μm。
单细胞液滴/单液滴发生系统所产生的液滴被引入到雾化装置雾化,雾化产物15随载气氩气和辅助气氧气进入电感耦合等离子体质谱仪16,在时间分辨模式下进行检测;
所述的雾化装置包括雾化器9和雾化室12;石英毛细管b4穿过第二毛细管套管8与雾化器溶液通道13相连,并穿过雾化器溶液通道13,使石英毛细管b4出口端与雾化器9终端相差0~4mm;高纯氩气经载气入口10进入雾化器气体通道14。雾化器9终端伸入雾化室12的位置为1/3,雾化室12内腔为圆柱形或圆锥形通道,雾化室12容积为30ml,雾化室12与雾化器9同心设置,雾化室12内腔的轴向有效长度与径向有效长度比为5:2,雾化室12的出口与雾化器9同向设置,高纯氧气作为辅助气体经辅助气入口11进入雾化室12;
一种单细胞液滴/单液滴发生系统使用方法一,采用所述的单细胞液滴/单液滴发生系统制备单细胞液滴/单液滴,包括如下步骤:
步骤1,由连续相微量注射泵1提供己醇:碳酸二甲酯:司盘80按体积:体积:质量=100ml:20ml:2.5mg的混合溶液,由分散相微量注射泵2提供无聚沉的金纳米粒子溶液(12nm,浓度1μmol/l,au原子的浓度);
步骤2,根据流动聚焦原理,固定分散相石英毛细管a3内流速5μl/min,逐步增加连续相石英毛细管a3的流速至70μl/min,分散相被剪切成直径为27μm的连续液滴;
本发明的单细胞液滴/单液滴发生系统使用方法二,采用包含雾化装置和电感耦合等离子体质谱仪对液滴发生器产生的单液滴进行检测,包括如下步骤:
步骤1和步骤2,同所述的一种单细胞液滴/单液滴发生系统使用方法一的步骤1和步骤2;
步骤3,单液滴由石英毛细管b4穿过雾化器溶液通道13,引入雾化器9出口,在雾化器9出口,被载气入口10进入的氩气(1.09l/min,99.999%)雾化。
步骤4,在雾化室12中雾化产物15随载气氩气和辅助气氧气(30ml/min,99.999%)带动下进入电感耦合等离子体质谱仪16,在时间分辨模式下进行检测;通过该液滴发生-电感耦合等离子体质谱仪联用系统,可以获得金纳米粒子液滴的瞬时信号随时间响应,根据迭代算法获取有效信号,根据有效信号获取信号强度-频率分布状况,并对频率分布状况进行高斯拟合;根据金的理化性质,可以得到一个液滴中金纳米粒子的个数以及样品引入效率。其中,电感耦合等离子体功率为1360w,积分时间为10ms。
步骤5,清洗单液滴发生系统和雾化器9,再次进样检测。
实施例2
一种单细胞液滴/单液滴发生系统,同实施例1。
一种单细胞液滴/单液滴发生系统使用方法一,采用所述的单细胞液滴/单液滴发生系统制备单细胞液滴/单液滴,包括如下步骤:
步骤1,由连续相微量注射泵1提供己醇:碳酸二甲酯:司盘80按体积:体积:质量=100ml:20ml:2.5mg的混合溶液,由分散相微量注射泵2提供在含金纳米粒子(12nm,浓度1μmol/l,au原子的浓度)培养基中孵育过的细胞的细胞悬浮液;
细胞内含金纳米粒子的细胞悬浮液的制备方法为:①在细胞培养瓶中,将第一培养基中培养细胞至对数生长期,去除第一培养基并清洗;②在细胞培养瓶中,换入含有一定纳米粒子溶液(12nm金纳米粒子,au原子的浓度1μmol/l)的新鲜培养基培养一定时间,孵育细胞;③将孵育好的细胞从细胞培养瓶中消化下来,并进行离心清洗,用磷酸缓冲溶液(0.01mol/lpo43-,ph=7.4)重悬离心产物以制成细胞悬浮液;④使用血球计数板对细胞悬浮液中的细胞进行计数,并用磷酸缓冲溶液稀释到所需细胞数浓度(106cells/ml);
步骤2,根据流动聚焦原理,固定分散相石英毛细管a3内流速5μl/min,逐步增加连续相石英毛细管a3的流速至70μl/min,当液滴直径减小至27μm时,实现对单细胞的封装,确保有细胞的液滴中,有且只有一个细胞;
本发明的单细胞液滴/单液滴发生系统使用方法二,采用包含雾化装置和电感耦合等离子体质谱仪对液滴发生器产生的单细胞液滴进行检测,包括如下步骤:
步骤1和步骤2,同所述的一种单细胞液滴/单液滴发生系统使用方法一的步骤1和步骤2;
步骤3,单液滴由石英毛细管b4穿过雾化器溶液通道13,引入雾化器9出口,在雾化器9出口,被载气入口10进入的氩气(1.09l/min,99.999%)雾化;
步骤4,在雾化室13中雾化产物15随载气氩气和辅助气氧气(30ml/min,99.999%)带动下进入电感耦合等离子体质谱仪16,在时间分辨模式下进行检测;通过该液滴发生-电感耦合等离子体质谱仪联用系统,可以获得金元素的瞬时信号随时间响应,根据迭代算法获取有效信号,根据有效信号获取信号强度-频率分布状况,并对频率分布状况进行高斯拟合;根据金的理化性质,获得单细胞中金纳米粒子的质量和数量,并获得金纳米粒子在细胞亚群中随时间的分布概况。其中,电感耦合等离子体功率为1360w,积分时间为10ms。
步骤5,清洗单细胞液滴发生系统和雾化器9,准备进行下一次进样检测。
实施例3
一种单细胞液滴/单液滴发生系统,同实施例1。
一种单细胞液滴/单液滴发生系统使用方法一,采用所述的单细胞液滴/单液滴发生系统制备单细胞液滴/单液滴,包括如下步骤:
步骤1,由连续相微量注射泵1提供己醇:碳酸二甲酯:司盘80按体积:体积:质量=100ml:20ml:2.5mg的混合溶液,由分散相微量注射泵2提供在含上转换纳米粒子(50nm,浓度1μg/l)培养基中孵育过的细胞的细胞悬浮液;
细胞内含上转换纳米粒子的细胞悬浮液的制备方法为:①在细胞培养瓶中,将第一培养基中培养细胞至对数生长期,去除第一培养基并清洗;②在细胞培养瓶中,换入含有一定纳米粒子溶液(50nm上转换纳米粒子,浓度1μg/l)的新鲜培养基培养一定时间,孵育细胞;③将孵育好的细胞从细胞培养瓶中消化下来,并进行离心清洗,用磷酸缓冲溶液(0.01mol/lpo43-,ph=7.4)重悬离心产物以制成细胞悬浮液;④使用血球计数板对细胞悬浮液中的细胞进行计数,并由磷酸缓冲溶液稀释到所需细胞数浓度(106cells/ml);
步骤2,根据流动聚焦原理,固定分散相石英毛细管a3内流速5μl/min,逐步增加连续相石英毛细管a3的流速至70μl/min,当液滴直径减小至27μm时,实现对单细胞的封装;确保有细胞的液滴中,有且只有一个细胞;
本发明的单细胞液滴/单液滴发生系统使用方法二,采用包含雾化装置和电感耦合等离子体质谱仪对液滴发生器产生的单细胞液滴进行检测,包括如下步骤:
步骤1和步骤2,同所述的一种单细胞液滴/单液滴发生系统使用方法一的步骤1和步骤2;
步骤3,单液滴由石英毛细管b4穿过雾化器溶液通道13,引入雾化器9出口,在雾化器9出口,被载气入口10进入的氩气(1.09l/min,99.999%)雾化;
步骤4,在雾化室12中雾化产物15随载气氩气和辅助气氧气(30ml/min,99.999%)带动下进入电感耦合等离子体质谱仪16,在时间分辨模式下进行检测;通过该液滴发生-电感耦合等离子体质谱仪联用系统,可以获得钇元素的瞬时信号随时间响应,根据迭代算法获取有效信号,根据有效信号获取信号强度-频率分布状况,并对频率分布状况进行高斯拟合,并获得上转换纳米粒子在细胞亚群中随时间的分布概况。其中,电感耦合等离子体功率为1360w,积分时间为10ms。
步骤5,清洗单细胞液滴发生系统和雾化器9,准备进行下一次进样检测。
- 还没有人留言评论。精彩留言会获得点赞!