数字微流控芯片及基于其的病原体免疫检测方法与流程
本发明涉及微流控芯片技术领域,具体涉及一种数字微流控芯片及基于其的病原体免疫检测方法。
背景技术:
免疫检测是目前临床检测中最重要的检测手段之一,应用于疾病诊断、病原体筛查、药物检测等方面,在环境监测、食品安全等领域也有广泛应用。上世纪80年代以来,自动化检测技术的引进与改进,使得自动化、高通量免疫分析成为可能,大大促进了免疫检测技术的应用推广。
目前的自动化免疫检测仪器存在操作繁琐、反应缓慢、耗时长、试剂及样品消耗量大、检测成本高等缺点。同时,检测设备结构复杂、依赖高精密制造技术、价格昂贵、体积庞大,需要经培训的专业人员进行操作。此外,目前的自动化免疫检测仪器主要为批量化检测而设计,多数仪器只提供2-3个应急检测通道,灵活性差,不适宜零星样本的检测。随着床边检测(point-of-care)、家庭健康检测(homehealthtests)、远程诊断(tele-diagnosis)等概念的提出,以及社区医院的发展,现有的自动化免疫检测仪器已不能满足现代医疗发展模式的需求。而以胶体金技术为代表的试纸条检测,虽然使用方便,但其检测目标有限且检测灵敏度较低,检测效果有限。
技术实现要素:
本发明为了解决上述技术问题,提供了一种数字微流控芯片及基于其的病原体免疫检测方法,反应时间短,检测灵敏度高,成本低。
为了达到上述技术效果,本发明包括以下技术方案:第一方面,本发明提供了一种病原体免疫检测方法,包括如下步骤:
(1)制作数字微流控芯片:所述数字微流控芯片包括上样孔、形成试剂储池的试剂电极、形成液滴运行通道的输运电极以及形成检测区的检测电极;
(2)在所述数字微流控芯片的检测区修饰抗原;
(3)加入样本并运行数字微流控芯片,通过荧光检测系统ccd拍照检测荧光信号并进行定量分析。
进一步地,所述制作数字微流控芯片的具体步骤包括:
步骤1:制作下层微流控芯片:
(1)在基底上设置电极层;所述电极层包括形成试剂储池的试剂电极、形成液滴运行通道的输运电极以及形成检测区的检测电极;
(2)所述电极层上设置sio2绝缘层;
步骤2:制作上层微流控芯片:
(1)所述上层微流控芯片采用ito导电玻璃,在所述ito导电玻璃上开设有上样孔,所述上样孔与所述液滴运行通道相通;
(2)所述上层微流控芯片上设置试剂储池口,所述试剂储池口和试剂电极共同形成试剂储池;
步骤3:将所述上层微流控芯片和下层微流控芯片上下叠合在一起。
所述在所述数字微流控芯片的检测区修饰抗原,包括:
(1)采用多层微纳加工技术,在检测电极上的绝缘层表面沉积金膜,并利用湿法刻蚀技术进行图案化;
(2)在沉积有金膜的检测电极上包被抗原。
进一步地,所述加入样本并运行数字微流控芯片,通过荧光检测系统ccd拍照检测荧光信号并进行定量分析,具体为:
(3.1)将血清样品由上样孔的位置处加入,血清样品经由输运电极形成的液体运行通道输送至其中一个检测区,血清样品在相应检测区与邻近电极间往复运动,使血清中的抗体与检测区修饰的抗原充分反应;
(3.2)由试剂储池产生的荧光标记二抗液滴输运至检测区,与吸附在检测区表面的抗体反应,该抗体为一抗,孵育时液滴在检测区与相邻电极间间歇往复运动,促进抗体的识别与结合;
(3.3)通过荧光检测系统ccd拍照检测荧光信号并进行定量分析。
在检测中,由于往复流的混匀作用,血清中的抗体不会形成通常elisa检测中的抗体浓度梯度差,提高了液体与抗原接触面的抗体浓度,抗原抗体的结合速度与结合效率将大大提高,缩短反应时间,提高检测灵敏度。
优选地,所述检测区修饰的抗原为core、ns3、ns4混合抗原,所述二抗使用dylight-488标记igg。具有更强的荧光强度和更高的稳定性,荧光抗体的使用有利于增强检测信号,提高检测灵敏度。
第二方面,本发明提供了一种数字微流控芯片,上述的病原体免疫检测方法采用所述数字微流控芯片,所述数字微流控芯片包括上下叠合设置的下层微流控芯片和上层微流控芯片,所述下层微流控芯片上设有多个电极,所述多个电极包括对应形成试剂储池的试剂电极、形成检测区的检测电极以及形成液滴运行通道的输运电极;所述上层微流控芯片上设有贯通所述上层微流控芯片的上样孔。
进一步地,所述微流控芯片包括基底层,所述多个电极间隔平铺于所述基底层表面,所述电极上形成有绝缘层,所述检测电极上的绝缘层表面沉积有金膜。
采用上述技术方案,包括以下有益效果:本发明所提供的数字微流控芯片及基于其的病原体免疫检测方法,反应时间短,检测灵敏度高,外围设备简单,灵活性强,能耗低;由于机械部件少,维护量小,能够满足社区医院、远程诊疗等场合的需求,适于构建便携式分析平台;既可以批量分析,也可以分析单个样本,对样本量的适应性强。
附图说明
图1为本发明所提供病原体免疫检测数字微流控芯片的结构示意图;
图2为本发明所提供病原体免疫检测数字微流控芯片的电极布置示意图。
图中,
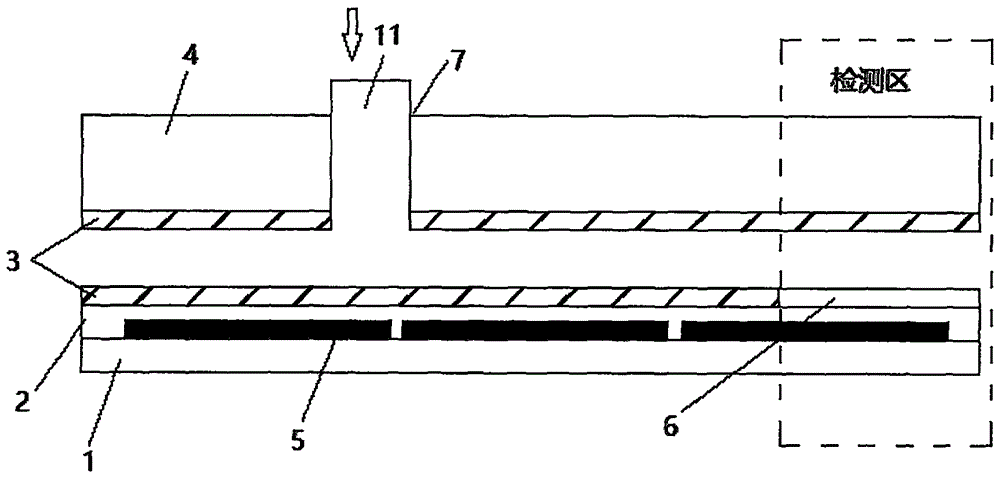
1、基底层;2、绝缘层;3、特氟龙层;4、导电玻璃层;5、电极;6、金膜;7、特氟龙管;8、pbs池;9、废液储池;10、试剂储池;11、上样孔;12、检测区;13、输运电极;14、第一通道;15、第二通道;16、第三通道。
具体实施方式
下面通过具体的实施例并结合附图对本发明做进一步的详细描述。
实施例:
本实施例提供了一种病原体免疫检测方法,所述检测方法采用数字微流控芯片,所述微流控芯片包括上下叠合设置的下层微流控芯片和上层微流控芯片,所述下层微流控芯片上设有多个电极,具体地,所述下层微流控芯片包括基底层1,所述多个电极间隔平铺于所述基底层表面,所述电极上形成有绝缘层2,所述检测电极上的绝缘层2表面沉积有金膜6。本实施例中,优选地,所述基底层1为玻璃基底层,所述绝缘层为sio2绝缘层,所述导电玻璃为ito导电玻璃。
所述多个电极包括对应形成试剂储池10的试剂电极、形成废液储池9的废液电极、形成pbs池8的pbs电极、形成检测区12的检测电极以及形成液滴运行通道的输运电极13;所述上层微流控芯片上设有贯通所述上层微流控芯片的上样孔11,所述上样孔11覆盖所述pbs池8所在液体运行通道上的一个输运电极。整个下层微流控芯片涂覆有特氟龙层3,所述金膜6表面的特氟龙层经洗脱后脱离。检测区处的金膜表面包被有hcv抗原。
所述上层微流控芯片包括导电玻璃层4,所述导电玻璃层底面涂覆有特氟龙层3,所述上样孔贯通所述导电玻璃层。所述上样孔11内插设有特氟龙管。在上、下层微流控芯片上涂敷特氟龙层,能够减小样本在电极上的黏附,降低液滴运动的阻力,同时有利于降低样品间交叉污染的可能性。
所述液滴运行通道包括分设两列的第一通道14、第二通道15以及连接两个通道的第三通道16,所述第一通道为pbs池所在液体运行通道,所述第二通道为试剂池所在液体运行通道。
为了提高对样本量的适应性,所述检测区有24个且均分四列,每列有6个,其中两列分别位于所述第一通道两侧,另外两列位于所述第二通道两侧,所述上样孔、pbs池、试剂池、废液池和检测区通过输运电极连通。
采用上述数字微流控芯片的病原体免疫检测方法包括如下步骤:
s1、制作数字微流控芯片;
步骤1:制作下层微流控芯片:
(1)在基底上设置电极层;所述电极层包括形成试剂储池的试剂电极、形成液滴运行通道的输运电极以及形成检测区的检测电极;
所设置的电极层包括形成废液储池的废液电极和形成pbs池的pbs电极,所述上层微流控芯片上设置有废液储池口和pbs池口,所述废液储池口和所述废液电极共同形成所述废液储池,所述pbs池口和所述pbs电极共同形成所述pbs池;所述废液储池、pbs池分别与所述液体运行通道相通。
(2)所述电极层上设置sio2绝缘层;
二氧化硅薄膜绝缘性和稳定性良好,膜层牢固,应用广泛。本实施例采用磁控溅射法制备sio2薄膜;磁控溅射中阴极尺寸(目标尺寸)可以按比例扩大,生产工艺易于放大,适于进行商业化生产。
步骤2:制作上层微流控芯片:
(1)所述上层微流控芯片采用ito导电玻璃,在所述ito导电玻璃上开设有上样孔,所述上样孔与所述液滴运行通道相通;
在ito玻璃上旋涂1.5%teflonaf1600,然后175℃烘烤30min,使特氟龙镀层固化;特氟龙层能够减少液滴运动的阻力,同时降低样品或试剂在电极上的吸附,降低污染的可能性。
(2)所述上层微流控芯片上设置试剂储池口,用于试剂注入;所述试剂储池口和试剂电极共同形成试剂储池;
步骤3:将所述上层微流控芯片和下层微流控芯片上下叠合在一起。
s2、在所述数字微流控芯片的检测区修饰抗原,包括:
s201、采用多层微纳加工技术,在检测电极上的绝缘层表面沉积金膜,并利用湿法刻蚀技术进行图案化;
在溅射了sio2绝缘层的芯片表面旋涂正性光刻胶,用掩膜遮盖检测电极以外的区域,紫外曝光15s,用5%naoh洗去曝光区域(电极)的正胶;溅射300nm厚的金膜;整体紫外曝光15s,用5%naoh洗去曝光区域(检测电极以外区域)的正胶,溅射在正胶上的金膜也会同时被洗去,仅留下电极上的金膜。
还包括加工特氟龙层:在芯片表面旋涂正性光刻胶,用掩膜遮盖检测电极区域,紫外曝光15s,用5%naoh洗去曝光区域(检测电极以外区域)的正胶;旋涂1.5%teflonaf1600,然后175℃烘烤30min,使特氟龙镀层固化;整体紫外曝光15s,用5%naoh洗去检测电极上剩余的正胶,涂覆在正胶上的特氟龙也会同时被洗去,留下未被特氟龙覆盖的金膜表面。
s202、在沉积有金膜的检测电极上包被抗原,具体为:
(1)将抗原用pbs缓冲液稀释至0.1mg/ml;
(2)取2.0mg盐酸硫醇亚胺溶于1.0ml蒸馏水中,得到浓度为2.0mg/ml的巯基化试剂;
(3)将1.0ml上述步骤(1)的抗原溶液和25μl上述步骤(2)的巯基化试剂混合,室温条件下搅拌反应0.5h;
(4)用20mm的pbs缓冲液,其中含0.15mnacl和1.0mmedta,ph为7.2,对步骤(3)所得到的反应液透析48h,期间每2h更换一次透析液,得到巯基化抗原溶液;
(5)将镀有金膜的芯片洗净并晾干,在待包被金膜表面滴加3μl步骤(4)中所获得的巯基化抗原溶液,使其完全覆盖金膜表面,37℃温育1h。
s3、加入样本并运行数字微流控芯片,通过荧光检测系统ccd拍照检测荧光信号并进行定量分析。
所述加入样本并运行数字微流控芯片,通过荧光检测系统ccd拍照检测荧光信号并进行定量分析,具体为:
s301、将血清样品由上样孔的位置处加入,血清样品经由输运电极形成的液体运行通道输送至其中一个检测区,血清样品在相应检测区与邻近电极间往复运动,使血清中的抗体与检测区修饰的抗原充分反应;
s302、从pbs池生成pbs液滴,清洗上样孔处的残留样品,废液排出到废液池;
s303、反应后的废液经输运电极运至废液池,经注射器手动抽出;
s304、由pbs储池产生的一个pbs液滴输运至检测区,同样进行往复运动,洗去残留血清,废液排至废液池,重复2-3次;
s305、由试剂储池产生的荧光标记二抗液滴输运至检测区,与吸附在检测区表面的抗体反应,该抗体为一抗,孵育时液滴在检测区与相邻电极间间歇往复运动,促进抗体的识别与结合;
所述检测区修饰的抗原为core、ns3、ns4混合抗原,所述二抗使用dylight-488标记igg。
s306、废液排出后用pbs液滴润洗,重复2-3次;
s307、通过荧光检测系统ccd拍照检测荧光信号并进行定量分析。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!