维生素D的测定方法与流程
本发明涉及化学发光检测
技术领域:
,特别涉及一种维生素d的测定方法。
背景技术:
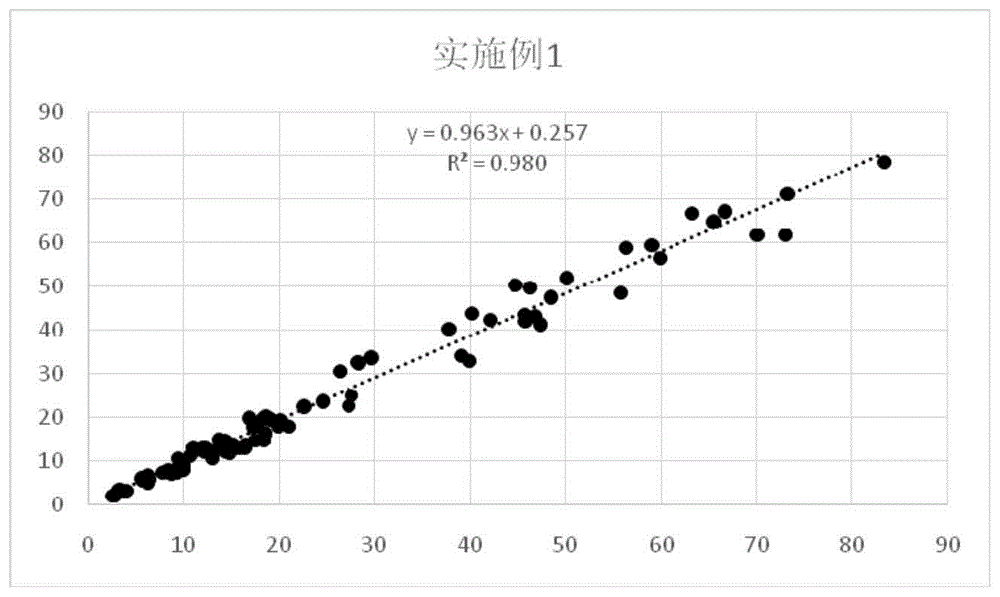
:在临床实践中,25-羟基-维生素d的血清水平被认为是维生素d状态的主要指标。血清中几乎所有循环25(oh)-维生素d是与维生素d结合蛋白(88%)和白蛋白(12%)结合。维生素d结合蛋白(dbp)是血清浓度250-400mg/l的含量丰富的蛋白。维生素d以接近抗体合力的相对高亲合力(5*108m-1)与dbp结合血清中维生素d浓度的精确测量需要从dbp上释放结合的维生素d。目前维生素d(vd)解离液也有以下几种,但都具有相应的技术缺陷。1)有机溶剂提取法,如使用乙腈提取,其原理是通过相似相溶原理,将vd溶解到有机相中,使用离心机离心,获取含有vd的萃取液。该方法,vd解离后需要离心,不便于实现自动化操作。2)强酸、强碱法。依赖过高或或低的ph值维生素d结合蛋白变性或者构象变化,失去与维生素d的结合能力,从而将维生素d释放出来。该方法获取的维生素d溶液为高ph或低ph溶液,不利于下一步的vd与vd抗体发生免疫反应。3)竞争法。使用维生素d类似物对vd进行竞争性的取代替换,将vd从维生素d结合蛋白中替换出来。该方法的缺陷为,溶液中同时存在vd和vd类似物两种成分,vd类似物会干扰vd的检测,引发交叉反应。4)vd结合蛋白水解法。向样本中加入蛋白酶,使维生素d结合蛋白水解,从而释放维生素d。该方法的缺陷为酶水解时间过长,导致整个检测过程时间长。5)组合方法。目前较为常用的方法为使用ph3.8-4.8的试剂和5-30%dmso、液体有机酰胺、0.5-5%的短链醇钟提取维生素d。该方法含有dmso为剧毒物质,具有生物安全性风险。技术实现要素:本发明的主要目的是提供一种维生素d的测定方法,旨在提高血液中维生素d测定的精度。为实现上述目的,本发明提出的一种维生素d的测定方法,包括如下步骤:a、取解离液于反应杯中,加入血清、血浆或全血样本;b、转移至孵育盘上反应;c、取步骤b中反应后的混合物至新的反应管中作为处理后的样本;d、向步骤c中处理后的样本中加入维生素d单抗包被的磁珠,反应8min-15min后进行磁分离,去上清;e、向步骤d反应管中加入维生素的ap酶标记物,反应后进行磁分离,去上清;f、加入底物amppd或aps-5,测试反应的发光值,通过所述发光值得到维生素d的含量;其中,步骤a中的解离液包括如下组分:磷酸盐缓冲液,其中磷酸盐在所述25-羟基-维生素d解离液中的浓度为10mm-50mm;beta-巯基乙醇0.1%-2%;异硫氰胍0.1%-2%;edta-2na0.1%-2%;sds0.1%-2%;tween-200.1%-5%。在一实施例中,所述步骤b中,反应时间为5min~12min。在一实施例中,所述步骤b中,反应时间为7min~9min。在一实施例中,所述磷酸盐浓度为30mm-40mm。在一实施例中,所述beta-巯基乙醇的含量为0.5%-1%。在一实施例中,所述异硫氰胍0.5%-1%,所述edta-2na的含量为0.4%-1.2%。在一实施例中,所述sds的含量为0.5%-1%。在一实施例中,所述tween-20的含量为2%-4%。本发明技术方案通过将磷酸盐、beta-巯基乙醇、异硫氰胍、edta-2na、sds、tween-20按照合理的配比后,用于25-羟基-维生素d的降解,从而可以将维生素d充分且快速解离出来,提高了血液中维生素d的进度,减少了维生素d的测定时间。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。图1为本发明25-羟基-维生素d解离液第1实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图2为本发明25-羟基-维生素d解离液第2实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图3为本发明25-羟基-维生素d解离液第3实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图4为本发明25-羟基-维生素d解离液第4实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图5为本发明25-羟基-维生素d解离液第5实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图6为本发明25-羟基-维生素d解离液第6实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图7为本发明25-羟基-维生素d解离液第7实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图8为本发明25-羟基-维生素d解离液第8实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图9为本发明25-羟基-维生素d解离液第9实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图10为本发明25-羟基-维生素d解离液第10实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图11为本发明25-羟基-维生素d解离液第11实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图12为本发明25-羟基-维生素d解离液第12实施例对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图13为本发明25-羟基-维生素d解离液对比例1对样本进行解离测定浓度后,与罗氏测定数据相关线性图;图14为本发明25-羟基-维生素d解离液对比例2对样本进行解离测定浓度后,与罗氏测定数据相关线性图。具体实施方式下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明提出的一种维生素d的测定方法,包括如下步骤:a、取解离液于反应杯中,加入血清、血浆或全血样本;b、转移至孵育盘上反应;c、取步骤b中反应后的混合物至新的反应管中作为处理后的样本;d、向步骤c中处理后的样本中加入维生素d单抗包被的磁珠,反应8min-15min后进行磁分离,去上清;e、向步骤d反应管中加入维生素的ap酶标记物,反应后进行磁分离,去上清;f、加入底物amppd或aps-5,测试反应的发光值,通过所述发光值得到维生素d的含量;步骤a中的解离液(25-羟基-维生素d解离液)包括如下组分:磷酸盐缓冲液、beta-巯基乙醇、异硫氰酸胍、edta-2na、sds和tween-20。其具体配比如下:磷酸盐缓冲液,其中磷酸盐在所述25-羟基-维生素d解离液中的浓度为10mm-50mm;beta-巯基乙醇0.1%-2%;异硫氰胍0.1%-2%;edta-2na0.1%-2%;sds0.1%-2%;tween-200.1%-5%。在此,在解离过程中,磷酸盐缓冲液主要是用来提供缓冲环境,使反应在ph6.5-7.5的缓冲区间进行,该缓冲区间最适宜解离后的维生素d与维生素d单抗进行抗原抗体结合反应。下述内容将主要围绕解离液作详细阐述。beta-巯基乙醇是一种强还原剂,beta-巯基乙醇可以使维生素d结合蛋白构象发生变化,释放维生素d。异硫氰酸胍是一种强变性剂,使维生素d结合蛋白变性,继而释放更多的维生素d。edta-2na作为络合剂,它可以使变性后的维生素d结合蛋白发生聚集,沉淀,释放吸附的维生素d。sds是表面活性剂,破坏全血样本中的磷脂双分子层,便于维生素d结合蛋白与反应物质重复混合。tween-20是表面活性剂,它可以使解离的游离维生素d与后续维生素d抗体反应更具有特异性。为了验证本发明中,解离液对25-羟基-维生素d的解离效果,关于磷酸盐缓冲液、beta-巯基乙醇、异硫氰酸胍、edta-2na、sds及tween-20的比率作如下配比。具体的,磷酸盐在所述25-羟基-维生素d解离液中的浓度为10-50mm;beta-巯基乙醇0.1-2%;异硫氰酸胍0.1-2%;edta-2na0.1%-2%;sds0.1-2%;tween-200.1-5%。具体为12组实施例和2组对比例:实施例1物料名称配比含量/浓度磷酸盐缓冲液30mmbeta-巯基乙醇0.5%异硫氰酸胍2%edta-2na0.2%sds0.5%tween-202.0%实施例2物料名称配比含量/浓度磷酸盐缓冲液20mmbeta-巯基乙醇1.2%异硫氰酸胍1.2%edta-2na0.1%sds0.5%tween-203.0%实施例3物料名称配比含量/浓度磷酸盐缓冲液25mmbeta-巯基乙醇1.5%异硫氰酸胍0.5%edta-2na0.5%sds1.0%tween-204.0%实施例4物料名称配比含量/浓度磷酸盐缓冲液30mmbeta-巯基乙醇0.1%异硫氰酸胍0.6%edta-2na0.5%sds0.5%tween-205%实施例5物料名称配比含量/浓度磷酸盐缓冲液20mmbeta-巯基乙醇0.4%异硫氰酸胍0.1%edta-2na1.6%sds1.5%tween-200.5%实施例6物料名称配比含量/浓度磷酸盐缓冲液40mmbeta-巯基乙醇1.0%异硫氰酸胍0.8%edta-2na0.7%sds1.0%tween-200.2%实施例7实施例8物料名称配比含量/浓度磷酸盐缓冲液45mmbeta-巯基乙醇1.8%异硫氰酸胍1.8%edta-2na0.2%sds0.5%tween-201.5%实施例9物料名称配比含量/浓度磷酸盐缓冲液35mmbeta-巯基乙醇0.8%异硫氰酸胍0.4%edta-2na2%sds1.0%tween-200.1%实施例10物料名称配比含量/浓度磷酸盐缓冲液40mmbeta-巯基乙醇0.2%异硫氰酸胍0.9%edta-2na1%sds0.5%tween-203.5%实施例11实施例12物料名称配比含量/浓度磷酸盐缓冲液30mmbeta-巯基乙醇2%异硫氰酸胍0.4%edta-2na1.5%sds1.0%tween-201.0%反例1物料名称配比含量/浓度磷酸盐缓冲液5mmbeta-巯基乙醇3.0%异硫氰酸胍0.5%edta-2na0.05%sds1.0%tween-201.0%反例2物料名称配比含量/浓度磷酸盐缓冲液100mmbeta-巯基乙醇1.0%异硫氰酸胍0.05%edta-2na3.0%sds1.0%tween-201.0%一、线性的验证:采用88个标本,用上述12个实施例及2组对比例对88个标本分别进行解离,并通过化学发光的方法测定维生素d的浓度(ng/ml);同时获取88个标本的罗氏测定值(ng/ml)。然后通过每个实施例与罗氏测定值进行线性拟合,获取其相关性。表1结合表1至表14,图1至图14,可以看出,实施例1至实施例12的线性相关较好,r2值都在0.96以上,表明其相关性较佳。从图13和图14可以看出,r2值为0.88,相关性较低,在对比例1中,25-羟基-维生素d解离液中,磷酸盐缓冲液和beta-巯基乙醇超出预定范围,所以其解离效果一般,从而导致最终测定值偏差较大。在对比例2中,磷酸盐缓冲液、异硫氰酸胍和edta-2na都超出也与预定范围,所以其解离效果一般,从而导致最终测定值偏差也较大。另外,从实施例1至实施例12可以看出,就线性相关性而言,实施例1>实施例12>实施例6>实施例4>实施例10=实施例9>实施例3>实施例7=实施例8=实施例2>实施例5>实施例11。但是在12个实施例中,实施例1、4、6、9、10和12的r2值相对其他实施例而言更佳,而实施例1、4、6、9、10和12中,磷酸盐的浓度为30mm至40mm,所以,相对而言,磷酸盐的浓度在30mm至40mm范围内对r2值相对来说具有积极影响。另外,从线性排名来看,实施例4、实施例10是偏低的,而实施例4和实施例10对应的beta-巯基乙醇浓度偏低(依次为0.2%和0.3%)。其他实施例对应的beta-巯基乙醇浓度为0.5%,1%,由此可见,beta-巯基乙醇的浓度不易偏低,较佳范围为0.5%-1%。二、反应时间的测定取20个25-羟基-维生素d的样本(vd样本),用市场上的a产品(beckman的酶促化学发光试剂,其解离液组分)对20个样本进行解离,然后用化学发光的方法测定其浓度(ng/ml)。表2从反应时间上看,a产品对20个25-羟基-维生素d的解离在10分钟之后达到稳定。而从本实施例中可以看出,实施例1至实施例12大部分在3分钟内都可以达到a产品10分钟的效果,少部分虽然没有达到a产品10分钟的效果,但是也很接近。由此可见,本发明的25-羟基-维生素d解离液的解离时间大大缩短了,相对于市场上的产品,本发明的解离液解离时间缩短了2/3。三、对后续反应的影响解离液在对25-羟基-维生素d进行解离后,为了验证解离后的残留液对后续维生素d的测定是否有影响,实验如下:取20个25-羟基-维生素d样本,用市场上的a产品对其进行解离,然后测定化学发光的信号值(信号值越高,测定越准确,信号值越低,说明测定误差越大,也反应了释放维生素d后,对后续反应大)。表3从表3可以看出,实施例1至实施例12的信号强度相对于a产品而言大约高出50%,由此可见,相对于a产品而言,本发明的解离液对后续反应影响小得多。另外,tween-20是表面活性剂,它可以使解离的游离维生素d与后续维生素d抗体反应更具有特异性。所以,tween-20的浓度对信号强度有影响。挑选样本浓度较低的几个样本:样本7、11、14、16和19,在这5个样本中,实施例1的对应样本7、11、14、16和19的信号增加百分比依次为27.25%、43.42%、49.18%、35.21%和23.84%,平均为35.78%,同样,实施例2相对于样本7、11、14、16和19的信号增加百分比平均值为36.11%,实施例3为35.68%、实施例4为32.01%、实施例5为34.98%、实施例6为29.48%、实施例7为26.58、实施例8为33.17%、实施例9为33.92%、实施例10为39.97%、实施例11为35.31%、实施例12为34.50%。其中,实施例1、2、3、10、11对应的平均值都高于35%,且依次为:35.78%、36.11%、35.68%、39.97%和35.31%。而实施例1、2、3、10和11对应的tween-20的浓度范围为:2%-4%,由此可见,tween-20的浓度在该范围内对维生素d的充分解离具有积极贡献。四、解离充分性验证解离液在对25-羟基-维生素d进行解离后,为了验证解离是否充分,实验如下:取20个25-羟基-维生素d样本,用市场上的a产品、12组实施例、两组对比例对其进行解离,然后以10min和15min两个时间点分别测定维生素d的浓度。表4使用市场上a产品对维生素d样本进行处理,解离10分钟后,再增加反应时间,游离维生素d的量不再增加,说明达到了最大解离程度。使用本发明解离液,解离5分钟后,也可达到最大裂解程度,但裂解出的维生素d的量比a产品大约多出20%~30%,说明本发明解离液对维生素d的解离更加彻底。需要说明的是,异硫氰酸胍和edta-2na为两种对维生素d的解离起到决定性作用的试剂,其用量相当关键。异硫氰酸胍是一种强变性剂,使维生素d结合蛋白变性,继而释放更多的维生素d。另外,edta-2na作为络合剂,它可以使变性后的维生素d结合蛋白发生聚集,沉淀,释放吸附的维生素d。所以异硫氰酸胍和edta-2na的用量在一定程度上可以反应解离液的解离度。样本6、12和20的浓度较高,经过12个实施例解离后,实施例3、4、6、10、11相对于样本a的平均解离度分别对应高出29%、31%、28%、27%、27%。而实施例3、4、6、10、11对应的异硫氰酸胍浓度为0.5%-1%,对应的edta-2na浓度为0.4%-1.2%。另外,从实施例1、7和12可以看出,实施例1中异硫氰酸胍的浓度不满足0.5%-1%,但是edta-2na浓度满足0.4%-1.2%;实施例7中异硫氰酸胍的浓度满足0.5%-1%,但是edta-2na浓度不满足0.4%-1.2%;实施例12中异硫氰酸胍的浓度不满足0.5%-1%,但是edta-2na浓度满足0.4%-1.2%;实施例1、7和12对样本的解离效果相比实施例3、4、6、10、11要差,由此可见,异硫氰酸胍和edta-2na的浓度要同时对应满足0.5%-1%、0.4%-1.2%方可达到较佳的解离效果。sds是表面活性剂,破坏全血样本中的磷脂双分子层,便于维生素d结合蛋白与反应物质重复混合。sds的含量最佳在0.5%-1%。以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的
技术领域:
均包括在本发明的专利保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1