一种基于HPLC法对κ-酪蛋白分型检测的方法与流程
本发明属于分析技术领域,具体涉及一种基于hplc法对κ-酪蛋白分型的方法。
背景技术:
κ-酪蛋白是最重要的酪蛋白之一,通常是牛乳腺分泌的一种含有少量磷酸基的磷蛋白之一,它不仅在酪蛋白微团的稳定性方面起至关重要的作用,而且对奶牛泌乳性能及乳成分组成和奶酪品质均有一定程度的影响。许多研究结果表明,牛κ-酪蛋白基因可能会影响乳牛的产奶量、乳脂量、乳蛋白量、乳脂率和乳蛋白率,而且对牛乳的凝固特性和奶酪产量有显著影响。牛κ-酪蛋白现已发现13种变异体,主要是a、b及e三种变异体,均由核苷酸非同义替换造成,其中,b型κ-酪蛋白有利于增加乳蛋白量及奶酪产量。由于ae型和b型κ酪蛋白的性质非常接近,因此不易分型。目前主要通过毛细管电泳法和高效液相色谱法来分析蛋白的多态性,其中高效液相色谱法操作简单,灵敏度高,分离效果好,应用潜力较大。但针对κ-酪蛋白进行分型检测,还未见有报道。
技术实现要素:
为了解决上述技术问题,本发明提供一种基于hplc法对牛乳中κ-酪蛋白分型检测的方法,该方法能有效检测ae-κ酪蛋白、b-κ酪蛋白,该方法准确度高,重复性好,能够实现对批量样品的检测,而且方法简单易行,方便可靠。
为实现上述目的,本发明采用以下的技术方案为:
一种基于hplc法对κ-酪蛋白分型检测的方法,包括如下步骤:
s1、样品制备:向分装的冷冻奶样中加入等体积的工作液ⅰ,样品融化后振荡几秒混匀得混合液,室温静置;将混合液10000r/min4℃离心5min,除去表层乳脂,取底层溶液于新的离心管中,加入工作液ⅱ稀释,混匀,过滤到进样瓶中待测;
s2、标准品准备:配制κ-酪蛋白标准品,浓度为10g/l;
s3、色谱检测:
利用高效液相色谱对κ-酪蛋白标准品和样品进行检测,根据κ-酪蛋白标准品中ae型和b型各自的保留时间定性,峰面积定量,外标法绘制工作曲线计算ae型和b型κ-酪蛋白的含量。
如上所述的分型检测方法,优选地,在步骤s1中,所述工作液ⅰ为包含有0.1mol/lbistris,6mol/l盐酸胍,5.37mmol/l柠檬酸钠和19.5mmol/ldtt的混合溶液;所述工作液ⅱ为以0.1%tfa的水溶液为溶剂的4.5mol/l盐酸胍溶液。
在本发明中所采用的工作液ⅰ的作用主要是使蛋白质变性,并能够更好的溶解κ-酪蛋白。工作液ⅱ的主要作用是为了消除溶剂效应,增大ae型和b型κ-酪蛋白的分离度,使峰型更尖锐、对称。
如上所述的分型检测方法,优选地,在步骤s1中,所述底层溶液与工作液ⅱ的体积比为1:3。经过大量实验研究发现采用此比例可使样品中ae型和b型κ-酪蛋白有较合适的峰面积响应,可相对避免出现平头峰、峰分叉、肩峰、对称性差等分离问题。
如上所述的分型检测方法,优选地,在步骤s3中,所述高效液相色谱的液相系统为agilent1260,色谱柱为c83.5μm,
如上所述的分型检测方法,优选地,在步骤s3中,所述高效液相色谱的流动性a为0.1%tfa的水溶液,流动性b为0.1%tfa乙腈溶液,所述液相梯度洗脱程序为:0min:67%流动相a;5min,65%流动相a;6min,63%流动相a;8min,60%流动相a;12min,59%流动相a;16min,59%流动相a;20min,58.5%流动相a;23min,58%流动相a;24.1min,57.7%流动相a;26min,57.6%流动相a;30min,57.3%流动相a;32min,57%流动相a;35min,67%流动相a;45min,67%流动相a;其中,每个时间段中除流动相a外,剩余为流动相b,流动相a与流动相b之和为100%。
如上所述的分型检测方法,优选地,在步骤s3中,所述高效液相色谱的流速为0.5ml/min,柱温为45℃,吸收波长为214nm,进样体积为10μl。
本发明的有益效果在于:
本发明提供的一种基于hplc法对κ-酪蛋白分型的方法,可有效地将牛乳中的ae-κ酪蛋白、b-κ酪蛋白分离,并进行分型的方法。本发明的方法准确度高,重复性好,能够实现对批量样品的检测,大大缩短分析时间,而且方法简单易行,方便可靠。本发明提供的方法为牛乳中κ-酪蛋白基因分型和蛋白分型双验证工作奠定了基础。
附图说明
图1为两种相近的c8色谱柱洗脱κ-酪蛋白的对照色谱图。
图2为不同梯度洗脱程序洗脱各型态κ-酪蛋白的对照色谱图。
图3为ae型和b型κ酪蛋白全部包含的样品色谱图。
图4为仅包含ae型κ酪蛋白的样品色谱图。
图5为仅包含b型κ酪蛋白的样品色谱图。
具体实施方式
以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。在不背离本发明精神和实质的前提下,对本发明所作的修饰或者替换,均属于本发明的范畴。
以下实施例中的奶样来自于北京首农畜牧发展有限公司的荷斯坦奶牛的牛乳。若未特别指明,下面实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1
本实施例中采用的作为κ-酪蛋白标准品(κ-caseinfrombovinemilk)购自(sigma-alorich,≥70%(page),lyophilizedpowder),证书纯度99%。
配制浓度为10g/l的κ-酪蛋白标准工作溶液:准确称取κ-酪蛋白标准品10.1mg于1ml具塞刻度试管中,-20℃保存。
工作溶液的制备:
工作液ⅰ为含有0.1mol/lbistris,6mol/l盐酸胍,5.37mmol/l柠檬酸钠,19.5mmol/ldtt(二硫苏糖醇)的混合溶液;
工作液ⅱ为以流动相a为溶液的4.5mol/l盐酸胍溶液。
本实施例中采用hplc系统液相系统为agilent1260,色谱柱为c83.5μm,
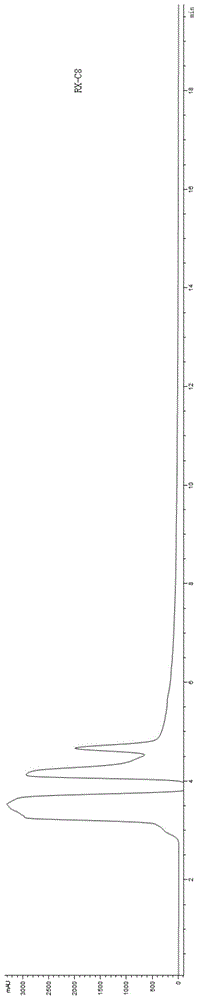
色谱柱的选择:经大量实验对色谱柱进行了筛选,在此仅例举两种c8色谱柱rx-c8和300sb-c8的筛选结果,在其他参数一致的情况下,采用这两种色谱柱谱图检测结果见图1。其中,图1(1)为rx-c8色谱柱检测结果,图1(2)为300sb-c8色谱柱检测结果,可见,rx-c8可能对κ-酪蛋白无保留或保留时间过长,不能分离出ae或b型κ-酪蛋白;采用300sb-c8生化测定色谱柱能有效分离开ae或b型κ-酪蛋白,检测效果更好。
1、样品制备
向500μl牛乳样品中加入等体积的工作液ⅰ,涡旋混匀,室温静置1h。将混合液10000r/min4℃离心5min,除去表层乳脂,取底层溶液300μl于新的离心管中,加入工作液ⅱ稀释(即底层溶液与工作液ⅱ的体积比为1:3),混匀,0.45μm有机系滤膜过滤到进样瓶中待测。
2、hplc检测条件
(1)准备所需的流动相:配制流动相a:0.1%tfa(trifluoroaceticacid,三氟乙酸)的水溶液和流动相b:0.1%tfa乙腈溶液,经过滤,超声脱气15min后备用。
(2)根据下面方法设定仪器各参数如下:
流速:0.5ml/min,柱温:40℃,吸收波长:214nm,进样体积:10μl,液相梯度如下表1。
洗脱程序的优化:经过大量实验依据κ-酪蛋白在c8与流动相两相间的洗脱和保留的关系,上机测定优化梯度洗脱程序。主要例举针对8分钟~12分钟各型κ-酪蛋白的出峰时段进行优化,结果如图2所示,其中,(1)为a相由60%降至59%,b相由40%升至41%的结果,(2)为a相由61%降至59%,b相由39%升至41%的结果,(3)为a相由62%降至59%,b相由38%升至41%的结果。由图可见,a相由60%降至59%,b相由40%升至41%时,ae、b型κ-酪蛋白洗脱效果最佳,其他比例时ae或b型κ-酪蛋白峰变宽或保留时间过长。
柱温优化:进行了40℃-45℃柱温优化,柱温对色谱图几乎没有影响,最终选择40℃柱温。
表1液相色谱梯度表
(3)质量控制
每批样品进样前进行60min初始平衡,保证基线和压力线均在平稳状态再进样。先进1针样品试剂空白(工作液ⅱ),以检查试剂纯度,再进行标准样品和样本样品的检测。由于样本基质较为复杂,因此进样前设置了进样针外壁清洗;另外,设置了每进15针左右样品后,增加1针标准样品的检测,以避免保留时间的漂移。检测结果如表2所示。
表2标准样品保留时间和峰面积等参数
(4)定性判定
根据标准品中ae型、b型κ-酪蛋白的保留时间就可以对样品中ae-κ酪蛋白、b-κ酪蛋白进行定性。经比对,ae-κ酪蛋白、b-κ酪蛋白出峰顺序为:ae-κ酪蛋白、b-κ酪蛋白,ae型与b型κ酪蛋白分离度能达到r=11.3,具体获得的色谱图见附图3、图4和图5。根据色谱图可区分出ae-κ酪蛋白、b-κ酪蛋白,通过对应时间可分别收集不同型的κ酪蛋白。
- 还没有人留言评论。精彩留言会获得点赞!