一种测定循环肿瘤细胞的电致化学发光免疫传感器及其制备方法与应用与流程
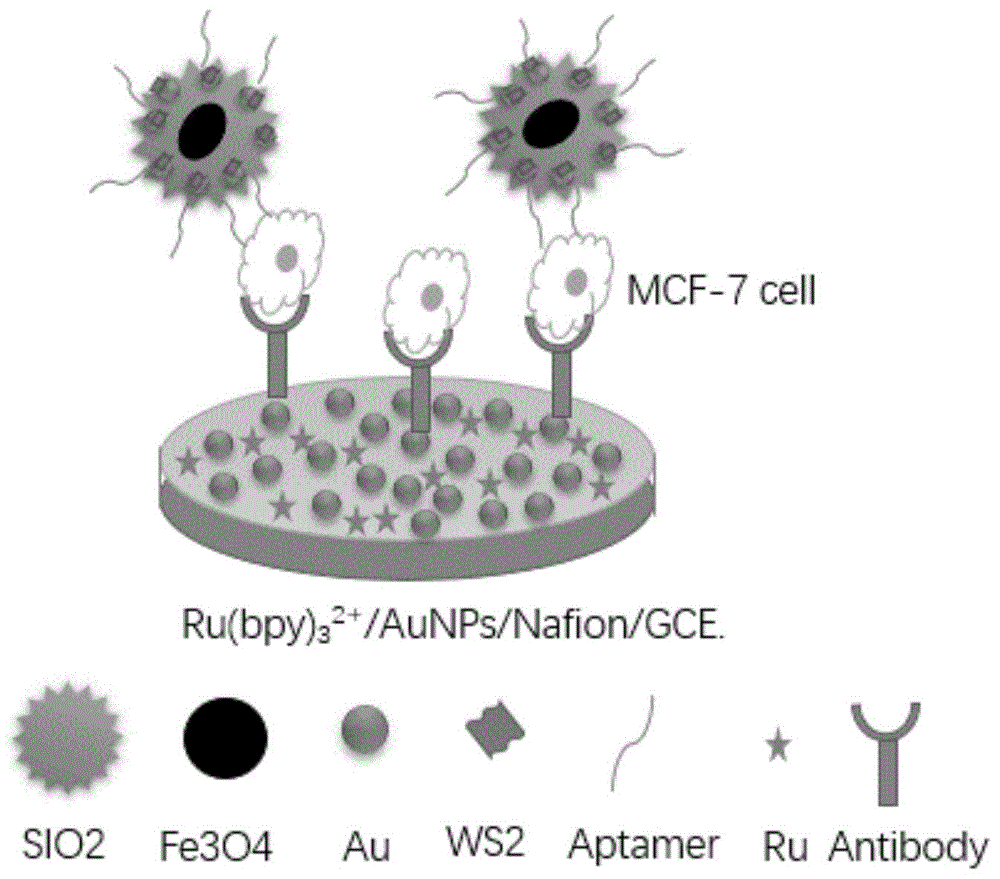
本发明属于生物医学检测,具体涉及一种测定循环肿瘤细胞的电致化学发光免疫传感器及其制备方法与应用。
背景技术:
循环肿瘤细胞(ctcs)是指恶性肿瘤在发展过程中播散并存活于外周血中的肿瘤细胞,与肿瘤的转移和预后密切相关。循环肿瘤细胞的数量可以用作癌症患者的治疗效果的评估指标。如果治疗后血液中肿瘤细胞的数量减少,则治疗效果良好。如果数量增加,最好改变治疗方案或停止治疗,特别是化疗。许多患者难以耐受副作用。如果通过这种方法预先预测治疗的效果,患者可以遭受更少的痛苦。循环肿瘤细胞检测是指对肿瘤患者外周血中的循环肿瘤细胞进行分析的方法,有助于肿瘤转移患者的诊断、监测术后患者肿瘤的复发与转移、评估抗肿瘤药物的敏感性与患者预后以及选择个体化治疗的策略。从ctcs的发现到检测和临床应用进展一直不太理想。直到上个世纪末,特别是本世纪初,随着分子生物学和计算机技术的发展,ctcs免疫标记技术和分子生物学技术的迅速发展,ctcs的分离和分析与鉴定技术得到了迅速发展,为恶性肿瘤的早期检测提供了相应的方法。然而目前方法大多需要大型设备或者高精密机器,不能满足大量急需实时检测。因此,为了满足对早期恶性肿瘤病变快速便捷的临床筛查需求,迫切需要开发一种快速,高灵敏度的微器械。
电致化学发光(ecl)免疫传感器是电化学传感器中重要组成部分,它以荧光探针标记抗体或者抗原,通过传感元件将荧光探针的光信号转换为电信号,从而对待检物进行定量。ecl免疫传感器具有选择性好、灵敏度高、成本低,所需设备相对简单,适合联机化,容易微型化等优点,成功应用在医学、环境和食品安全检测等多领域,已成为各种生物活性物质快速检测的研究热点和发展前沿,具有广阔而良好的应用前景。与传统检测技术不同,电极表面发生ecl发光反应,因此降低电极表面活性物质的消耗是非常重要的。
新兴的ws2量子点是一类独特的石墨烯类似的过渡金属二硫族化合物纳米材料,具有基于cd的量子点的优异性能,更重要的是,由于其无重金属特性,它们具有卓越的生物相容性。此外,与在表面上悬挂键提供配体连接的其他量子点不同,ws2量子点在其基面上没有悬空键,除了可能的缺陷位置和边缘。因此,溶液中ws2qds的表面直接暴露在溶剂环境中而不受表面结合配体的干扰,尽管它们可以在缺陷位点或边缘处引入ws2qd溶剂和qd间相互作用,可以预计其电子和光学性质在ws2qd中比具有表面结合配体的qds更强。
技术实现要素:
发明目的:为解决现有技术存在的缺陷,本发明提供了一种基于二硫化钨量子点信号放大的电致化学发光免疫传感器及其制备方法。
本发明还提供上述电致化学发光免疫传感器在测定循环肿瘤细胞中的应用。
为了解决上述技术问题,本发明采取的技术方案如下:
一种测定循环肿瘤细胞的电致化学发光免疫传感器,包括磁性ecl探针fe3o4@sio2/aunps/ws2-aptamer,以及循环肿瘤细胞抗体进行表面结合的基底电极,所述基底电极表面采用nafion/aunps/ru(bpy)32+溶液进行修饰。
其中,所述磁性ecl探针fe3o4@sio2/aunps/ws2-aptamer采用如下方法制备:
(1)称取氯化铁和柠檬酸三钠加入到乙二醇中,放于磁力搅拌器上搅拌溶解,随后在搅拌状态下向其中加入适量乙酸钠,待完全溶解,搅拌10~50min,转入高温高压反应釜中于100~250℃,反应2~24h,待反应完成后取出冷却至室温,离心分离清洗,得到fe3o4纳米粒子;
(2)将制备好的fe3o4纳米粒子溶解到乙醇水溶液中,向其中加入适量甲醛溶液和间苯二酚,在10~60℃下机械搅拌2~20h,然后升温至10~200℃获得f-fe3o4复合纳米材料;取适量上述制备的材料溶解在含有十六烷基三甲基溴化铵的氨水溶液中,10~60min内滴加入正硅酸乙酯,在4~60℃下机械搅拌2~20h,获得fe3o4@sio2;用3-氨丙基三乙氧基硅烷对其氨基化后加入适量纳米金溶液,4~60℃下搅拌1~20h,得到fe3o4@sio2/aunps复合材料;
(3)将上述复合材料加入到浓度为0.1~10mg/ml的二硫化钨量子点溶液中,4~60℃下搅拌1~20h,得到fe3o4@sio2/aunps/ws2;
(4)先用edc/nhs对fe3o4@sio2/aunps/ws2进行活化处理,再将细胞适体溶液加入其中,黑暗条件下于4~60℃搅拌反应1~20h,然后加入bsa溶液室温搅拌反应1~5h,离心并重悬于pbs溶液中得到fe3o4@sio2/aunps/ws2-aptamer溶液。
优选地,步骤(1)中,所述氯化铁、柠檬酸三钠和乙酸钠的质量比为(1:1:1)~(4:1:10)。
步骤(2)中,所述fe3o4纳米粒子、甲醛、间苯二酚的质量比为(1:1:1)~(4:1:10);所述f-fe3o4、十六烷基三甲基溴化铵、正硅酸乙酯使用量比例为(1g:5g:1ml)~(1g:5g:5ml);所述fe3o4@sio2、aptes和aunps混合质量比为(1:1:1)~(1:1:3)。
步骤(3)中,所述fe3o4@sio2/aunps复合材料与二硫化钨量子点溶液混合质量比为(1:1)~(1:20)。
步骤(4)中,edc、nhs和aunps的质量比为4:2:1~2:1:2。
步骤(4)中,所述细胞适体溶液的溶剂为超纯水,浓度为0.1~10μm;bsa溶液的溶剂为0.1mpbs,bsa的质量分数为0.2~2wt%。
其中,所述基底电极采用如下方法进行修饰和表面抗体结合:
(1)将aunps分散在0.1~2wt%nafion溶液中并搅拌0.2~3h,得到nafion/aunps溶液;
(2)将nafion/aunps溶液滴加到预处理过的基底电极表面,室温放置2h,用pbs溶液清洗,晾干;得到的电极浸泡在浓度为0.1-10mmru(bpy)32+溶液中,室温放置0.1~5h,然后用pbs溶液清洗,晾干;
(3)将循环肿瘤细胞抗体溶液滴加在步骤(2)得到的电极表面,1~10℃放置12h,然后用pbs溶液清洗,晾干;
(4)向步骤(3)得到的电极表面滴加bsa溶液,室温放置1~5h,然后用pbs溶液清洗,晾干即得。
优选地,步骤(1)中,将0.2~3ml0.01-10mg/mlaunps分散在0.2~3ml0.5vt%nafion水溶液中并超声0.2~3h,nafion/aunps溶液。
步骤(2)中,所述基底电极为玻碳电极;预处理包括打磨、抛光和超声清洗。
步骤(2)中,ru(bpy)32+溶液的浓度为0.1-10mm。
步骤(3)中,循环肿瘤细胞抗体溶液的溶剂为0.1mpbs,浓度为10~100μg/ml。
步骤(4)中,bsa溶液的溶剂为0.1mpbs,bsa的质量分数为0.2~2wt%。
上述电致化学发光免疫传感器用于测定循环肿瘤细胞的应用也在本发明的保护范围中。
进一步地,本发明提供上述电致化学发光免疫传感器用于测定循环肿瘤细胞的方法,包括如下步骤:
(1)将磁性ecl探针fe3o4@sio2/aunps/ws2-aptamer溶液加入含有循环肿瘤细胞的溶液中,10-50℃捕捉10-100min,磁性分离并重悬成细胞悬液;
(2)将表面结合有循环肿瘤细胞抗体的基底电极浸泡在步骤(1)得到得细胞悬液中进行特异性反应,20~50℃反应10~60min,然后用pbs溶液清洗,晾干;
(3)将步骤(2)得到的电极放在含有pbs的溶液中进行ecl测定,根据ecl信号强度与循环肿瘤细胞浓度之间的线性关系,实现循环肿瘤细胞的定量检测。
优选地,所述循环肿瘤细胞为mcf-7。
步骤(1)中,所述磁性ecl探针fe3o4@sio2/aunps/ws2-aptamer溶液的浓度为0.1~10mg/ml。
有益效果:
1、本发明电致化学发光免疫传感器利用ws2量子点作为ru(bpy)32+电致化学发光共反应剂信号放大的三明治型ecl免疫传感器,用于循环肿瘤细胞的定量分析,具有优异的抗干扰性能和较高的选择性,既不需要常规检测方法中对样品进行复杂处理,也避免了使用流式细胞仪等常规检测方法费用高、操作繁琐等问题;
2、本发明选择绿色化学试剂纳米金、nafion和三联吡啶钌复合材料作为循环肿瘤细胞检测时玻碳电极的修饰材料,健康安全;同时,利用其高导电性提高了ecl免疫传感器的灵敏度。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
图1为本发明检测方法的原理图;
图2为各阶段基底电极循环伏安图;
图3为磁性ecl探针捕捉时间与ecl强度关系的曲线图;
图4为本发明电致化学发光免疫传感器ecl强度与对不同循环肿瘤细胞浓度之间的线性关系。
具体实施方式
根据下述实施例,可以更好地理解本发明。
本发明中技术术语的缩写如下:
人乳腺癌细胞:mcf-7;纳米金:aunps;硫化钨:ws2;十六烷基三甲基溴化铵:ctab;si(oc2h5)4:teos;h2nch2ch2ch2si(oc2h5)3:aptes;1~乙基~(3~二甲基氨基丙基)碳化二亚胺盐酸盐:edc;n羟基琥珀酰亚胺:nhs。
mcf-7抗体和mcf-7适体购买自北京科跃中楷生物技术有限公司,抗体和适体均为固体粉末,溶剂为0.1mpbs。
实施例1磁性ecl探针fe3o4@sio2/aunps/ws2-aptamer的制备
(1)fe3o4@sio2的制备
称取0.65g氯化铁和0.2g柠檬酸三钠加入到20ml乙二醇中,放于磁力搅拌器上搅拌溶解,随后搅拌情况下向其中加入1.2g乙酸钠,搅拌30min,待完全溶解转入高温高压反应釜中200℃,反应10h,待反应后取出冷却至室温,离心分离清洗,得到fe3o4纳米粒子。将0.1g制备好的fe3o4溶解到乙醇水混合液(30ml,体积比2:1)中,向其中加入0.1g氨水、0.1g甲醛溶液(37%)和0.1间苯二酚,在30℃下机械搅拌10h,然后升温至100℃获得f-fe3o4复合纳米材料。取0.2g上述制备的材料溶解在含有0.5gctab和0.8ml氨水的80ml水溶液中,30min内滴加入5mlteos,在在20℃下机械搅拌12h,在乙醇70℃下回流除去ctab,获得fe3o4@sio2。
(2)fe3o4@sio2/aunps/ws2的制备
用aptes对其氨基化后加入10ml纳米金溶液(0.12mg/ml),室温拌8h,得到fe3o4@sio2/aunps复合材料。再将其加入到10mlws2qds(1mg/ml)溶液中,室温下反应8h,磁性分离获得fe3o4@sio2/aunps/ws2。
(3)fe3o4@sio2/aunps/ws2-aptamer的制备
0.1ml4ummcf-7细胞适体共价偶联到步骤(2)的fe3o4@sio2/aunps/ws2,并在黑暗条件下4℃反应12h,然后加入100μl10mg/mlbsa溶液,室温搅拌2h封闭剩余的活性位点,离心除去上清液中未结合的抗体或bsa,最后得到fe3o4@sio2/aunps/ws2-aptamer,重悬于pbs溶液中得到fe3o4@sio2/aunps/ws2-aptamer。
实施例2电致化学发光免疫传感器(ecl免疫传感器)的组装及其测定方法
电致化学发光免疫传感器的检测原理如图1所示,包括以下步骤:
(1)电极预处理:将玻碳电极分别用0.05和0.03μmal2o3粉末处理,然后分别用无水乙醇和超纯水超声清洗5min;
(2)修饰基地电极:用移液枪取5μl0.5%nafion/aunps溶液滴加在预处理后的玻碳电极表面,室温放置2h干燥,pbs溶液清洗未结合的复合材料,晾干,利用其较大的比表面积优势使抗体更多的富集在电极表面;电极浸泡在浓度为1mmru(bpy)32+溶液中,室温放置0.5h,然后用pbs溶液清洗,晾干;
(3)细胞抗体的固定:将10μl50μg/ml抗体滴加在电极表面,在4℃冰箱中放置12h,将捕捉抗体固定在电极表面,用pbs溶液清洗未结合的抗体,晾干;
(4)封闭非特异性位点:滴加10μl10mg/mlbsa溶液到步骤(3)得到的电极表面,室温放置2h,封闭未被抗体结合的位点,防止待测样品中某些物质与之发生非特异性结合,提高背景信号,然后用pbs溶液清洗未结合的bsa,晾干;
(5)mcf-7细胞富集:将制备好相应的ecl探针fe3o4@sio2/aunps/ws2-aptamer(100μl1mg/ml)加入含有1mlmcf-7细胞的溶液中,37℃捕捉50min,磁性分离并重悬成细胞悬液0.1ml;
(6)夹心法免疫传感器构建:向步骤(4)得到的电极表面浸泡在上述(5)中的细胞悬液中进行特异性反应,37℃反应40min,使mcf-7和抗体充分发生特异性反应,然后用pbs溶液清洗,晾干。
(7)信号检测:将步骤(6)得到的电极放在含有0.1mpbs溶液中进行ecl测定,光电倍增高压(pmt)为700v,记录ecl信号强度,分析结果。
实施例3测定mcf-7细胞的ecl免疫传感器循环伏安图
为探究mcf-7细胞的ecl免疫传感器各修饰阶段传感器的信号响应,将实施例2中每个步骤得到的玻碳电极置于0.01mpbs溶液中以0.1v/s的速度进行循环伏安扫描,结果见图2所示。随着nafion/aunps/ru(bpy)32+修饰在玻碳电极表面,与裸电极相比较获得了一个增大的峰电流信号,因为ru(bpy)32+增强了电子传递,提高了传感器的灵敏度。随后将抗体、bsa、带有标记探针的mcf-7细胞修饰在电极表面,传感器的响应信号逐渐降低,其原因是蛋白增大了电极表面的阻抗值,使电流降低。
实施例4测定mcf-7细胞的ecl免疫传感器细胞捕捉孵育时间与ecl强度关系
探究ecl探针与mcf-7的捕捉时间对传感器ecl信号强度的影响。电化学免疫传感器的制备方法同实施例2,不同的是步骤(5)中选用10min、20min、30min、40min、50min和60min8个不同的捕捉时间进行本次实验。结果如图3,在10~50min时,ecl信号随时间的延长而急剧增加,在50min时达到最大值,故本次实验选用50min作为孵育时间。
实施例5测定mcf-7细胞的ecl免疫传感器ecl强度与细胞浓度之间的线性关系电化学免疫传感器的制备方法同实施例2,不同的是步骤(5)中mcf-7细胞的浓度不同。配制不同浓度的甲胎蛋白标准溶液,分别为10-5×105cell/ml,每个浓度平行对照三次。通过对数据分析,得到ecl强度与细胞浓度的对数之间的线性关系,结果见图4。随着细胞浓度的不断增大,ecl传感器的信号强度也随之不断增大。该传感器最低检测限为3cell/ml,本发明具有更高的灵敏度。
本发明提供了一种测定循环肿瘤细胞的电致化学发光免疫传感器及其制备方法与应用的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
- 还没有人留言评论。精彩留言会获得点赞!