单克隆抗体保护液及制备方法和应用、应用单克隆抗体保护液的试剂与免疫组化试剂盒与流程
本发明涉及生物检测
技术领域:
,尤其是涉及一种单克隆抗体保护液及制备方法和应用、应用单克隆抗体保护液的试剂与免疫组化试剂盒。
背景技术:
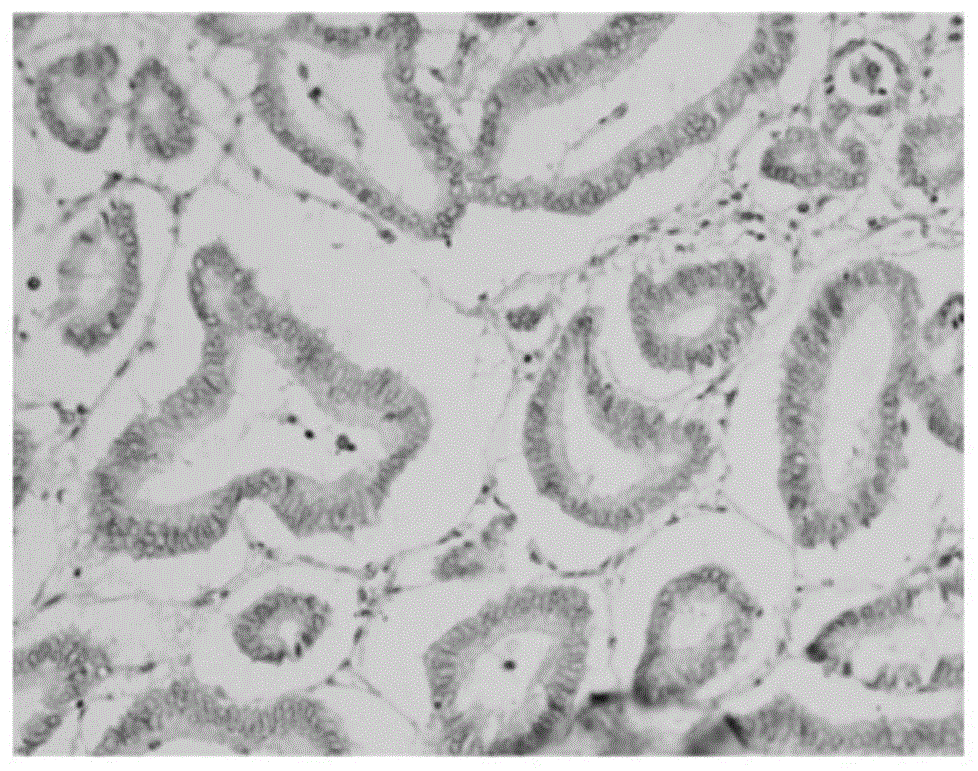
:恶性肿瘤具有细胞分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征,其发生是一个多因子、多步骤的复杂过程。在全球范围内,肠癌是第三常见的恶性肿瘤,发病原因复杂,多与患者的饮食习惯以及潜在的遗传性疾病有关。目前肠癌的治疗手段包括外科手术,化疗,放疗以及靶向治疗。肠癌患者若在早期发现,诊断时肿瘤细胞仅局限在结肠内壁中,那么通过手术切除,治愈率较高。但是肿瘤细胞一旦发生转移就为肠癌的治疗增加了许多难度,严重影响患者的生存。因此寻找和鉴定早期诊断肠癌的分子标记物十分关键。n1,n12-二乙酰精胺(n1,n12-diacetylspermine,diacspm)是尿液中发现的一种二乙酰多胺类物质,分子式为c14h30n4o2,在体内由鸟氨酸经鸟氨酸脱羧酶作用生成,是多胺代谢途径中非常重要的一环。人细胞中都含有大量的多胺类物质。游离态的多胺,例如腐胺,亚精胺,精胺主要存在于细胞内池中。细胞中的多胺类物质经过代谢可以生成乙酰化衍生物,并经过代谢排泄于尿液中。在增殖活跃的组织中发现多胺类物质的生成和积聚都明显增加,因此认为多胺在细胞增殖的过程中发挥关键作用。研究发现肿瘤患者尿液中多胺的排出量较健康人高。通过高效液相色谱在尿液中可分离出n1,n12-二乙酰精胺(n1,n12-diacetylspermine,diacspm)。diacspm是人尿液常规的组成成分,健康人尿液中仅为痕量,并且其含量的浮动范围非常小。因此,尿液中游离多胺,乙酰化多胺等各自的含量以及总量作为肿瘤标记物并不十分可靠。目前对于n1,n12-二乙酰精胺的检测方法主要有酶联免疫法、胶体金法和免疫比浊法等,现有方法均是通过直接检测尿液中二乙酰精胺的含量来预测患肠癌的风险,主要用于早期筛查,得到的是一个患病的概率,无法准确地指导诊断。而应用到n1,n12-二乙酰精胺单克隆抗体的检测方法成本较高,且抗体稳定性较差,无法长期存放。有鉴于此,特提出本发明。技术实现要素:本发明的第一个目的在于提供一种单克隆抗体保护液,以至少缓解现有技术中存在的技术问题之一。本发明的第二个目的在于提供上述单克隆抗体保护液的制备方法,该方法工艺简单、操作方便,且制备得到的单克隆抗体保护液性质稳定,能够有效保持抗体效价;本发明的第三个目的在于提供上述单克隆抗体保护液的应用。本发明的第四个目的在于提供一种试剂,该试剂性质稳定,其中的单克隆抗体能够在长期存放的条件下保持良好的效价。本发明的第五个目的在于提供上述试剂的应用。本发明的第六个目的在于提供一种免疫组化试剂盒,该试剂盒成本低廉,具有良好的特异性和可靠性,能够准确的检测病理切片中n1,n12-二乙酰精胺的水平,为二乙酰精胺的定性和定量检测提供了更为可靠的方法。本发明提供了一种单克隆抗体保护液,所述单克隆抗体保护液中包括:5-15mmol/lpbs、0.1‰-2‰(w/v)tween20、1%-15%(v/v)血清、1%-10%(w/v)海藻糖、0.1‰-2‰(v/v)prolin、0.5%-2%(w/v)甘油、0.1%-1%(w/v)6-氨基乙酸、20-80mmol/ledta和0.1%-0.5%(w/v)casein-na;所述单克隆抗体为n1,n12-二乙酰精胺单克隆抗体。进一步地,所述单克隆抗体保护液中包括:8-12mmol/lpbs、0.5‰-1.5‰(w/v)tween20、2%-12%(v/v)血清、2%-8%(w/v)海藻糖、0.5‰-1.5‰(v/v)prolin、0.8%-1.8%(w/v)甘油、0.2%-0.8%(w/v)6-氨基乙酸、30-70mmol/ledta和0.1%-0.4%(w/v)casein-na。进一步地,所述单克隆抗体保护液中包括:9-11mmol/lpbs、0.8‰-1.2‰(w/v)tween20、5%-10%(v/v)血清、3%-5%(w/v)海藻糖、0.8‰-1.2‰(v/v)prolin、1%-1.5%(w/v)甘油、0.3%-0.6%(w/v)6-氨基乙酸、40-60mmol/ledta和0.1%-0.25%(w/v)casein-na;优选地,所述血清选自山羊血清或牛血清。本发明还提供了上述的单克隆抗体保护液的制备方法,所述制备方法包括:取配方量的各组分配置为水溶液,得到所述单克隆抗体保护液。本发明还提供了上述的单克隆抗体保护液或采用上述的制备方法制备得到的单克隆抗体保护液在制备含有n1,n12-二乙酰精胺单克隆抗体的试剂或试剂盒中的应用。本发明还提供了一种试剂,所述试剂包括上述的单克隆抗体保护液和n1,n12-二乙酰精胺单克隆抗体;所述单克隆抗体保护液中n1,n12-二乙酰精胺单克隆抗体的浓度为2μg/ml-1mg/ml。本发明还提供了上述的试剂在制备用于检测细胞异常增殖类疾病的试剂盒中的应用。进一步地,所述细胞异常增殖类疾病包括恶性肿瘤或贫血;优选地,所述恶性肿瘤包括黑色素瘤、乳腺癌肿瘤、膀胱癌肿瘤、头颈癌肿瘤、肺癌肿瘤、结肠癌肿瘤、直肠癌肿瘤、胃癌肿瘤、前列腺癌肿瘤、肝癌肿瘤、胰腺癌肿瘤或卵巢癌肿瘤。另外,本发明还提供了一种免疫组化试剂盒,所述免疫组化试剂盒包括上述的试剂。进一步地,所述试剂盒还包括即用型羊抗兔/鼠igg抗体试剂、内源性过氧化物酶阻断剂、封闭液、原位微信号放大剂、染色剂、组织抗原修复缓冲液和空白对照试剂。另外,本发明还提供了一种二乙酰精胺的免疫组化检测方法,将待测组织切片进行预处理后,应用上述的免疫组化试剂盒进行免疫组化分析,通过染色结果判断二乙酰精胺的表达情况。优选地,所述待测组织切片的预处理包括脱蜡和水化;优选地,所述免疫组化分析包括如下(a)-(h):(a)、阻断内源性过氧化物酶;(b)、组织抗原修复;(c)、非特异性封闭;(d)、加本抗体试剂或空白对照试剂;(e)、加酶标二抗;(f)、加显色液;(g)、复染;(h)、脱水、透明、封片;优选地,所述染色结果的判断方法包括:随机选取4-6个400×视野观察,每个视野中二乙酰精胺阳性染色细胞数≥15%为二乙酰精胺阳性表达,每个视野中二乙酰精胺阳性染色细胞数<15%为二乙酰精胺阴性表达。本发明提供的n1,n12-二乙酰精胺单克隆抗体保护液,包括pbs、tween20、血清、海藻糖、prolin、甘油、6-氨基乙酸、edta和casein-na。该保护液通过各特定组分及配比之间的相互配合使得其性质稳定,使n1,n12-二乙酰精胺单克隆抗体能在2-8℃和常温条件下存放24个月并能在反复冻融多次的条件下保持良好的效价,延长单克隆抗体的有效期,从而有效的起到节约成本的作用。本发明提供的上述单克隆抗体保护液的制备方法,取配方量的各组分配置为水溶液即可得到。该方法工艺简单、操作方便,且制备得到的单克隆抗体保护液性质稳定,能够有效保持抗体效价。本发明提供的试剂,包括单克隆抗体保护液和n1,n12-二乙酰精胺单克隆抗体。该试剂性质稳定,其中的单克隆抗体能够在长期存放的条件下保持良好的效价。本发明提供的免疫组化试剂盒,包括本发明提供的试剂。该试剂盒成本低廉,具有良好的特异性和可靠性,能够准确的检测病理切片中n1,n12-二乙酰精胺的水平,为二乙酰精胺的定性和定量检测提供了更为可靠的方法。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明实验例2提供的肠癌组织diacspm强阳性染色结果图;图2为本发明实验例2提供的肠癌组织diacspm阳性染色结果图;图3a为本发明实验例2提供的正常肠粘膜上皮组织diacspm阴性表达染色结果图;图3b为本发明实验例2提供的第一腺癌组织diacspm阴性表达染色结果图;图3c为本发明实验例2提供的第二腺癌组织diacspm阴性表达染色结果图;图3d为本发明实验例2提供的管状腺癌组织diacspm阴性表达染色结果图;图3e为本发明实验例2提供的粘液腺癌组织diacspm阴性表达染色结果图;图3f为本发明实验例2提供的印戒细胞癌组织diacspm阴性表达染色结果图(400×)。具体实施方式下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。需要说明的是:本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。本发明中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案。本发明中,如果没有特别的说明,百分数(%)或者份指的是相对于组合物的重量百分数或重量份。本发明中,如果没有特别的说明,所涉及的各组分或其优选组分可以相互组合形成新的技术方案。本发明中,除非有其他说明,数值范围“a~b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围“3~30”表示本文中已经全部列出了“3~30”之间的全部实数,“3~30”只是这些数值组合的缩略表示。本发明所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。本发明中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以按照顺序进行。优选地,本文中的反应方法是顺序进行的。除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。本发明提供了一种单克隆抗体保护液,所述单克隆抗体保护液中包括:5-15mmol/lpbs、0.1‰-2‰(w/v)tween20、1%-15%(v/v)血清、1%-10%(w/v)海藻糖、0.1‰-2‰(v/v)prolin、0.5%-2%(w/v)甘油、0.1%-1%(w/v)6-氨基乙酸、20-80mmol/ledta和0.1%-0.5%(w/v)casein-na;所述单克隆抗体为n1,n12-二乙酰精胺单克隆抗体。本发明提供的n1,n12-二乙酰精胺单克隆抗体保护液,通过各特定组分及配比之间的相互配合使得其性质稳定,使n1,n12-二乙酰精胺单克隆抗体能在2-8℃和常温条件下存放24个月并能在反复冻融多次的条件下保持良好的效价,延长单克隆抗体的有效期,从而有效的起到节约成本的作用。其中,pbs作为蛋白稳定剂,其具有盐平衡、可调整的适宜ph缓冲作用,能够保证完整的、具有活性的物质在最适条件下参与生物反应,同时避免破坏生物蛋白的结构及生物特性;其含量例如可以为,但不限于5mmol/l、6mmol/l、7mmol/l、8mmol/l、9mmol/l、10mmol/l、11mmol/l、12mmol/l、13mmol/l、14mmol/l或15mmol/l;tween20作为抗体保护剂,能够适当降低抗体的结合力,减少背景和非特异性条带。其含量例如可以为,但不限于0.1‰(w/v)、0.2‰(w/v)、0.5‰(w/v)、0.8‰(w/v)、1‰(w/v)、1.2‰(w/v)、1.5‰(w/v)、1.8‰(w/v)或2‰(w/v);血清例如可以为,但不限于1%(v/v)、2%(v/v)、5%(v/v)、8%(v/v)、10%(v/v)、12%(v/v)或15%(v/v);海藻糖是抗体生物活性的稳定剂,在温度较高或较低或其他环境条件下,海藻糖能够维持抗体结构的稳定性。其含量例如可以为,但不限于1%(w/v)、2%(w/v)、3%(w/v)、4%(w/v)、5%(w/v)、6%(w/v)、7%(w/v)、8%(w/v)、9%(w/v)或10%(w/v);prolin作为防腐剂,能够有效抑制保护液中微生物的生长,防止蛋白类物质发生霉变。其含量例如可以为,但不限于0.1‰(v/v)、0.2‰(v/v)、0.5‰(v/v)、0.8‰(v/v)、1‰(v/v)、1.2‰(v/v)、1.5‰(v/v)、1.8‰(v/v)或2‰(v/v);甘油的冰点低,可以避免反复冻融。其含量例如可以为,但不限于0.5%(w/v)、0.6%(w/v)、0.7%(w/v)、0.8%(w/v)、0.9%(w/v)、1%(w/v)、1.2%(w/v)、1.5%(w/v)、1.8%(w/v)或2%(w/v);6-氨基乙酸能够有效保护乙酰精氨抗体,其含量例如可以为,但不限于0.1%(w/v)、0.2%(w/v)、0.3%(w/v)、0.4%(w/v)、0.5%(w/v)、0.6%(w/v)、0.7%(w/v)、0.8%(w/v)、0.9%(w/v)或1%(w/v);edta是金属螯合剂,在保护液中能够提高抗体存贮稳定性。其含量例如可以为,但不限于20mmol/l、30mmol/l、40mmol/l、50mmol/l、60mmol/l、70mmol/l或80mmol/l;casein-na酪蛋白酸钠具有热稳定性,不易受热变性,能够有效提高保护液的稳定性。其含量例如可以为,但不限于0.1%(w/v)、0.2%(w/v)、0.3%(w/v)、0.4%(w/v)或0.5%(w/v)。典型的n1,n12-二乙酰精胺单克隆抗体为通过n1,n12-二乙酰精胺抗原制备得到,其中n1,n12-二乙酰精胺抗原的分子式为achn(ch2)3nh(ch2)4nh(ch2)3nhac。在一些优选的实施方式中,所述单克隆抗体保护液中包括:8-12mmol/lpbs、0.5‰-1.5‰(w/v)tween20、2%-12%(v/v)血清、2%-8%(w/v)海藻糖、0.5‰-1.5‰(v/v)prolin、0.8%-1.8%(w/v)甘油、0.2%-0.8%(w/v)6-氨基乙酸、30-70mmol/ledta和0.1%-0.4%(w/v)casein-na。在一些更优选的实施方式中,所述单克隆抗体保护液中包括:9-11mmol/lpbs、0.8‰-1.2‰(w/v)tween20、5%-10%(v/v)血清、3%-5%(w/v)海藻糖、0.8‰-1.2‰(v/v)prolin、1%-1.5%(w/v)甘油、0.3%-0.6%(w/v)6-氨基乙酸、40-60mmol/ledta和0.1%-0.25%(w/v)casein-na;优选地,所述血清选自山羊血清或牛血清。通过对各组分的配比进行进一步的调整和优化,使得本发明提供的单克隆抗体保护液性质更稳定,能够更有效地使n1,n12-二乙酰精胺单克隆抗体保持良好的效价。本发明还提供了上述的单克隆抗体保护液的制备方法,所述制备方法包括:取配方量的各组分配置为水溶液,得到所述单克隆抗体保护液。该方法工艺简单、操作方便,且制备得到的单克隆抗体保护液性质稳定,能够有效保持抗体效价。在一些具体的实施方式中,上述的单克隆抗体保护液的制备方法如下:(a)10mmol/lpbs母液的配置:称取71.6gna2hpo4-12h2o,溶于1000ml水,得0.2m的母液;取50ml的0.2m的母液,加水稀释至1000ml即可;(b)1‰tween20称取1gtween20,溶于1000ml10mmol/lpbs;(c)5%-10%山羊血清(牛血清)取50-100ml山羊血清溶于1000ml10mmol/lpbs;(d)3%-5%海藻糖称取3-5g海藻糖溶于1000ml10mmol/lpbs;(e)1‰proclin吸取1mlproclin溶于1000ml10mmol/lpbs中;(f)1%-1.5%甘油称取甘油1-1.5g溶于1000ml10mmol/lpbs中;(g)0.5%6-氨基乙酸称取6-氨基乙酸0.5g溶于1000ml10mmol/lpbs中;(h)50mmoledta称取edta14.62g溶于1000ml10mmol/lpbs中;(i)0.1%-0.25%casein-na称取0.1-0.25gcasein-na溶于1000ml10mmol/lpbs中。本发明还提供了上述的单克隆抗体保护液或采用上述的制备方法制备得到的单克隆抗体保护液在制备含有n1,n12-二乙酰精胺单克隆抗体的试剂或试剂盒中的应用。应用本发明提供的单克隆抗体保护液制备含有n1,n12-二乙酰精胺单克隆抗体的试剂,能够有效延长n1,n12-二乙酰精胺单克隆抗体的有效时间,节约成本。本发明还提供了一种试剂,所述试剂包括上述的单克隆抗体保护液和n1,n12-二乙酰精胺单克隆抗体;所述单克隆抗体保护液中n1,n12-二乙酰精胺单克隆抗体的浓度为2μg/ml-1mg/ml,例如可以为,但不限于2μg/ml、50μg/ml、100μg/ml、200μg/ml、300μg/ml、400μg/ml、500μg/ml、600μg/ml、700μg/ml、800μg/ml、900μg/ml或1mg/ml。当采用上述比例的单克隆抗体保护液和n1,n12-二乙酰精胺单克隆抗体制备试剂时,该试剂性质更稳定,在有效节约成本的基础上,更能够使其中的单克隆抗体在长期存放的条件下保持良好的效价。本发明还提供了上述的试剂在制备用于检测细胞异常增殖类疾病的试剂盒中的应用。在一些优选的实施方式中,所述细胞异常增殖类疾病包括恶性肿瘤或贫血;优选地,所述恶性肿瘤包括黑色素瘤、乳腺癌肿瘤、膀胱癌肿瘤、头颈癌肿瘤、肺癌肿瘤、结肠癌肿瘤、直肠癌肿瘤、胃癌肿瘤、前列腺癌肿瘤、肝癌肿瘤、胰腺癌肿瘤或卵巢癌肿瘤。另外,本发明还提供了一种免疫组化试剂盒,所述免疫组化试剂盒包括上述的试剂。该试剂盒成本低廉,具有良好的特异性和可靠性,通过对福尔马林固定、石蜡包埋的人体组织切片进行免疫组织化学染色,可体外定性检测组织细胞中表达的n1,n12-二乙酰精胺抗原,检测病理切片中n1,n12-二乙酰精胺的水平。检测结果可用于评估组织细胞的增殖活跃程度,为二乙酰精胺的定性和定量检测提供了更为可靠的方法,也为医师提供辅助诊断信息。在一些优选的实施方式中,应用本发明提供的试剂盒,联合ki-67指标,将能够更准确的反应出肿瘤细胞的增殖活性。在一些优选的实施方式中,所述试剂盒还包括即用型羊抗兔/鼠igg抗体试剂、内源性过氧化物酶阻断剂、封闭液、原位微信号放大剂、染色剂、组织抗原修复缓冲液和空白对照试剂。另外,本发明还提供了一种二乙酰精胺的免疫组化检测方法,将待测组织切片进行预处理后,应用上述的免疫组化试剂盒进行免疫组化分析,通过染色结果判断二乙酰精胺的表达情况。优选地,所述待测组织切片的预处理包括脱蜡和水化;优选地,所述免疫组化分析包括如下(a)-(h):(a)、阻断内源性过氧化物酶;(b)、组织抗原修复;(c)、非特异性封闭;(d)、加本抗体试剂或空白对照试剂;(e)、加酶标二抗;(f)、加显色液;(g)、复染;(h)、脱水、透明、封片;优选地,所述染色结果的判断方法包括:随机选取4-6个400×视野观察,每个视野中二乙酰精胺阳性染色细胞数≥15%为二乙酰精胺阳性表达,每个视野中二乙酰精胺阳性染色细胞数<15%为二乙酰精胺阴性表达。二乙酰精胺染色阳性信号主要定位于细胞核,显微镜下为棕黄色。其中,染色结果判读方法为:阳性(+)/阴性(-)×100%。下面结合具体实施例和对比例,对本发明作进一步说明。实施例1本实施例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:5mmol/lpbs、2‰(w/v)tween20、1%(v/v)血清、10%(w/v)海藻糖、0.1‰(v/v)prolin、2%(w/v)甘油、0.1%(w/v)6-氨基乙酸、80mmol/ledta和0.1%(w/v)casein-na。实施例2本实施例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:15mmol/lpbs、0.1‰(w/v)tween20、15%(v/v)血清、1%(w/v)海藻糖、2‰(v/v)prolin、0.5%(w/v)甘油、1%(w/v)6-氨基乙酸、20mmol/ledta和0.5%(w/v)casein-na。实施例3本实施例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:10mmol/lpbs、1‰(w/v)tween20、5%-10%(v/v)血清、3%-5%(w/v)海藻糖、1‰(v/v)prolin、1%-1.5%(w/v)甘油、0.5%(w/v)6-氨基乙酸、50mmol/ledta和0.1%-0.25%(w/v)casein-na。对比例1本对比例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:10mmol/lpbs、1‰(w/v)tween20、3%-5%(w/v)海藻糖、1‰(v/v)prolin、1%-1.5%(w/v)甘油、0.5%(w/v)6-氨基乙酸、50mmol/ledta和0.1%-0.25%(w/v)casein-na。对比例2本对比例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:10mmol/lpbs、1‰(w/v)tween20、5%-10%(v/v)血清、1‰(v/v)prolin、1%-1.5%(w/v)甘油、0.5%(w/v)6-氨基乙酸、50mmol/ledta和0.1%-0.25%(w/v)casein-na。对比例3本对比例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:10mmol/lpbs、1‰(w/v)tween20、5%-10%(v/v)血清、3%-5%(w/v)海藻糖、1%-1.5%(w/v)甘油、0.5%(w/v)6-氨基乙酸、50mmol/ledta和0.1%-0.25%(w/v)casein-na。对比例4本对比例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:10mmol/lpbs、1‰(w/v)tween20、5%-10%(v/v)血清、3%-5%(w/v)海藻糖、1‰(v/v)prolin、1%-1.5%(w/v)甘油、50mmol/ledta和0.1%-0.25%(w/v)casein-na。对比例5本对比例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:10mmol/lpbs、1‰(w/v)tween20、5%-10%(v/v)血清、3%-5%(w/v)海藻糖、1‰(v/v)prolin、1%-1.5%(w/v)甘油、0.5%(w/v)6-氨基乙酸和50mmol/ledta。对比例6本对比例提供了一种n1,n12-二乙酰精胺单克隆抗体,包括:20mmol/lpbs、3‰(w/v)tween20、0.5%(v/v)血清、15%(w/v)海藻糖、0.05‰(v/v)prolin、5%(w/v)甘油、0.05%(w/v)6-氨基乙酸、90mmol/ledta和0.8%(w/v)casein-na。对比例7山羊血清,购自洛阳济佰生物科技有限公司。对比例8pbst,实验室自行配置,具体为0.05%tween20的pbs溶液。对比例9tbst,实验室自行配置,具体为10mmtris,100mmnacl,0.1%tween-20,调ph7.5。实验例1分别应用本发明实施例1-3及对比例1-9提供的单克隆抗体保护液制备包含n1,n12-二乙酰精胺单克隆抗体的试剂,其中n1,n12-二乙酰精胺单克隆抗体的浓度为500μg/ml。1、将上述试剂存放于2-8℃条件下,进行稳定性的检测,结果如表1所示。表1n1,n12-二乙酰精胺单克隆抗体在不同保护剂存放时在2-8℃下稳定性试验结果时间/效价0m3m6m9m12m16m20m24m实施例11:5121:5121:5121:5121:5121:2561:2561:256实施例21:5121:5121:5121:5121:5121:2561:2561:256实施例31:5121:5121:5121:5121:5121:5121:2561:256对比例11:5121:5121:5121:2561:2561:1281:641:64对比例21:5121:5121:2561:2561:2561:1281:641:64对比例31:5121:5121:2561:2561:1281:641:641:64对比例41:5121:5121:2561:2561:1281:641:641:64对比例51:5121:5121:2561:2561:1281:1281:641:64对比例61:5121:5121:5121:2561:2561:1281:641:64对比例71:5121:5121:5121:2561:2561:2561:1281:64对比例81:5121:5121:5121:5121:2561:2561:1281:64对比例91:5121:5121:5121:5121:2561:2561:2561:1282、将上述试剂存放于室温(22-25℃)条件下,进行稳定性的检测,结果如表2所示。表2n1,n12-二乙酰精胺单克隆抗体在不同保护剂存放时在室温下稳定性试验结果3、将上述试剂反复冻融4次,进行稳定性的检测,结果如表3所示。表3n1,n12-二乙酰精胺单克隆抗体反复冻融稳定性试验结果时间/效价1次2次3次4次实施例11:5121:2561:2561:256实施例21:5121:2561:2561:256实施例31:5121:2561:2561:256对比例11:5121:2561:1281:128对比例21:5121:1281:1281:128对比例31:5121:1281:1281:128对比例41:5121:1281:1281:128对比例51:5121:2561:1281:128对比例61:5121:2561:1281:128对比例71:5121:2561:1281:128对比例81:5121:2561:2561:128对比例91:5121:2561:1281:128从上述结果中可以看出,本发明实施例1-3提供的单克隆抗体保护液,通过各特定组分和配比之间的协同配合,使得该单克隆抗体保护液能够使n1,n12-二乙酰精胺单克隆抗体能在2-8℃和常温条件下长期存放,并能在反复冻融多次的条件下保持良好的效价,延长单克隆抗体的有效期。而对比例1-9提供的单克隆抗体保护液的效果远不及本发明实施例的水平。其中,实施例1-3提供的单克隆抗体保护液,其原料组分完全相同,仅配比不同。但实施例3提供的单克隆抗体保护液具有更好的保护抗体效价的作用。说明通过对各组分的配比进行进一步的调整和优化,使得本发明提供的单克隆抗体保护剂对n1,n12-二乙酰精胺单克隆抗体具有更好的稳定作用,能够有效延长抗体有效时长。实施例3与对比例1-5提供的单克隆抗体保护液相比,其相同组分的配比相同,但对比例1缺少血清、对比例2缺少海藻糖、对比例3缺少prolin、对比例4缺少6-氨基乙酸、对比例5缺少casein-na。实施例3提供的单克隆抗体保护液具有更好的保护抗体效价的作用。说明在相同原料组分的配比相同的情况下,只有通过各原料特定组分之间的协同配合,才能使得本发明提供的单克隆抗体保护剂对n1,n12-二乙酰精胺单克隆抗体具有更好的稳定作用,能够有效延长抗体有效时长。实施例3与对比例6提供的单克隆抗体保护液相比,其原料组分相同,但对比例6提供的单克隆抗体保护液的各组分的配比均不在本发明的范围内。实施例3提供的单克隆抗体保护液具有更好的保护抗体效价的作用。说明在原料组分相同的情况下,只有通过各原料特定配比之间的协同配合,才能使得本发明提供的单克隆抗体保护剂对n1,n12-二乙酰精胺单克隆抗体具有更好的稳定作用,能够有效延长抗体有效时长。实施例4免疫组化试剂盒将n1,n12-二乙酰精胺单克隆抗体溶于本发明实施例3提供的单克隆抗体保护液中(浓度为1mg/ml),制成n1,n12-二乙酰精胺单克隆抗体试剂。免疫组化试剂盒组成:一抗:n1,n12-二乙酰精胺单克隆抗体试剂;二抗:即用型羊抗兔/鼠igg(cellsignaltechnology公司);即用型非生物素免疫组化elivisionplus检测试剂(福州迈新生物技术开发有限公司);原位微信号(dab)放大试剂(福州迈新生物技术开发有限公司);其他试剂:内源性过氧化物酶阻断剂、酶标二抗、封闭抗体(即用型山羊血清)、苏木素染色液、柠檬酸组织抗原修复缓冲液、pbs缓冲液、空白对照试剂、二甲苯、乙醇、蒸馏水、中性树胶。实施例5本发明用于组织切片免疫组织化学染色诊断的具体操作步骤如下:(1)、脱蜡和水化1)石蜡切片置于二甲苯溶液中,浸泡5分钟/次,共3次;2)去除残液后,将切片置于无水乙醇中浸泡5分钟;3)去除残液后,将切片置于95%乙醇中浸泡2分钟;4)去除残液后,将切片置于80%乙醇中浸泡2分钟;5)去除残液后,将切片置于蒸馏水中浸泡5分钟;6)去除残液后,将切片置于pbs溶液冲洗3分钟。(2)、阻断内源性过氧化物酶1)去除残液后,在载玻片上用笔圈定待测组织区域;2)在区域内加入内源性过氧化物酶阻断剂100μl(2滴),室温孵育10分钟;3)用pbs溶液冲洗(共3次每次放置3分钟)。(3)、组织抗原修复1)将脱蜡后组织切片放入组织抗原修复液中,用微波炉加热至溶液沸腾,并继续加热6分钟;以上操作重复4次,每次要给切片补充足够液体防止干片;2)取出装有切片的容器后置于室温状态冷却30分钟;3)用pbs溶液冲洗(共3次,每次放置3分钟)。(4)、非特异性封闭切片滴加即用型山羊血清于室温下孵育30分钟进行非特异性蛋白封闭。(5)、加本抗体试剂或空白对照试剂去除残液后,加100μl本抗体试剂或空白对照试剂,4℃孵育,湿盒过夜。之后用pbs溶液冲洗3次,每次3分钟。(6)、加酶标二抗去除残液后,加100μl酶标二抗,37℃孵育30分钟。之后用pbs溶液冲洗3次,每次3分钟。(7)、加显色液去除残液后,样本滴加约100μl现配的dab显色液,于显微镜下进行显色,显色时间为1分钟。之后用pbs溶液冲洗3次,每次3分钟。(8)、复染去除残液后,加苏木素染色液100~200μl,室温孵育1分钟。之后用pbs溶液冲洗3次,每次3分钟。注意:苏木素染色液的过染或染色不足都有可能影响正确结果的判断。(9)、脱水、透明、封片1)将切片置于80%乙醇中,浸泡5分钟;2)去除残液后,将切片置于95%乙醇中,浸泡5分钟;3)去除残液后,将切片置于无水乙醇中,浸泡5分钟;4)去除残液后,将切片置于二甲苯溶液中,浸泡5分钟;5)用中性树胶和盖玻片封片。(10)、结果判断染色结果判读方法:阳性(+)/阴性(-)×100%。das染色阳性信号主要定位于细胞核,显微镜下为棕黄色。随机选取5个高倍(400×)视野观察,每个视野中das阳性染色的细胞数目判断标准:1)阳性染色细胞数≥15%为das阳性表达;2)阳性染色细胞数<15%为das阴性表达。实验例2样本组织取自于2011年3月到2016年3月之间在中国医科大学附属第一医院诊断为肠癌并接受外科手术的患者,选择7例相应癌旁健康组织作为对照组。患者在术前未接受化疗和放疗。其中男性患者29例,女性患者31例,患者年龄在37-84之间。患者有完整的临床病理资料。将收集的肠癌蜡块组织制备成为厚度为4μm的组织切片进行免疫组织化学检测。结果如图1和图2所示。从图中可以看出n1,n2-二乙酰精胺单克隆抗体das显色时间短,染色效果清晰明确,说明该单克隆抗体效价较高,可以进行免疫组织化学染色。通过免疫组织化学方法检测了60例肠癌组织以及7例相应癌旁健康组织中diacspm的蛋白表达水平。于显微镜下观察diacspm阳性染色表现为细胞核出现棕黄色染色。结果显示,60例肿瘤组织中,45例为diacspm阳性表达(如图3a-f所示),阳性表达率为75%。癌旁组织中diacspm的阳性表达率为14.3%,明显低于肿瘤组织。统计分析diacspm高表达与患者的年龄,性别,肿瘤的分化程度,tnm分期以及ki-67指数之间的关系发现,diacspm在肠癌中的高表达与患者较高ki-67(p=0.037)指数显著相关。但是与患者的年龄(p=0.646),性别(p=0.881),肿瘤的分化程度(p=0.816)以及肿瘤的tnm分期(p=0.543)无显著相关性(如表4所示)。表4.diacspm表达与肠癌患者临床病理因素相关性分析最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1