一种白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的定量检测方法与流程
本发明涉及中药材药物研究
技术领域:
,具体涉及一种白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的定量检测方法。
背景技术:
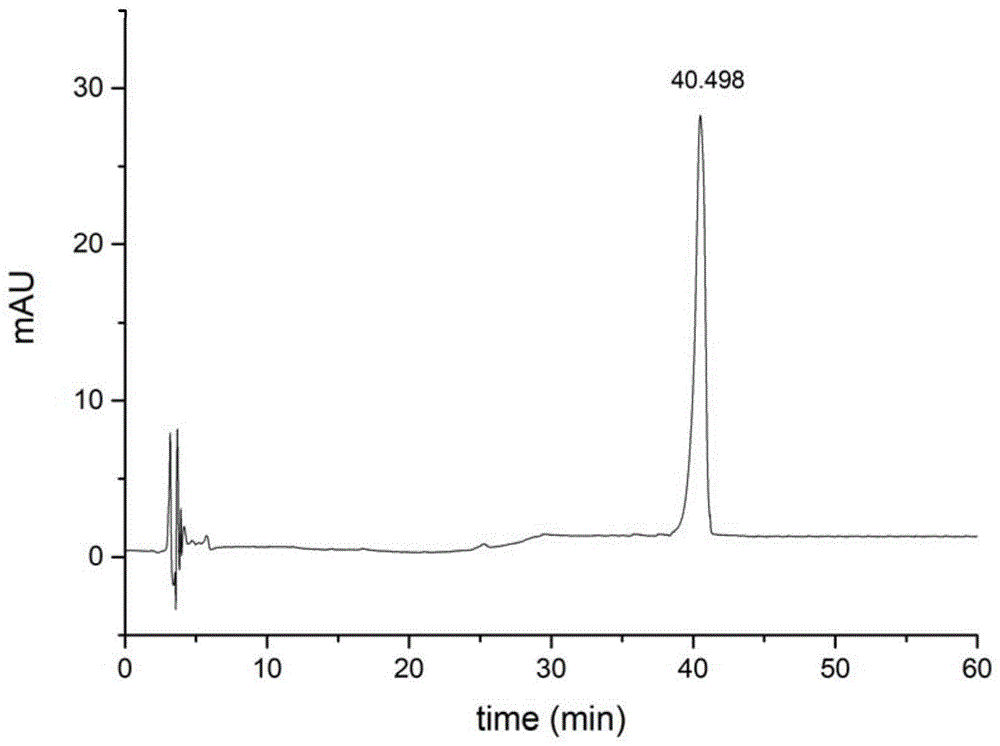
:白及(bletillastriata(thunb.)rchb.f.)为兰科白及属多年生草本植物,是历代药典收录的重要传统中药材,其味甘,性微寒,具有生肌治疮、止血收敛的功效,可用于治疗外伤出血等。9,10-二氢菲类化合物是目前报道的从白及中分离获得最多的次生代谢产物之一。该类化合物具有较高的医学研究价值,它对人癌细胞株hepg2的增殖有显著地抑制作用,同时对枯草芽孢杆菌atcc6633、金黄色葡萄球菌atcc25923、白色念珠菌atcc1057及发癣菌qm248等细菌也具有良好的抑制作用。目前,利用植物细胞悬浮培养技术高效的促进细胞增殖和定向诱导次生代谢物的合成积累,已成为利用植物细胞培养生产次生代谢物最有前景的生物合成方式。但是,国内外研究对于检测白及悬浮培养细胞中的其次生代谢产物尤其是9,10-二氢菲类化合物的研究却无相关报道。白及悬浮培养细胞中普遍存在2,7-二羟基-4-甲氧基-9,10-二氢菲化合物,该化合物属于9,10-二氢菲类化合物。因此,建立一种可以高效、准确、稳定得定量检测白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲化合物的方法显得尤为重要。技术实现要素:本发明意在提供一种白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的定量检测方法,以解决现有白及细胞悬浮培养中无法精确定量测定细胞中次生代谢产物2,7-二羟基-4-甲氧基-9,10-二氢菲累积情况的技术问题。本方案中的一种白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的定量检测方法,包括以下步骤:步骤一、取烘干后白及悬浮培养细胞,以甲醇水溶液为溶剂加热回流提取,提取液经回收溶剂后得到的残留物用甲醇水溶解转移定容,过滤,得到浓度为0.04g/ml~0.4g/ml的供试品溶液;步骤二、取2,7-二羟基-4-甲氧基-9,10-二氢菲对照品,以甲醇水溶液为溶剂溶解,过滤,得到浓度为0.1mg/ml~0.0025mg/ml的对照品溶液;步骤三、采用高效液相色谱法,分别对所述供试品溶液和对照品溶液进行检测,分别获得供试品色谱图和对照品色谱图;所述检测条件具体为:色谱柱的尺寸为:柱长150mm~250mm,柱内径为2mm~5mm,色谱柱填充剂为十八烷基硅烷键合硅胶,所述填充剂的颗粒直径为5μm~10μm;检测波长为225nm,柱温为25℃~30℃,流速为0.8ml/min~1.0ml/min;流动相由流动相a和流动相b组成,其中流动相a为甲醇,流动相b为超纯水,按如下条件进行洗脱:0~10min:流动相a占流动相总体积的百分比由20%增加到25%;10~25min:流动相a占流动相总体积的百分比由25%增加到50%;25~35min:流动相a占流动相总体积的百分比保持50%不变;35~50min:流动相a占流动相总体积的百分比由50%增加到100%;50~60min:流动相a占流动相总体积的百分比保持100%不变;步骤四、依据所述对照品色谱图与所述供试品色谱图中各自的2,7-二羟基-4-甲氧基-9,10-二氢菲峰面积,采用外标法计算所述待测白及悬浮培养细胞提取液中2,7-二羟基-4-甲氧基-9,10-二氢菲的含量;其中,所述甲醇水溶液的浓度为70%~100%。在本方案所限定的检测波长、柱温、流速、色谱柱等因素下,结合在上述流动相条件,可有效基线分离待测次生代谢产物2,7-二羟基-4-甲氧基-9,10-二氢菲化合物,保留时间合适,出峰位置无干扰,且峰形良好,从而能够准确的测定出白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的含量。通过该方法可以获得白及悬浮培养细胞中有效的药用成分2,7-二羟基-4-甲氧基-9,10-二氢菲化合物含量变化的信息,为后续定向诱导调控白及悬浮培养细胞生成2,7-二羟基-4-甲氧基-9,10-二氢菲化合物,利用液体悬浮培养工业化产2,7-二羟基-4-甲氧基-9,10-二氢菲化合物提供技术支持。进一步,本方案中还包括制备定位用对照品溶液的步骤,取不同质量的2,7-二羟基-4-甲氧基-9,10-二氢菲对照品配置成不同质量浓度的对照品溶液,以甲醇水溶液为溶剂溶解即得;采用步骤三所述高效液相色谱法检测所述定位所用对照品溶液,获得定位用对照品色谱图;步骤四依据所述定位用对照品色谱图与所述供试品色谱图中各自的2,7-二羟基-4-甲氧基-9,10-二氢菲峰及峰面积,采用外标法计算所述待测白及悬浮培养细胞提取液中2,7-二羟基-4-甲氧基-9,10-二氢菲峰的含量。进一步,步骤一中白及悬浮培养细胞由继代培养3~4代30~45天生长良好、质地疏松、生长状况一致的白及愈伤组织作为液体悬浮培养的外植体悬浮培养而来;悬浮培养基为ms+6-苄氨基嘌呤1.5±0.45mg/l+2,4-二氯苯氧乙酸2.5±0.5mg/l+30±20g/l蔗糖,悬浮培养基的ph为6.0±0.2;外植体的接种量与培养基的体积比例为1/80~1/20g/ml;接种后在转速为120±10r/min、温度为25±2℃的黑暗条件下进行振荡悬浮培养,悬浮培养时间为35~40天。在该培养条件下,白及悬浮培养细胞生物合成累积2,7-二羟基-4-甲氧基-9,10-二氢菲的累积效率可以达到相对最大值。进一步,步骤一中甲醇水溶液的浓度为70%,回流提取1~3次,每次提取2~4小时。进一步,步骤一中采用浓度为70%的甲醇回流提取2次,每次提取3小时。利用该提取条件提取,样品中2,7-二羟基-4-甲氧基-9,10-二氢菲化合物提取充分,并且提取过程耗能少。进一步,步骤三中,所述供试品溶液与所述对照品溶液的进样量均为20μl。进一步,步骤一中供试品溶液的浓度为0.4g/ml;步骤二中对照品溶液的浓度0.025g/ml。在供试品溶液浓度为0.4g/ml的条件下白及悬浮培养细胞供试品提取物可以全部溶解在70%甲醇水溶液中,且进样量为20μl时供试品溶液中待测的2,7-二羟基-4-甲氧基-9,10-二氢菲化合物的峰面积大小合适。且在0.025g/ml对照品溶液的峰面积大小与0.4g/ml供试品溶液中待测的9,10-二氢菲类化合物的的峰面积大小相近。合适的峰面积大小使测定准确,避免检测误差。进一步,步骤三中,柱温为25℃,流速为0.8ml/min。在该检测条件下,可以更为有效准确的测定2,7-二羟基-4-甲氧基-9,10-二氢菲化合物的峰面积。进一步,步骤三中,柱长为250mm,柱内径为4.6mm,填充剂的颗粒直径为5μm。使用该型色谱柱,可以同时满足2,7-二羟基-4-甲氧基-9,10-二氢菲化合物的测量条件与仪器的限制和要求。附图说明图1为实施例中白及悬浮培养细胞的供试品色谱图;图2为实施例中2,7-二羟基-4-甲氧基-9,10-二氢菲对照品色谱图;图3为实施例中2,7-二羟基-4-甲氧基-9,10-二氢菲对照品线性关系图。具体实施方式下面通过具体实施方式进一步详细的说明:本发明白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的定量检测方法,包括以下步骤:1)供试品溶液制备:取液体悬浮培养的白及细胞,离心去上清后烘干至恒重;精密称取0.20g,置三口烧瓶中,使用100ml浓度为70%的甲醇水溶液,加热回流提取2h,用干燥滤纸过滤后得到提取液;提取液减压回收溶剂至残留物干燥后,量取适量70%甲醇水溶解后转移到5ml容量瓶中,定容,摇匀,过滤得白及液体悬浮培养细胞的供试品溶液;2)对照品溶液制备:精密称取2,7-二羟基-4-甲氧基-9,10-二氢菲对照品适量,用浓度为70%的甲醇水溶液配制成质量浓度分别为0.1、0.05、0.025、0.01、0.005、0.0025mg/ml的对照品溶液;3)高效液相色谱法测定:色谱柱以十八烷基硅烷键合硅胶为填料,填料直径为5μm;柱长250mm,柱内径为4.6mm;检测波长为225nm,柱温为25℃,流速为0.8ml/min;流动相由流动相a和流动相b组成,其中流动相为甲醇a,超流动相b为纯水,按如下条件进行洗脱:0~10min:流动相a占流动相总体积的百分比由20%增加到25%;10~25min:流动相a占流动相总体积的百分比由25%增加到50%;25~35min:流动相a占流动相总体积的百分比保持50%不变;35~50min:流动相a占流动相总体积的百分比由50%增加到100%;50~60min:流动相a占流动相总体积的百分比保持100%不变;精密吸取供试品溶液、对照品溶液各20μl,注入液相色谱仪,获得供试品、对照品色谱图;以对照品2,7-二羟基-4-甲氧基-9,10-二氢菲的峰面积,与供试品溶液中2,7-二羟基-4-甲氧基-9,10-二氢菲的峰面积采用外标法计算待测悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的含量。本方法中,甲醇水溶液的浓度在70%~100%,色谱柱的尺寸为:柱长150mm~250mm,柱内径为2mm~5mm,色谱柱填充剂为十八烷基硅烷键合硅胶,所述填充剂的颗粒直径为5μm~10μm;柱温为25℃~30℃,流速为0.8ml/min~1.0ml/min;均能够有效检测出悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的含量。一、专属性考察:取供试品溶液与任一浓度对照品溶液进样,白及悬浮培养细胞的供试品色谱图(如图2所示),2,7-二羟基-4-甲氧基-9,10-二氢菲对照品色谱图(如图1所示),供试品色谱图中有与对照品保留时间相同的色谱峰,且无其他峰干扰测定,本方法专属性良好。二、线性关系考察:以浓度为70%甲醇水溶液配制成的质量浓度分别为0.1、0.05、0.025、0.01、0.005、0.0025mg/ml的对照品溶液,分别吸取20μl注入液相色谱仪,记录色谱图;如图3所示,以峰面积为纵坐标,以对照品浓度(mg/ml)为横坐标,进行线性回归,结果如表1。表12,7-二羟基-4-甲氧基-9,10-二氢菲线性回归结果结果表明2,7-二羟基-4-甲氧基-9,10-二氢菲在进样量为0.05~2.0μg之间,峰面积与进样量呈良好的线性关系。三、精密度考察:取0.01mg/ml的2,7-二羟基-4-甲氧基-9,10-二氢菲对照品溶液,按上述高效液相色谱法连续进样5次,记录标准品的保留时间与峰面积,然后根据公式计算其相对标准偏差(rsd),结果如表2。表2精密度考察结果(n=5)12345rsd(%)保留时间(min)40.52940.53140.56440.53240.6800.16峰面积(mau)459.6464.8463.8471.9456.91.24结果表明连续5次进样2,7-二羟基-4-甲氧基-9,10-二氢菲在进样量保留时间与峰面积的rsd分别为0.16%与1.24%,说明仪器进样精密度良好。四、稳定性考察:取白及悬浮培养细胞供试品溶液,分别在制备后0h、3h、6h、9h、12h依次进样,记录相应的保留时间与峰面积,根据公式计算其相对标准偏差(rsd),结果如表3。表3稳定性考察结果(n=5)0h3h6h9h12hrsd(%)保留时间(min)40.96040.92040.39940.02040.8821.61峰面积(mau)1431.01456.61511.21418.71411.22.80结果表明在不同时间进样,2,7-二羟基-4-甲氧基-9,10-二氢菲的进样量保留时间与峰面积的rsd分别为1.61%与2.80%,说明供试品溶液在制备后12h内保持稳定。五、重复性考察:取白及悬浮培养细胞,平行制备5份供试品溶液,按上述高效液相色谱法连续进样记录相应的保留时间与峰面积,计算白及悬浮培养细胞中2,7-二羟基-4-甲氧基-9,10-二氢菲的含量(mg/g),然后根据公式计算其相对标准偏差(rsd),结果如表4。表4重复性考察结果(n=5)12345rsd(%)保留时间(min)41.04841.28841.08441.59441.0130.59峰面积(mau)1388.81330.91407.61422.81389.72.51样品含量(mg/g)0.550.530.550.560.552.00结果表明5份平行制备白及悬浮培养细胞提取液保留时间、峰面积与样品含量的rsd分别为0.59%、2.51%与2.00%。六、加样回收实验:取上述相同处理条件下的白及悬浮培养细胞9份,精密称定0.02g,分别精密加入低、中、高3个质量浓度的对照品溶液(分别相当于原待测样品中质量分数的80%、100%、120%)每一质量浓度3份,根据测得量和加入量计算各成分的加样回收率和其相对标准偏差(rsd)。表5加样回收实验结果(n=5)结果表明,白及悬浮培养细胞提取液中加样2,7-二羟基-4-甲氧基-9,10-二氢菲回收样品的平均回收率为99.59%,rsd为1.98%。表明该方法准确度良好。尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1