一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法及其检测试剂盒与流程
本发明属于生物技术领域,具体涉及一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法及其检测试剂盒。
背景技术:
对于吸毒人员吸食新型阿片类精神物质,如芬太尼的检测和监管是各国监管部门的难题。因为目前的检测手段主要依赖于抗体(如抗芬太尼抗体)的免疫法,包括层析法、elisa法等;以及气质联用、液质联用等大型仪器分析。但芬太尼在人体内代谢较快,造成检测样本中目标检测成分含量极低,无法检测到。另一方面,新型合成的芬太尼层出不穷,且分子结构多样,使基于抗体的免疫检测法几乎不可能,甚至气质联用、液质联用也难以实现监管检测。
技术实现要素:
针对现有技术存在的上述技术问题,本发明的目的在于提供一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法及其检测试剂盒。
本发明构思为:无论是天然阿片类物质,还是各种各样的合成阿片类精神物质,如芬太尼及其衍生物,其在机体内都会作用到阿片受体这个靶点,从而产生其生物学效应。阿片受体至少包括μ型、k型、δ型、和σ型四种阿片受体,μ型阿片受体是吗啡、芬太尼等阿片类精神物质亲和力和作用最强的受体。阿片受体属于gpcr类,当受到阿片类分子激动剂作用后信号通路激活,即通过ip3-dag信号使内质网内储存的ca2+迅速释放到的细胞质,胞质内游离钙离子浓度升高,从而产生细胞应答,如神经细胞释放多巴胺。由于多巴胺的测定有成熟的elisa检测试剂盒,因而我们通过建立稳转mor1的神经母细胞瘤细胞系mor1/sk-n-sh,建立一种基于细胞多巴胺释放效应的阿片类活性物质检测方法,应用于快速、高效、精准、高通量的检测各种样品中的阿片类活性物质。
所述的一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法,其特征在于包括以下步骤:
1)将阿片受体基因克隆到cmv启动子下,构建真核表达质粒;
2)将步骤1)真核表达质粒转染到神经母细胞瘤细胞,并建立阿片受体稳转的神经母细胞瘤细胞系,进行培养扩增得到检测组细胞培养液;同时建立一个转染对照空载体的神经母细胞瘤细胞系,进行培养扩增得到对照组细胞培养液;
3)步骤2)检测组细胞培养液中加入标准品并充分反应,标准品为吗啡或芬太尼,配制一系列不同标准品浓度的标准液;将标准液离心分离后,取上清液并用elisa检测试剂盒检测多巴胺效应下的吸光度od值,以测得的吸光度od值为纵坐标,以标准液中的标准品浓度为横坐标绘制标准曲线,计算拟合回归方程;
4)步骤2)检测组细胞培养液中加入待测样本,充分反应,离心分离后取上清液,对反应后的检测组细胞培养液的上清液用elisa检测试剂盒检测多巴胺效应下的吸光度od1值;步骤2)对照组细胞培养液中加入待测样本,充分反应,离心分离后取上清液,对反应后的对照组细胞培养液的上清液用elisa检测试剂盒检测多巴胺效应下的吸光度od2值;计算吸光度od1值与吸光度od2值之差,并带入步骤3)回归方程,即可推算出待测样本中的阿片类活性物质的效应含量。
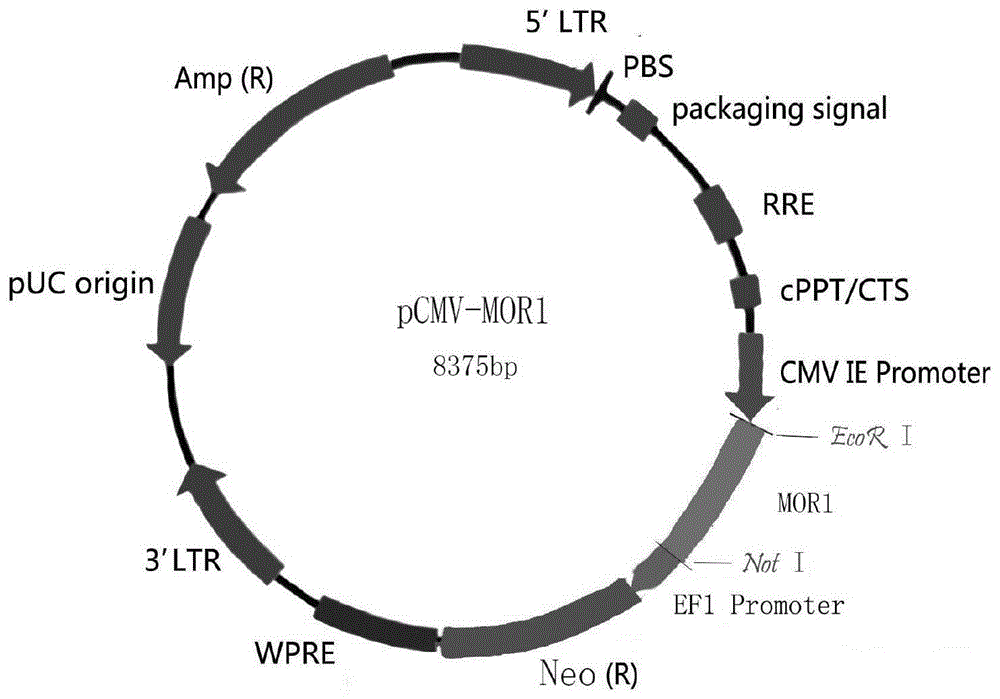
所述的一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法,其特征在于步骤1)中,所述阿片受体基因为人源μ型阿片受体mor1基因;所述真核表达质粒为pcmv-mor1质粒,其构建过程为:将人源μ型阿片受体mor1基因克隆到慢病毒表达载体pcdh-cmv-mcs-ef1-neo的cmv启动子下,连接酶切位点为ecori和noti,构建真核表达质粒pcmv-mor1。
所述的一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法,其特征在于步骤2)中,神经母细胞瘤细胞为sk-n-sh细胞;建立阿片受体稳转的神经母细胞瘤细胞系的过程为:将pcmv-mor1质粒、ph1质粒、ph2质粒共转染至慢病毒包装细胞293v,制备得到cmv-mor1慢病毒;将cmv-mor1慢病毒感染sk-n-sh细胞得到mor1/sk-n-sh稳转细胞,用含新霉素g418的条件培养基筛选mor1/sk-n-sh稳转细胞,并通过挑取克隆的方法获得稳定表达人源μ型阿片受体mor1基因的单克隆细胞系mor1/sk-n-sh。
所述的一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法,其特征在于步骤2)中,建立一个转染对照空载体的神经母细胞瘤细胞系的过程为:将pcdh-cmv-mcs-ef1-neo空载体、ph1质粒、ph2质粒共转染至慢病毒包装细胞293v,制备得到空载体慢病毒;将空载体慢病毒感染sk-n-sh细胞得到neo/sk-n-sh稳转细胞,用含新霉素g418的条件培养基筛选neo/sk-n-sh稳转细胞,并通过挑取克隆的方法获得空白对照细胞系neo/sk-n-sh。
所述的一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法,其特征在于步骤3)中,向检测组细胞培养液中加入标准品并充分反应,配制标准品浓度分别为0.01、0.05、0.25、1.25、6.25ng/ml的5种标准液,所述标准品为吗啡。
所述的一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法,其特征在于步骤3)中,向检测组细胞培养液中加入标准品并充分反应,配制标准品浓度分别为1、3、9、27、81pg/ml的5种标准液,所述标准品为芬太尼。
所述的一种基于细胞多巴胺释放效应的阿片类活性物质的检测方法,其特征在于步骤4)中,所述待测样本为吸毒人员的尿液、血液、毛发、头皮屑、汗液或唾液,或者为天然大麻、天然大麻制品、合成大麻、合成大麻制品、污水、土壤、水塘中的任意一种。
所述的一种阿片类活性物质的检测试剂盒,其特征在于所述检测试剂盒包括检测组试剂盒和对照组试剂盒两种成分,所述检测组试剂盒包括稳定表达人源μ型阿片受体mor1基因的单克隆细胞系mor1/sk-n-sh和elisa检测试剂盒,所述对照组试剂盒包括空白对照细胞系neo/sk-n-sh和elisa检测试剂盒。
相对于现有技术,本发明取得的有益效果是:
(1)避免了免疫检测法依赖于抗体的局限,可直接对所有阿片类活性物质进行通用检测,没有非特异性结合问题,无需昂贵人力物力和繁复长周期的抗体研发过程;同时也避免了气质联用、液质联用法依赖于对照品的局限、有限的检测限、以及复杂的样品前处理工作。本发明的技术方案可实现所有阿片类活性物质的精确、高灵敏的快速检测,无论是天然阿片类产品、还是合成阿片类分子,包括层出不穷的新型合成阿片活性物质,如芬太尼及其各种衍生物,可解决新型合成阿片类精神活性物质监管难的问题。
(2)可利用现有的多巴胺elisa检测试剂盒定量检测分析。
(3)可用通用的荧光酶标仪测定,可在绝大多数普通实验室实现检测。
(4)由于是基于受体信号通路的生物学效应的检测,结果不仅可正确判断是否是阿片类活性物质,而且可以对其活性进行定量评估,为监管、和医学干预提供可靠的实验依据。
(5)本发明提供一种稳转细胞系,其能够通过mor1的ip3-dag信号通路对包括天然阿片类产品和合成阿片类分子在内的所有阿片类活性物质产生应答,细胞释放多巴胺,从而可应用于阿片类活性物质的高灵敏的通用检测。该稳转神经母细胞瘤细胞系中包含一个由cmv启动高表达基因mor1,当阿片类活性物质作用于mor1时,即可启动ip3-dag信号通路,使神经细胞迅速释放多巴胺;因而可利用现有的多巴胺检测试剂盒定量检测分析。另一方面,本发明提供了一种简单、快速、高效、灵敏(皮克级)、精确、高通量的阿片类活性物质通用检测试剂盒,该检测试剂盒基于mor1受体的ip3-dag信号通路,通过检测细胞迅速释放的多巴胺检测来实现快速、灵敏、精确的定量检测分析。
附图说明
图1为pcmv-mor1质粒图谱;
图2为以吗啡标准品浓度为横坐标,检测的吸光度od值为纵坐标绘制的标准曲线;
图3为采用本发明的阿片类活性物质通用检测试剂盒对吗啡毛发样本的检测结果;
图4为竞争elisa法对0-12.8ng/ml浓度的吗啡的检测结果,曲线表明吗啡检测极限>0.2ng/ml;
图5为竞争elisa法对0.2-6.4ng/ml浓度的吗啡检测标准曲线;
图6为竞争elisa法对毛发样本的检测结果;
图7为以芬太尼标准品浓度为横坐标,标准品组的吸光度od值为纵坐标绘制标准曲线标;
图8为采用本发明的阿片类活性物质通用检测试剂盒对芬太类样本的检测结果;
图9为竞争elisa法对0-12.8ng/ml浓度的芬太尼标准品的检测结果,曲线表明芬太尼检测极限>0.4ng/ml;
图10为竞争elisa法对0.4-12.8ng/ml浓度的芬太尼检测标准曲线;
图11为竞争elisa法对芬太尼样本的检测结果。
具体实施方式
下面结合具体实施例对本发明作进一步说明,但本发明的保护范围并不限于此。
以下实施例中,慢病毒包装系细胞293v购自于北京英茂盛业生物科技有限公司。
实施例1pcmv-mor1质粒构建
通过连接酶切位点ecori和noti,将人源μ型阿片受体mor1基因克隆到慢病毒表达载体pcdh-cmv-mcs-ef1-neo的cmv启动子下,构建真核表达质粒pcmv-mor1(如图1所示)。
实施例2建立mor1/sk-n-sh稳转细胞系和空白对照neo/sk-n-sh稳转细胞系
将pcmv-mor1质粒、ph1质粒、ph2质粒共转染到慢病毒包装系细胞293v,制备mor1慢病毒,并转染sk-n-sh细胞,g418筛选、克隆建立mor1/sk-n-sh稳转细胞系。将pcdh-cmv-mcs-ef1-neo质粒、ph1质粒、ph2质粒共转染到慢病毒包装系细胞293v,制备空载体慢病毒,并转染sk-n-sh细胞,g418筛选、克隆建立空白对照neo/sk-n-sh稳转细胞系。具体步骤如下:
1)包装系细胞准备:转染前一天,将用dmem-h完全培养液(含10%fbs和100u/ml青霉素、100μg/ml链霉素双抗)将慢病毒包装系细胞293v配成1×106个/ml浓度接种于一个d19cm的细胞培养皿,37℃、5%co2培养过夜。
2)转染:待培养皿中细胞长至70%-80%的融合度时,用pei转染试剂(参照其标准的转染操作规程)将20μg的pcmv-mor1质粒、14μg的ph1质粒和4.7μg的ph2质粒共转染培养皿中的细胞293v。
3)收集病毒:步骤2)培养72小时后收集上清液;在4℃温度且8000g相对离心力的条件下离心分离15分钟,去沉淀,取上清病毒液过0.45μm滤膜,得到滤过的上清病毒液。
4)病毒浓缩:取步骤3)滤过的上清病毒液(约30ml),在4℃温度且90000g相对离心力的条件下离心分离90分钟,去上清,沉淀即为cmv-mor1慢病毒,用1ml的dmem-h完全培养液重悬,得到浓缩后的cmv-mor1慢病毒。
5)sk-n-sh细胞准备:预先将1×105个/ml浓度的sk-n-sh细胞接种12孔细胞培养板1个孔,37℃、5%co2培养至50%的细胞融合度。
6)sk-n-sh细胞转染:将步骤5)的12孔板中的培养sk-n-sh细胞的培养液吸掉,加入步骤4)浓缩后的1ml的cmv-mor1慢病毒;37℃、5%co2培养22-24小时,换新鲜dmem-h完全培养液。
7)mor1/sk-n-sh稳转细胞筛选:上述步骤6)转染后的sk-n-sh细胞培养一周以上后,配成1×104个/ml浓度接种于6孔细胞培养板,2ml/孔;第二天细胞贴壁后吸去培养液,加入2ml的条件培养液(含600μg/ml的g418的dmem-h完全培养液);每三天换1次新鲜的条件培养液(含600μg/ml的g418的dmem-h完全培养液),21-30天后换含有200μg/ml的g418的dmem-h完全培养液。
8)单克隆mor1/sk-n-sh稳转细胞系建立:将上述步骤7)mor1/sk-n-sh稳转细胞配成1×103个/ml浓度接种于6孔细胞培养板,2ml/孔;培养10天后在显微镜下用50μl的移液枪挑取单个克隆移至新的6孔细胞培养板培养,1个克隆/孔;扩增后用pcr检测mor1基因、wb检测mor1蛋白,以获得高、中、低不同表达水平的mor1/sk-n-sh细胞克隆系,用于不同活性效应程度的阿片类活性物质检测。
空白对照neo/sk-n-sh稳转细胞系建立:依上述1)-7)的步骤,建立空白对照neo/sk-n-sh稳转细胞系,不同之处在于:步骤2)中的pcmv-mor1质粒用同等质量的pcdh-cmv-mcs-ef1-neo质粒替换,最后得到空白对照neo/sk-n-sh稳转细胞系。
实施例3阿片类活性物质通用检测试剂盒的应用
基于本发明技术方案研发的阿片类活性物质通用检测试剂盒可应用于含阿片类活性物质的各种样本检测。本实施例中我们以吸食吗啡人员的毛发为例。具体步骤如下:
1)毛发样本处理:取5份吗啡吸食人员的毛发样本和5份无吸食史的正常人的毛发样本,编号如表1。
剪取发根3cm以内的毛发样本20mg/份,剪碎后放入5ml的ep管,加2ml含1%角蛋白酶的hbss缓冲液(ph7.4),加入少量锆珠和石英砂,粉碎仪上振荡粉碎1分钟,分别得到相应的样本液。
2)细胞准备:提前一天将5×105个/ml浓度的单克隆mor1/sk-n-sh细胞和空白对照neo/sk-n-sh细胞分别各接种于一个96孔细胞培养板,200μl/孔;37℃、5%co2培养24小时。
3)加样处理:分为标准品组、样本组,处理方法如下。
标准品组:mor1/sk-n-sh细胞6孔,各孔分别加终浓度为0、0.01、0.05、0.25、1.25、6.25ng/ml的吗啡(mop)标准品,100μl/孔;空白对照neo/sk-n-sh细胞同样处理。
样本组:mor1/sk-n-sh细胞共42孔(每样3个重复孔),分别加入步骤1)所得样本液,100μl/孔;空白对照neo/sk-n-sh细胞同样处理。
4)检测:对步骤3)处理的标准品组和样本组,分别进行多巴胺浓度测试,标准品组和样本组的检测方法步骤相同。标准品组的检测过程为:步骤3)处理后的标准品组反应5-10分钟后,在800g相对离心力的条件下离心分离5分钟,吸取上清液加到多巴胺elisa检测试剂盒的孔板进行定量测定分析。
5)结果:以吗啡标准品浓度为横坐标,多巴胺检测的吸光度od值为纵坐标绘制标准曲线,y=0.4551x+0.46,r2=0.9814,如图2所示。样本组多巴胺检测的吸光度od值的结果如图3,可明显区分阳性样本和阴性样本;根据绘制标准曲线方程计算,阴性样本均检测不到吗啡成分,阳性样本中吗啡含量分别为(ng/mg):m1:0.0429、m2:0.0845、m3:0.0404、m4:0.0544、m5:0.0096。
对比例1:竞争elisa法检测吗啡吸食人员的毛发样本
目前阿片类检测主要依赖于免疫法检测,包括胶体金免疫层析法和竞争elisa法。胶体金法适合快检,但在灵敏度上elisa法要比胶体金法高1个数量级。本对比例即以elisa法检测吗啡吸食人员的毛发样本为例。具体步骤如下:
1)毛发样本处理:用实施例3中同一的处理样本,分别得到相应的样本液(毛发样本编号与表1相同)。
2)包被抗原:用0.05mol/l碳酸盐缓冲液(ph9.6)将mop-bsa抗原蛋白配制成1μg/ml浓度,并包被96孔板,100μl/孔,4℃过夜后,用pbs缓冲液(ph7.4)洗板5次尽量除去非特异性结合。
3)实验分组:标准曲线组、样本组,处理方法如下:
标准曲线组:将mop标准品用pbs缓冲液(ph7.4)配成终浓度分别为0、0.10、0.20、0.40、0.80、1.60、3.20、6.40、12.80ng/ml的9组,各组均含5μg/ml(浓度的选择由抗体的效价决定)的mop-mab单抗,混匀后加入mop-bsa包被的96孔板各1孔,100μl/孔。
样本组:在毛发提取的样本液加入mop-mab单抗,mop-mab单抗终浓度为5μg/ml,混匀后加入mop-bsa包被的96孔板各1孔,100μl/孔,每个样品3个复孔。
4)竞争结合与测定:上述各组37℃孵育30分钟,倒去溶液,用pbs缓冲液(ph7.4)洗板5次;加hrp标记羊抗小鼠二抗,37℃孵育30分钟,倒去溶液,用pbs缓冲液(ph7.4)洗板5次;显色、终止反应后用酶标仪在450nm波长下测定吸光度(od)值。
5)结果:如图4所示,结果表明该竞争elisa法对mop的检测极限>0.2ng/ml;mop浓度为0.2-6.4ng/ml下的吸光度(od)值的标准曲线如图5,曲线方程为y=-0.2458x+1.6281,r2=0.9444。样本组的结果如图6所示,5个阳性样本中检出4个,1个未检出。据绘制标准曲线方程计算,阴性样本均检测不到吗啡成分,检出的4个阳性样本中吗啡含量分别为(ng/mg):m1:0.049、m2:0.078、m3:0.063、m4:0.059。
从实施例3和对比例1可以看出,竞争elisa法检测吗啡吸食人员的毛发样本灵敏度、准确性远不如本发明所述之系统。而且,elisa法依赖于特定的抗体,只能检测单一成分,对于层出不穷的各类合成阿片则无能为力,而本发明的技术却很好地解决了这个难题。
实施例4阿片类活性物质通用检测试剂盒的应用-芬太尼类检测
基于本发明技术方案研发的阿片类活性物质通用检测试剂盒可应用于含阿片类活性物质的各种样本检测。本实施例中我们以含芬太尼类样本为例。具体步骤如下:
1)兔毛样本处理:取3份静脉注射过芬太尼的家兔的毛样本和3份正常兔毛样本,编号如表2。
取兔毛样本20mg/份,剪碎后放入5ml的ep管,加2ml含1%角蛋白酶的hbss缓冲液(ph7.4),加入少量锆珠和石英砂,粉碎仪上振荡粉碎1分钟。各样本用无菌pbs缓冲液(ph7.4)稀释10倍用,分别得到相应的样本液。
2)城市污水:取城市污水,分为3份,其中2份分别加芬太尼和卡芬太尼使终浓度分别为3pg/ml和0.3pg/ml,分别为表2加样城市污水的f4和f5;另1份为不加任何药物的空白对照的城市污水(nf4)。各样本经1200g相对离心力的条件下离心分离15分钟,取上清液过0.22μm滤膜除菌后用无菌pbs缓冲液(ph7.4)透析过夜,分别得到相应的样本液。
3)细胞准备:提前一天将5×105个/ml浓度的单克隆mor1/sk-n-sh细胞接种于一个96孔细胞培养板,200μl/孔;37℃、5%co2培养24小时。
4)加样处理:分为标准品组、样本组,处理方法如下。
标准品组:mor1/sk-n-sh细胞共5孔,各孔含芬太尼标准品,芬太尼(fentanyl)终浓度分别为1、3、9、27、81pg/ml,100μl/孔。
样本组:mor1/sk-n-sh细胞共30孔(每样3个重复孔),100μl/孔,分别加入步骤1)或步骤2)所得样本液,另设空白对照加入pbs缓冲液(ph7.4),同样3个重复孔,100μl/孔;空白对照neo/sk-n-sh细胞同样处理。
5)检测:步骤4)各组加样作用5-10分钟,800g相对离心力的条件下离心分离5分钟,吸取上清液加到多巴胺elisa检测试剂盒的孔板进行定量测定分析。
6)结果:以芬太尼标准品浓度为横坐标,多巴胺检测的od值为纵坐标绘制标准曲线,标准曲线的回归方程为y=0.036x+0.7015,r2=0.9871,如图7所示。样本组的检测结果如图8,可明显区分阳性样本和阴性样本;根据绘制标准曲线方程计算,阴性样本均检测不到芬太尼成分,阳性兔毛样本中芬太尼含量分别为(pg/mg):f1:19.87、f2:32.09、f3:44.00。加样城市污水样本中,含3pg/ml芬太尼的污水样本的平均od值(n=3)为0.8112±0.2820,是阴性样本的4.09倍;含0.3pg/ml卡芬太尼的污水样本的平均od值(n=3)为1.7043±0.4354,是阴性样本的8.91倍。
对比例2:竞争elisa法检测含芬太尼类物质成分样本
目前阿片类物质检测主要依赖于免疫法检测,包括胶体金免疫层析法和竞争elisa法。胶体金法适合快检,但在灵敏度上elisa法要比胶体金法高1个数量级。本对比例即以elisa法检测含芬太尼类物质成分样本为例。具体步骤如下:
1)样本处理:用实例4中同一的处理样本。但兔毛样本制后不用无菌pbs(ph7.4)稀释,原液直接用,分别得到相应的样本液(兔毛样本编号与表2相同)。
2)包被抗原:用0.05mol/l碳酸盐缓冲液(ph9.6)将fentanly-bsa抗原蛋白配制成1μg/ml浓度,并包被96孔板,100μl/孔,4℃过夜后,用pbs缓冲液(ph7.4)洗板5次尽量除去非特异性结合。
3)实验分组:标准曲线组、样本组,处理方法如下:
标准曲线组:将芬太尼标准品用pbs缓冲液(ph7.4)配成终浓度分别为0、0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8ng/ml的9组,各组均含5μg/ml的fentanly-mab单抗,混匀后加入fentanly-bsa包被的96孔板各1孔,100μl/孔。
样本组:在兔毛提取的样本液加入fentanly-mab单抗,fentanly-mab单抗终浓度为5μg/ml,混匀后加入fentanly-bsa包被的96孔板各1孔,100μl/孔,每个样品3个复孔。
4)竞争结合与测定:上述各组37℃孵育30分钟,倒去溶液,用pbs缓冲液(ph7.4)洗板5次;加hrp标记羊抗小鼠二抗,37℃孵育30分钟,倒去溶液,用pbs缓冲液(ph7.4)洗板5次;显色、终止反应后用酶标仪在450nm波长下测定吸光度(od)值。
5)结果:如图9所示,结果表明该竞争elisa法对芬太尼(fentanyl)的检测极限>0.4ng/ml;芬太尼浓度为0.4-12.8ng/ml下的吸光度(od)值的标准曲线如图10,曲线方程为y=-0.1465x+1.7861,r2=0.9031。样本组的结果如图11所示,5个阳性样本和5个阴性样本均未检出芬太尼成分。
从实施例4和对比例2可以看出,竞争elisa法检测芬太尼样本灵敏度、准确性远不如本发明所述之系统。而且,elisa法依赖于特定的抗体,只能检测单一成分,对于层出不穷的各类合成芬太尼则无能为力,而本发明的技术却很好地解决了这个难题,且以被检物质生物活性程度为检测依据,可真实的反映被检物质的生物效应。另外,本发明所述之方法是直接法,有敏感性、操作简便性、量效的线性范围及定量的准确性等方法都明显优于竞争elisa法。
本说明书所述的内容仅仅是对发明构思实现形式的列举,本发明的保护范围不应当被视为仅限于实施例所陈述的具体形式。
- 还没有人留言评论。精彩留言会获得点赞!