一种多向诱导Dean流的三维缩扩微流控器件及方法与流程
本发明专利涉及一种三维缩扩微流控器件及方法,尤其适用于一种肿瘤研究领域中无需借助鞘液流及外场力条件下使用的多向诱导dean流的三维缩扩微流控器件及方法。
背景技术:
随着时代的发展,恶性肿瘤已经成为影响人类公共健康的重大问题,人民对健康幸福生活的追求与医疗诊断资源相对匮乏之间的矛盾日益突出。现场即时诊断(point-of-caretesting,poct)仪器,因具有检测装置微型化、操作过程简单化、诊断结果即时化及检测费用平民化等独特优势,在完善资源匮乏地区医疗建设、应对突发事故灾害和推动家庭护理诊断等领域具有广阔应用前景,是解决上述矛盾的有力工具。依托先进微结构加工工艺,微流控(microfluidic)技术通过微米级流道精确操控微升、毫升级别样品,是开发新一代poct仪器的主流技术。
作为poct仪器重要前处理单元之一,样品预聚焦的精度将直接制约检测仪器的性能指标。现有的微流控聚焦技术据操控机制的不同可概括为以下三类:第一类是从传统宏观方法演化而来的鞘液夹流技术;第二类是基于电、磁、声、光等外场的主动聚焦技术;第三类是基于复杂形态微流道诱导流体,并通过流体自身作用操控粒子的被动聚焦技术。对细胞检测而言,理想的粒子聚焦器件应具有:①操作简单,②无需鞘液流辅助,③聚焦流束窄,④聚焦位置远离流道壁面,⑤处理通量高等特点。各国学者虽已在微流控聚焦领域取得突出成就,但实现一种微流控聚焦器件能同时兼具上述优势仍存在巨大挑战:如鞘液夹流技术面临高通量鞘液流的引入,且应用于微流控芯片中粒子聚焦多呈二维平面状态;主动聚焦技术则需要庞大、昂贵的外部设备,且一般通量较低,操作繁琐。相较而言,作为一种典型的被动聚焦技术,惯性微流控(inertialmicrofluidic)巧妙利用微尺度流体的惯性效应(惯性迁移及横截面dean流)实现粒子运动状态及平衡位置的精确操控,具有流道结构简单,无需鞘液夹流,无需借助外场力以及处理通量高等显著优势,是近年来得到广泛关注的一种微纳米生物粒子操控方法。
然而,现有的惯性聚焦技术大多是将粒子排布于两个或两个以上平衡位置,且聚焦平衡位置贴近流道壁面,传统单侧或平面对称双侧缩扩流道、螺旋流道及非对称正弦流道等结构仅能在主流道截面的横向方向上诱导生成一组dean涡流,致使粒子聚焦存在两个平衡位置,且平衡位置贴近壁面,易产生壁面对检测光束的散射,限制了传统流式细胞术或其它光学检测手段的应用。鉴于此,本发明专利设计一种三维缩扩新型结构,并据此提出一种多向诱导dean流操控生物粒子单列、截面中心位置聚焦方法,可为血液中肿瘤细胞的精准检测提供重要样品预聚焦单元,以简单流道结构及操控方法实现流式检测精度和灵敏度的大幅提升。
技术实现要素:
发明专利目的:针对上述技术中的不足之处,提供一种克服现有惯性微流控器件在操控粒子聚焦时存在多个聚焦平衡位置且平衡位置贴近流道壁面的不足,实现生物细胞在流道截面中心位置处的单列精准聚焦,为高精度流式检测提供重要样品预聚焦单元的多向诱导dean流的三维缩扩微流控器件及方法。
技术方案:为实现上述目的,本发明的多向诱导dean流的三维缩扩微流控器件,它包括微流控芯片,微流控芯片内设有三维缩扩流道,三维缩扩流道的首尾两端分别设有与微流控芯片外界连同的入口连接器和出口连接器,入口连接器上设有入口导管,出口连接器上设有出口导管;其中三维缩扩流道包括设置在微流控芯片内的矩形通道结构的主流道,主流道的截面为正方形或深宽比不为1的矩形,主流道的入口连接器处为圆柱空间的入口,主流道的出口连接器处为圆柱空间的出口,其中主流道的中部与入口之间的上游为矩形结构,在主流道的中部与出口之间的下游设有缩聚-扩展结构,缩聚-扩展结构与出口间留有距离。
所述的缩聚-扩展结构包括在主流道外侧间隔设置的凸起结构或者凹陷结构。
所述的凸起结构包括在主流道顶部设有凸起阵列,主流道的侧面设有凸起阵列,其中凸起阵列与凸起阵列在轴向坐标上一一对应设置;
所述在主流道上对应凸起阵列的另一面上镜像设有凸起阵列,凸起阵列与凸起阵列与凸起阵列在轴向坐标上一一对应设置。
所述在主流道上对应凸起阵列的另一面上上镜像设有凸起阵列,在主流道上镜像设有凸起阵列的另一面上分别设有凸起阵列最终形成凹陷阵列,凸起阵列、凸起阵列、凸起阵列和凸起阵列在轴向坐标上一一对应设置。
主流道的截面尺寸为200×200μm;所述凸起阵列、凸起阵列、凸起阵列和凸起阵列为多个间隔设置的矩形凸起,矩形凸起的尺寸为200×50×50μm,矩形凸起之间间间距50μm。
所述凹陷结构为设置在主流道顶部和单边侧壁或两侧壁和底部的矩形凹陷。
一种多向诱导dean流的三维缩扩微流控制方法,其步骤为:将肿瘤细胞利用荧光标记,并与非荧光标记背景白细胞混合制成初始混合样品,将初始混合样呈随机分散状态顺序通过入口导管和入口连接器导入三维缩扩流道,经三维缩扩流道中主流道上游处矩形截面通道内惯性升力作用,带动白细胞与肿瘤细胞做横向迁移运动,由此将白细胞与肿瘤细胞聚焦至靠近三维缩扩流道四壁面中心处的四个平衡位置,并在三维缩扩流道中下游处,由主流道及侧面凸起阵列、顶部凸起阵列共同构成缩扩结构,位于主流道侧面的凸起阵列在三维缩扩流道截面的横向方向上诱导生成上下对称的两个dean涡流;位于主流道顶部的凸起阵列在三维缩扩流道截面的纵向方向上诱导生成左右对称的两个dean涡流,横向方向生成的两个dean涡流和纵向方向生成的两个dean涡流互相耦合,形成新的复杂dean流模式,从而使白细胞与肿瘤细胞呈单列、截面中心位置精准惯性聚焦的方式移动形成单列聚焦粒子束流,使用外部流式检测装置对三维缩扩流道截面中心位置形成的单列聚焦粒子束流进行检测,肿瘤细胞受外部流式检测装置发出的荧光激发发射出发射光,并被外部流式检测装置接收识别,完成对肿瘤细胞的精准计数,随后聚焦粒子束经出口、出口连接器、出口导管顺序导出,并由废液收集装置收集。
有益效果:本发明通过在主流道的侧面及顶部同时设置凸起阵列,可在主流道截面的横向及纵向方向上同时诱导生成dean涡流,多向dean涡流耦合后形成一种全新的复杂dean涡流模式,从而高效操控生物细胞,实现生物细胞单列、截面中心位置精准聚焦;生物细胞单列聚焦可确保每一细胞粒子均经过检测系统激发光束焦点处;聚焦位置位于流道截面中心处可有效避免流道壁面对检测系统光束的散射,从而大幅提升光学检测的精度及灵敏度,为高精度流式检测提供重要的样品预聚焦单元;此外本发明无需借助鞘液夹流或外场力,成本低、操作简单、易集成微型化的优点,可广泛用于临床诊断、生物学研究、生化分析等领域,尤其适用于血液中循环肿瘤细胞(circulatingtumorcells,ctcs)的早期检测方面。
附图说明:
图1是本发明多向诱导dean流的三维缩扩微流控器件的结构示意图;
图2是本发明多向诱导dean流的三维缩扩微流控器件的三维缩扩流道结构示意图;
图3是本发明多向诱导dean流的三维缩扩微流控器件的三维缩扩流道截面多向dean流生成及耦合示意图;
图4是本发明多向诱导dean流的三维缩扩微流控器件的惯性聚焦原理示意图;
图5是本发明多向诱导dean流的三维缩扩微流控器件结构示意图;
图6是本发明多向诱导dean流的三维缩扩微流控器件结构示意图。
具体实施方式:
下面结合附图对本发明的具体实施方式作详细说明。
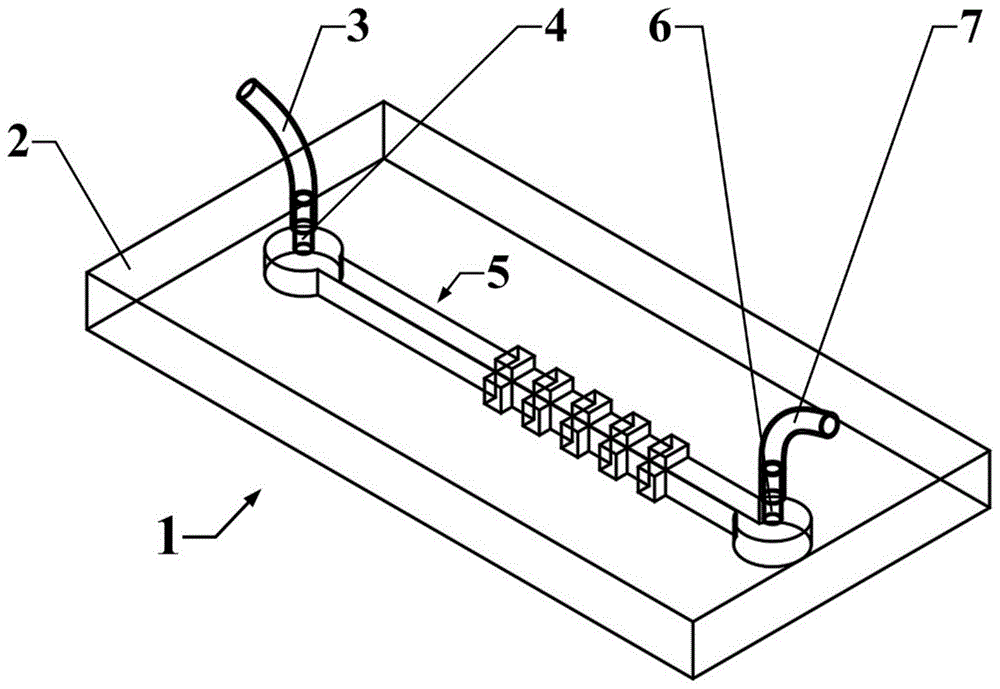
如图1和图2所示,本发明的多向诱导dean流的三维缩扩微流控器件1包括微流控芯片2,微流控芯片2内设有三维缩扩流道5,三维缩扩流道5的首尾两端分别设有与微流控芯片2外界连同的入口连接器4和出口连接器6,入口连接器4上设有入口导管3,出口连接器6上设有出口导管7;其中三维缩扩流道5包括设置在微流控芯片2内的矩形通道结构的主流道52,主流道52的截面为正方形或深宽比不为1的矩形,主流道52的入口连接器4处为圆柱空间的入口51,主流道52的出口连接器6处为圆柱空间的出口54,其中主流道52的中部与入口51之间的上游为矩形结构,在主流道52的中部与出口54之间的下游设有缩聚-扩展结构,缩聚-扩展结构与出口54间留有距离。
如图5所示,所述在主流道52上对应凸起阵列531的另一面上镜像设有凸起阵列533,凸起阵列533与凸起阵列531与凸起阵列532在轴向坐标上一一对应设置。
如图6所示,所述在主流道52上对应凸起阵列531的另一面上上镜像设有凸起阵列533,在主流道52上设有凸起阵列532的另一面上镜像设有凸起阵列534,凸起阵列531、凸起阵列532、凸起阵列533和凸起阵列534在轴向坐标上一一对应设置。
主流道52的截面尺寸为200×200μm;所述凸起阵列531、凸起阵列532、凸起阵列533和凸起阵列534为多个间隔设置的矩形凸起,矩形凸起的尺寸为200×50×50μm,矩形凸起之间间间距50μm,
一种多向诱导dean流的三维缩扩微流控制方法,其步骤为:将肿瘤细胞9利用荧光标记,并与非荧光标记背景白细胞8混合制成初始混合样品,将初始混合样呈随机分散状态顺序通过入口导管3和入口连接器4导入三维缩扩流道5,如图4所示,经三维缩扩流道(5)中主流道(52)上游处矩形截面通道内惯性升力作用,带动白细胞(8)与肿瘤细胞(9)做横向迁移运动,由此将白细胞(8)与肿瘤细胞(9)聚焦至靠近三维缩扩流道(5)四壁面中心处的四个平衡位置,并在三维缩扩流道5中下游处,由主流道及侧面、顶部凸起阵列共同构成缩扩结构,位于主流道侧面的凸起阵列在三维缩扩流道5截面的横向方向上诱导生成上下对称的两个dean涡流;位于主流道顶部的凸起阵列在三维缩扩流道5截面的纵向方向上诱导生成左右对称的两个dean涡流;如图4所示,横向方向生成的两个dean涡流和纵向方向生成的两个dean涡流互相耦合,形成新的复杂dean流模式,从而使白细胞8与肿瘤细胞9惯性聚焦呈单列、截面中心位置精准聚焦的方式移动形成单列聚焦粒子束流,使用外部流式检测装置对三维缩扩流道5截面中心位置形成的单列聚焦粒子束流进行检测,肿瘤细胞9受外部流式检测装置发出的荧光激发发射出发射光,并被外部流式检测装置接收识别,完成对肿瘤细胞9的精准计数,随后聚焦粒子束经出口54、出口连接器6、出口导管7顺序导出,并由废液收集装置收集。
实施例1:
本实施例中多向诱导dean流的三维缩扩微流控器件1采用聚二甲基硅氧烷pdms、聚甲基丙烯酸甲酯pmma、聚碳酸酯pc等材质通过软光刻加工工艺制备,该工艺具体包括光刻su-8阳模、pdms浇注以及pdms-玻璃键合等步骤,具有加工精度高等优点;亦可采用硅胶薄膜、聚対苯二甲酸类塑料pet薄膜、聚氯乙烯pvc薄膜等材质通过激光微加工工艺制备,该工艺具体包括激光切割撕除成型、等离子体表面处理、键合以及夹具封装等步骤,具有制作成本低、加工周期短等优点。此外,本实施例中的流道结构还可采用玻璃、硅、金属等其他材质,通过湿法/深反应离子刻蚀、超精密机加工、感光电路板刻蚀等微加工技术实现。
本实施例所述器件主要用于血液中血细胞及循环肿瘤细胞的精准聚焦及流式检测,也可应用于其他体液如尿液、唾液、胸水、腹水等中生物细胞的聚焦检测,还可拓展应用于其他环境下微纳米粒子的高效惯性操控。
如图3所示为三维缩扩流道多向诱导dean流的原理示意图。在三维缩扩流道5的中下游区域,由主流道52、位于主流道52侧面的凸起阵列531、位于主流道52顶部的凸起阵列532共同构成三维缩扩结构。在该结构下,流体流经时,位于侧面的凸起阵列531可在主流道52横截面的横向方向上诱导生成一组上下对称的dean涡流;位于顶部的凸起阵列532可在主流道52横截面的纵向方向上生成一组左右对称的dean涡流。通过调控主流道52/凸起阵列531/凸起阵列532的结构尺寸以及样品流速等参数,可调整两组dean涡流的强度及形貌。两组dean涡流相互叠加耦合,生成一种复杂的dean涡流新模式(如图3右图所示为收聚段截面流场仿真),从而可为微纳米粒子高效操控提供一种全新手段,使生物细胞在主流道52截面中心位置的单列精准聚焦成为可能。
如图4所示为裂解血液中白细胞8与肿瘤细胞9在三维缩扩流道5中的精准聚焦过程。无荧光染色白细胞8与荧光染色肿瘤细胞9混合样品自入口导管3及入口连接器4注入后,在入口51处呈随机分散状态。随后在主流道52的上游区域,据惯性操控经典理论,受惯性升力fl含指向流道中心的壁面诱导惯性升力flw与指向流道壁面的剪切诱导惯性升力fls作用发生横向迁移,并逐渐聚焦至靠近四壁面中心的四处平衡位置。随后在主流道52中下游部分与凸起阵列531、凸起阵列532共同组成具有三维缩聚-扩展特征的缩扩结构区域,随着多向耦合复杂dean涡流的引入,细胞粒子除收到惯性升力作用外,还将受到额外的dean拽力fd作用。通过调整流道结构尺寸及样品流速,可驱动白细胞8与肿瘤细胞9逐渐向主流道52的截面中心处迁移,最终实现流道中心位置的单列精准聚焦。在凸起阵列531/凸起阵列532与出口54之间的检测区域,外部光学检测系统的激发光束垂直照射于聚焦粒子束,此时荧光染色肿瘤细胞9受激发并发射出发射光,被检测系统接收识别;而无荧光染色的白细胞8不激发出荧光,从而实现对肿瘤细胞9的检测计数。由于本发明设计的三维缩扩流道可实现单列、截面中心位置的精准聚焦,其中单列聚焦可确保每一细胞粒子均通过检测系统激发光束的焦点,而聚焦位置处于流道截面中心可有效避免流道壁面对检测系统激发光束的散射,故整体上可极大程度上提升流式检测的精度与灵敏度。
本实施例中提出的可多向诱导dean流三维缩扩微流控器件可突破传统惯性微流控器件仅能在截面横向方向上诱导生成dean流,致使粒子聚焦存在两个或两个以上平衡位置,且平衡位置贴近流道壁面的局限,实现生物细胞在流道截面中心位置的单束精准聚焦,为高精度流式检测提供重要样品预聚焦单元。同时,本实施例提出的三维缩扩微流控器件还具有结构简单、加工成本低、操作方便、检测通量高等优势,亦可广泛拓展应用于临床诊断、生物学分析、生化分析等领域,尤其适用于血液中循环肿瘤细胞的早期检测、细胞学水平的化疗药物敏感性测试等方面。
实施例2,如图5所示,本实施例在主流道52侧面、与凸起阵列531相对的另一侧设置凸起阵列533,且所述凸起阵列533与凸起阵列531呈镜像关系,以在三个方向上诱导dean涡流并耦合,高效操控生物细胞实现截面中心位置单列精准聚焦。
实施例3,如图6所示,本实施例在主流道52的底部设置凸起阵列534,且所述凸起阵列534与凸起阵列532呈镜像关系,以在四个方向上诱导dean涡流并耦合,高效操控生物细胞实现截面中心位置单列精准聚焦。
在其他一些实施例中,所述凸起阵列531/凸起阵列532/凸起阵列533/凸起阵列544结构为凹陷设置在主流道52中的矩形凹陷结构构成,在主流动方向上形成三维缩聚-扩展特征,以多向诱导dean流并高效操控微纳米粒子。
- 还没有人留言评论。精彩留言会获得点赞!