破伤风类毒素或白喉类毒素的监测方法与流程
本发明涉及一种破伤风类毒素(即甲醛脱毒的破伤风蛋白)或白喉类毒素(即甲醛脱毒的白喉蛋白)的监测方法,属于疫苗质量评价技术领域。
背景技术:
化学脱毒是疫苗常见的生产工艺,通过甲醛或戊二醛与蛋白的作用,减少蛋白的毒性而保留其免疫原性。化学脱毒的外毒素蛋白和外膜蛋白可直接作为疫苗的主要成分,如甲醛脱毒的白喉蛋白(白喉类毒素)和甲醛脱毒的破伤风蛋白(破伤风类毒素)。两者与甲醛(戊二醛)脱毒的百日咳鲍特氏菌蛋白按比例配置成为百白破疫苗。甲醛脱毒的蛋白还可作为疫苗生产的原料,如破伤风类毒素或白喉类毒素可作为多糖蛋白疫苗的载体蛋白。多糖蛋白结合疫苗是将多糖通过化学键与蛋白结合后形成的一类疫苗。用于多糖蛋白结合疫苗的蛋白称为蛋白载体。常用蛋白载体有破伤风类毒素、白喉类毒素和crm197。常见的多糖蛋白结合疫苗包括四价脑膜炎疫苗(a、c、w、y),hib疫苗和13价肺炎多糖疫苗(1、3、4、5、6a、6b、7f、9v、14、18c、19f、19a和23f)。与多糖疫苗相比,多糖蛋白结合疫苗具有不同的免疫用途。如23价肺炎疫苗(多糖疫苗)用于2岁以上儿童和成人,对2岁以下儿童免疫效果较差,而13价肺炎疫苗(多糖蛋白结合疫苗)由于有蛋白载体辅助作用,可以很好的激发2岁以下儿童t细胞的免疫反应,从而达到预防多种肺炎病毒入侵的作用。与多糖疫苗相比,多糖蛋白结合疫苗具有制备工艺更复杂,质量控制更困难的问题。多糖蛋白结合疫苗往往需要先生产出质量良好的多糖疫苗和蛋白载体,再通过化学反应生产多糖蛋白结合疫苗。因此多糖质量、蛋白载体质量和多糖蛋白结合率均应作为多糖蛋白结合疫苗的质量控制指标对破伤风类毒素和白喉类毒素为载体蛋白的多糖蛋白结合疫苗,其质量还受载体蛋白脱毒工艺的影响。因此,甲醛脱毒情况影响着疫苗的有效性和安全性(脱毒时甲醛的浓度、脱毒时间和其它因素是怎样影响蛋白(病毒)的,怎样确保不同批次甲醛脱毒后蛋白的结构一致性,从而提高甲醛为载体的多糖蛋白结合疫苗的批次稳定性和重复性,减少多糖蛋白疫苗质量的不确定性)。但目前除测试毒性和免疫原性外,尚无评价或监测甲醛脱毒工艺的方法。
技术实现要素:
针对上述现有技术,本发明提供了一种破伤风类毒素或白喉类毒素的监测方法,可对破伤风类毒素、白喉类毒素进行稳定性监测。
本发明是通过以下技术方案实现的:
一种破伤风类毒素或白喉类毒素的监测方法,包括以下步骤:
(1)标准品的酶解:取破伤风类毒素或白喉类毒素标准品溶液,加入蛋白质变性剂使蛋白变性;加入二硫键断裂试剂使二硫键断裂;加入碘代乙酰胺溶液;加入蛋白酶酶解,得蛋白酶解液;
(2)固相萃取富集目标肽段:蛋白酶解液通过固相萃取柱,得含目标肽段的蛋白洗脱液;
(3)高效液相色谱串联质谱分析:用高效液相色谱串联质谱分析蛋白洗脱液,得色谱图,色谱图中的特征峰与特征肽段一一对应,计算各特征肽段峰的峰面积;
(4)绘制标准特征肽段表:以峰面积最高的特征肽段的峰面积(am)为分母,以特征肽段n的峰面积(an)为分子,再乘以100%得到各特征肽段相对响应强度(i%标);表达成方程:i%标n=an标/am标x100%;
以特征肽段n的名称为表格第一列,特征肽段n的相对响应强度(i%标n)为表格第二列,得到标准特征肽段表;
(5)样品检测:取待检测的破伤风类毒素或白喉类毒素样品溶液,进行步骤(1)、(2)、(3)、(4),得各特征肽段的相对响应强度(i%样n);根据下述方程计算样品中特征肽段n的回收率(rn%):rn%=i%样n/i%标nx100%;
(6)判断:rn%大于100%,说明样品中特征肽段n脱毒程度小于标准品中相应特征肽段的脱毒程度;rn%小于100%,说明样品中特征肽段n脱毒程度大于标准品中相应特征肽段的脱毒程度;脱毒程度太低意味着残留毒性升高,被脱毒肽段的安全性存在一定隐患;脱毒程度太低意味着活性降低且与多糖的结合活性降低,被脱毒肽段的有效性有待考量;
rn%在80%~120%之间为重复性良好肽段,根据rn%良好的肽段数目对脱毒效果进行评价:rn%良好的特征肽段数目占总肽段数目的80%及以上,60%及以上和60%之下分别为良好、合格和有待改进,按照此标准,破伤风类毒素、白喉类毒素判断的肽段数如表1所示:
表1用于肽段脱毒程度判断的肽段数目
进一步地,所述步骤(1)对照品的酶解的具体操作如下:
①取破伤风类毒素或白喉类毒素溶液,加入蛋白质变性剂,60℃孵育15分钟;
②加入二硫键断裂试剂,60℃反应60分钟;
③冷却至室温,加入碘代乙酰胺溶液,在室温、避光条件下反应30分钟;
④加入蛋白酶,或:加入碳酸氢铵溶液和蛋白酶,25~37℃酶解4~20小时;
⑤加入酸液,37℃反应30分钟,得蛋白酶解液。
进一步地,所述蛋白变性剂选自尿素、十二烷基磺酸钠、辛烷磺酸钠、rapigesttm,以溶液形式加入时,浓度为10mmol/l~10mol/l。
进一步地,所述二硫键断裂试剂选自二硫苏糖醇(dtt)、三(2-羧乙基)膦(tcep);以溶液形式加入时,浓度为10mmol/l~2mol/l。
进一步地,所述碳酸氢铵溶液的浓度为10~500mmol/l(加入碳酸氢铵的目的是:为胰蛋白酶提供合适的ph环境,保证胰蛋白酶活性)。
进一步地,所述碘代乙酰胺溶液的浓度为10mmol/l~2mol/l(加入碘代乙酰胺的目的是:封闭被二硫键断裂试剂打开的二硫键,避免二硫键的再次形成)。
进一步地,所述酸液选自甲酸、乙酸、三氟乙酸,以溶液形式加入时,溶液中酸与水的体积比为1:0.1~1000。
注:加入蛋白变性剂、二硫键断裂试剂、胰蛋白酶、酸液时,可以直接加入,也可以以溶液的形式加入,此为本领域的惯用手段,不再赘述。
进一步地,所述蛋白酶选自胰蛋白酶、糜蛋白酶;当使用胰蛋白酶时,酶解温度为37℃;当使用糜蛋白酶时,酶解温度为25℃。
进一步地,所述步骤(2)中,固定相选自聚合物基质或硅胶基质的弱阴离子交换固定相(wax)、聚合物基质或硅胶基质的强阴离子交换固定相(sax)、聚合物基质或硅胶基质的十八烷基混合弱阴离子交换固定相(c18wax)、聚合物基质或硅胶基质的十八烷基混合强阴离子交换固定相(c18sax)。
进一步地,所述步骤(2)中,流动相为酸液-有机溶剂混合液。
进一步地,所述步骤(2)中,所述酸液选自甲酸、乙酸、三氟乙酸,溶液中酸与水的体积比为1:0.1~1000。
进一步地,所述步骤(2)中,所述有机溶剂选自甲醇、乙腈、乙醇、丙酮中的任意一种或两种以上;
进一步地,所述步骤(2)中,酸液-有机溶剂混合液中,酸液与有机溶剂的体积比为1:1~1000。
进一步地,所述步骤(2)的具体操作如下:
①取混合模式固相萃取柱,填充固定相,用酸液-有机溶剂混合液活化;
②用酸液-水混合液平衡;
③将蛋白酶解液加入固相萃取柱中;
④用酸液-水混合液洗涤固相萃取柱;
⑤用酸液-有机溶剂混合液洗脱目标肽段,得蛋白洗脱液;
⑥用氮气吹干蛋白洗脱液,用酸液-有机溶剂-水混合液溶解,得固相萃取重溶液,用于高效液相色谱串联质谱分析。
优选的,所述步骤(2)的具体操作如下:
①取混合模式固相萃取柱,填充固定相30~100mg,用0.1~2ml酸液-有机溶剂混合液活化;酸液-有机溶剂混合液中,酸液与有机溶剂的体积比为1:1~1000;
②用0.1~2ml酸液-水混合液平衡;酸液-水混合液中,酸液与水的体积比为1:1~1000;
③将蛋白酶解液加入固相萃取柱中;
④用0.1~2ml酸液-水混合液洗涤固相萃取柱;酸液-水混合液中,酸液与水的体积比为1:1~1000;
⑤用0.1~2ml酸液-有机溶剂混合液洗脱目标肽段,得蛋白洗脱液;酸液-有机溶剂混合液中,酸液与有机溶剂的体积比为1:1~1000;
⑥用氮气吹干蛋白洗脱液,用100μl酸液-有机溶剂-水混合液溶解,得固相萃取重溶液,用于高效液相色谱串联质谱分析;酸液-有机溶剂-水混合液中,酸液、有机溶剂、水三者的体积比为1:50:950。
进一步地,所述步骤(3)中,色谱条件如下:
固定相:固定相1和固定相2;
柱温:20~60℃;
流动相:a:离子交换剂水溶液;b:含离子交换剂的有机溶剂水溶液;
所述固定相1为生物兼容c18色谱柱,所述固定相2为生物兼容c8色谱柱:
所述离子交换剂为质谱兼容的酸、盐,或酸和盐的混合物,所述盐选自甲酸铵、乙酸铵,所述酸选自甲酸、乙酸或三氟乙酸;
所述有机溶剂为可与水互溶的有机溶剂,选自甲醇、乙腈或/和乙醇;
所述流动相a中离子交换剂的浓度为0~20mmol/l;
所述流动相b中离子交换剂的浓度为0~20mmol/l,有机溶剂与:水的体积比为60~100:0~40;
梯度:0~8min,5%b~40%b;8~8.1min,40%b~100%b;8.1~10min,100%b;10~10.1min,100%b~5%b;10.1~15min,5%b;
流速:0.2~0.5ml/min;
进样体积:10μl。
进一步地,所述步骤(3)中,质谱条件如下:
离子源:es+模式;质谱仪:三重四级杆质谱仪;雾化器流速:3l/min;
加热器流速:10l/min;接口温度:200℃;dl温度:250℃;加热模块温度:400℃;
干燥气流速:10l/min;接口电压:1.5~4kv。
质谱检测器检测模式为多离子选择监控(mrm),质谱检测参数见表2-5。
进一步地,所述步骤(3)中,胰蛋白酶酶解所得破伤风类毒素特征肽段如表2所示,糜蛋白酶酶解所得破伤风类毒素特征肽段如表3所示,胰蛋白酶酶解所得白喉类毒素特征肽段如表4所示,糜蛋白酶酶解所得白喉类毒素的特征肽段如表5所示。
表2胰蛋白酶酶解的破伤风类毒素的特征肽段、质谱参数(*为定量离子)
表3糜蛋白酶酶解的破伤风类毒素的特征肽段、质谱参数(*为定量离子)
表4胰蛋白酶酶解的白喉类毒素的特征肽段、质谱参数(*为定量离子)
表5糜蛋白酶酶解的白喉类毒素的特征肽段、质谱参数(*为定量离子)
本发明采用高效液相色谱串联质谱方法,建立了一种破伤风类毒素或白喉类毒素稳定性的监测方法,首次实现了定量监测破伤风类毒素、白喉类毒素生产工艺稳定性的方法,解决甲醛脱毒蛋白的工艺缺乏监测方法的问题。
类毒素按药典方法一直是按活性lf定量,本方法首次实现了蛋白定量评价破伤风类毒素、白喉类毒素。甲醛脱毒是疫苗生产的重要环节,脱毒位点和脱毒强度关系着疫苗的活性和安全性,但自甲醛脱毒方法发展以来的几十年间一直缺乏工艺评价方法,尤其是定量评价甲醛脱毒蛋白工艺稳定性的方法。破伤风类毒素、白喉类毒素是多种多糖蛋白结合疫苗的载体,如4价脑膜炎(a,w,c,y)疫苗、hib疫苗和13价肺炎多糖疫苗(1、3、4、5、6a、6b、7f、9v、14、18c、19f、19a和23f)。甲醛脱毒工艺的稳定性直接关系着多糖蛋白结合疫苗结合率等多糖蛋白结合疫苗的稳定性以及甲醛脱毒蛋白相关疫苗,如百白破疫苗的有效性和安全性。由于本方法发明前的几十年间一直缺乏检测脱毒工艺的方法,导致百白破疫苗和多糖蛋白结合疫苗的生产不可控程度较高。本发明的监测方法,首次实现了定量监测破伤风类毒素、白喉类毒素工艺稳定性的方法,解决甲醛脱毒蛋白的工艺缺乏监测方法的问题,将为破伤风疫苗、白破二联、百白破三联、五联苗、多糖蛋白结合疫苗的生产优化和新型多糖蛋白结合疫苗的研发提供有效的定量数据,加快疫苗质量提升进程和新产品研发。此外,该监测方法对甲醛脱毒的其它蛋白工艺也具有借鉴意义。
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
附图说明
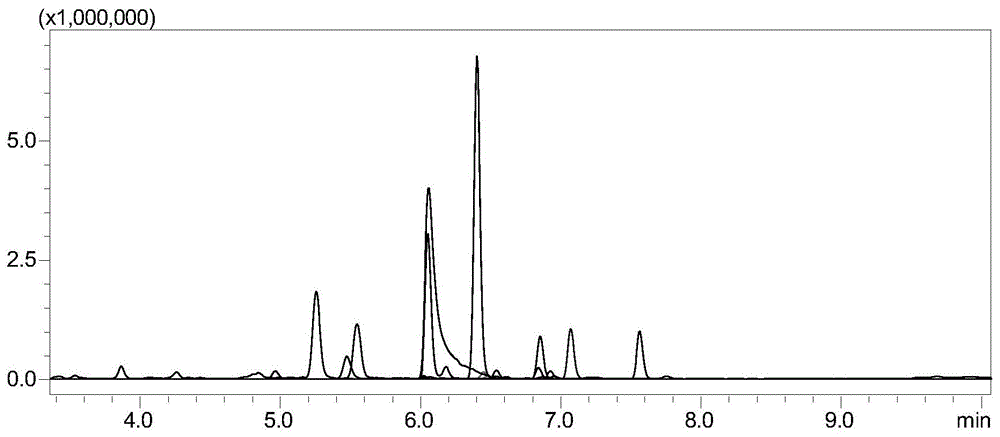
图1:破伤风类毒素标准品的特征肽段谱图(胰蛋白酶酶解)。
图2:破伤风类毒素标准品的特征肽段谱图(糜蛋白酶酶解)。
图3:白喉类毒素标准品的特征肽段谱图(胰蛋白酶酶解)。
图4:白喉类毒素标准品的特征肽段谱图(糜蛋白酶酶解)。
具体实施方式
下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
实施例1破伤风类毒素的监测
1.实验仪器与设备:高压二元泵、脱气机、自动进样器、柱温箱和三重四级杆质谱仪。
2.实验试剂:破伤风类毒素标准品、二硫苏糖醇(dtt)、碘代乙酰胺(iaa)、碳酸氢铵、rapigesttm、胰蛋白酶、破伤风类毒素样品。
3.检测条件:
色谱条件:
色谱柱:固定相1(生物兼容c18色谱柱);
流动相:a:乙酸水溶液(乙酸与水的体积比为1:1000);b:乙酸-乙腈混合液(乙酸与乙腈的体积比为1:1000);
梯度:0~8min,5%b~40%b;8~8.1min,40%b~100%b;8.1~10min,100%b;10~10.1min,100%b~5%b;10.1~15min,5%b;柱温:35℃;流速:0.2~0.5ml/min;进样体积:10μl。
质谱条件:
离子源:es+模式;质谱仪:三重四级杆质谱仪;雾化器流速:3l/min;
加热器流速:10l/min;接口温度:200℃;dl温度:250℃;加热模块温度:400℃;
干燥气流速:10l/min;接口电压:3kv。
质谱检测器检测模式为多离子选择监控(mrm),质谱检测参数见表2。
4.标准特征肽段表和特征肽段谱的获取:
(1)标准品的酶解:
①取100μl破伤风类毒素标准品溶液,加入100μlrapigesttm,60℃孵育15分钟;
②加入10μl的0.5mol/l的tcep溶液,60℃反应60分钟;
③冷却至室温,加入10μl的1mol/l的碘代乙酰胺溶液,在室温、避光条件下反应30分钟;
④加入765μl的50mmol/l的碳酸氢铵溶液,以及5μl的0.1mg/ml的胰蛋白酶溶液,37℃反应12小时;
⑤加入5μl的甲酸,37℃反应30分钟,得胰蛋白酶解液。
(2)固相萃取富集目标肽段:
①取混合模式固相萃取柱,填充c18wax固定相100mg,用1ml甲酸-乙腈混合液活化;甲酸-乙腈混合液中,甲酸与乙腈的体积比为1:1000;
②用1ml甲酸-水混合液平衡;甲酸-水混合液中,甲酸与水的体积比为1:1000;
③将胰蛋白酶解液加入固相萃取柱中;
④用1ml甲酸-水混合液洗涤固相萃取柱;甲酸-水混合液中,甲酸与水的体积比为1:1000;
⑤用1ml甲酸-乙腈混合液洗脱目标肽段,得蛋白洗脱液;甲酸-乙腈混合液中,甲酸与乙腈的体积比为1:1000;
⑥用氮气吹干蛋白洗脱液,用100μl三氟乙酸-乙腈-水混合液溶解,得固相萃取重溶液,用于高效液相色谱串联质谱分析;三氟乙酸-乙腈-水混合液中,三氟乙酸、乙腈、水三者的体积比为1:50:950。
(3)高效液相色谱串联质谱分析:用高效液相色谱串联质谱分析固相萃取重溶液,得色谱图,色谱图中的特征峰与特征肽段一一对应(特征肽段谱图如图1所示),计算各特征肽段峰的峰面积;
(4)绘制标准特征肽段表,如表6所示:以峰面积最高的特征肽段的峰面积(am)为分母,以特征肽段n的峰面积(an)为分子,再乘以100%得到各特征肽段相对响应强度(i%标);表达成方程,如下所示:i%标n=an标/am标x100%;
5.样品检测:取待检测的破伤风类毒素或白喉类毒素样品溶液,进行步骤(1)、(2)、(3)、(4),得各特征肽段的相对响应强度(i%样n);根据下述方程计算样品中特征肽段n的回收率(rn%):rn%=i%样n/i%标nx100%,如表6所示;
根据表6所示数据,批次1和2的特征肽段rn%在80%~120%的肽段数目高于28个,为脱毒良好的产品;批次3的特征肽段rn%在80%~120%的肽段数目高于16个、低于28个,为脱毒合格但品质尚有提升空间的产品。
表6胰蛋白酶酶解破伤风类毒素特征肽段丰度和3批次破伤风类毒素特征肽段回收率
*为定量离子
实施例2破伤风类毒素的监测
1.实验仪器与设备:高压二元泵、脱气机、自动进样器、柱温箱和三重四级杆质谱仪。
2.实验试剂:破伤风类毒素标准品、二硫苏糖醇(dtt)、碘代乙酰胺(iaa)、碳酸氢铵、rapigesttm、糜蛋白酶、破伤风类毒素样品。
3.检测条件:
色谱条件:
色谱柱:固定相1(生物兼容c18色谱柱);
流动相:a:乙酸水溶液(乙酸与水的体积比为1:1000);b:乙酸-乙腈混合液(乙酸与乙腈的体积比为1:1000);
梯度:0~8min,5%b~40%b;8~8.1min,40%b~100%b;8.1~10min,100%b;10~10.1min,100%b~5%b;10.1~15min,5%b;柱温:35℃;流速:0.2~0.5ml/min;进样体积:10μl。
质谱条件:
离子源:es+模式;质谱仪:三重四级杆质谱仪;雾化器流速:3l/min;
加热器流速:10l/min;接口温度:200℃;dl温度:250℃;加热模块温度:400℃;
干燥气流速:10l/min;接口电压:2.5kv。
质谱检测器检测模式为多离子选择监控(mrm),质谱检测参数见表3。
4.标准特征肽段表和特征肽段谱的获取:
(1)标准品的酶解:
①取100μl破伤风类毒素溶液,加入100μlrapigesttm,60℃孵育15分钟;
②加入10μl的0.5mol/l的二硫苏糖醇溶液,60℃反应60分钟;
③冷却至室温,加入10μl的1mol/l的碘代乙酰胺溶液,在室温、避光条件下反应30分钟;
④加入765μl的50mmol/l的碳酸氢铵溶液,以及5μl的0.1mg/ml的糜蛋白酶溶液,37℃反应12小时;
⑤加入5μl的甲酸,37℃反应30分钟,得糜蛋白酶解液。
(2)固相萃取富集目标肽段:
①取混合模式固相萃取柱,填充c18sax固定相50mg,用1ml乙酸-甲醇混合液活化;乙酸-甲醇混合液中,乙酸与甲醇的体积比为1:1000;
②用1ml乙酸-水混合液平衡;乙酸-水混合液中,乙酸与水的体积比为1:1000;
③将糜蛋白酶解液加入固相萃取柱中;
④用1ml乙酸-水洗涤固相萃取柱;乙酸-水混合液中,乙酸与水的体积比为1:1000;
⑤用1ml乙酸-有机溶剂混合液洗脱目标肽段,得蛋白洗脱液;乙酸-甲醇混合液中,乙酸与甲醇的体积比为1:1000;
⑥用氮气吹干蛋白洗脱液,用100μl三氟乙酸-甲醇-水混合液溶解,得固相萃取重溶液,用于高效液相色谱串联质谱分析;三氟乙酸-甲醇-水混合液中,三氟乙酸、甲醇、水三者的体积比为1:50:950。
(3)高效液相色谱串联质谱分析:用高效液相色谱串联质谱分析固相萃取重溶液,得色谱图,色谱图中的特征峰与特征肽段一一对应(特征肽段谱图如图2所示),计算各特征肽段峰的峰面积;
(4)绘制标准特征肽段表,如表7所示:以峰面积最高的特征肽段的峰面积(am)为分母,以特征肽段n的峰面积(an)为分子,再乘以100%得到各特征肽段相对响应强度(i%标);表达成方程,如方下所示:i%标n=an标/am标x100%;
5.样品检测:取待检测的破伤风类毒素或白喉类毒素样品溶液,进行步骤(1)、(2)、(3)、(4),得各特征肽段的相对响应强度(i%样n);根据下述方程计算样品中特征肽段n的回收率(rn%):rn%=i%样n/i%标nx100%,如表7所示;
根据表7所示数据,批次2的回收率在80%~120%的肽段数目高于42个,为脱毒良好的产品;批次1的回收率在80%~120%的肽段数目高于31个、低于42个,为脱毒合格但品质尚有提升空间的产品;批次3的产品肽段回收率在80%~120%的肽段数目低于31个,为有待改善产品。
表7糜蛋白酶酶解破伤风类毒素特征肽段丰度和3批次破伤风类毒素特征肽段回收率
*为定量离子
实施例3白喉类毒素的监测
1.实验仪器与设备:高压二元泵、脱气机、自动进样器、柱温箱和三重四级杆质谱仪。
2.实验试剂:白喉类毒素标准品、二硫苏糖醇(dtt)、碘代乙酰胺(iaa)、碳酸氢铵、rapigesttm、胰蛋白酶、白喉类毒素样品。
3.检测条件:
色谱条件:
色谱柱:固定相1(生物兼容c18色谱柱);
流动相:a:乙酸水溶液(乙酸与水的体积比为1:1000);b:乙酸-乙腈混合液(乙酸与乙腈的体积比为1:1000);
梯度:0~8min,5%b~40%b;8~8.1min,40%b~100%b;8.1~10min,100%b;10~10.1min,100%b~5%b;10.1~15min,5%b;柱温:35℃;流速:0.2~0.5ml/min;进样体积:10μl。
质谱条件:
离子源:es+模式;质谱仪:三重四级杆质谱仪;雾化器流速:3l/min;
加热器流速:10l/min;接口温度:200℃;dl温度:250℃;加热模块温度:400℃;
干燥气流速:10l/min;接口电压:1.5kv。
质谱检测器检测模式为多离子选择监控(mrm),质谱检测参数见表4。
4.标准特征肽段表和特征肽段谱的获取:
(1)标准品的酶解:
①取100μl白喉蛋白溶液,加入100μlrapigesttm,60℃孵育15分钟;
②加入10μl的0.5mol/l的tcep溶液,60℃反应60分钟;
③冷却至室温,加入10μl的1mol/l的碘代乙酰胺溶液,在室温、避光条件下反应30分钟;
④加入765μl的50mmol/l的碳酸氢铵溶液,以及5μl的0.1mg/ml的胰蛋白酶溶液,37℃反应12小时;
⑤加入5μl的甲酸,37℃反应30分钟,得胰蛋白酶解液。
(2)固相萃取富集目标肽段:
①取混合模式固相萃取柱,填充c18wax固定相100mg,用1ml甲酸-乙腈混合液活化;甲酸-乙腈混合液中,甲酸与乙腈的体积比为1:1000;
②用1ml甲酸-水混合液平衡;甲酸-水混合液中,甲酸与水的体积比为1:1000;
③将胰蛋白酶解液加入固相萃取柱中;
④用1ml甲酸-水洗涤固相萃取柱;甲酸-水混合液中,甲酸与水的体积比为1:1000;
⑤用1ml甲酸-乙腈混合液洗脱目标肽段,得蛋白洗脱液;甲酸-乙腈混合液中,甲酸与乙腈的体积比为1:1000;
⑥用氮气吹干蛋白洗脱液,用100μl三氟乙酸-乙腈-水混合液溶解,得固相萃取重溶液,用于高效液相色谱串联质谱分析;三氟乙酸-乙腈-水中,三氟乙酸、乙腈、水三者的体积比为1:50:950。
(3)高效液相色谱串联质谱分析:用高效液相色谱串联质谱分析固相萃取重溶液,得色谱图,色谱图中的特征峰与特征肽段一一对应(特征肽段谱图如图3所示),计算各特征肽段峰的峰面积;
(4)绘制标准特征肽段表,如表8所示:以峰面积最高的特征肽段的峰面积(am)为分母,以特征肽段n的峰面积(an)为分子,再乘以100%得到各特征肽段相对响应强度(i%标);表达成方程,如下所示:i%标n=an标/am标x100%;
5.样品检测:取待检测的白喉类毒素样品溶液,进行步骤(1)、(2)、(3)、(4),得各特征肽段的相对响应强度(i%样n);根据下述方程计算样品中特征肽段n的回收率(rn%):rn%=i%样n/i%标nx100%,如表8所示;
根据表8所示数据,批次1的特征肽段rn%在80%~120%的肽段数目高于15个,为脱毒良好的产品;批次2和3的特征肽段rn%在80%~120%的肽段数目15于11个、低于28个,为脱毒合格但品质尚有提升空间的产品。
表8胰蛋白酶酶解白喉类毒素特征肽段丰度和3批次白喉类毒素特征肽段回收率
*为定量离子
实施例4白喉类毒素的监测
1.实验仪器与设备:高压二元泵、脱气机、自动进样器、柱温箱和三重四级杆质谱仪。
2.实验试剂:白喉类毒素标准品、二硫苏糖醇(dtt)、碘代乙酰胺(iaa)、碳酸氢铵、rapigesttm、糜蛋白酶、白喉类毒素样品。
3.检测条件:
色谱条件:
色谱柱:固定相1(生物兼容c18色谱柱);
流动相:a:乙酸水溶液(乙酸与水的体积比为1:1000);b:乙酸-乙腈混合液(乙酸与乙腈的体积比为1:1000);
梯度:0~8min,5%b~40%b;8~8.1min,40%b~100%b;8.1~10min,100%b;10~10.1min,100%b~5%b;10.1~15min,5%b;柱温:35℃;流速:0.2~0.5ml/min;进样体积:10μl。
质谱条件:
离子源:es+模式;质谱仪:三重四级杆质谱仪;雾化器流速:3l/min;
加热器流速:10l/min;接口温度:200℃;dl温度:250℃;加热模块温度:400℃;
干燥气流速:10l/min;接口电压:2.5kv。
质谱检测器检测模式为多离子选择监控(mrm),质谱检测参数见表5。
4.标准特征肽段表和特征肽段谱的获取:
(1)标准品的酶解:
①取100μl白喉类毒素溶液,加入100μlrapigesttm,60℃孵育15分钟;
②加入10μl的0.5mol/l的二硫苏糖醇溶液,60℃反应60分钟;
③冷却至室温,加入10μl的1mol/l的碘代乙酰胺溶液,在室温、避光条件下反应30分钟;
④加入765μl的50mmol/l的碳酸氢铵溶液,以及5μl的0.1mg/ml的糜蛋白酶溶液,37℃反应12小时;
⑤加入5μl的甲酸,37℃反应30分钟,得糜蛋白酶解液。
(2)固相萃取富集目标肽段:
①取混合模式固相萃取柱,填充c8sax固定相80mg,用1ml乙酸-甲醇混合液活化;乙酸-甲醇混合液中,乙酸与甲醇的体积比为1:1000;
②用1ml乙酸-水混合液平衡;乙酸-水混合液中,乙酸与水的体积比为1:1000;
③将糜蛋白酶解液加入固相萃取柱中;
④用1ml乙酸-水洗涤固相萃取柱;乙酸-水混合液中,乙酸与水的体积比为1:1000;
⑤用1ml乙酸-甲醇混合液洗脱目标肽段,得蛋白洗脱液;乙酸-甲醇中,乙酸与甲醇的体积比为1:1000;
⑥用氮气吹干蛋白洗脱液,用100μl三氟乙酸-甲醇-水混合液溶解,得固相萃取重溶液,用于高效液相色谱串联质谱分析;三氟乙酸-甲醇-水混合液中,三氟乙酸、甲醇、水三者的体积比为1:50:950。
(3)高效液相色谱串联质谱分析:用高效液相色谱串联质谱分析固相萃取重溶液,得色谱图,色谱图中的特征峰与特征肽段一一对应(特征肽段谱图如图4所示),计算各特征肽段峰的峰面积;
(4)绘制标准特征肽段表,如表9所示:以峰面积最高的特征肽段的峰面积(am)为分母,以特征肽段n的峰面积(an)为分子,再乘以100%得到各特征肽段相对响应强度(i%标);表达成方程,如下所示:i%标n=an标/am标x100%。;
5.样品检测:取待检测的白喉类毒素样品溶液,进行步骤(1)、(2)、(3)、(4),得各特征肽段的相对响应强度(i%样n);根据下述方程计算样品中特征肽段n的回收率(rn%):rn%=i%样n/i%标nx100%,如表9所示;
根据表9所示数据,批次1和2的回收率在80%~120%的肽段数目高于22个,为脱毒良好的产品;批次3的回收率在80%~120%的肽段数目高于16个、低于22个,为脱毒合格但品质尚有提升空间的产品。
表9糜蛋白酶酶解白喉类毒素特征肽段丰度和3批次白喉类毒素特征肽段回收率
*为定量离子
给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!