一种免疫活性肽的筛选方法与流程
本发明涉及生物技术领域,更具体地,涉及一种免疫活性肽的筛选方法。
背景技术:
近年来,老龄化、肥胖症、睡眠时间或质量下降、吸烟与饮酒等不良生活习惯导致的机体免疫力下降而引发各种疾病的现象日趋严重。寻求适宜的免疫调节剂来提高人体免疫能力,成为了人们的迫切需求。目前获得免疫活性肽的方法主要是分离纯化技术,而利用线上预测方法结合实验筛选获得免疫活性肽的手段十分有限。当前的分离纯化技术,主要依据分子量大小、离子强度、疏水性质等各种分子特性将肽库中的多肽分离为不同的组分,再通过免疫指标对组分进行评价,筛选出免疫活性高的纯肽或混合肽组分。这些方法分离组分过多,实验过程繁琐,且大大降低了活性肽的筛选效率。
技术实现要素:
基于此,本发明的目的就是提供一种免疫活性肽的筛选方法,该筛选方法耗时短、操作简单,且筛选效率高。
为实现上述目的,采用如下技术方案:
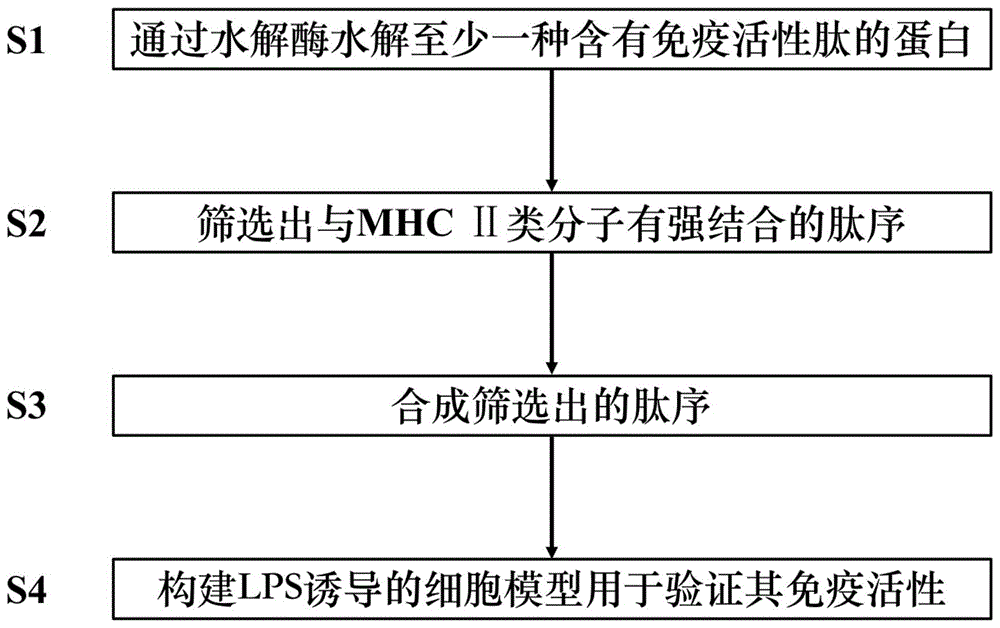
一种免疫活性肽的筛选方法,所述筛选方法包括如下步骤:
s1、通过水解酶水解少一种含有免疫活性肽的蛋白质,获得免疫活性肽组成的肽库,所述肽库中的多肽通过质谱技术获得其肽序;
s2、筛选出与mhcⅱ类分子有强结合的肽序;
s3、合成s2中筛选出的肽序;
s4、构建lps诱导的细胞模型用于验证s3所合成的多肽的免疫活性。
在一些实施方式中,所述蛋白质选自植物来源的蛋白质和动物来源的食源性蛋白质中的一种或多种组合。
在一些实施方式中,所述水解酶选自胃蛋白酶、风味蛋白酶、胰蛋白酶、酸性蛋白酶、中性蛋白酶、菠萝蛋白酶、木瓜蛋白酶、复合蛋白酶和碱性蛋白酶中的一种或多种组合。
在一些实施方式中,所述与mhcⅱ类分子结合的表位选自下组:drb1*0101、drb1*0301、drb1*0401、drb1*0701、drb1*1101、drb1*1501、h-2-iab和h-2-iad。
在一些实施方式中,所述s4步骤包括:
建立lps诱导小鼠巨噬细胞raw264.7的细胞模型,以no为初级指标,并通过对细胞炎症因子tnf-α、inos、il-6和il-1β在蛋白水平和mrna水平的考察以此验证合成多肽的免疫活性。
在一些实施方式中,所述多个为3以上。
在一些实施方式中,所述s2中与所述mhcⅱ类分子有强结合的肽序选自:seqidno.1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37。
在一些实施方式中,在s2步骤中,与mhcⅱ类分子强结合的%rank值设定为2,弱结合的%rank值设定为10。
在一些实施方式中,所述步骤s4中,在对no指标的考察中,合成的多肽在0~100μg/ml范围内,至少存在某一浓度与炎症组相比具有显著性差异,即p<0.05;在对细胞炎症因子的考察中,合成的多肽在0~25μg/ml范围内,至少存在某一浓度与炎症组相比具有显著性差异,即p<0.05。
本发明通过netmhciipan3.1从肽库中筛选出一部分与识别分子间具有强反应原性的多肽,可将搜寻范围缩小至原来的0.1%~20%;再构建lps诱导的细胞模型继续筛选与识别分子间具有免疫原性的多肽,确定具有免疫活性的多肽。经过层层筛选,极大缩小了免疫活性肽的筛选范围。同时,所需时间也可从传统方法需要的1~10个月时间缩短为1~10天时间。实验结果表明,筛选结果的准确性高,且与传统的分离纯化方法以及其他筛选活性肽方法相比,提高了免疫活性肽的筛选效率,且筛选手段简便快捷,检测指标说服力强,拓宽了筛选免疫活性肽的方法,效果显著。此外,本发明还可避免后续对肽序和结合位点的繁琐鉴定,直接获得与mhcⅱ类分子结合的多肽;且可以对多肽与mhcⅱ类分子结合的反应原性和免疫原性同时进行说明,使数据更完善,获得多肽的过程更快捷,效率更高。
附图说明
图1为本发明公开的一种免疫活性肽的筛选方法的流程示意图;
图2为不同浓度lps对细胞增殖的影响;
图3为不同浓度lps对no释放量的影响;
图4为不同浓度lr13对no释放量的影响;
图5为不同浓度tk17对no释放量的影响;
图6为不同浓度lr13对细胞tnf-α表达的影响;
图7为不同浓度tk17对细胞tnf-α表达的影响;
图8为不同浓度lr13对细胞il-6表达的影响;
图9为不同浓度tk17对细胞il-6表达的影响;
图10为不同浓度lr13对细胞il-1β的影响;
图11为不同浓度tk17对细胞il-1β的影响;
图12为lr13对tnf-αmrna表达的影响;
图13为tk17对tnf-αmrna表达的影响;
图14为lr13对inosmrna表达的影响;
图15为tk17对inosmrna表达的影响;
图16为lr13对il-6mrna表达的影响;
图17为tk17对il-6mrna表达的影响;
图18为lr13对il-1βmrna表达的影响;
图19为tk17对il-1βmrna表达的影响。
具体实施方式
在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
如本文中所使用的术语“mhc”是主要组织相容性复合体(majorhistocompatibilitycomplex)的简称,是一组编码哺乳动物主要组织相容性抗原的基因群的统称。
如本文中所使用的术语“mhcⅱ类分子”是由hla复合体中的d区基因编码,ⅱ类分子包括hla-dr、dp和dq抗原;ⅱ类分子亦是由非共价连接的两条多肽链组成,分别称为α链和β链,两条链均由hla基因编码,α链的分子量约34kd,β链约29kd,两条肽链均嵌入细胞膜,伸入胞质之中。
如本文中所使用的术语“免疫活性肽”是指一类存在于生物体内具有免疫功能的多肽,这种多肽在体内一般含量较低,结构多样,是一种细胞信号传递物质,它通过内分泌、旁分泌、神经分泌等多种作用方式行使其生物学功能,沟通各类细胞间的相互联系。
如本文中所使用的术语“lps”为脂多糖,是革兰氏阴性细菌细胞壁中的一种成分,脂多糖对宿主是有毒性的;脂多糖只有当细菌死亡溶解或用人工方法破坏菌细胞后才释放出来,所以叫做内毒素;其毒性成分主要为类脂质a;内毒素位于细胞壁的最外层、覆盖于细胞壁的粘肽上;各种细菌的内毒素的毒性作用较弱,大致相同,可引起发热、微循环障碍、内毒素休克及播散性血管内凝血等;内毒素耐热而稳定,抗原性弱。
如本文中所使用的术语“no”是一种极不典型的中枢和外周神经系统的递质,因为它并非包裹在突触囊泡中或以细胞排粒作用而释放,也不作用于典型的细胞表面受体,但由于其扩散快,传导距离长而在学习和记忆中发挥作用。同时作为一种舒血管剂,no在人体生理状态的脑内大血管活动中起重要作用。外源性或内源性的no过量产生或释放却具有神经毒性,部分原因是由于no能与超氧阴离子作用,形成过氧化亚硝酸离子(onoo-)。
参见图1,一种免疫活性肽的筛选方法,包括如下步骤:
1.提取大米蛋白质后进行胰酶水解,通过质谱技术得到胰酶水解物的肽库
(1)大米蛋白提取:1000g大米粉→碱提(以液固比10:1溶解于10l0.05mol/lnaoh溶液)→室温下搅拌浸提2h→将浸提液于3500r/min下离心分离30min→酸沉(上清液调ph至4.8)→3500r/min下离心分离10min→沉淀水洗3次→冷冻干燥。
(2)胰酶水解大米蛋白质:5%(m/v)大米蛋白悬浮液→加热至胰酶最适温度→加酸碱调整至胰酶最适ph→加酶(加酶量3000u/g)→酶解3h→灭酶(15min/80℃)→离心取上清液(3500r/min,20min)→真空浓缩→冷冻干燥→大米蛋白胰酶水解物。
(3)将大米蛋白胰酶水解物进行质谱分析,得到酶解物肽库。
2.利用netmhcⅱpan3.1在得到的肽库中筛选出显示与mhcⅱ类分子有强结合的肽序
预测前工作已将肽库按照氨基酸长度进行分类,因此预测输入文件直接采用peptide格式而未采用常用的fasta格式。表位选择drb1*0101,drb1*0301,drb1*0401,drb1*0701,drb1*1101,drb1*1501,h-2-iab,h-2-iad共8项。强结合的%rank值设定为2,弱结合的%rank值设定为10。经此步骤初步筛选出显示强结合的多肽,归纳整理。在显示强结合的肽中筛选出与多个(≥3)表位都显示强结合的肽,即筛选出与识别分子具有反应原性的多肽,得到两条肽序:llppfhqassllr、tpmggflgalsslsatk,下文中分别命名为lr13和tk17。
3.合成筛选出来的肽序
(1)通过质谱确定样品是否正确;
(2)样品分析:取部分小样在离心管内溶解,用液相分析样品,10~100%的梯度,柱子型号4.6×250mm,kromasilc18,分析样品出峰时间;
(3)制备:根据分析出来的时间确定制备的梯度,一般情况下梯度间隔10来洗脱杂质,柱子型号50×250mm,kromasilc18;
(4)跟踪样品纯度:根据制备的梯度来分析制备出来的样品,从而取得合格的样品,分析的梯度一般1min走一格,走25min;
(5)旋蒸:将合格的样品并在一起进行旋蒸;
(6)样品冻干:将干燥机预冷,使温度降到零下50摄氏度左右上样品;
(7)称样包装。
4、验证合成多肽的免疫活性
(1)建立lps诱导小鼠巨噬细胞raw264.7的细胞模型
以1.5×104个/孔的密度铺96孔板,分为对照组和实验组,每组设6复孔。待细胞贴壁后,每组实验组加入不同浓度的lps溶液,对照组加水,保证lps的最终浓度为0.1、1、10、100μg/ml。37℃,5%co2的培养箱中培养24h后,每孔加入5mg/ml的mtt20μl。37℃恒温箱中孵育4h,用mtt法检测细胞增殖率,参见图2。
铺板方法同上,加入lps溶液后培养24h。收集培养基上清,4℃,12000×g离心5min除杂,用griess法检测上清中的no含量变化:在96孔板各孔中分别加入100μl的no标准液或各组培养基上清样品,再向每孔中加入50μl的griessa液,在37℃恒温箱中反应10min后再加入50μl的griessb液后继续37℃反应10min,整块板在振荡器上振荡5min使各孔反应液充分混匀,酶标仪540nm处检测吸光值,以no标准溶液的浓度和吸光值建立标准曲线,按照各个样品的吸光值计算相应的no浓度,参见图3。
通过mtt法和griess法确定最佳lps浓度。在该浓度下,需使细胞增殖率最小且no产量最大。由图2和图3可确定lps的最佳浓度为10μg/ml。
(2)griess法检测细胞培养基上清中的no含量变化
体内no是由一氧化氮合酶(nos)催化l-精氨酸的代谢而产生的。nos主要存在三种类型:神经性nos(nnos或nos1)、分泌型nos(inos或nos2)和内皮型nos(enos或nos3),在炎症反应中,lps通过刺激巨噬细胞的inos在mrna和蛋白水平的表达的升高,从而催化产生大量no。因此以no作为抗炎活性肽的筛选指标,主要实验步骤如下:
以1.5×104个/孔的密度铺96孔板,分为对照组、炎症组和实验组,每组设6复孔。待细胞贴壁后,每组实验组加入不同组分或不同浓度的肽溶液,对照组和炎症组加水。37℃,5%co2的培养箱中培养12h后,每孔加入lps溶液,使其最终浓度为10μg/ml。37℃,5%co2的培养箱中培养24h,griess法检测细胞培养基上清中的no含量变化。若实验组no浓度低于炎症组no浓度,即定义为阳性指标。参见图4-5。
(3)蛋白水平表达的检测
使用前将所有试剂充分混匀,避免产生泡沫。根据实验孔数量确定板条数目(本实验中所用的孔板为预包被板)。100μl/well加入稀释后的cytokinestandard至标准孔,100μl/well加入dilutionbufferr(1×)至空白对照孔,100μl/well加入样本至样本孔(检测样本为原样本稀释8倍)。50μl/well加入biotinylatedantibody工作液,混匀后盖上封板膜,37℃温育90分钟。扣去孔内液体,300μl/well加入washingbuffer(1×)工作液,停留一分钟后弃去孔内液体。重复4次,每一次在无尘纸或滤纸上扣干。100μl/well加入streptavidin-hrp工作液。盖上封板膜,37℃温育30分钟。重复洗板操作。100μl/well加入tmb,37℃避光温育20分钟。100μl/well迅速加入stopsolution终止反应,10分钟内用检测波长450nm读值,参见图6-11。
(4)mrna水平表达的检测
细胞总rna的提取:弃去各作用组中的细胞上清,每孔加入1mltrizol试剂,轻轻吹下细胞,转入1.50mlep管中,室温静置5min后加入200μl三氯甲烷,振摇15s,室温静置5min,4℃、12000×g低温离心15min,上清转移到新的1.5mlep管中(不要触及底部液体),加入500μl异丙醇,振摇15s,室温静置5min,于4℃、12000×g低温离心8min,弃上清,加入1ml75%乙醇,振摇15s,4℃、7500×g低温离心5min,弃上清,待乙醇挥发完全,加入适量depc水,60℃加热5min,即为提取的细胞总rna。用nd1000微量紫外可见分光光度计测rna浓度。
rna逆转录为cdna:用depc水稀释2μgrna到14.5μl,加入2μloligod(t)15(0.50μg/μl),pcr仪上70℃加热5min,马上冰浴5min,再分别加入5μlm-mlvbuffer,2.50μldntpmixture,0.50μlrnaseinhibtor,0.50μlm-mlvrt,pcr仪上42℃反转录60min,产物即为cdna。
pcr扩增:取40.50μlddh2o、5μl含有mg2+的10×pcrbuffer、1μldntp、0.50μltaqdna聚合酶以及0.50μl的上游引物和0.50μl的下游引物,充分混匀,取48μl混合液和2μlcdna混匀,根据不同引物设置pcr程序扩增。其中以β-actin为内参基因。
琼脂糖凝胶电泳:利用tae溶液配制1.5%(w/v)的琼脂糖凝胶,凝胶中加入溴化乙锭(eb)荧光显像。扩增样品中加入pcr上样缓冲液,在电泳槽中加样,接上电源,电压180v电泳20~30min后,在凝胶成像系统中拍照,分析条带灰度值,计算目标条带与内参条带灰度值比值。若实验组比值低于炎症组比值,即定义为阳性指标。参见图12-19。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!