一种肼的零背景荧光检测方法及其应用与流程
本发明属于肼检测技术领域,涉及一种用于检测肼的方法策略。更具体地,涉及一种肼的零背景荧光检测方法及其应用。
背景技术:
众所周知,肼是一种广泛使用的火箭推进剂,由于其固有的强碱性和还原性,在工业领域中应用广泛,主要用于制造化学催化剂,医药中间体和农用化学品。然而,世界卫生组织将肼定义为生产和运输过程中的具有剧毒性和致癌性的环境污染物,并且阈值限值定为10ppb。此外,肼的水溶性极佳,易通过口腔和皮肤接触吸收,对肾脏、肺脏、肝脏甚至中枢神经系统等人体器官造成严重的损害。因此,对于肼的检测,监测其痕量浓度是十分重要的,从而满足在水溶液中高灵敏度和具有良好传感性能的需求。
目前,肼的检测的常用分析方法主要有电化学分析、HPLC/GS-MS方法和毛细管电泳,但这些方法通常需要在高成本的实验仪器上进行,样品制备繁琐,并且与荧光探针相比,不适用于生物系统中的分析。
荧光探针作为一种在对目标物的传感中具有特殊光学特性的化合物,其能够满足日益增长的解决环境污染和人类健康问题的需求,并且荧光探针在灵敏度和选择性方面取得了很大进步。迄今已开发出一系列适用于实际样品、活细胞甚至生物体的荧光探针,这些探针简单易行,可用于标记或生物成像,使它们在疾病的早期诊断和环境污染检测方面具有巨大潜力。
此外,为了提高荧光探针的分析灵敏度和信噪比,虽然目前文献报道中,已经有多种方法设计和构建分子结构来提高响应信号或减少背景干扰。例如,通过扭曲的分子内电荷转移(TICT)、荧光共振能量转移(FRET)和光致电子转移(PET)等光物理过程设计探针结构。但是使用探针和分析物原位生成发色团的分析方法可以完全避免背景荧光的干扰,并且该类探针通常具有巧妙的分子结构,其本身是不发光的,与分析物结合可自行产生发光体实现对分析物的检测,以及简单的分子结构可有效地避免繁琐的合成及纯化过程,其是目前比较具有应用价值的水中肼检测方法,通过探针和目标分析物之间的特定反应生成发色团的分析方法,为实现目标物的高灵敏度零背景检测提供了一种新思路。
技术实现要素:
有鉴于此,本发明的目的是针对现有技术中存在的问题,提供一种CTAB胶束促进4-二乙氨基水杨醛与肼的缩合反应,原位生成的发色团作为肼检测指示剂的新型传感策略。
为了实现上述目的,本发明的技术方案如下:
一种肼的零背景荧光检测方法,通过十六烷基三乙基溴化铵(CTAB)胶束促进4-二乙氨基水杨醛与分析物肼之间的缩合反应,原位生成的具有分子内氢键的新生色团作为肼检测的指示剂。
本发明通过4-二乙氨基水杨醛(DEASA)在CTAB胶束中与肼的缩合反应,原位生成的新生色团作为肼检测的荧光指示剂,实现了水相中肼的零背景检测,避免了繁琐的有机合成及有机溶剂的使用。
上述公开的具体检测方法,包括如下步骤:
步骤一:在比色管中加入PBS缓冲液作为溶剂;
步骤二:向步骤一的溶剂中加入探针DEASA和特定浓度的CTAB。
步骤三:向步骤二的溶液中加入分析物肼,DEASA与肼发生缩合反应,生成发光物质HDBM。
需要说明的是,上述缩合反应的反应温度为室温,反应迅速。
优选的,所述新生色团的合成方法具体包括如下步骤:
(1)以PBS缓冲液为反应介质,加入4-二乙氨基水杨醛和十六烷基三乙基溴化铵(CTAB);
(2)在步骤(1)得到的溶液中加入分析物肼,DEASA与肼发生缩合反应,最终生成本发明公开的新生色团—发光物质HDBM。
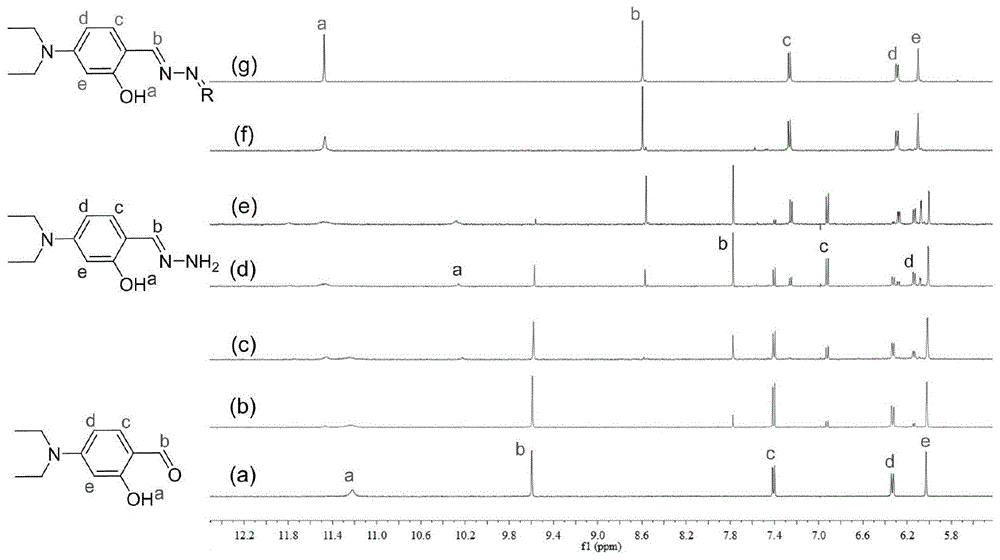
需要说明的是,参见说明书附图1,本发明通过核磁共振氢谱对所生成的发光物质HDBM进行结构表征,以表明通过上述合成方法成功生成发光物质HDBM。
特别的,本发明公开的制备发光物质HDBM的具体方案如下:
通过等摩尔连续变化法(Job法)测得肼和DEASA的结合比为1:2,通过在不同浓度的CTAB存在下检测反应溶液的光谱,优化的CTAB浓度为1×10-3mol·L-1,因而在5mL比色管中加入2mL的PBS缓冲液作为溶剂,向其中加入20μL DEASA的DMSO溶液(5×10-3mol·L-1)后,然后加入2μL CTAB的水溶液(1mol·L-1),再加入0.5当量的肼后,即得到发光物质HDBM。
其中,本发明中生成的发光物质HDBM的结构为:
优选的,所述分析物肼和4-二乙氨基水杨醛的摩尔比为1:2。
值得说明的是,在本发明中分析物肼和4-二乙氨基水杨醛的摩尔比为1:2时具有最好的发光效果,故本申请公开的荧光检测方法中均选用二者的摩尔比为1:2。
优选的,所述十六烷基三乙基溴化铵(CTAB)的浓度控制在0.1~5×10-3mol·L-1之间。
其中,本发明将十六烷基三乙基溴化铵(CTAB)的浓度控制在0.1~5×10-3mol·L-1范围内可以促进发光物质HDBM的生成,且本发明优选的浓度为1×10-3mol·L-1。并且申请人对CTAB的浓度考察范围为0.1~5×10-3mol·L-1,如附图3可知,当CTAB的浓度为1×10-3mol·L-1时,发光物质HDBM的荧光强度最高,所以后续实验优选CTAB的浓度为1×10-3mol·L-1。
本发明还有一个目的,就是提供一种肼的零背景荧光检测方法在溶剂体系中肼的选择性识别和定量检测中的应用。
优选的,所述溶剂体系中的十六烷基三乙基溴化铵(CTAB)的浓度为1×10-3mol·L-1。
在一些应用场景中,还包括所述检测方法在以肼为标志物的检测及成像中的应用。
值得说明的是,本发明公开了4-二乙基氨基水杨醛(DEASA)与肼之间的缩合反应生成的发色团的肼传感策略。其中,十六烷基三甲基溴化铵(CTAB)胶束提供了稳定的疏水空腔,有利于DEASA和肼在胶束界面发生缩合反应。同时,产生的发光物质在CTAB胶束的保护下具有更好的发光性能,从而可以提高检测的灵敏度,具体的传感原理如说明书附图2所示。
经由上述的技术方案可知,与现有技术相比,本发明公开了一种肼的零背景荧光检测方法及其应用,首先本发明提供了一种4-二乙氨基水杨醛在CTAB胶束中与肼反应生成新发色团作为肼检测指示剂的新型传感策略,该零背景检测模式具有超高灵敏度,适用于实际样品和生物体内痕量肼的检测;
其次,本发明公开的检测方案建立在非荧光物质DEASA和肼的缩合反应的基础上,通过引入CTAB胶束为疏水性探针和亲水性肼提供合适的反应位点,反应效率得到了极大的提升,以含有分子内氢键的荧光产物HDBM作为荧光信号指示剂;
然后,本发明运用的CTAB胶束的使得在水溶液中对于肼的检测方便可行,而无需通过有机溶剂调节;
最后,本发明公开的传感检测分析成功地在实际样品中进行对肼的检测,并且在活细胞成像中相当灵敏,对体内的肼的研究也进一步证明了其不受复杂环境的干扰和持久成像效果良好的性能。
综上所述,本发明公开的检测方法能够高效选择性识别肼,并对肼具有很高的灵敏度。本发明提供了一种新的肼的检测途径,具有制备简便和良好的生物相容性等优点,这对于工业、生活和生物领域具有市场应用与推广价值。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1为本发明HDBM在氘代DMSO中的核磁共振氢谱。
图2为本发明4-二乙基氨基水杨醛(DEASA)与肼之间的缩合反应生成发色团的肼传感原理图。
图3为本发明DEASA与0.5mM肼在含有不同浓度CTAB时的荧光强度图。
图4为本发明含有CTAB的DEASA溶液中和不同浓度肼的荧光光谱图。
图5为本发明DEASA和CTAB溶液中含有肼和其他分析物的荧光光谱图。
图6为本发明实际样品中肼的测定表。
图7为本发明分别用DEASA处理后,HeLa细胞与不同浓度肼的共聚焦荧光图像。
图8为本发明小鼠体内肼的荧光成像。
图9为本发明HeLa细胞存活率的柱形图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例公开了一种在CTAB胶束中4-二乙氨基水杨醛与肼反应,生成新生色团作为肼指示剂的传感策略。
为更好地理解本发明,下面通过以下实施例对本发明作进一步具体的阐述,但不可理解为对本发明的限定,对于本领域的技术人员根据上述发明内容所作的一些非本质的改进与调整,也视为落在本发明的保护范围内。
本发明公开了一种肼的零背景荧光检测方法,通过十六烷基三乙基溴化铵(CTAB)胶束促进4-二乙氨基水杨醛与分析物肼之间的缩合反应,原位生成的具有分子内氢键的新生色团作为肼检测的指示剂。
本发明新生色团—发光物质HDBM的生成,是在比色管中加入PBS缓冲溶液作为溶剂,然后加入探针DEASA和CTAB,最后加入分析物肼,在CTAB胶束中发生缩合反应,最终生成发光物质HDBM。
具体制备方案如下:
在5mL比色管中加入2mL的纯水溶液作为溶剂,向其中加入20μL DEASA的DMSO溶液(5×10-3mol·L-1)后,然后加入CTAB的水溶液(1×10-3mol·L-1),再加入0.5当量的肼,即得到发光物质HDBM。
为了进一步验证本发明的优异效果,发明人还进行了如下实验:
实验1:发光物质HDBM的合成及结构表征
1、发光物质HDBM的合成
在5mL比色管中加入2mL的纯水溶液作为溶剂,向其中加入20μL DEASA的DMSO溶液(5×10-3mol·L-1)后,然后加入CTAB的水溶液(1×10-3mol·L-1),再加入0.5当量的肼,即得到发光物质HDBM。
2、测试分析
发光物质HDBM的1HNMR谱峰值为:
1H NMR(500MHz,DMSO-d6)δ(ppm)11.47(s,2H),8.59(s,2H),7.26(d,J=8.8Hz,2H),6.30-6.28(m,2H),6.10(d,J=1.7Hz,2H),3.36(q,J=6.9Hz,4H),2.48(t,J=7.0Hz,4H);
13CNMR谱峰值为:
13C NMR(126MHz,DMSO-d6)δ(ppm)δ161.08,133.44,106.85,104.49,97.50,44.29,12.99.
通过本发明公开的合成方法制得发光物质的H谱图和C谱图得知,附图中的谱峰值与HDBM一一对应,即可证明发光物质HDBM合成成功。
实验2:一种基于肼的零背景荧光检测方法在溶剂体系中检测肼的具体应用
1、测试实验
在含有1.0mM CTAB和50μM DEASA的水溶液中,依次向每支比色管中分别加入肼、K+、Na+、Mg2+、Ca2+、F-、Cl-、NO3-、Glu,Cys、Gly、苯胺的水溶液(1×10-4mol·L-1),混匀后,测试其荧光光谱,参见附图5(A)。
对比的,在含有1.0mM CTAB、100μM肼和50μM DEASA的水溶液中,依次向每支比色管中分别加入肼、K+、Na+、Mg2+、Ca2+、F-、Cl-、NO3-、Glu,Cys、Gly、苯胺的水溶液(1×10-4mol·L-1),混匀后,测试其荧光光谱,参见附图5(B)。
2、测试分析
探针DEASA对肼具有相对选择性,实验中涉及多种潜在的干扰化合物,如阳离子(K+,Na+,Mg2+和Ca2+),阴离子(F-,Cl-和NO3-),氨基酸(Glu,Cys和Gly)和甚至类似物(苯胺),荧光响应只能由肼引发,而潜在的干扰物种几乎不会引起光谱变化。进一步的对比试验测定显示出干扰物的共存对DEASA对肼的响应几乎没有影响。
上述结果表明,探针DEASA对肼的检测具有很强的特异性,并适用于生理环境中的检测,这可能是由基于特定反应的传感策略提供的,提供了空白背景和原位生成的信号系统。
综上,本发明可实现在水溶液中选择性识别肼。
实验3:探针DEASA对肼定量检测的最低检测限的测定
在25℃时,利用荧光发射光谱,根据肼对含有1.0mMCTAB和50μM DEASA的滴定实验,通过3σ/k计算,得到探针DEASA对肼的最低检测限达0.42nM,说明该方法对肼的检测灵敏度高,表明该探针DEASA在CTAB胶束中对肼高效检测方面有潜在的应用价值。
实验4:上述肼的零背景荧光检测方法在实际水和血清样本、活细胞甚至小鼠成像中检测肼的具体应用
(1)检测方法在实际水样和血清样本中检测肼的具体应用
首先,将所提出的传感分析方法应用于自来水中的检测,分别检测从五个地方收集的海水,污水和稀释的人血清中的肼含量,测试结果如图6所示。从图6显示的实际样品中肼的测定表得知,回收率和相对标准偏差(RSD)值都在正常范围以内,另外2个高水平的肼含量(分别为2μM和10μM),揭示了污水中的肼残留。上述结果表明,探针DEASA和所提出的原位检测设计可适用于实际样品的定量分析。
(2)检测方法在活细胞中检测肼的具体应用
将HeLa细胞与50μM探针DEASA一起孵育1小时,用PBS缓冲液洗涤后,加入不同浓度(从10μM增加至150μM)的肼再培养2小时,未用肼进一步处理的细胞作为对照样品,如图7所示。其中图7(a)~图7(e)依次为肼浓度分别为0μM、10μM、50μM、100μM、150μM时的细胞荧光成像。
从图7得知,未用肼进一步处理的细胞显示完全黑暗的荧光,说明探针DEASA连同反应介质CTAB胶束不能触发任何荧光反应。该零响应肯定了传感测定的零背景性质,并排除了活细胞中不同组分干扰的可能性。另外,在用10μM肼处理HeLa细胞后可以捕获明显的绿色荧光发射,这验证了生物成像的原位传感的可行性。
(3)检测方法在生物体中检测肼的具体应用
将探针DEASA(40μL,50μM的DMSO溶液)通过皮肤注射到裸鼠中,并且分别在注射0和2小时后拍摄前两个成像图片,如图8所示。小鼠本身不发光,而荧光图像在2小时内仍然不发光,证明了DEASA在复杂生物环境中的相对稳定性。在拍摄第二张照片后不久,在相同部位注射另外的肼(2μL,0.1M),并按照计划时间表捕获荧光图像,随后在注射肼后6小时观察到荧光成像,其源自于DEASA与肼反应的过程中产生的发光产物HDBM,说明本发明提出的原位传感策略也可应用于生物体。
此外,在24小时的实时检测期间获得的发射强度也可归一量化,并在24小时后仍然可以获得强荧光而没有强度损失,这表明在分析中原位生成的发光物具有持久有效成像的优点。因此,该方案显示出的良好响应特征和高稳定性,以使本发明公开的检测方法即使在生物水平上也可通过原位缩合反应实现肼的检测。
综上,本发明公开的检测方法能够成功地应用在活细胞成像及小鼠体成像,以说明上述零背景荧光检测方法具有良好的生物相容性。并且为了进一步证明检测方法的生物相容性,申请人还对HeLa细胞毒性进行了表征分析,具体实验结果如实验5所示。
实验5:上述肼的零背景荧光检测方法的细胞毒性实验
将HeLa细胞接种于96孔板中,孵育24h,加入50μM探针DEASA分别孵育0、1、2、4、8、12、24小时后,用磷酸盐缓冲液冲洗细胞,并采用CCK-8法检测细胞毒性,其中HeLa细胞存活率的柱形图如图9所示。
从附图9可知,在50μM DEASA孵育24小时后细胞存活率依然保持在90%以上,得以证明DEASA具有相对较低的细胞毒性,该结果显示了探针DEASA对活细胞中肼的生物成像研究具有良好的生物相容性。
综上所述,本发明提出了一种多功能和直接的肼检测策略,具有无背景干扰的检测功能,适用于实际样品和生物体内检测。CTAB胶束的使得检测在水溶液中可行,而无需通过有机溶剂调节,并且通过原位检测方案,探针DEASA对肼的灵敏度和选择性相对较高,无背景性质也可用于细胞内成像甚至生物分析。本发明公开的良好的肼荧光检测传感方案为实现目标物的高灵敏度零背景检测提供了新的检测途径,这对于工业、生活和生物领域是极具有市场应用与推广价值的。
对所公开的实施例及实验例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!