一种用于化合物毒性筛查的细胞内传感器、制备方法以及使用方法与流程
本发明涉及一种用于化合物毒性筛查的细胞内传感器、制备方法以及使用方法,属于纳米生物学技术领域。
背景技术:
生物环境安全性问题不仅是科学家关心的科学前沿问题,同时也是公众关心的人类健康的社会问题。对于存在于人类生存环境中的污染物以及现如今广泛研制及应用于疾病救治中的化学药物,保健品,甚至是个人护理用品等的安全性问题无疑是人类关心的最基础的问题。同时对于化合物的毒性监测是药物研发及临床应用前的第一道防线,是扼制环境污染物肆意应用的首要方法,为保障人类健康起到防微杜渐的作用。化合物对人类健康造成的毒性作用严重威胁着人类的健康,轻度毒性化合物长期接触会造成肝损伤,免疫系统损伤,发育系统受限,内分泌系统紊乱以及神经系统受损等危害同时一些化合物长期接触有诱发肥胖的风险,高毒性化合物中毒甚至会导致死亡,同时药物和临床候选药物的毒性仍然是制药行业的一个重要问题,导致人员损耗和成本增加、后期失败和市场退出。来自cmr-international的最新数据显示,2006年至2010年期间进入临床开发的候选药物中,有22%由于非临床毒理学或临床安全问题而失败。在临床前开发中,毒性和安全性问题占54%(占所有临床前候选项的18%)。这些昂贵的延迟失败占了制药研发成本的很大一部分,最近估计每销售一种药物的成本为18亿美元。因此对于化合物的毒性监测必不可缺。
目前对于化合物的毒性监测包括分子水平,细胞水平以及动物水平。相对于耗时、耗力且受到伦理质疑的动物毒性监测,体外细胞水平的研究是化合物毒性测试的一种快速筛查方法,同时无疑是毒性数据获取的不可或缺的方式。目前的细胞毒性监测多采用终点式的检测方法,在较短的孵育时间后,用染色、荧光、聚合酶链式反应(pcr)等方法定量相关的生物分子的变化。这些方法不能响应细胞内功能或信号的实时变化,同时无法在较低的时间分辨率内观测细胞响应的细微变化。
技术实现要素:
本发明所要解决的技术问题是,提供一种可用于化合物细胞毒性试验多功能、长时间实时监测的细胞内传感器、制备方法以及使用方法。
为解决上述技术问题,本发明采用的技术方案为:
一种用于化合物毒性筛查的细胞内传感器,采用双乳液合成法制备以聚乳酸羟基乙酸共聚物(plga)为载体的包覆有与细胞功能相关的小分子探针或分子信标形成的传感器。
进一步的,所述传感器尺寸为800-1200nm。
进一步的,采用正电荷的聚赖氨酸(pll)对所述传感器进行表面电荷修饰。
进一步的,所述小分子探针为calceinam或cellrox。
进一步的,所述分子信标为pparγmb或ap2mb。
一种用于化合物毒性筛查的细胞内传感器的制备方法,包括以下步骤:
(1)plga传感器的制备:将20mgplga溶于0.93ml二氯甲烷中分别与calceinam(20μl,1mg/ml)或cellrox(50μl,2.5mm)或pparγmb(10μl,50μm)或ap2mb(10μl,50μm)溶液混合,并于冰浴条件下,在均质器(24000rpm/min,1min)不断搅拌时逐滴分别将以上混合溶液滴入0.4ml1%pva中形成乳化溶液,随后旋蒸(真空度200,转速80rpm/min,温度25℃)4min,去除二氯甲烷,得到纳米颗粒后离心(6000rpm/min,5min)并用ph=7.4磷酸缓冲溶液(pbs)清洗,重复以上实验操作三次,所得传感器冷冻干燥24小时后放于-20℃保存;
(2)plga传感器的表面电荷修饰:取2mgplga传感器与1ml聚赖氨酸(pll)溶液混合并共孵育4小时后,离心去除上清液,传感器冷冻干燥24小时后放于-20℃冰箱储存备用;
(3)制得上述的plga传感器后,用动态光散射(dls)测试颗粒的尺寸、扫描电镜(sem)观察颗粒的形态及尺寸分布,以尺寸为800-1200nm球形颗粒为合格。
一种用于化合物毒性筛查的细胞内传感器的使用方法,将上述制备的所述传感器集成到细胞内,进行化合物细胞毒性试验,长期监测所述传感器中分子探针或分子信标情况来监测化合物的细胞毒性。
本发明制备机理:本发明选取细胞内探针为calceinam和cellrox分别检测细胞活性和活性氧变化以及细胞脂肪化相关基因的分子信标,pparγmb和ap2mb选用了聚乳酸羟基乙酸共聚物(plga)作为载体,可以有效保护以上探针的活性。本发明用双乳液的合成方法进行plga传感器的制备,通过控制均质器的转速及搅拌时间将传感器尺寸控制在约1μm,这种尺寸的颗粒极大地扼制了由于细胞的胞吐作用所带来的信号损失,增长了传感器在细胞内的停留时间,传感器用正电荷的聚赖氨酸(pll)进行了表面电荷修饰,提高了传感器的细胞摄取率。本发明所制备的传感器保留了所装载探针的特异性,实现了对细胞内功能及信号变化的实时响应,提供了一个化合物毒性监测的平台。
本发明所达到的有益效果:
(1)本发明基于plga的传感器制备工艺简单,且制备工艺材料均为食品药品监督管理局批准材料,生物安全性好。
(2)本发明所制备的plga传感器尺寸分布在约800-1200nm,此尺寸的颗粒极好的抑制了由于胞吐作用带来的信号稀释问题,同时plga具有缓慢降解的特点,用其所制备的传感器标记细胞后可作为细胞内的一个储存仓,随着plga的缓慢降解信号分子不断释放,解决了荧光信号分子较快稀释的问题,从而实现了传感器可进行实时较长时间的毒性监测的目的。
(3)本发明为细胞毒性监测提供了一个很好的平台,所装载的信号分子可以进行替换,为化合物的细胞毒性监测提供更多的可能,进行细胞不同功能的监测。
附图说明
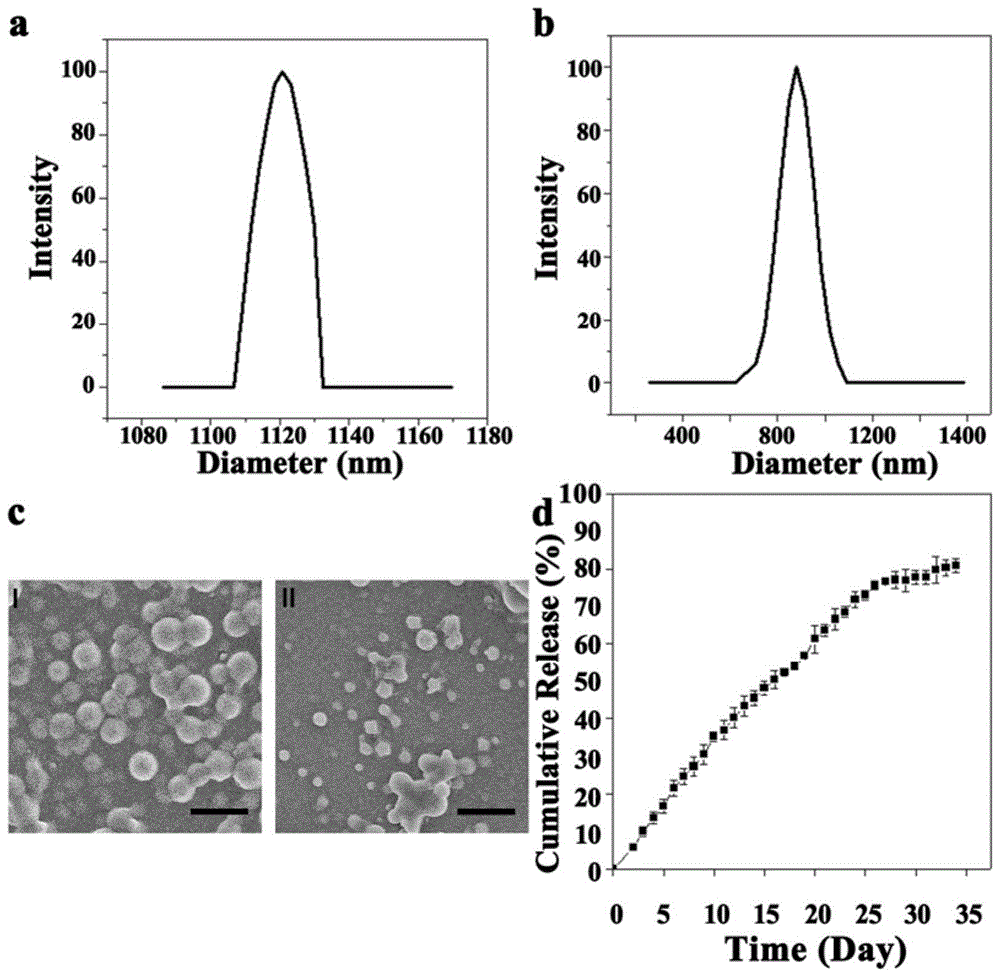
图1a是本发明实施例1中plga@calceinam传感器的水合粒径表征示意图;
图1b是本发明实施例1中plga@cellrox传感器的水合粒径表征示意图;
图1c是本发明实施例1中plga@calceinam传感器制备好和放置30天后的形貌对比扫描电镜示意图;
图1d是本发明实施例1中plga@calceinam传感器在34天内的探针释放曲线示意图;
图2是本发明实施例2验证plga@calceinam传感器特异性响应hmscs细胞活性变化示意图;
图3是本发明实施例3验证plga@cellrox传感器特异性响应hmscs细胞内活性氧变化情况示意图;
图4是本发明实施例4验证pparγmb和ap2mb在细胞外与靶标链互补配对示意图;
图5是本发明实施例5验证plga@pparγ传感器在hmscs细胞内标记示意图;
图6是本发明实施例6验证plga@ap2传感器在3t3细胞内标记示意图。
其中,diameter:尺寸;intensity:强度;cumulativerelease:累积释放;concentration:浓度;normalizedfluorescence:归一化荧光强度;tbhp:叔丁基过氧化氢;gsh:还原型谷胱甘肽;plga:聚乳酸羟基乙酸共聚物;pparγ:过氧化物酶体激活物增殖受体γ;ap2:脂肪细胞型脂肪酸结合蛋白;mb:分子信标;target:靶标链。
具体实施方式
下面结合附图对本发明作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
实施例1
参照图1a&b,检测合成的plga@calceinam和plga@cellrox传感器水合粒径。
首先,plga@calceinam或plga@cellrox的制备,将20mgplga溶于0.93ml二氯甲烷中分别与(20μl,1mg/ml)calceinam或(50μl,2.5mm)cellrox溶液混合,并在冰浴条件下,在均质器(24000rpm/min,1min)不断搅拌时逐滴将以上混合溶液滴入0.4ml1%pva中形成乳化溶液,随后旋蒸(真空度200,转速80rpm/min,温度25℃)约4min去除二氯甲烷,得到纳米颗粒后离心(6000rpm/min,5min)并用ph=7.4pbs清洗,重复以上实验操作三次,所得传感器冷冻干燥24小时后放于-20℃保存。
随后,取1mg传感器粉末溶解于1ml超纯水中,将以上混合溶液置于一次性比色皿中,并用zetapalspotentialanalyzer测定传感器的水合粒径。
从图1a&b,可以看出plga@calceinam和plga@cellrox传感器的粒径分别分布在1.12±0.04和0.87±0.21μm,尺寸分布很好的满足正态分布情况。
参照图1c,检测plga@calceinam传感器的降解情况。
取新制备好的2mgplga@calceinam传感器粉末完全溶于2ml超纯水中,随后吸取10-15μl溶液置于清洗干净的硅片上,自然晾干后用sem观察传感器的形貌。同样地,取2mgplga@calceinam传感器粉末完全溶于2mlph=7.4的磷酸缓冲溶液中,并将上述溶液置于1.5ml离心管中于37℃摇床中不断摇晃,使溶液保持均匀状态,30天后,吸取10-15μl溶液置于清洗干净的硅片上,自然晾干后用sem观察传感器的形貌。
从图1c,可以看出,图片ι中的传感器呈完美的球型,然而图片п中的传感器已经不具备球型,呈部分降解的不规则形状,以上现象证明plga传感器在30天后已经部分降解,此现象满足探针逐渐释放的目的。
参考图1d,监测plga@calceinam传感器的探针缓慢释放情况。
首先将calceinam探针用pbs稀释到预定的浓度(5,2.5,1.25,0.625,0.3125μm),根据每个浓度溶液在λ=515nm处的荧光值绘制了calceinam的荧光标准曲线。随后将2mgplga@calceinam传感器溶于1mlph=7.4的pbs中,以上溶液置入1.5ml离心管,并于摇床中震荡保证溶液混合均匀,并于设定好的不同时间点(1,2,3……35天)离心取上清液。测量上清液的荧光值,确定传感器的探针释放曲线。
从图1d,plga@calceinam传感器的calceinam探针在1至25天的累积释放呈直线型上升趋势,在第33天时达到平台,释放量达到80%,传感器的持续缓慢释放很好地避免了探针被光漂白的可能性。
实施例2
参考图2a,确定plga@calceinam传感器对细胞活性的特异性响应情况。
首先,将人源间充质干细胞(hmscs)接种到玻璃底的共聚焦皿中,在37℃、5%co2环境中孵育24小时后,弃去上层培养液。将用新鲜培养液稀释好的0.8mg/mlplga@calceinam传感器溶液与hmscs在以上细胞培养环境下共孵育24小时后,弃去以上培养液并用pbs清洗三次,随后,换用0%,0.25%,2.5%的dmso溶液与以上传感器标记过的细胞共孵育4小时后,同样用pbs清洗三次,加入新鲜培养液,并用h33342染细胞核20分钟后,进行共聚焦成像分析。
参考图2b,对图2a中共聚焦图片进行荧光强度定量分析。
利用imagej软件对三个实验组中的单个细胞荧光强度进行荧光强度统计,每个实验组统计100个细胞,并用spss软件进行显著性分析。
从图2a&b,dmso是一种可以抑制细胞增殖并降低细胞活性的试剂。此图中dmso处理的细胞荧光强度明显比对照组低,并且荧光强度的降低呈剂量依赖型。所制备的传感器可以特异性地响应细胞活性的变化。
实施例3
参考图3a,确定plga@cellrox传感器对细胞内活性氧变化的特异性响应情况。
对于细胞内活性氧的特异性监测,同以上方法,用0.8mg/mlplga@cellrox传感器标记过的细胞分别与新鲜培养基,5mm,30mm,60mm的tbhp共孵育30分钟后,用pbs清洗三次并换用新鲜培养基,用h33342染细胞核20分钟后,进行共聚焦成像分析。
同时对于细胞内活性氧的特异性监测进行了以下实验进行进一步验证,将plga@cellrox传感器标记过的hmscs分别与包含0.0015ggsh的30mmtbhp,30mmtbhp,新鲜培养基共孵育30分钟后,进行以上相同的细胞核染色实验,进行共聚焦成像分析。
参考图3b,对图3a中的共聚焦图片单个细胞进行荧光强度定量分析。
从图3a&b,叔丁基过氧化氢(tbhp)是一种可以刺激细胞产生氧化应激的试剂,图3a中细胞的荧光强度与tbhp呈剂量依赖型关系,同时从图3c&d,还原型谷胱甘肽(gsh)具有还原过氧化氢的能力,tbhp实验组中的荧光强度明显高于对照组且当gsh加入后细胞的红色荧光强度明显降低,证明plga@cellrox传感器可以特异性响应细胞内活性氧的变化。
实施例4
参照图4,验证pparγmb和ap2mb在细胞外与靶标链互补配对的情况。
首先,将0.5μm的pparγ和ap2分子信标分别与0.1、0.2、0.3、0.4、0.5μm的相对应靶标链共孵育,避光于37℃恒温箱中共孵育15分钟,随后用荧光分光光度计对以上混合溶液进行测试,所得数据用origin软件进行绘图整理。
从图4,4a为pparγ分子信标与靶标链的互补配对示意图,4b为ap2分子信标与靶标链的互补配对示意图,随着靶标链浓度的增加,分子信标的颈环结构逐渐打开,荧光分子与猝灭剂远离,荧光分子恢复荧光,如图中显示荧光强度逐渐增强,符合预期的设计,证明所设计的颈环结构分子信标可以正常工作。
实施例5
参照图5,确定plga@pparγ传感器的成功制备并能成功标记细胞。
首先,plga@pparγ传感器的制备,将20mgplga溶于0.93ml二氯甲烷中分别与10μl50μmpparγmb溶液混合,并于冰浴条件下,在均质器(24000rpm/min,1min)不断搅拌时逐滴将以上混合溶液滴入0.4ml1%pva中形成乳化溶液,随后旋蒸(真空度200,转速80rpm/min,温度25℃)约4min去除二氯甲烷,得到纳米颗粒后离心(6000rpm/min,5min)并用ph=7.4pbs清洗,重复以上实验操作三次,所得传感器冷冻干燥24小时后放于-20℃保存。随后,按照以上实施例2中的细胞培养条件培养细胞并铺皿,将用新鲜培养液稀释好的0.8mg/mlplga@pparγ传感器溶液与实验组hmscs在以上细胞培养环境下共孵育24小时后,弃去以上培养液并用pbs清洗三次,随后,用h33342染细胞核20分钟,对照组细胞只进行同样的染细胞核处理后进行共聚焦成像分析。
从图5,用plga@pparγ传感器标记过的细胞在559nm激光器的激发下细胞有明显的绿色荧光,其荧光强度明显高于对照组未经标记的细胞,证明所制备的plga@pparγ传感器可以成功标记细胞。
实施例6
参照图6,确定plga@ap2传感器的成功制备并能成功标记细胞。
首先,plga@ap2传感器的制备,将20mgplga溶于0.93ml二氯甲烷中分别与10μl50μmap2mb溶液混合,并于冰浴条件下,在均质器(24000rpm/min,1min)不断搅拌时逐滴将以上混合溶液滴入0.4ml1%pva中形成乳化溶液,随后旋蒸(真空度200,转速80rpm/min,温度25℃)约4min去除二氯甲烷,得到的纳米颗粒离心(6000rpm/min,5min)并用ph=7.4pbs清洗,重复以上实验操作三次,所得传感器冷冻干燥24小时后放于-20℃保存。随后,按照以上实施例2中的细胞培养条件培养细胞并铺皿,将用新鲜培养液稀释好的0.8mg/mlplga@ap2传感器溶液与实验组3t3在以上细胞培养环境下共孵育24小时后,弃去以上培养液并用pbs清洗三次,随后,用h33342染细胞核20分钟,对照组细胞只进行同样的染细胞核处理后进行共聚焦成像分析。
从图6,用plga@ap2传感器标记过的细胞在559nm激光器的激发下细胞有明显的绿色荧光,其荧光强度明显高于对照组未经标记的细胞,证明所制备的plga@ap2传感器可以成功标记细胞。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!